应用血栓弹力图检测血小板抑制率指导急性非心源性卒中抗血小板治疗的研究
2022-12-28刘勇冯雪梅王娟
刘勇 冯雪梅 王娟
四川省宜宾市第四人民医院神经专科,四川宜宾 644000
全球疾病负担研究(globalburden of disease study,GBD)数据显示,卒中已成为致我国居民死亡的首位疾病[1,2],我国缺血性脑卒中年复发率高达17.7%[3]。缺血性脑卒中的特异性治疗措施中,“抗血小板”是最常用、最普遍的治疗措施。自2013年以来,针对抗血小板治疗的原则、建议和进展,国内外陆续发布并更新一系列关于缺血性脑卒中的各种指南及专家共识[4,5]。阿司匹林、氯吡格雷等抗血小板药物在临床一线中发挥重要作用,但由于存在药物抵抗等因素,可能出现病情恶化或复发,也有过度抗血小板治疗而引发出血事件。利用血栓弹力图(thrombelastogram,TEG)评价抗血小板药物的治疗效果有效[6],可为缺血性脑卒中患者抗血小板药物个体化治疗提供依据。本研究旨在探讨应用TEG 检测血小板抑制率,结合临床预后和终点事件,明确其在急性非心源性卒中抗血小板治疗中的应用价值。
1 资料与方法
1.1 一般资料
选取2020 年9 月至2021 年10 月于四川省宜宾市第四人民医院住院确诊的100 例初发急性非心源性卒中患者为研究对象,根据是否行TEG 检测分为观察组(行TEG 检测)和对照组,每组各50 例。纳入标准:①急性非心源性卒中;②无阿司匹林及氯吡格雷使用禁忌证。排除标准:①心源性脑栓塞;②有血液病或出血倾向;③活动性消化性溃疡;④血小板计数<100×109/L;⑤严重肝肾衰竭、心功能不全。本研究通过四川省宜宾市第四人民医院伦理委员会批准(审批号:2020 伦审第001 号),所有入组患者或其家属均签署知情同意书。
1.2 方法
1.2.1 入院后根据《中国急性缺血性脑卒中诊治指南》2018、中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2015 及Essen 卒中风险评分量表(Essen stroke risk rating scale,ESRS)评分选择抗血小板药物,包括阿司匹林(德国拜耳医药公司,国药准字J20171021,100mg/片)、氯吡格雷(杭州赛诺菲公司,商品名波立维,国药准字J20180029,75mg/片),根据以上指南和量表,使用阿司匹林或氯吡格雷单抗血小板治疗及两者联合双抗血小板治疗,均连续用药1 周。
1.2.2 血小板抑制率检测 观察组患者入院后先采血,然后再给予相应的抗血小板药物,治疗1 周后再次采血,应用TEG(重庆鼎润,DRNX-Ⅲ型)及其配套试剂,依据使用抗血小板药物的情况检测血小板抑制率。
1.3 评价指标
氯吡格雷治疗后二磷酸腺苷(adenosine diphosphate,ADP)途径诱导的血小板抑制率30%~90%为正常,>90%为过度抑制,<30%为低反应性或药物抵抗。阿司匹林治疗后花生四烯酸(arachidonic acid,AA)途径诱导的血小板抑制率50%~90%为正常,>90%为过度抑制,<50%为低反应性或药物抵抗。抑制率在正常范围者药物保持不变,抑制率>90%者需控制药物剂量,密切观察有无出血征象;抑制率低于正常下限者可增加药物剂量或换用其他抗血小板药物[7]。
1.4 疗效评估及安全性
观察患者出院时美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分、随访3 个月时改良Rankin 量表(modified Rankin scale,mRS)评分与终点事件(卒中复发、出血及死亡事件等)的发生情况。
1.5 统计学方法
使用SPSS 22.0 统计学软件对数据进行分析和处理,符合正态分布的计量资料以均数±标准差()表示,采用t检验,计数资料以例数(百分率)[n(%)]表示,采用χ2检验,P<0.05 为差异有统计意义。
2 结果
2.1 两组患者的基本资料比较
两组患者入院时的基本资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者的基本资料比较
2.2 AA 或ADP 途径诱导的血小板抑制率变化比较
观察组共有27 例患者行单抗血小板治疗,其中13 例单用阿司匹林的患者检测AA 途径诱导的血小板抑制率,14 例单用氯吡格雷的患者检测ADP 途径诱导的血小板抑制率;观察组23 例联用阿司匹林和氯吡格雷行双抗血小板治疗的患者检测AA+ADP 途径诱导的血小板抑制率。治疗后观察组的AA、ADP途径诱导的血小板抑制率均分别显著高于治疗前(P<0.05),治疗后双抗者的AA、ADP 途径诱导的血小板抑制率均分别高于单抗者(P<0.05),见表2。
表2 AA、ADP 途径诱导的血小板抑制率比较(,%)

表2 AA、ADP 途径诱导的血小板抑制率比较(,%)
注:与治疗前比较,*P<0.05;与阿司匹林比较,▲P<0.05;与氯吡格雷比较,△P<0.05
2.3 疗效及不良事件发生情况
观察组患者出院时的NIHSS 评分、随访3 个月时mRS 评分均低于对照组,差异有统计学意义(P<0.05);观察组良好功能结局者(mRS 评分0~2分)多于对照组,差异有统计学意义(P<0.05);观察组患者的卒中复发及出血发生率均低于对照组,差异有统计学意义(P<0.05),见表3、4。
表3 两组患者的神经功能缺损及临床结局比较(,分)
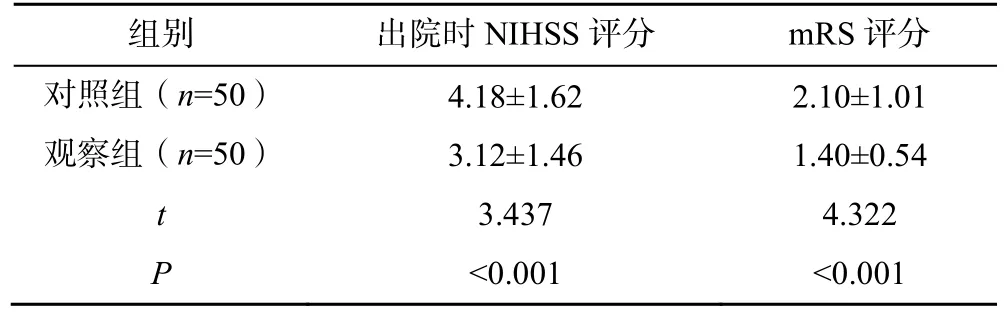
表3 两组患者的神经功能缺损及临床结局比较(,分)
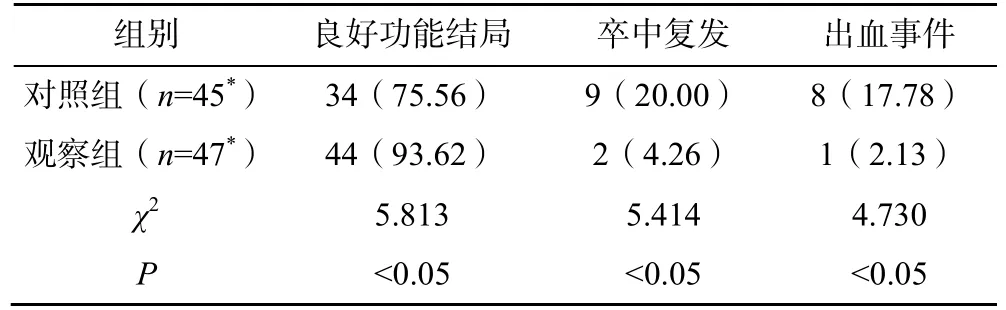
表4 两组患者的良好功能结局(mRS 评分0~2 分)、终点事件比较[n(%)]
3 讨论
研究证实,阿司匹林和氯吡格雷是国内外相关指南共识推荐常用的缺血性脑卒中治疗药物[8-10],但仍有10%~20%的患者经规律的抗血小板药物治疗后出现反复的卒中复发,表明对抗血小板药物的反应性较低,临床上称作抗血小板药物抵抗[11]。由于抗血小板药物抵抗或低反应性的存在,可能出现病情加重或复发,且使用强化抗血小板治疗,与更多、更严重的出血事件有关。目前针对阿司匹林及氯吡格雷的基因多态性与药物抵抗关系的临床研究取得一定进展,尤其与氯吡格雷抵抗有关的CYP2C19 基因突变[12]。
阿司匹林抗血小板聚集的机制是通过不可逆抑制环氧化酶的合成,减少血栓素A2 的生成以抑制血小板聚集而发挥抗血栓作用[13]。氯吡格雷抗血小板聚集的机制是在肝脏内经两步代谢形成活性代谢产物,与血小板表面的P2Y12 受体不可逆结合,进而抑制ADP 介导的糖蛋白(glycoprotein,GP)Ⅱb/Ⅲa 复合物的活化,抑制血小板聚集[14],因此,可用血小板抑制率来评价抗血小板药物的疗效,从而及时进行干预,减少复发及出血风险。
TEG 检测值可反映血液凝固动态变化的综合指标。本研究应用TEG 对抗血小板药物治疗前后的血小板抑制率改变情况、血小板抑制率异常者进行分析调整,并评估预后情况,结果显示,AA、ADP 途径诱导的血小板抑制率均显著高于治疗前,双抗治疗患者的AA、ADP 途径诱导的血小板抑制率均分别高于单抗者,提示阿司匹林与氯吡格雷联合应用具有相互协同效应,AA 途径诱导的血小板抑制率升高的同时可使ADP 途径诱导的血小板抑制率进一步升高,两种路径同时抑制血小板聚集时存在相互促进的作用结果。邱石等[15]采用Meta 分析方法分析阿司匹林、氯吡格雷及两者联用的抗血小板作用效果,共纳入5 篇病例对照研究,提示常规剂量的阿司匹林和氯吡格雷联合抗血小板治疗具有协同作用,与本研究结果一致。观察组出院时的NIHSS 评分、随访期间mRS 评分均低于对照组,观察组良好功能结局者多于对照组,且卒中复发、出血发生率均低于对照组。2013 年Wang等[16]研究提出阿司匹林+氯吡格雷联合治疗能有效减少卒中复发且不增加出血风险[16]。Rowe等[17]发现,TEG 在急性缺血性卒中的抗血小板个体化治疗中,不仅能够动态监测药物疗效,且还能改善卒中患者的临床预后,具有一定的临床价值[18]。当然,有条件者同时联合基因分型筛查选择用药方案可能更为全面。有研究发现携带1 个或2 个CYP2C19 失活等位基因的患者氯吡格雷活性代谢产物的血清学浓度明显偏低[19]。最新的CHANCE-2 研究结果显示,带有CYP2C19 功能缺失等位基因的中国轻型缺血性卒中(NIHSS 评分≤3)或TIA 患者中,阿司匹林与替格瑞洛联用预防卒中复发的疗效优于氯吡格雷联用阿司匹林,前者比后者90d 内卒中复发率降低23%[20]。
综上所述,应用TEG 检测血小板抑制率可指导急性非心源性卒中患者抗血小板治疗,通过疗效评估和危险分层,减少复发及出血事件,改善患者的临床预后,值得在临床工作中推广。
