基于UPLC-Q-Exactive Orbitrap-MS指纹图谱和多成分定量的不同产地辣木叶药材及其黄酮部位质量研究
2022-12-28袁永兵王保锦常子豪刘宇琦陈尹心周立鹏雒晓卫王树楷刘乡乡张兰珍
袁 静,袁永兵,周 铭,刘 越,黄 雅,王保锦,常子豪,刘宇琦,胡 倩,陈尹心,周立鹏,雒晓卫,王树楷,刘乡乡,张兰珍*
基于UPLC-Q-Exactive Orbitrap-MS指纹图谱和多成分定量的不同产地辣木叶药材及其黄酮部位质量研究
袁 静1,袁永兵2,周 铭1,刘 越1,黄 雅1,王保锦1,常子豪1,刘宇琦1,胡 倩1,陈尹心1,周立鹏1,雒晓卫1,王树楷1,刘乡乡3,张兰珍1*
1. 北京中医药大学中药学院,北京 102488 2. 天津药物研究院,天津 300462 3. 广州泽力医药科技有限公司,广东 广州 510663
建立不同产地辣木叶药材和黄酮部位UPLC-Q-Exactive Orbitrap-MS指纹图谱和多成分定量方法,并进行化学计量学分析,为辣木叶药材和黄酮部位的质量控制提供参考。采用UPLC-Q-Exactive Orbitrap-MS检测并结合“中药色谱指纹图谱相似度评价系统(2012A版)”建立15个不同批次辣木叶药材和黄酮部位(S1~S15)指纹图谱,并进行相似度评价和共有峰指认,测定3个黄酮类成分异牡荆素、异槲皮苷、紫云英苷含量。采用聚类分析(hierarchical clustering analysis,HCA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)等化学计量学分析方法对15批不同产地辣木叶药材质量和黄酮部位进行评价。15批不同产地辣木叶药材标定了17个共有峰,指认出其中14个共有峰;辣木叶黄酮部位标定和指认出10个共有峰。15批不同产地辣木叶和黄酮部位的相似度和HCA分析聚为4类,且HCA结果与相似度评价结果基本相一致;PCA、OPLS-DA分析聚为3类。15批药材中异牡荆素、异槲皮苷、紫云英苷的含量分别为0.06%~0.19%、0.27%~0.79%、0.08%~0.23%;黄酮部位中含量分别为0.53%~3.53%、6.49%~14.36%、2.05%~4.66%。建立了专属性强、灵敏度高的不同产地辣木叶药材和辣木叶黄酮部位的定性定量方法,为辣木叶药材和辣木叶黄酮部位综合评价提供依据。
辣木叶;辣木叶黄酮部位;UPLC-Q-Exactive Orbitrap-MS;指纹图谱;化学计量学;异牡荆素;异槲皮苷;紫云英苷
辣木Lam.为辣木科辣木属多年生乔木,原产于印度和非洲的干旱或半干旱地区[1-2],于20世纪早期引进我国云南[3-4],目前在云南、海南、福建、广东、广西等地均有种植,已成为一种极具营养价值、药用价值和经济价值的植物,且在2012年被列为我国新资源食品原料[5]。根据《印度阿育吠托药典》()中的记载,辣木叶味甘性凉,具有除风、消除脂肪、止痛、杀腹虫、润肤、明目、清脑等功效。具有良好的抗炎、抗氧化、抗肿瘤、降糖、降压、调血脂等生物活性[6]。辣木叶质量研究目前有辣木叶药材HPLC指纹图谱和含量测定[7-8],但对不同产地多批次药材及黄酮部位的UPLC-MS指纹图谱及黄酮多成分含量测定综合评价尚无报道。本研究建立了不同产地辣木叶药材和黄酮部位的UPLC-Q-Exactive Orbitrap-MS指纹图谱,并进行化学计量学分析和主要黄酮成分含量测定,为辣木叶药材和黄酮部位的质量控制提供参考。
1 仪器与试药
1.1 仪器
Acquity UPLC H-Class液相色谱仪(包括PDA检测器,美国Waters公司);DIONEX Ultimate 3000超高效液相色谱系统,Q Exactive FOCUS质谱仪(美国Thermo Scientific公司,配有电喷雾离子源ESI以及Xcalibur 3.0数据处理系统、Compound Discover 3.0软件);SECURA124-1CN型电子天平(十万分之一,北京赛多利斯仪器系统有限公司);KQ5200E型超声清洗器(昆山市超声仪器有限公司)。
1.2 试药
对照品异牡荆素、异槲皮素、紫云英苷均为实验室自制,质量分数均>98%;甲醇、乙腈(美国Fisher公司,色谱纯);磷酸(天津光复精细化工研究所,色谱纯);甲酸(天津市大茂化学试剂厂,色谱纯);超纯水。
15批辣木叶产地来源见表1。由北京中医药大学中药鉴定系刘春生教授鉴定均为辣木.Lam.叶,样品保存于北京中医药大学中药学院中药化学实验室。
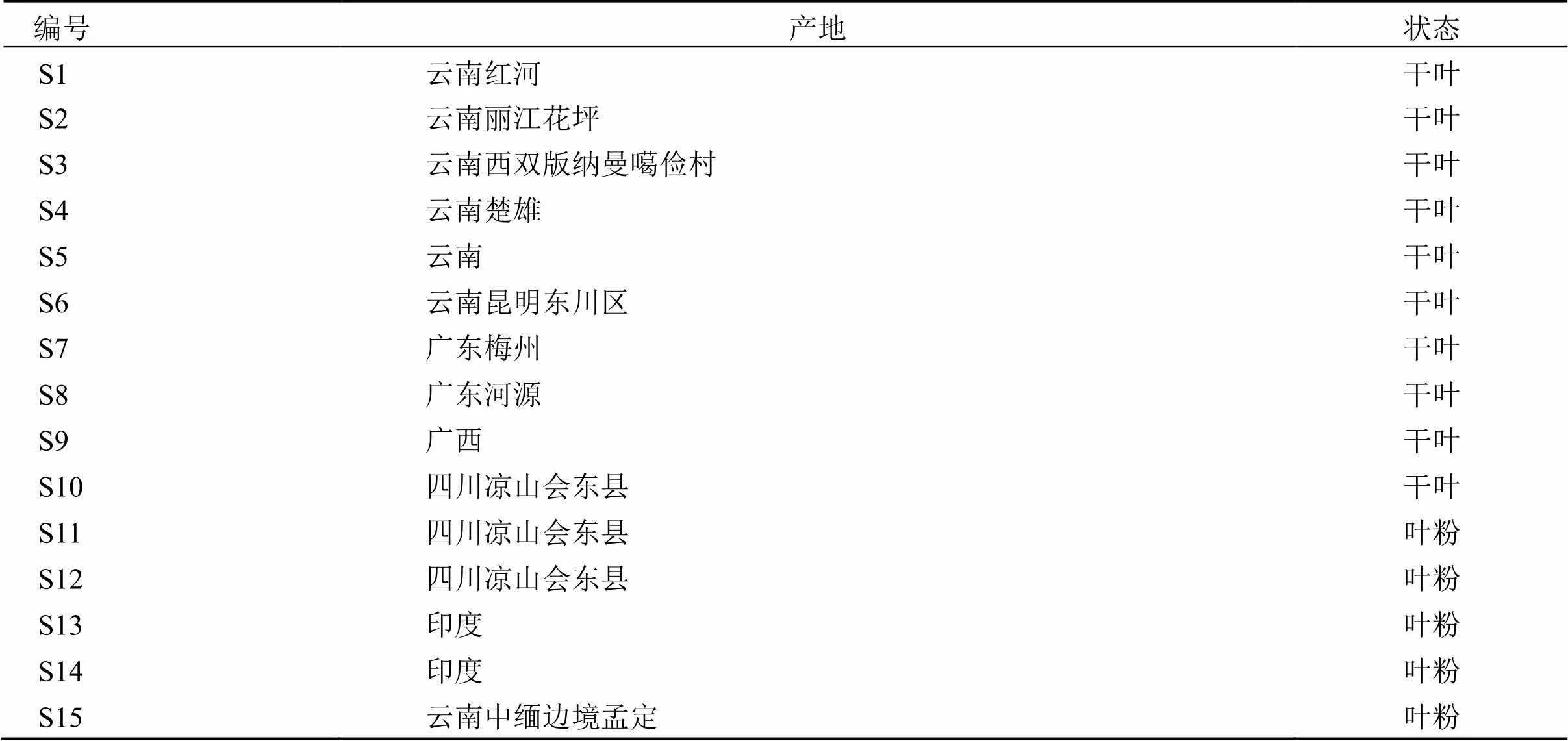
表1 辣木叶产地来源
2 方法与结果
2.1 指纹图谱的建立
2.1.1 色谱条件 色谱柱:Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相:0.1%甲酸溶液-乙腈,药材梯度洗脱:0~10 min,3.0%~6.0%乙腈;10~11 min,6.0%~10.5%乙腈;11~20 min,10.5%~16.5%乙腈;20~28 min,16.5%~27.0%乙腈;黄酮部位梯度洗脱:0~2 min,3.0%~5.0%乙腈;2~8 min,5.0%~8.0%乙腈;8.0~8.1 min,8.0%~10.5%乙腈;8.1~16.0 min,10.5%~28.0%乙腈;体积流量0.4 mL/min;柱温30 ℃;进样量5 μL。
2.1.2 质谱条件 电喷雾离子化电离源(ESI);负极性毛细管电压3.0 kV;毛细管温度320 ℃;检测模式:负离子模式;扫描范围:120~1800;鞘气体积流量35 arb;辅助气体积流量10 arb;离子源温度400 ℃;质谱分辨率(70 000/17 500);碰撞能量(阶梯模式):30、35、40 eV。
2.1.3 对照品溶液的制备 分别精密称取对照品牡荆素、异槲皮苷和紫云英苷适量,加甲醇溶解稀释,即得异牡荆素(0.228 mg/mL)、异槲皮苷(0.416 mg/mL)、紫云英苷(0.169 mg/mL)的对照品溶液。
2.1.4 供试品溶液的制备
(1)药材供试品溶液制备:称取15批辣木叶粉末0.5 g,精密称定,分别置于100 mL锥形瓶中,加入50%甲醇50 mL,称定质量,室温浸泡30 min后,超声60 min,放至室温,补足减失的质量,滤过,取续滤液即得辣木叶供试品溶液,进样前过0.22 μm微孔滤膜。
(2)黄酮部位供试品溶液的制备:称取15个不同批次的辣木叶粉,70%乙醇70 ℃加热浸泡2 h,溶剂用量为20倍,提取2次,合并滤液后浓缩成质量浓度为0.1 g生药/mL的药液,离心,上清液上样于20 mL NKA-9型大孔树脂,上样5个柱体积,进行动态吸附,吸附体积流量1 mL/min,待吸附完成后,用蒸馏水除杂4个柱体积,除杂体积流量1 mL/min,洗脱剂为60%乙醇,洗脱体积为5个柱体积,洗脱体积流量为1 mL/min,收集60%乙醇洗脱液,减压干燥即得辣木叶黄酮部位。称取黄酮部位10 mg,精密称定,分别置于25 mL量瓶中,加50%甲醇溶解并定容,即得黄酮部位供试液,进样前过0.22 μm微孔滤膜。
2.1.5 精密度试验 取批号药材(S1)及其黄酮部位供试品溶液,按照“2.1.1”和“2.1.2”项下相应的条件进样测定,分别连续进样6次,以异槲皮苷峰(药材为11号和黄酮部位为D号峰)为参照峰,计算各共有峰的相对保留时间和相对峰面积并计算RSD。药材相对保留时间的RSD<0.16%,相对峰面积的RSD<3%;黄酮部位相对保留时间的RSD<0.24%,相对峰面积的RSD<3%;且药材各谱图相似度均在0.999以上,黄酮部位各谱图相似度均为1.0,符合指纹图谱技术要求,表明仪器精密度良好。
2.1.6 重复性试验 取批号S1的药材和黄酮部位,按照“2.1.4”项下供试液制备方法各平行制备6份,按照“2.1.1”和“2.1.2”项下相应的条件进样测定,以异槲皮苷峰为参照峰,计算各共有峰的相对保留时间和相对峰面积并计算RSD。药材相对保留时间的RSD<0.21%,相对峰面积的RSD<3%;黄酮部位相对保留时间的RSD<0.13%,相对峰面积的RSD<2.6%;且药材各谱图相似度均在0.999以上,黄酮部位各谱图相似度均为1.0,符合指纹图谱技术要求,表明该方法重复性良好。
2.1.7 稳定性试验 取批号S1的药材和黄酮部位供试品溶液,按照“2.1.1”和“2.1.2”项下相应的条件分别于0、2、4、8、12、24 h进样测定,以异槲皮苷峰为参照峰,计算各共有峰的相对保留时间和相对峰面积并计算RSD。药材相对保留时间的RSD<0.43%,相对峰面积的RSD<3%;部位相对保留时间的RSD<0.48%,相对峰面积的RSD<1.25%;且药材各谱图相似度均≥0.999,黄酮部位各谱图相似度均为1.0,符合指纹图谱技术要求,表明供试品溶液在24 h内稳定。
2.1.8 指纹图谱的建立及主要共有峰的指认 分别取15批辣木叶药材和黄酮部位样品溶液,按照“2.1.1”项和“2.1.2”项下条件进样测定,将各样品负离子模式下基峰离子流色谱图(base peak chromatogram,BPC)的原始数据积分后以AIA格式输出,导入“中药色谱指纹图谱相似度评价系统(2012 A版)”,以S1号样品色谱图为参照图谱,采用平均数法,时间窗宽度为0.1,生成特征图谱,经过多点校正和自动匹配,得到辣木叶药材和黄酮部位的UPLC-Q-Exactive Orbitrap-MS指纹图谱叠加图及对照图谱(R),其中,标定出药材17个共有峰,指认了14个峰,各样品图谱见图1和对照图谱见图2,鉴定结果见表2;黄酮部位10个共有峰,指认了10个峰,样品图见图3,对照图谱见图4,鉴定结果见表3。
2.1.9 指纹图谱相似度评价 采用“中药色谱指纹图谱相似度评价系统(2012 A版)”对辣木叶药材及黄酮部位指纹图谱进行相似度评价,以S1为参照图谱,由于11号和D号异槲皮苷色谱峰的分离度、峰形均较好且峰面积稳定,所以选其作为参照峰,计算得到的15批辣木叶药材和黄酮部位的共有峰的相对保留时间及相对峰面积。结果表明显示,共有峰的相对保留时间的RSD<3%,相对峰面积的RSD差异较大,说明不同产地辣木叶所含成分的含量存在较大差异。相似度评价结果(表4、5)表明,除S8和S9 2批的相似度小于0.85外,其余辣木叶药材的相似度均在0.9以上,而15批辣木叶黄酮部位除S9的相似度是0.893,剩余14批的相似度均在0.9以上,说明辣木叶不同产地不同批次的辣木叶药材的整体质量具有较好的一致性,而S8和S9 2批药材可能由于环境因素或者加工、储存、运输方式的原因,造成药材质量不稳定,相似度较差。但是辣木叶经过提取纯化工艺制备后,黄酮部位的相似度基本一致,整体质量达到基本一致。
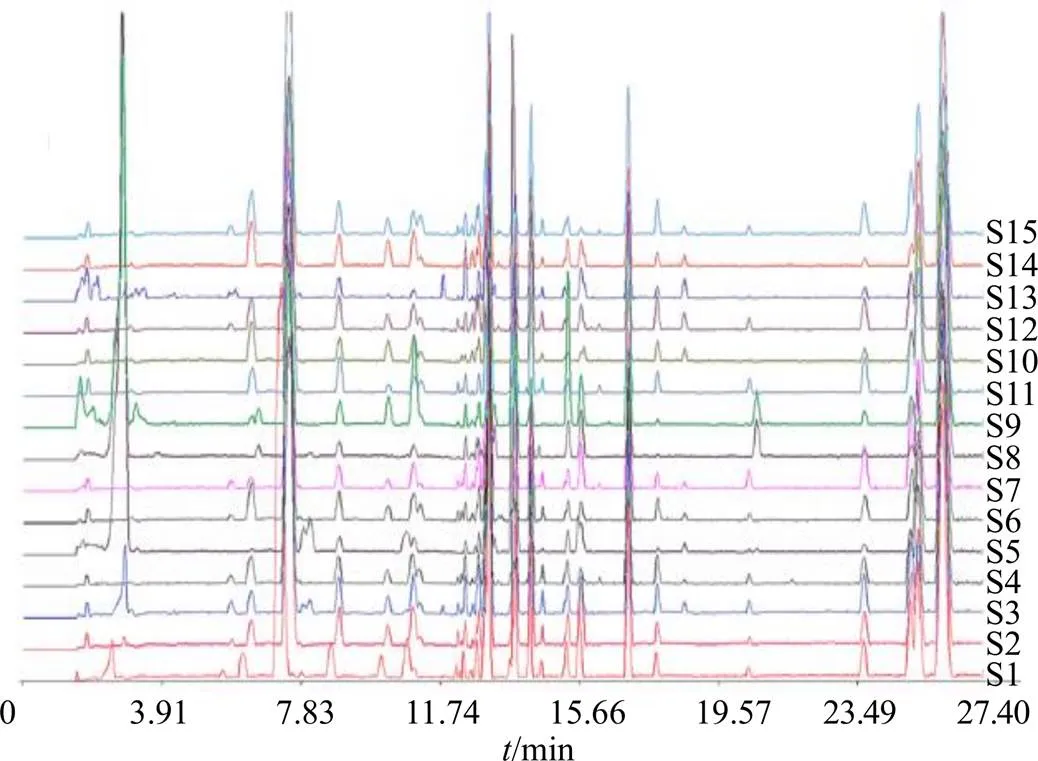
图1 15批辣木叶药材UPLC-Q-Exactive Orbitrap-MS叠加图谱

图2 15批辣木叶药材UPLC-Q-Exactive Orbitrap-MS对照指纹图谱

表2 不同批次辣木叶药材共有峰鉴定结果

图3 15批辣木叶黄酮部位UPLC-Q-Exactive Orbitrap-MS叠加图谱

图4 15批辣木叶黄酮部位UPLC-Q-Exactive Orbitrap-MS对照指纹图谱
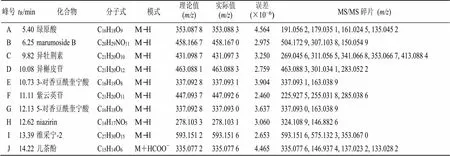
表3 不同批次辣木叶黄酮部位共有峰鉴定结果

表4 15批辣木叶药材相似度评价

表5 15批辣木叶黄酮部位相似度评价
2.2 化学计量学分析
2.2.1 聚类分析(hierarchical clustering analysis,HCA)利用SAS 8.2将15批辣木叶药材共有峰的峰面积进行HCA,采用组间连接法,以平方欧氏距离作为样品测度进行HCA可知,15批辣木叶药材可聚为4类:S5、S13聚为一类,S8、S9聚为一类,S1~S4聚为一类,S6~S12、S14、S15聚为一类。HCA与相似度评价结果基本一致。
2.2.2 主成分分析(principal component analysis,PCA) 将15批辣木叶的17个共有峰的相对峰面积导入SIMCA 14.1软件,采用非监督模式识别法进行PCA,并绘制PCA得分散点图,见图5。15批辣木叶药材可聚为3类:S9、S13聚为一类,S8、S5聚为一类,S1~S4、S5~S10、S11、S12、S14、S15聚为一类。与相似度评价和HCA分析结果基本一致,说明可以将不同产地辣木叶化学特征性成分的差异性通过指纹图谱的差异性来反映。

图5 15批辣木叶药材PCA得分散点图
2.2.3 正交偏最小二乘法-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA) 为了更准确地反映15批辣木叶药材的成分差异,基于PCA的结果,采用监督模式识别法进行OPLS-DA,绘制OPLS-DA模型得分图,见图6。15批辣木叶药材可聚为3类,与PCA结果一致。OPLS-DA模型的主成分回归系数2=0.986,2=0.612,模型预测参数2=0.559,全部大于0.5,说明建立的模型稳定且预测能力强。通过模型变量投影重要性VIP值筛选15批辣木叶的差异化学成分,VIP值越大,表明变量离轴越远,该色谱峰对分类的贡献越大,如图7所示,以VIP>1为显著影响,VIP>1的峰按照大小排序有17、5、15、4、6、3、12号峰,剩余色谱峰的VIP至均小于1,对于分类贡献不大。
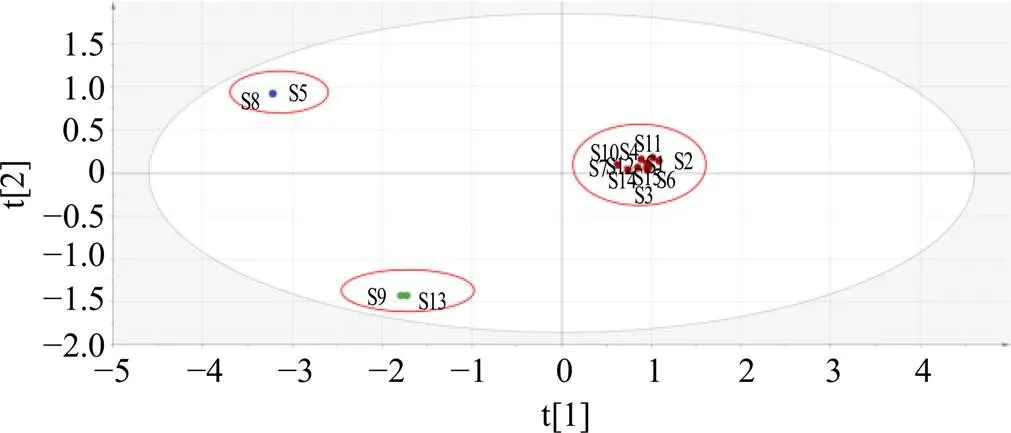
图6 15批辣木叶药材OPLS-DA得分散点图

图7 差异性化学成分VIP图
2.3 黄酮类成分的含量测定
2.3.1 专属性考察 取“2.1.3”项下对照品溶液及“2.1.4”项下供试品溶液,按“2.1.1”和“2.1.2”项下色谱条进样分析,供试品色谱在与对照品色谱相应的保留时间处有相同的色谱峰,说明该方法专属性良好,色谱图见图8。

10-异牡荆素 11-异槲皮苷 13-紫云英苷
2.3.2 线性关系考察 取3种对照品溶液各5.0 mL,混合均匀,定量稀释成分别含有异牡荆素7.60、9.50、15.20、19.00、38.00、76.00 μg/mL,异槲皮苷13.87、17.33、27.73、34.67、69.33、138.67 μg/mL,紫云英苷5.64、7.05、11.28、14.10、28.20、56.40 μg/mL的混合对照品溶液,按照“2.1.1”和“2.1.2”项下相应的色谱条件进样测定分析,以质量浓度为横坐标(),峰面积为纵坐标(),进行线性回归,结果见表6。

表6 3种成分的线性关系考察结果
2.3.3 精密度试验 取批号S1的辣木叶药材和黄酮部位供试品溶液,按照“2.1.1”和“2.1.2”项下相应的色谱条件进样测定,分别连续进样6次,记录峰面积。结果显示,药材异牡荆素、异槲皮苷、紫云英苷峰面积的RSD分别为0.37%、0.28%、0.85%;黄酮部位异牡荆素、异槲皮苷、紫云英苷峰面积的RSD分别为0.38%、0.43%、0.54%。
2.3.4 重复性试验 取批号S1的辣木叶药材和黄酮部位,按照“2.1.4”项下供试液制备方法各平行制备6份,按照“2.1.1”和“2.1.2”项下相应的色谱条件进样测定,计算待测成分含量。结果显示,药材中药材异牡荆素、异槲皮苷、紫云英苷的平均质量分数分别为0.14%、0.38%、0.19%,RSD分别为0.49%、0.32%、0.71%;黄酮部位中中药材异牡荆素、异槲皮苷、紫云英苷的平均质量分数分别为2.81%、12.00%、4.22%,RSD分别为0.39%、1.09%、0.61%。
2.3.5 稳定性试验 取批号S1的辣木叶药材和黄酮部位供试品溶液,按照“2.1.1”和“2.1.2”项下相应的色谱条件分别于0、2、4、8、12、24 h进样测定,记录峰面积。辣木叶药材异牡荆素、异槲皮苷、紫云英苷峰面积的RSD分别为1.71%、4.88%、2.73%;黄酮部位异牡荆素、异槲皮苷、紫云英苷峰面积的RSD分别为0.84%、0.49%、1.04%。
2.3.6 加样回收率试验 取批号S1的辣木叶粉末250 mg,精密称定,共6份,分别加入混合对照溶液(含有异牡荆素0.380 mg/mL、异槲皮苷0.986 mg/mL、紫云英苷0.520 mg/mL)1 mL,精密量取,分别置于100 mL锥形瓶中,加入50%甲醇49 mL,摇匀,称定质量,按照“2.1.4”项下制备供试液,按照“2.1.1”和“2.1.2”项下色谱条件进样测定,计算加样回收率以及RSD。结果表明药材异牡荆素、异槲皮苷、紫云英苷的平均加样回收率分别为100.6%、100.6%、101.4%,RSD分别为1.70%、0.78%、1.35%。
取批号S1的黄酮部位5 mg,精密称定,共6份,分别精密加入混合对照品溶液(含有异牡荆素0.144 mg/mL、异槲皮苷0.612 mg/mL、紫云英苷0.222 mg/mL的混合对照品溶液)1 mL,置于25 mL量瓶中,加50%甲醇溶解并定容,摇匀,按照“2.1.4”项下制备供试液,按照“2.1.1”和“2.1.2”项下色谱条件进样测定,计算加样回收率以及RSD。结果表明黄酮部位异牡荆素、异槲皮苷、紫云英苷的平均加样回收率分别为100.8%、100.2%、101.1%,RSD分别为1.31%、1.64%、1.85%。
2.3.7 样品含量测定 取15批辣木叶药材粉末0.5 g和黄酮部位5.0 mg,精密称量,平行制备3份,按照“2.1.4”项下方法制备得到供试液,并在“2.1.1”和“2.1.2”项下色谱条件进样检测,计算异牡荆素、异槲皮苷、紫云英苷的含量。15批辣木叶药材中异牡荆素、异槲皮苷、紫云英苷的平均质量分数分别为0.13%、0.44%、0.17%;质量分数分布在0.06%~0.19%、0.27%~0.79%、0.49%~1.08%,黄酮部位中异牡荆素、异槲皮苷、紫云英苷的平均质量分数分别为2.3%,10.9%,3.43%,质量分数分布在0.53%~3.53%、6.49%~14.36%、2.05%~4.66%,见表7。由此可见,不同产地不同批次辣木叶中上述3中成分的含量差异明显。
3 讨论
本研究建立了不同产地辣木叶药材和辣木叶黄酮部位的UPLC-Q-Exactive Orbitrap-MS指纹图谱,分别指认14个和10个共有峰。不同产地的辣木叶和黄酮部位的相似度分别为0.767~0.995和0.893~0.998,不同产地的辣木叶药材化学成分含量差异较大,而富集纯化后的黄酮部位相似度差异明显变小。测定了不同产地辣木叶药材和辣木叶黄酮部位中异牡荆素、异槲皮苷、紫云英苷的含量,可为辣木叶药材和黄酮部位的质量控制提供参考。
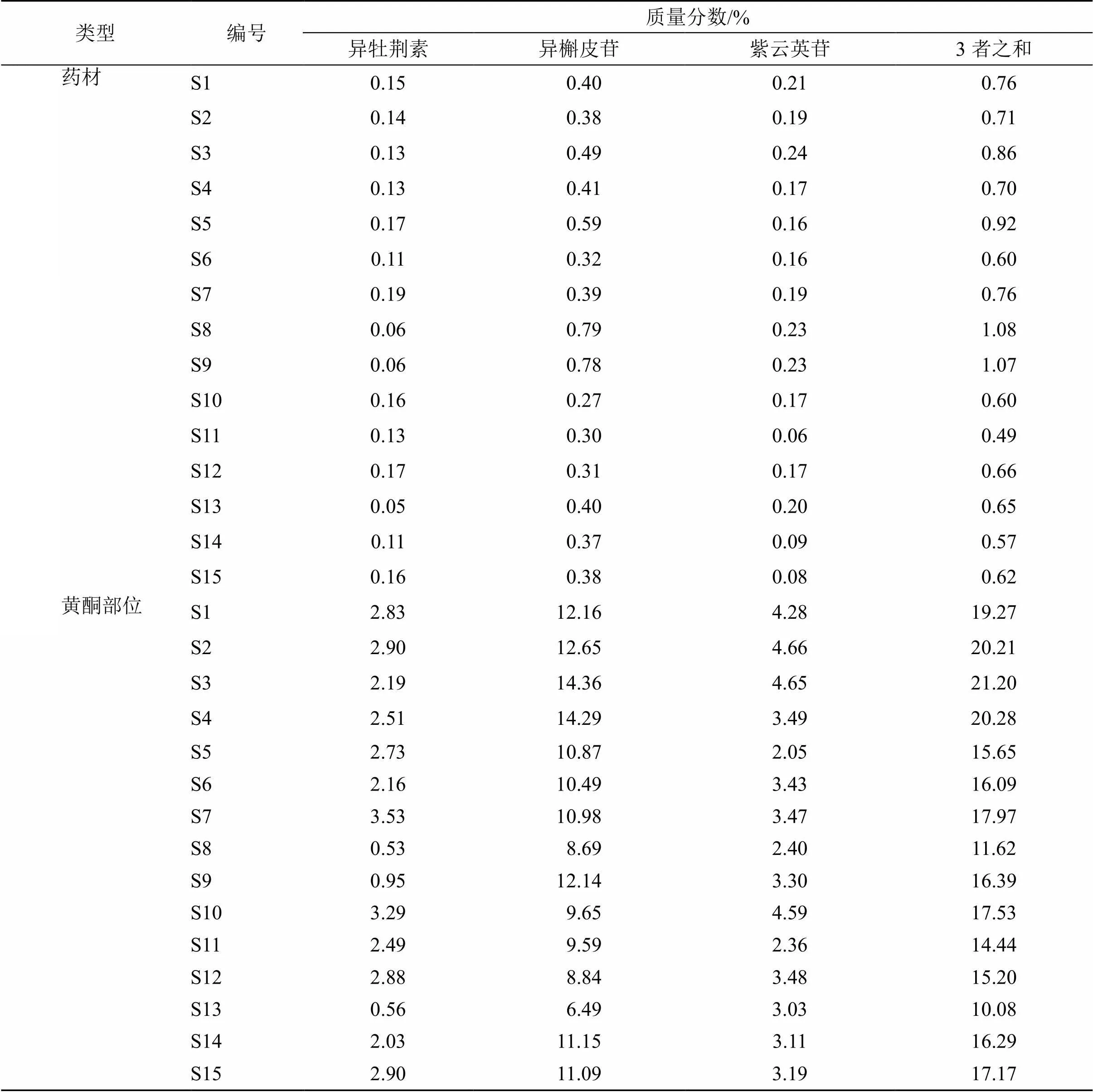
表7 15批辣木叶药材及黄酮部位中3种成分的平均含量(n = 3)
利益冲突 所有作者均声明不存在利益冲突
[1] Stohs S J, Hartman M J. Review of the safety and efficacy of[J]., 2015, 29(6): 796-804.
[2] Liu Y, Wang X Y, Wei X M,. Values, properties and utility of different parts of: An overview [J]., 2018, 10(4): 371-378.
[3] Miettinen D J. Free amino acids and carotenes in the leaves of[J]., 1965, 34(12): 374-375.
[4] Ramiah N N G A. Amino acids and sugars in the flowers and fruits ofLam. (Syn.Gaertn) [J]., 1977, 49(3): 163-165.
[5] 刘凤霞, 王苗苗, 赵有为, 等. 辣木中功能性成分提取及产品开发的研究进展 [J]. 食品科学, 2015, 36(19): 282-286.
[6] 袁静, 梁文仪, 袁永兵, 等. 辣木叶化学成分和药理活性的研究进展 [J]. 中草药, 2021, 52(14): 4422-4432.
[7] 段海霞, 刘常青, 唐晓纯, 等. 不同产地辣木叶HPLC指纹图谱研究 [J]. 食品与药品, 2020, 22(3): 175-179.
[8] 许琳, 范春林, 黄晓君, 等. 辣木叶的UPLC特征指纹图谱研究 [J]. 中国中药杂志, 2018, 43(22): 4474-4478.
[9] 曾明莹, 傅咏梅, 张蜀, 等. 不同产地辣木叶提取物的含量测定及指纹图谱相似性评价 [J]. 云南农业大学学报: 自然科学, 2018, 33(3): 485-493.
[10] 金玲, 娄涛涛, 刘旋, 等. 辣木叶的HPLC指纹图谱 [J]. 中国实验方剂学杂志, 2017, 23(8): 86-91.
[11] 肖丹, 范东生, 刘星, 等. 不同产地铁线蕨药材指纹图谱的建立、分析及差异成分的含量测定 [J]. 中国药房, 2021, 32(17): 2085-2090.
Quality evaluation ofleaves and its flavonoid fractions based on UPLC-Q-Exactive Orbitrap-MS fingerprint and multi-component quantitative analysis
YUAN Jing1, YUAN Yong-bing2, ZHOU Ming1, LIU Yue1, HUANG Ya1, WANG Bao-jin1, CHANG Zi-hao1, LIU Yu-qi1, HU Qian1, CHEN Yin-xin1, ZHOU Li-peng1, LUO Xiao-wei1, WANG Shu-kai1, LIU Xiang-xiang3, ZHANG Lan-zhen1
1. School of Chinese Materia Medica, Beijing University of Chinese Medicine,Beijing 102488, China 2. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3. Guangzhou Zeli Pharmaceutical Technology Co., Ltd., Guangzhou 510663, China
The UPLC-Q-Exactive Orbitrap-MS fingerprints ofleaves and flavonoid fractions from different producing areas were established, and the chemometrics analysis and content determination of important components were carried out to provide reference for the quality control of.leaves.UPLC-Q-Exactive Orbitrap-MS combined with similarity evaluation system of TCM chromatogramtic fingerprin (2012 A edition) were used to establish fingerprint of 15 batches of.leaves and flavonoid fractions from different producing areas (S1—S15). Common peaks were confirmed and their similarities were evaluated, and the contents of the identified components were determined. Stoichiometric analysis methods such as hierarchical clustering analysis (HCA), principal component analysis (PCA), orthogonal partial least squares discriminant analysis (OPLS-DA) were used to evaluate the quality of 15 batches of.leaves and flavonoid fractions from different producing areas.A total of 17 common peaks were identified in 15 batches of.leaves from different producing areas, and 10 common peaks were identified in the flavonoid fraction of.leaves. The similarity and HCA analysis of leaves and flavonoids of 15 batches ofleaves from different producing areas were classified into four groups and the HCA results were basically consistent with the results of similarity evaluation. It was found that they were clustered into three categories by PCA and OPLS-DA analysis. The contents of isovitexin, isoquercitrin and astragalin in 15 batches of medicinal materials were 0.06%—0.19%, 0.27%—0.79% and 0.08%—0.23%, respectively. The contents of isovitexin, isoquercitrin and astragalin in flavonoid fractions were 0.53%—3.53%, 6.49%—14.36% and 2.05%—4.66%, respectively.In this study, the qualitative and quantitative methods of flavonoids in leaves of.from different producing areas with strong specificity and high sensitivity were established to provide a basis for the comprehensive evaluation of flavonoid fractions of leaves of..
leaves ofLam.; flavonoid fractions of leaves of.Lam.; UPLC-Q-Exactive Orbitrap-MS; fingerprint; chemometrics; isovitexin; isoquercetin; astragalin
R286.2
A
0253 - 2670(2022)24 - 7897 - 08
10.7501/j.issn.0253-2670.2022.24.027
2022-06-25
北京中医药大学纵向科研发展基金项目(2022-ZXFZJJ-001)
袁 静,女,硕士研究生,研究方向为药效物质基础及其药理作用。E-mail: yuanjing961103@163.com
张兰珍,研究员,主要从事中药药效物质与质量控制工作。E-mail: zhanglanzhen01@126.com
[责任编辑 时圣明]
