牡荆素与DNA相互作用的机理研究
2014-03-28刘炜,刘红
刘 炜,刘 红
(海南师范大学化学与化工学院,海口571158)
DNA与药物分子相互作用的研究有助于了解药物的作用机理,并更有效地指导新药设计,以DNA作为药物作用靶是有效的新兴的药物筛选和新药设计手段[1-3].
牡荆素属于黄酮苷类化合物,存在于山楂、牡荆、竹叶等植物中,主要用于治疗心血管疾病,也是防癌抗肿瘤的天然药物成分,具有较强的抗氧化、抗癌、抗病毒的药理活性,生物活性测定中对人类癌细胞显示了广泛的细胞毒作用.本论文主要通过紫外吸收光谱法、荧光光谱法和黏度法研究牡荆素与DNA的相互作用,该研究将有助于揭示牡荆素的抗癌机理.

图1 牡荆素结构式Fig.1 The structure of vitexin
1 实验部分
1.1 仪器与试剂
TU-1901紫外可见分光光度计(普析通用,北京),PHS-25型p H计(上海雷磁),日立F-4500荧光分光光度仪(日本).
DNA贮备液:称取0.1 g的鲱鱼精DNA(Sigma公司)以二次蒸馏水定容于100 m L的容量瓶中,由在260 nm处的吸光度(ε=6600 L·mol-1·cm-1)确定其浓度,冰箱中冷藏.
牡荆素(中检所,纯度≥99.8%)贮备液:称取一定量的牡荆素,以乙醇定容至100 mL的容量瓶中配制成浓度为10-3mol/L,置于0至4℃下保存.
缓冲溶液:用盐酸滴加到0.1 mol/L的Tris(三羟甲基氨基甲烷)中,在p H计上调成p H7.4的缓冲溶液.
1.2 实验方法
在10 m L的比色管中依次加入1 m L p H7.4的缓冲溶液、小檗碱、DNA溶液,以及不同量的牡荆素工作溶液,定容、摇匀,进行荧光光谱的测定.荧光激发波长定为358 nm,荧光发射峰位为532 nm,狭缝宽均为5 nm.
在10 m L的比色管中依次加入1 m L p H7.4的缓冲溶液、牡荆素工作溶液和不同量的DNA溶液,定容、摇匀,以试剂空白为参比,进行紫外吸收光谱的测定.
2 结果与讨论
2.1 牡荆素对DNA紫外吸收光谱的影响
图2为牡荆素对DNA紫外吸收光谱的影响.
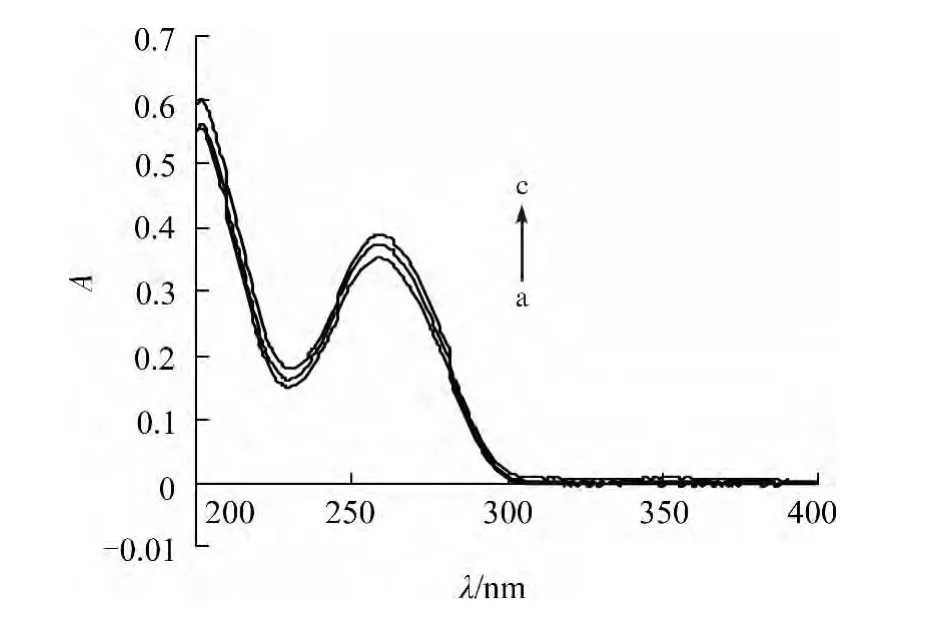
图2 牡荆素对DNA紫外吸收光谱的影响Fig.2 The UV absorption spectra of DNA in the presence of vitexin
从图2中可以看出,DNA在257 nm处有一最大紫外吸收峰,连续加入牡荆素后,其吸收度持续增强,表明牡荆素与DNA发生了反应.由于DNA在257 nm处的吸收峰来自于其碱基对,因此表明牡荆素与DNA的碱基对发生了结合.
2.2 DNA对牡荆素紫外吸收光谱的影响
图3为DNA对牡荆素紫外吸收光谱的影响,由图3可以看出,牡荆素在220 nm及274 nm处各有一紫外吸收峰,DNA的加入导致两处吸收峰的吸光度明显降低,同时紫外吸收峰明显红移(274 nm→279 nm).由于药物与DNA大致有3种结合模式:静电式、嵌入式和沟槽式,其中静电式结合不会发生药物吸收峰的红移或蓝移;如果小分子与DNA是通过嵌入式键合,DNA的加入会引起药物分子的紫外吸收峰发生红移,沟槽式则发生蓝移[4-6].因此,可判断荭草苷与DNA为嵌入式结合.

图3 DNA对牡荆素紫外吸收光谱的影响Fig.3 The UV absorption spectra of vitexin in the presence of DNA
2.3 牡荆素对BR-DNA体系荧光光谱的影响
盐酸小檗碱(BR)可作为荧光探针研究小分子化合物与DNA的相互作用,当药物小分子插入到DNA双螺旋中时,可与小檗碱发生竞争结合DNA的反应,将小檗碱从双螺旋中挤出,从而荧光强度降低[4-5].连续向小檗碱-DNA体系中加入不同量的牡荆素,实验结果如图4所示.小檗碱-DNA体系在532 nm处有一显著荧光发射峰,随着牡荆素的连续加入,其荧光强度持续下降,说明牡荆素对小檗碱-DNA体系发生了荧光猝灭作用.

图4 牡荆素对小檗碱-DNA体系荧光发射光谱的影响Fig.4 The fluorescence emission spectra of BR-DNA in the presence of vitexin
2.4 荧光猝灭方式的判断
由动态猝灭Stern-Volmer 方程:F0/F=1+Kqτ0c=1+Ksvc(1)[7],根据牡荆素对BRDNA的猝灭光谱所得荧光强度计算得F0/F-1,按式(1)对c作线性回归(图5),求得在298 K时,牡荆素对BR-DNA的Stern-Volmer猝灭常数Ksv为5.785×103L/mol(相关系数为0.9647),则其双分子速率常数Kq为5.785×1011L·mol-1·s-1,远大于各猝灭剂对生物大分子最大扩散控制的碰撞猝灭常数2.0×1010L·mol-1·s-1[8],因此牡荆素对BR-DNA的荧光猝灭不是动态猝灭所引起,而是因为形成复合物所产生的静态猝灭.实验结果表明,牡荆素与DNA是以嵌入方式结合,导致小檗碱被挤出DNA双螺旋,从而发生荧光猝灭.

图5 牡荆素与BR-DNA反应的stern-volmer方程Fig.5 Stern-Volmer curves for the binding of vitexin to BR-DNA at 298 K
2.5 牡荆素与DNA的结合常数和结合位点数由静态猝灭公式

由式(2)分别作出不同温度下牡荆素-DNA体系的关系图.结果如图6,通过外推截距和斜率可求出25℃和40℃牡荆素与DNA之间的结合常数分别为1.156×105L·mol-1和1.885×104L·mol-1,结合位点数分别为1.336 3和1.061 5.
2.6 牡荆素与DNA结合反应的热力学性质及作用力的影响
根据热力学公式可以计算药物小分子与生物大分子作用间的有关热力学参数[10-11]:

根据热力学参数可以简单判断其相互作用类型:ΔH>0及ΔS>0为疏水作用,ΔH<0及ΔS>0为静电作用,ΔH<0及ΔS<0为氢键或者范德华作用[12-15].
根据牡荆素与DNA的结合常数K1(298 K)=1.156×105L·mol-1,K2(313 K)=1.885×104L·mol-1,按式(3)~(5)可以求得二者结合过程的热力学参数:
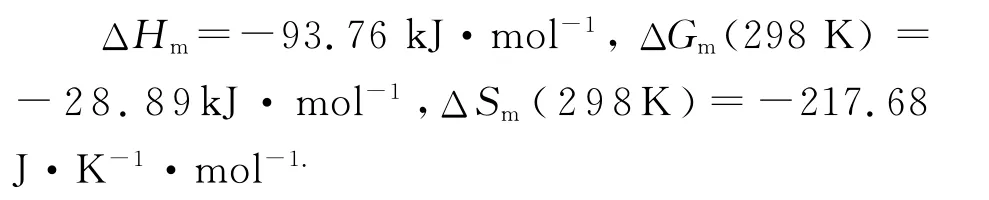
由此可初步判断牡荆素与DNA主要是以氢键或者范德华作用力结合.
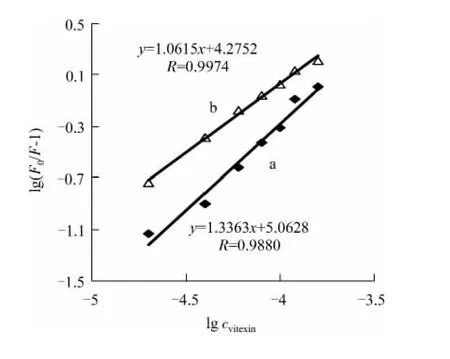
图6 牡荆素与DNA反应的lg[(F 0-F)/F]~lg c关系图Fig.6 The plot of lg[(F 0-F)/F]vs lg c of the reaction between vitexin and DNA

图7 牡荆素对DNA相对黏度的影响Fig.7 The effect of vitexin on the relative viscosity
2.7 牡荆素与DNA反应的黏度研究
当药物分子以嵌入的方式与DNA结合,DNA双螺旋变长,粘度增加[12,16].向固定浓度的DNA溶液中加入不同量的牡荆素,由实验结果,按下式计算相对粘度:η=(t-t0)/t0.式中t0为空白溶液流经毛细管所需时间,t为含不同量牡荆素的DNA溶液流经毛细管所需时间,以(η/η0)1/3对结合比率r(cvitexin/cDNA)作图,η0为未加入牡荆素时DNA的粘度[12],如图7所示.随着牡荆素浓度的增大,DNA相对粘度逐渐增大,由此可知牡荆素与DNA以嵌入方式结合,结果与荧光、紫外光谱结果相吻合.
3 结论
本文利用荧光光谱法和紫外吸收光谱法研究了牡荆素与DNA相互作用的机理,实验结果表明,牡荆素与DNA主要通过氢键或者范德华作用力以嵌入模式结合,从而阻止了细胞中DNA的复制,这可能是牡荆素具有较强抗癌活性的原因之一.25℃和40℃两个不同温度下下牡荆素与DNA之间的结合常数分别为1.156×105和1.885×104L·mol-1,结合位点数分别为1.3363和1.0615.
[1] 吴会灵,杨芃原,张重杰,等.小分子与核酸相互作用的研究进展[J].分析化学,2004,32(9):1256-1261.
[2] Janjua N K,Siddiqa A,Yaqub A,et al.Spectrophotometric analysis of flavonoid-dna binding interactions at physiological conditions[J].Spectrochim Acta A,2009,74:1135-1137.
[3] Zhou J L,Qian Z M,Luo Y D,et al.Screening and mechanism study of components targeting DNA from the Chinese herb Lonicera japonica by liquid chromatography/mass spectrometry and fluorescence spectroscopy[J].Biomed Chromatogr,2008,22:1164-1172.
[4] 刘 炜,张琼梅,毕和平.硫酸长春碱与DNA相互作用的机理研究[J].海南师范大学学报:自然科学版,2010,23(4):403-406.
[5] 沈景山,孙丹丹,付连春,等.荧光光谱法研究抗癌药物与DNA的相互作用[J].光谱学与光谱分析,2005,25(2):232-234.
[6] Li N,Ma Y,Yang C,et al.Interaction of anticancer drug,mitoxantrone with DNA analyzed by electrochemical and spectroscopic methods[J].Biophys Chem,2005,116:199-205.
[7] 邓胜国,邓泽元,范亚苇,等.荷叶中紫云英苷和DNA相互作用的光谱学研究[J].光谱学与光谱分析,2010,30(2):476-480.
[8] Kandagal P B,Seetharamappa J,Shaikh S M T,et al.Bind-ing of trazodone hydrochloride with human serum albumin:A spectroscopic study[J].J Photochem Photobiol A,2007,185:239-244.
[9] Kandagal P B,Ashoka S,Seetharamappa J,et al.Study of the interaction of an anticancer drug with human and bovine serum albumin:Spectroscopic approach[J].J Pharmaceutical and Biomedical Anal,2006,41:393-399.
[10] 刘 炜,张琼梅,史载锋,等.酒石酸长春质碱与DNA相互作用的光谱研究[J].华中师范大学学报:自然科学版,2011,45(4):595-598
[11] Zhao N,Wang X M,Pan H Z,et al.Spectroscopic studies on the interaction between tryptophan-erbium(III)complex and herring sperm DNA[J].Spectrochim Acta A,2010,75:1435-1442.
[12] 刘 炜,张琼梅.岩白菜素与DNA相互作用的光谱研究[J].海南师范大学学报:自然科学版,2011,24(2):177-179.
[13] Bi S,Zhang H,Qiao C,et al.Studies of interaction of emodin and DNA in the presence of ethidium bromide by spectroscopic method[J].Spectrochim Acta A,2008,69:123-129.
[14] Yuan J L,Liu H,Kang X,et al.Characteristics of the isomeric flavonoids apigenin and genistein binding to hemoglobin by spectroscopic methods[J].J Mol Struct,2008,891:333-339.
[15] Lu Y,Lv J,Zhang G S,et al.Interaction of an anthracycline disaccharide with ctDNA:Investigation by spectroscopic technique and modeling studies[J].Spectrochim Acta A,2010,75:1511-1515.
[16] Bhat I H,Tabassum S.Synthesis of new piperazine derived Cu(II)/Zn(II)metal complexes,their DNA binding studies,electrochemistry and anti-microbial activity:validation for specific recognition of Zn(II)complex to DNA helix by interaction with thymine base[J].Spectrochim Acta A,2009,72:1026-1033.
