基于NELL2 Lumicrine信号通路探索引阳索胶囊对肾阳虚型精子损伤的保护作用及机制
2022-12-28徐盼瑜李佳珊杜寒倩李泽辉
徐盼瑜,李佳珊,杜寒倩,李泽辉,李 源,林 娜,徐 颖*
基于NELL2 Lumicrine信号通路探索引阳索胶囊对肾阳虚型精子损伤的保护作用及机制
徐盼瑜1, 2,李佳珊2,杜寒倩2,李泽辉2,李 源2,林 娜2,徐 颖1, 2*
1. 上海中医药大学 中药研究所,上海 201203 2. 中国中医科学院 中药研究所,北京 100700
研究引阳索胶囊对腺嘌呤诱导的肾阳虚大鼠精子损伤的保护作用,并从睾丸神经表皮样生长因子2(neural EGFL like 2,NELL2)Lumicrine信号通路探索其作用机制。雄性SD大鼠随机分为对照组、模型组、引阳索(432 mg/kg)组和左卡尼汀(100 mg/kg)组,每组10只。连续ig腺嘌呤(200 mg/kg)14 d建立大鼠肾阳虚模型,并通过观察大鼠肾阳虚证候表现、眼眶取血检测血清中睾酮水平判断造模是否成功;造模同时给予药物干预49 d后取材,计算睾丸、附睾脏脑系数;计算机辅助精子分析(computer assisted sperm analysis,CASA)检测附睾精子动力学参数;光镜下进行精子计数、精子畸形率检测;精子荧光检测精子活率;苏木素-伊红(HE)染色观察睾丸、附睾组织病理变化;ELISA法检测血清中睾酮水平;免疫荧光法观察睾丸NELL2分泌及附睾c-ros癌基因1(ROS proto-oncogene 1,ROS1)表达;Western blotting检测附睾蛋白酶卵磷脂酶2(ovochymase 2,OVCH2)和精子去整合素金属蛋白酶3(a disintegrin and metalloproteinase 3,ADAM3)表达。与模型组比较,引阳索胶囊可改善肾阳虚大鼠毛发粗糙脱落、精神不振、蜷缩拱背、尿量增多、体质量降低等肾阳虚证候表现,升高睾丸、附睾脏脑系数(<0.01);显著提高精子数量、精子活率、各精子动力学参数(<0.05、0.01、0.001),降低精子畸形率,降低曲细精管病变率(<0.001),升高14、49 d血清中睾酮水平(<0.01、0.001);显著升高睾丸NELL2及附睾ROS1、OVCH2、ADAM3蛋白表达水平(<0.05、0.01、0.001)。引阳索胶囊对腺嘌呤诱导的肾阳虚大鼠精子损伤具有保护作用,其机制可能与其调节NELL2 Lumicrine信号通路参与精子发生成熟过程有关。
引阳索胶囊;神经表皮样生长因子2;Lumicrine;肾阳虚;精子损伤
我国2021年人口出生率降至0.752%[1],出生人口少于死亡人口,进入人口负增长时代,男性不育症的发病率正逐年上升,已成为影响我国国计民生、社会和谐的重大问题。其中少弱精症是男性不育的核心病症,目前尚无特效治疗方案,临床上多以性激素类药物作为内分泌治疗或口服左卡尼汀为主,但有出现性欲减退、肝功能损害等不良反应的报道[2-3]。中医学认为“肾藏精,主生殖”,少弱精症在中医学上属“精少”“精寒”“精薄”“精冷”的范畴[4],目前对少弱精症病因病机的认识复杂,主要包括肾精虚衰[5]、肝郁气滞[6]、电磁辐射、微生物的感染等“毒、虫”因素、慢性前列腺炎、精索静脉曲张等“湿热瘀”范围的疾病因素等[7]。病位在肾精,临床治疗大多在“补肾”基础上进行辨证论治,包括肾阳虚衰、肾阴不足、肾精亏损等[8]。引阳索胶囊由淫羊藿浸膏、五味子浸膏组成,临床上用于治疗阳痿早泄、腰膝酸软、津亏自汗、头晕目眩[9]。目前针对引阳索胶囊的研究仅集中在质量标准研究[10]及临床早泄联合治疗[11]上,并未有其对少弱精症的药效及机制研究。
2020年日本学者Kiyozumi等[12]在发表的研究论文证明睾丸生殖细胞会分泌一种精子成熟因子(Lumicrine)——睾丸神经表皮样生长因子2(neural EGFL like 2,NELL2)与附睾上的c-ros癌基因1(ROS proto-oncogene 1,ROS1)特异性结合,帮助附睾分化成熟;随后附睾分泌蛋白酶卵磷脂酶2(ovochymase 2,OVCH2),作用于精子去整合素金属蛋白酶3(a disintegrin and metalloproteinase 3,ADAM3),使其加工成熟,精子才具有正常受精的能力。这项研究确定了睾丸-附睾-精子成熟(NELL2-ROS1-OVCH2-ADAM3)Lumicrine信号传递是男性生育所必需的精子发育系统,澳大利亚学者也在撰文评点Lumicrine精子成熟系统的发现有望解决男性不育问题[13]。因此本研究以腺嘌呤诱导的肾阳虚大鼠精子损伤模型为载体,通过对Lumicrine信号通路相关靶点的验证,探讨具有精子保护潜力的中成药引阳索胶囊对精子数量及质量的影响,并明确其作用机制,以期发现引阳索胶囊新适应证,提高其临床应用价值。
1 材料
1.1 动物
SPF级雄性SD大鼠40只,9周龄,体质量330~340 g,购自北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2019-0008。动物饲养于中国中医科学院中药研究所实验动物中心,恒温恒湿,自然昼夜节律光照,自由活动、饮水、进食,适应性饲养7 d后开始实验。动物实验通过中国中医科学院中药研究所实验动物福利伦理审查(批准号2021B166)。
1.2 药品与试剂
腺嘌呤(批号S18009)购自上海源叶生物科技有限公司;引阳索胶囊(批号9694)购自四川通园制药集团有限公司;左卡尼汀口服液(批号210372)购自沈阳第一制药有限公司;精子活/死细胞染色试剂盒(批号HR0444)购自北京百奥莱博科技有限公司;大鼠睾酮ELISA试剂盒(批号E-EL-0155c、ml059506)分别购自Elabscience、上海酶联科技生物有限公司;NELL2抗体、OVCH2抗体、ROS1抗体(批号分别为YT7088、YN3162、YN0013)购自美国ImmunoWay公司;ADAM3抗体(批号sc365288)购自美国Santa Cruz公司;GAPDH抗体(批号PA1-987)购自美国Thermo Fisher Scientific公司;Dylight 594标记的山羊抗兔抗体(批号E032410)、HRP标记的山羊抗兔/鼠二抗(批号分别为E030120、E030110)购自美国Earthox公司;含DAPI抗荧光淬灭封片剂(批号P0131)购自碧云天生物技术。
1.3 仪器
BSA224S型天平(赛多利斯科学仪器有限公司);BX60型正置显微镜(日本Olympus公司);HH-S4A型水浴锅(科伟);EOS计算机辅助精子分析仪(北京穗加软件公司);FV1000型激光共聚焦显微镜(日本Olympus公司);Power Pac Basic型电泳仪和转膜仪(美国Bio-Rad公司);TS-1型水平摇床(江苏海门其林贝尔仪器制造有限公司);涡旋混合器(北京金北德工贸有限公司);Fusion FX5型凝胶成像仪(法国Vilber公司)。
2 方法
2.1 造模、分组及给药
将40只9周龄雄性SD大鼠,依据体质量按随机数表法分为对照组、模型组、引阳索(432 mg/kg,相当于临床2倍剂量)组和左卡尼汀(100 mg/kg)组,每组10只。大鼠适应性饲养7 d后,除对照组外,其余各组连续ig腺嘌呤(200 mg/kg)14 d造模,造模同时各给药组ig引阳索胶囊及左卡尼汀口服液,1次/d,连续49 d,对照组和模型组ig等体积0.3%羧甲基纤维素钠。
2.2 造模效果评价
给予腺嘌呤14 d后观察大鼠在造模后的肾阳虚证候表现,每3天测定大鼠体质量1次,并记录精神状态、排尿情况、毛发色泽等;于第15天给药前每组随机取6只大鼠眼眶取血,按ELISA试剂盒说明书测定血清中雄激素睾酮水平。
2.3 脏脑系数测定
第49天给药结束后,各组大鼠禁食12 h,ip戊巴比妥钠麻醉,腹主动脉取血,取睾丸、附睾、全脑称定质量,计算脏脑系数。
脏脑系数=脏器质量/全脑质量
2.4 附睾精子动力学参数、精子活率、精子计数及精子畸形率检测
取各组大鼠左侧附睾尾,置于2 mL无酚红DMEM培养基(37 ℃预热)中剪碎,充分摇匀,置于37 ℃水浴锅中孵育10 min,使精子全部游出附睾。取1滴精子混合液滴在玻片上,利用计算机辅助精子分析(computer assisted sperm analysis,CASA)技术观察曲线速度、平均路径速度、直线性、前向性、摆动性及鞭打频率。
吸取20 μL新鲜精子悬液至提前配好的PI(稀释3000倍)、CAM(稀释200倍)染色液中,染色30 min后于共聚焦显微镜200倍油镜下镜检。若精子头、体、尾部均呈现绿色荧光,则表示精子处于存活状态,且在镜下能明显看到精子活动,成片有虚影;若精子头尖端呈现绿色荧光而后端呈现红色荧光,且体部绿色荧光明显,表示此时精子正处于存活与死亡的过渡期,而死亡精子头部将完全呈现红色荧光[14]。计算存活精子及过渡期精子数目总和与总精子数的比值。
将剩余精子悬液置于60 ℃水浴锅中灭活10 min,将灭活后的精子悬液稀释后置于血细胞计数板上进行计数。吸取5 μL滴至载玻片上,均匀推片,静置晾干。随后用甲醇固定10 min,静置晾干后伊红染色1.5 h,流水冲干后静置晾干。在显微镜下计数不同视野每200条精子中畸形精子数目。
2.5 睾丸、附睾组织病理学及血清中睾酮水平检测
将各组大鼠右侧睾丸、附睾放在4%中性甲醛固定液中进行固定,随后石蜡包埋、切片,苏木素-伊红(HE)染色。光镜下观察睾丸和附睾组织病理改变,观察睾丸生精小管结构及病变程度、管腔中精子数量及分布,附睾中附睾管的结构和大小、生精细胞块脱落程度、管腔中精子的数量及分布等。
按ELISA试剂盒说明书测定血清中雄激素睾酮水平。
2.6 免疫荧光法测定大鼠睾丸组织NELL2、附睾组织ROS1蛋白表达
取各组大鼠睾丸、附睾石蜡切片,脱水,抗原修复,5%牛血清白蛋白封闭,滴加NELL2(1∶200)、ROS1(1∶100)抗体,4 ℃孵育过夜,滴加结合荧光山羊抗兔二抗(1∶400),滴加含DAPI的防荧光淬灭封片剂,荧光显微镜下观察并采集图像,采用Image J软件统计平均荧光强度。
2.7 Western blotting测定大鼠附睾组织OVCH2、ADAM3蛋白表达
取各组大鼠附睾组织,于冰上匀浆、裂解后,采用BCA蛋白定量试剂盒测定蛋白浓度,加入5×蛋白上样缓冲液,100 ℃水浴5 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭后,分别加入OVCH2(1∶500)、ADAM3(1∶500)、GAPDH(1∶5000)抗体,4 ℃孵育过夜;TBST洗膜后,加入HRP标记的山羊抗兔/鼠二抗(1∶5000),室温孵育2 h,TBST洗膜后,采用凝胶成像仪成像,Image J软件分析条带灰度值。
2.8 统计学分析
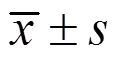
3 结果
3.1 腺嘌呤造模效果评价
如图1-A所示,腺嘌呤造模期间,对照组大鼠体质量逐渐增加,毛发光滑,精神良好,进食饮水、排便排尿均正常;模型组大鼠随着给予腺嘌呤时间延长,体质量逐渐降低,并于给药14 d降至最低(<0.001),毛发脱落且粗糙,精神不振,反应迟钝,蜷缩拱背,尿量增加,表现明显肾阳虚症状;引阳索组和左卡尼汀组大鼠体质量随着给予腺嘌呤时间延长亦逐渐降低,但下降程度较模型组减轻,尤以14 d时与模型组比较差异有统计学意义(<0.05、0.01),同时肾阳虚状态亦较模型组有不同程度的减轻,表明引阳索胶囊及左卡尼汀对腺嘌呤致肾阳虚大鼠体质量及体征均有一定程度的保护作用。如图1-B所示,造模14 d后,与对照组比较,模型组大鼠血清中睾酮水平明显降低(<0.001);与模型组比较,引阳索组和左卡尼汀组血清中睾酮水平均明显升高(<0.01)。表明腺嘌呤致大鼠肾阳虚模型制备成功,且引阳索胶囊及左卡尼汀口服液对腺嘌呤致大鼠肾阳虚症有一定的预防作用。

与对照组比较:#P<0.05 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
3.2 引阳索胶囊对肾阳虚大鼠脏脑系数影响
如表1所示,对照组大鼠睾丸饱满、充盈、鞘膜韧性强,附睾呈半月形,紧贴于睾丸上端及后缘;与对照组比较,模型组大鼠睾丸、附睾均有明显萎缩,睾丸、附睾脏脑系数均明显降低(<0.01、0.001);与模型组比较,引阳索组及左卡尼汀组大鼠睾丸、附睾大小均较为正常,形状舒展,同时脏脑系数均有显著上升,其中引阳索组对肾阳虚大鼠脏脑系数的改善作用优于左卡尼汀组,呈现较好药效(<0.01)。
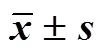
表1 引阳索胶囊对肾阳虚大鼠睾丸、附睾脏脑系数的影响(, n = 10)
与对照组比较:#<0.05##<0.01###<0.001;与模型组比较:*<0.05**<0.01***<0.001,下表同
#< 0.05##< 0.01###< 0.001control group;*< 0.05**< 0.01***< 0.001model group, same as below tables
3.3 引阳索胶囊对肾阳虚大鼠附睾精子数量、精子活率、精子畸形率及精子各动力学参数的影响
如图2~4和表2所示,对照组大鼠精子密度高,头部呈镰刀型,体部修长,尾部自然弯曲,整体形态流畅;与对照组比较,模型组大鼠精子数量减少(<0.001),精子活率低(<0.001),镜下很难观察到活动精子,精子畸形率显著升高(<0.001),过渡期精子数目亦减少,精子曲线速率、平均路径速度、前向性、摆动性等精子动力学参数显著降低(<0.05、0.01),精子直线性、鞭打频率也有所降低。与模型组比较,引阳索显著增加精子数量(<0.01),同时一定程度上降低了精子畸形率,在相同染色条件下,精子存活时间更长,精子活力增加,处于过渡期精子数量增多,精子活率显著升高(<0.001);显著增加精子曲线速率、平均路径速度、直线性、前向性、摆动性、鞭打频率等精子各动力学参数(<0.05、0.01);与左卡尼汀组比较,引阳索组在对精子数量、精子畸形率方面的改善作用相对较弱,但在精子活率、精子动力学参数方面的改善作用较突出,可见引阳索胶囊可通过提高精子数量、精子形态以及精子活力改善精子质量,并且对精子活力、动力方面的保护作用优于左卡尼汀,呈现良好药效。

a-正常精子 b-无头 c-波状体 d-折叠体 e-折叠尾 f-卷体 g-颈弯曲 h-无钩

图3 引阳索胶囊对肾阳虚大鼠精子数量和精子畸形率的影响(, n = 10)

a-存活精子 b-过渡期精子 c-死亡精子
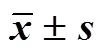
表2 引阳索胶囊对肾阳虚大鼠精子动力学参数的影响(, n = 10)
3.4 引阳索胶囊对肾阳虚大鼠睾丸、附睾组织病理学及血清中睾酮水平的影响
如图5、6所示,对照组大鼠睾丸生精小管呈圆形,各级生精细胞规则排列,层次清晰,脱落细胞较少;附睾管直径较大,形状舒展,腔内可见大量精子。模型组大鼠睾丸和附睾出现明显的组织病理学改变,睾丸生精小管病变率显著增加(<0.001),生精小管结构不规则,腔内脱落细胞块增多,线性精子数量变少,生精细胞排列紊乱;附睾管形态崎岖,脱落细胞块增多,精子排列紊乱、数量减少。与模型组比较,引阳索组大鼠睾丸生精小管病变率显著下降(<0.001),能改善肾阳虚大鼠睾丸、附睾病理状态,使睾丸生精小管截面积增加,生精细胞排列规则,管腔内可见脱落的生精细胞数减少,线性精子数量增多;附睾管形状舒展,排列紧密,管内脱落细胞块减少,精子数量增多且分布均匀。与左卡尼汀组比较,引阳索组降低大鼠睾丸曲细精管病变率效果更显著,且生精小管内精子数量较多,生精细胞排列更整齐,附睾管腔内线性精子数分布更均匀。与对照组比较,模型组血清中睾酮水平明显降低(<0.001);与模型组比较,引阳索组和左卡尼汀组均能明显升高血清中睾酮水平(<0.001),且引阳索组升高睾酮效果优于左卡尼汀组,睾酮水平甚至恢复正常。

图5 引阳索胶囊对肾阳虚大鼠睾丸、附睾组织病理学的影响
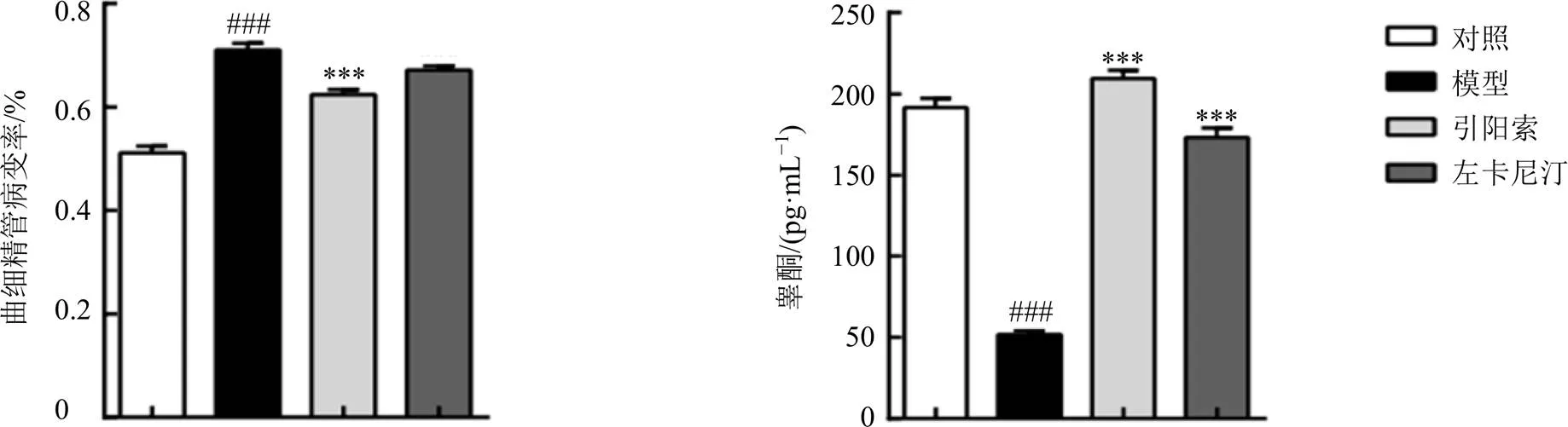
图6 引阳索胶囊对肾阳虚大鼠曲细精管病变率 (n = 6) 及血清中睾酮水平(n = 10) 的影响()
3.5 引阳索胶囊对肾阳虚大鼠睾丸NELL2、附睾ROS1蛋白表达的影响
如图7和表3所示,与对照组比较,模型组大鼠睾丸NELL2、附睾ROS1的表达显著降低(<0.001);与模型组比较,引阳索组及左卡尼汀组均显著升高NELL2、ROS1表达(<0.05、0.001),且引阳索胶囊对肾阳虚大鼠附睾ROS1的上调作用优于左卡尼汀,表明引阳索胶囊可能通过增加Lumicrine信号通路源头NELL2表达,同时保护附睾,帮助附睾头部发育,发挥对肾阳虚大鼠精子损伤的保护作用。

图7 引阳索胶囊对肾阳虚大鼠睾丸NELL2和附睾头部ROS1蛋白表达的影响
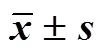
表3 引阳索胶囊对肾阳虚大鼠睾丸NELL2、附睾ROS1蛋白表达的影响(, n = 6)
3.6 引阳索胶囊对肾阳虚大鼠附睾OVCH2、精子ADAM3蛋白表达的影响
如图8所示,与对照组比较,模型组大鼠附睾OVCH2、2种形式ADAM3蛋白表达水平均明显降低(<0.05、0.001);与模型组比较,引阳索组及左卡尼汀组均可显著升高OVCH2、2种形式ADAM3蛋白表达水平(<0.05、0.01、0.001),且引阳索胶囊对附睾OVCH2的促分泌作用及对ADAM3的加工作用优于左卡尼汀,表明引阳索胶囊可能通过调节Lumicrine信号通路中附睾OVCH2分泌、帮助精子头部ADAM3加工,发挥对肾阳虚大鼠精子损伤的保护作用。

图8 引阳索胶囊对肾阳虚大鼠附睾OVCH2、精子ADAM3蛋白表达的影响(, n = 3)
4 讨论
近年来少弱精症发病率逐年升高,中医药以多成分、多靶点、多途径的独特优势,已在少弱精症的临床治疗上占据一席之地。如今补肾中药行业市场规模已增长至2020年的548.5亿元,其中补肾中成药一直保持27%左右的份额[15]。然而目前大部分补肾中成药上市前临床研究主要关注患者的症状、体征,缺乏明确药效机制验证,加之早期中成药由于不强制要求上市后再评价,使得大部分补肾壮阳品种未开展再评价工作[16],导致许多药效优良、价格低廉的补肾中成药未能得到足够的重视利用及开发。因此,在这种市场环境和临床需求牵引下,对补肾壮阳优势中药品种药效及机制再评价尤为重要。
本研究对上市药引阳索胶囊进行了精子保护药效方面的再评价工作,揭示了精子发生到成熟过程中从睾丸到附睾这一接连不断的生物进程实质,结果表明,引阳索胶囊可显著降低肾阳虚大鼠睾丸曲细精管病变比例,促进睾丸生精小管正常发育,同时显著升高血清睾酮水平,从激素内分泌及生殖源头靶器官水平保证精子发生的稳定环境,进而显著提高精子数量;改善附睾组织病理学异变,调节附睾管管壁厚度、排列顺序,为精子创造适宜发育环境,促进精子发育成熟,获得受精和渐进运动的功能,进而改善精子活率、精子动力学参数,提升精子质量。本研究联合激素内分泌及靶器官相关检测指标,发现引阳索胶囊可通过保护睾丸、附睾的正常发育,创造适宜精子发生及成熟的管腔环境,进而提升精子质量,起到精子保护的作用。
哺乳动物精子发生过程是在睾丸中进行的,成熟完整、功能完备的睾丸为精子提供适宜发育的微环境,形态正常的精子进入附睾,在下一个靶器官内获得渐进运动和使卵子受精的能力。而附睾通常分为附睾近端IS区、附睾体和附睾尾3个主要区域。研究表明,在精子发生的同时,不同阶段的睾丸生精细胞将分泌Lumicrine精子成熟因子——NELL2,通过睾丸输出小管流入附睾,与附睾表面ROS1特异性结合,介导附睾头部IS端的发育,进而帮助附睾起始IS端分化成熟。随后发育成熟的附睾近端IS区的上皮细胞进而特异性分泌能够使得精子发育成熟的相关蛋白OVCH2,并靶向作用于位于精子头部的跨膜蛋白ADAM3,使其加工成熟,随后精子才会成熟并获得使卵母细胞受精的能力,通过子宫输卵管连接处进入输卵管并与卵母细胞细胞外基质透明带结合[17-21]。Lumicrine信号通路参与附睾器官的成熟、精子成熟蛋白的装配,在精子成熟过程中起着关键性作用。
本研究通过免疫荧光及Western blotting方法,以肾阳虚型精子损伤大鼠为载体,对上市药引阳索胶囊的精子保护作用机制进行了再评价工作。结果表明,腺嘌呤致毒损害睾丸、附睾等相应生殖靶器官,造成睾丸生精细胞发育受阻,精子发生减少,睾丸NELL2分泌减少,同时造成附睾发育不良,无法表达足够数量的ROS1受体,阻碍两者的结合,进一步导致附睾的不正常分化,降低OVCH2的分泌,减少精子头部ADAM3的加工,最终阻断Lumicrine信号通路。而引阳索胶囊能够在一定程度上保护睾丸生精细胞及支持细胞,提升睾丸NELL2的分泌量,促进NELL2与附睾ROS1结合,通过对附睾上皮细胞及附睾管的保护提升ROS1的表达量促进肾阳虚大鼠附睾的分化,帮助附睾IS端发育成熟,进而提高附睾管腔OVCH2的分泌、帮助睾丸中产生的精子进行头部ADAM3的加工,使其获得受精能力,保证精子质量,提示引阳索胶囊可能通过Lumicrine信号通路改善肾阳虚大鼠精子损伤。
引阳索胶囊由淫羊藿、五味子2味药组成,具补肾、壮阳、生津之功效,方中的淫羊藿自古以来便是补命门、益精气、补肾壮阳之要药,主要起生精、增加精液分泌量的作用[22],研究表明,淫羊藿可提高少弱精症患者精子密度,改善精子前向运动力[23]、提升精子活率[24]、改善精子线粒体结构和功能[25]。而方中的另一味药五味子,具有收敛固涩、补肾宁心之功效,研究表明,五味子可有效增强抗氧化酶活性,保证精子膜完整性,保护精子不被氧化损伤[26],同时可促进性激素正常分泌,改善睾丸生精功能,提高精子数量和质量[27]。2种中药既温补肾阳,又能滋肾阴、补肾气、调和阴阳、扶正固本,具有改善少弱精症患者的精子损伤状态、发挥精子保护作用的极大潜力。
综上,引阳索胶囊对腺嘌呤所致肾阳虚型大鼠精子损伤具有保护作用,其作用机制可能与Lumicrine信号通路有关,通过上调靶蛋白NELL2、ROS1的表达促进附睾成熟及OVCH2分泌,帮助精子头部ADAM3蛋白加工完全,获得受精能力,对男性生殖关键靶器官睾丸、附睾的发育及体内激素的分泌均具有良好的调节作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 赵晨熙. 拿什么提高民众生育意愿 [J]. 法治与社会, 2022(4): 60-61.
[2] Shoshany O, Abhyankar N, Mufarreh N,. Outcomes of anastrozole in oligozoospermic hypoandrogenic subfertile men [J]., 2017, 107(3): 589-594.
[3] Busetto G, del Giudice F, de Berardinis E,. A systematic review and meta-analysis of clinical trials implementing aromatase inhibitors to treat male infertility [J]., 2020, 22(4): 360.
[4] 王莉, 姜珊珊, 王亚玲, 等. 少弱精子症中医研究进展 [J]. 中医药临床杂志, 2017, 29(2): 296-298.
[5] 管鹏飞, 徐新宇, 应志康, 等. 中医药治疗少精子症的研究进展 [J]. 中国中医药科技, 2022, 29(3): 521-523.
[6] 陶方泽, 周小敏, 方跃坤, 等. 崔云教授治疗少弱精子症遣方用药特色探讨 [J]. 浙江中医药大学学报, 2017, 41(2): 103-107.
[7] 吕小洽, 郭明菲, 孙自学, 等. 王琦教授治疗男性不育症的思路 [J]. 中国中医药现代远程教育, 2017, 15(17): 74-76.
[8] 张哲. 紫蓉汤治疗男性不育症 (肾阳虚衰证) 的临床研究 [D]. 长春: 长春中医药大学, 2019.
[9] 孟淑智, 王忠海. 引阳索的质量研究 [J]. 中国药品标准, 2009, 10(4): 262-264.
[10] 王喜明. 引阳索颗粒剂中淫羊藿苷的含量测定研究 [J]. 科技情报开发与经济, 2012, 22(24): 120-121.
[11] 王博, 王锡智. 引阳索胶囊联合舍曲林治疗早泄的临床疗效观察 [J]. 医学信息, 2015, 28(28): 128-129.
[12] Kiyozumi D, Noda T, Yamaguchi R,. NELL2-mediated lumicrine signaling through OVCH2 is required for male fertility [J]., 2020, 368(6495): 1132-1135.
[13] Lord T, Oatley J M. Testicular-borne factors affect sperm fertility [J]., 2020, 368(6495): 1053-1054.
[14] 周定杰, 靳镭. 荧光染色技术在精子检测中的应用 [J]. 中国优生与遗传杂志, 2007, 15(7): 1-3.
[15] 孙雪姣, 高珊. 补肾中成药市场竞争环境分析 [J]. 大众投资指南, 2018(14): 257-259.
[16] 陈玉欢, 凌霄, 李春晓, 等. 中药上市后临床再评价研究思路探讨 [J]. 中国新药杂志, 2021, 30(24): 2262-2267.
[17] Xin A J, Zhao Y, Yu H G,. Characterization of β-defensin 42 expressed in principal cells at the initial segment of the rat epididymis [J]., 2015, 47(11): 861-869.
[18] Xu B F, Washington A M, Hinton B T. Initial segment differentiation begins during a critical window and is dependent upon lumicrine factors andproto-oncogene () in the mouse [J]., 2016, 95(1): 15.
[19] Lagarrigue M, Lavigne R, Guével B,. Spatial segmentation and metabolite annotation involved in sperm maturation in the rat epididymis by MALDI imaging mass spectrometry [J]., 2020, 55(12): e4633.
[20] Ben Maamar M, Beck D, Nilsson E,. Developmental alterations in DNA methylation during gametogenesis from primordial germ cells to sperm [J]., 2022, 25(2): 103786.
[21] 许钰薇, 李文婧, 茅欣怡, 等. 精子tsRNA在父系遗传中的作用 [J]. 国际生殖健康/计划生育杂志, 2022, 41(1): 37-41.
[22] 李铖, 崔毓桂, 覃莲菊, 等. 淫羊藿(苷) 对男性生殖系统的作用和机制 [J]. 国际生殖健康/计划生育杂志, 2022, 41(3): 236-239.
[23] 简百录, 张晓霞, 乔少谊, 等. 生精汤治疗少弱精子症60例 [J]. 陕西中医, 2013, 34(7): 859-860.
[24] 杨亚璋, 孙迪, 李杰, 等. 复方玄驹胶囊联合维参锌胶囊治疗弱精子伴精液不液化症的临床观察 [J]. 云南中医中药杂志, 2018, 39(8): 29-31.
[25] Liu M L, Wang B, Cui Y L,. PINK1/Parkin-mediated mitophagy is activated to protect against testicular damage caused by aluminum [J]., 2022, 232: 111840.
[26] 孙智, 张彬彬, 刘铁军, 等. 益肾活血方对肾阳虚型弱精子症临床疗效研究 [J]. 辽宁中医药大学学报, 2022, 24(7): 96-99.
[27] 叶广华, 郭颖梅, 黄自平. 五子衍宗丸合四君子汤加味治疗少弱精子症临床分析 [J]. 实用中医药杂志, 2019, 35(7): 789-790.
Protective effect and mechanism of Yinyangsuo Capsules on sperm damage of kidney-deficiency model based on NELL2 Lumicrine signaling pathway
XU Pan-yu1, 2, LI Jia-shan2, DU Han-qian2, LI Ze-hui2, LI Yuan2, LIN Na2, XU Ying1, 2
1. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China 2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
To study the protective effect of Yinyangsuo Capsules (引阳索胶囊) on sperm damage induced by adenine in rats with kidney-deficiency, and explore its mechanism from neural EGFL like 2 (NELL2) Lumirine signal pathway.Male SD rats were randomly divided into control group, model group, Yinyangsuo Capsules (432 mg/kg) group and levocarnitine (100 mg/kg) group with 10 rats in each group. The rat model of kidney-deficiency was established by ig adenine (200 mg/kg) for 14 d. The success of model was judged by observing the syndrome of kidney-deficiency and testosterone level in serum. At the same time of modeling, drugs were given for 49 d, testicle and epididymis visceral brain coefficients were calculated. Computer assisted sperm analysis (CASA) was used to detect epididymal sperm kinetic parameters. Sperm count and sperm deformity rate were detected under light microscope. Sperm viability was detected by fluorescence; Histopathological changes of testis and epididymis were observed by HE staining. Testosterone level in serum was detected by ELISA. Immunofluorescence was used to observe the secretion of NELL2 in testis and expression of c-ros oncogene 1 (ROS1) in epididymis. The expression of epididymal protease lecithin 2 (OVCH2) and sperm a disintegrin and metalloproteinase 3 (ADAM3) were detected by Western blotting.Compared with model group, Yinyangsuo Capsules can improve the symptoms of kidney-deficiency in rats with kidney-deficiency, such as rough hair loss, listlessness, curled back, increased urine output and decreased body weight, increase the visceral brain coefficient of testis and epididymis (< 0.01); Significantly increased sperm number, sperm viability and sperm dynamics parameters (< 0.05, 0.01, 0.001), decreased sperm deformity rate, decreased seminiferous tubule lesions rate (< 0.001), and increased testosterone level in serum on 14th and 49th d (< 0.01, 0.001); The expression levels of NELL2 in testis and ROS1, OVCH2 and ADAM3 in epididymis were significantly increased (< 0.05, 0.01, 0.001).Yinyangsuo Capsules has a protective effect on sperm injury induced by adenine in rats with kidney-deficiency, and its mechanism may be related to its regulation of NELL2 Lumicrine signaling pathway to participate in spermatogenesis and maturation.
Yinyangsuo Capsules; NELL2; Lumicrine; kidney-deficiency; sperm damage
R285.5
A
0253 - 2670(2022)24 - 7774 - 09
10.7501/j.issn.0253-2670.2022.24.015
2022-10-16
中国中医科学院科技创新工程项目(CI2021A03802);国家自然科学基金资助项目(82004248)
徐盼瑜,硕士研究生,从事中药药理研究。Tel: 18058786679 E-mail: 1340117961@qq.com
徐 颖,博士,研究员,主要从事中药药性和中药生殖药理研究。Tel: 15910527526 E-mail: yxu@icmm.ac.cn
[责任编辑 李亚楠]
