基于噬菌体抗体库技术制备诺如病毒全人源单链抗体
2022-12-28周飞园王璐余京蓉梁芷妍林璧慧张绪富戴迎春
周飞园,王璐,余京蓉,梁芷妍,林璧慧,张绪富,戴迎春
1.南方医科大学公共卫生学院流行病学系,广东 广州 510515;2.南方医科大学中医药学院,广东 广州 510515
诺如病毒(norovirus,NoV)是引起全球急性胃肠炎(acute gastroenteritis,AGE)暴发及散发的主要病原体,每年由NoV感染造成的全球经济负担高达600亿美元,超过100 万人住院治疗,21.9 万人死亡[1-2]。NoV具有变异快、传染性强及传播速度快等特点[3-5],给NoV 防控带来了巨大挑战。目前,已知NoV 分为10个基因型(GⅠ~GⅩ),其中GⅠ、GⅡ和GⅣ基因型可感染人[6]。20 世纪90年代以来,GⅡ.4 NoV 是全球NoV 胃肠炎的主要优势流行株,占所有NoV 相关感染的70%以上[7]。2014—2016年NoV 流行季中,GⅡ.17 NoV 变异株在中国、日本、韩国、巴西等多个国家均造成了胃肠炎的暴发流行[8-12]。在中国,GⅡ.17 NoV 变异株取代GⅡ.4 NoV 基因簇成为该时期的优势毒株[9]。GⅡ.6 NoV以散发为主,较少引起暴发流行,2016 — 2018年间,我国疫情监测数据显示,GⅡ.6 NoV共引起16起胃肠炎暴发(3.4%),其中2017—2018年冬季13 起(81.3%)[13]。该毒株在美国、巴西、阿根廷、日本等国家也引起了多起NoV暴发[14-17],成为幼儿感染NoV 的第二大常见毒株[18],提示GⅡ.6 NoV 发病率在我国及全球范围内呈一定上升趋势。
NoV 感染是全球重要公共卫生问题之一,目前尚无有效疫苗和特定的抗病毒药物。抗NoV 抗体药物能为有感染风险的个体提供及时保护,其中全人源单链抗体(single-chain antibody fragment,scFv)具有可避免补体炎性反应、组织穿透力强、耐受性好、免疫原性低和有效性高等优点[19-21],有望成为NoV新型抗体药物。本研究基于噬菌体抗体库技术制备10 株scFv,并检测其特异性和中和能力,以期为NoV新型治疗性单抗药物研发奠定基础。
1 材料与方法
1.1 载体及菌株 噬菌粒载体pCANTAB-5E 购自美国GE 公司;载体pGEX-4T-1 由南方医科大学流行病学实验室制备并提供;辅助噬菌体M13K07购自美国NEB公司;E.coliTOP10购自天根生化科技(北京)有限公司;E.coliTG1购自碧云天生物技术有限公司。
1.2 唾液及血清样本 明确人类组织血型抗原(Histoblooding group antigen,HBGA)表型为B 型的人唾液标本由南方医科大学流行病学实验室提供;急性期血清样本来自上海市金山区某医院GⅡ.6 NoV 引起胃肠炎的患者,于感染1 周内采集血清[22],血清编号分别为1、9、11、12、13、15、16、17、18、19、21,外周血样本来自该次疫情中恢复期(NoV感染2周)的患者[22]。
1.3 主要试剂及仪器 RevertAid First Strand cDNA Synthesis Kit、GeneJET Gel Extraction Kit、T4 DNA 连接酶、CloneJet PCR Cloning Kit、限制性内切酶NotⅠ、SfiⅠ、BamHⅠ均购自美国Thermo Fisher Scientific公司;Ficoll-Paque™PLUS Media 淋巴细胞分离液及Glutathione Sepharose 4B 购自美国GE 公司;HRP 标记的小鼠抗M13 单克隆抗体购自北京Sino Biological 公司;IPTG 购自上海麦克林生化技术有限公司;GSTResin 购自七海生物科技有限公司;重组蛋白亲和层析纯化柱及TMB显色剂均购自碧云天生物技术有限公司;还原型谷胱甘肽(L-Glutathione reduced,GSH)购自德国BioFroxx 公司;HRP 标记的羊抗人和羊抗鼠IgG 均购自美国Abcam 公司;SOB-AG 培养基、2×YT 液体培养基、GⅡ.6、GⅡ.4、GⅡ.17 NoV P 蛋白由南方医科大学流行病学实验室制备[23],无NoV 中和抗体的血清及小鼠抗GⅡ.6、GⅡ.4、GⅡ.17 NoV血清由该实验室保存。
1.4 患者急性期血清NoV IgG 抗体及阻断抗体滴度的测定
1.4.1 IgG 抗体滴度测定 将0.5 μg/mL 的GⅡ.4、GⅡ.6、GⅡ.17 P 蛋白加至96 孔板,于4 ℃包被过夜;用5%脱脂奶于37 ℃封闭1 h;加入患者急性期血清(1∶500 稀释),同时以1%脱脂奶为空白对照,37 ℃孵育1 h;0.05%PBST 洗涤5 次,加入HRP 标记的羊抗人IgG(1∶6 000 稀释),37 ℃孵育40 min;加入TMB,避光显色,用酶标仪检测A450。
1.4.2 阻断抗体滴度测定 将明确HBGA 表型为B型人唾液标本进行1∶1 000 稀释,加至96 孔板,4 ℃包被过夜;用5%脱脂奶于37 ℃封闭1 h;将55 μL 患者急性期血清(1∶25~1∶12 800 稀释)与55 μL相应GⅡ.4、GⅡ、6、GⅡ、17 NoV P蛋白充分混匀,以未加血清的NoV P 蛋白为结合对照,1%脱脂奶为阴性对照,于37 ℃孵育1 h;将混合液加至96 孔板中,于37 ℃孵育1 h;0.05%PBST 洗涤5 次,加入相应小鼠抗GⅡ.4、GⅡ.6、GⅡ.17 NoV血清(均1∶3 000稀释),于37 ℃孵育1 h;0.05% PBST 洗涤5 次,加入HRP标记的羊抗鼠IgG(1∶6 000稀释),于37 ℃孵育40 min;加入TMB 显色,用酶标仪检测A450。结合对照A450应为(1.0 ± 0.3),与结合对照比较,阻断50%时血清样本的最大稀释倍数定义为阻断抗体效价(50%blockade titer,BT50);当血清样本的BT50<25 时,则计为12.5。
1.5scFv基因的合成 参考文献[24-25]设计合成scFv重链和轻链基因的引物,包括6对重链、12对轻链(分为kappa 和lambda 亚型)的正反向引物,引物序列见表1,由华大科技有限公司合成。用淋巴细胞分离液从恢复期患者外周血中分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),Trizol试剂抽提PBMCs 总RNA,经RevertAid First Strand cDNA Synthesis 试剂盒逆转录为cDNA,以其为模板分别扩增scFv 重链轻链基因片段。PCR 反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃再延伸10 min。以切胶纯化后等量的重链和轻链片段混合物作为模板,5′-SfiⅠ及3′-NotⅠ为引物,采用OverLap PCR 技术(使用的DNA 聚合酶为Advantage®2 PCR Enzyme)将两者随机拼接成scFv基因片段。PCR 反应条件为:95 ℃预变性5 min;95 ℃变性1 min,68 ℃退火3 min,共7 个循环。轻链、重链及scFv基因片段的PCR 产物均经1%琼脂糖凝胶电泳检测。

表1 scFv重链和轻链基因扩增所用引物Tab.1 Primers for amplification of VH and VL genes of scFv
1.6 全人源scFv 噬菌体抗体库的构建 将scFv基因片段经NotⅠ和SfiⅠ酶切位点克隆至噬菌体质粒pCANTAB-5E,构建重组质粒pCANTAB-5E-scFv,转化至感受态E.coliTG1,加入20 mL SOB-AG 培养基,37 ℃振荡培养1 h;取10 μL 菌液,接种至SOB-AG 培养皿,30 ℃培养过夜;观察噬菌斑形成情况,并计算抗体库滴度。随机挑取数个菌落,进行菌落PCR鉴定,并将阳性菌落送华大科技有限公司测序以分析抗体库多样性。剩余菌液加入辅助噬菌体M13K07和100 mg/mL的氨苄青霉素溶液,37 ℃静置孵育30 min后振荡培养1 h;1 000 ×g离心10 min,弃上清,加入100 mL 2 ×YT-AK 培养基重悬,37 ℃振荡培养过夜;1 000×g离心15 min,收集上清,加入10 mL 20% PEG/NaCl沉淀噬菌体,冰上孵育30 min;10 000×g离心30 min,弃上清,即获得scFv噬菌体抗体库。
抗体库滴度(PFU/mL)=稀释度×噬菌斑数目(PFU)/铺板用菌液体积(mL)
1.7 全人源性scFv噬菌体抗体库的筛选 将4 μg/mL的GⅡ.6 NoV P 蛋白加至免疫管,4 ℃包被过夜;用5%脱脂奶于37 ℃封闭2 h;PBST 洗涤2 次,加入1 mL 1.6项制备的全人源scFv噬菌体抗体库,37 ℃孵育2 h;PBST洗涤5~9次(逐轮增加次数),在免疫管内加入1 mL对数期TG1感染噬菌体,37 ℃孵育15 min;转移至离心管中,补加7 mL 2×YT 培养基。向免疫管内加入1 mL 甘氨酸-盐酸洗脱液(0.1 mol/L,pH 2.2),37 ℃孵育10 min;加入17 μL Tris中和液(2 mol/L,pH 8.8)及1 mL对数期E.ciliTG1,继续孵育15 min;将免疫管内液体转移至上述离心管中,取10 μL 菌液,接种至LB-A 培养皿,37 ℃培养过夜,计算产出量。将离心管内剩余菌液转移至锥形瓶中,向锥形瓶中加入90 mL 2×YT-A培养液体,37 ℃,220 r/min振荡培养1 h,至菌液A600约为0.5;加入2 mL M13K07辅助噬菌体,30 ℃,220 r/min 振荡培养12 ~16 h;6 580×g离心30 min;弃上清,加入2 mL 1% BSA 重悬,10 000 ×g离心5 min,收集上清,用于下一轮富集筛选,计算滴度,以确定投入量。重复以上过程4轮,即可富集与GⅡ.6 NoV P蛋白结合的噬菌体。
1.8 特异性scFv噬菌体抗体的鉴定 采用Phage-ELISA法。将200 μL第4 轮洗脱噬菌体接种至LB-A 培养皿上,37 ℃培养过夜;随机选取多个单克隆,接种至1 mL 2×YT-A液体培养基,于37 ℃,200 r/min振荡培养8 h;加入20 μL M13K07,30 ℃,200 r/min 振荡过夜;于2 570×g离心10 min,收集上清液。将GⅡ.6 NoV P蛋白(2 μg/mL)包被于96 孔板中,4 ℃培养过夜;5%脱脂奶于37 ℃封闭2 h;加入上清液,同时设阴性对照(筛选中未与P 蛋白结合的噬菌体)及空白对照(2YT-A培养基),均设2个复孔,37 ℃培养1 h;用0.05%PBST 洗涤5 次,加入HRP 标记的小鼠M13 单克隆抗体(1∶3 000稀释),37 ℃培养40 min;加入TMB 显色液,避光显色10 min,用酶标仪测定A450。若实验孔A450大于阴性孔A450的2 倍及2 倍以上,判定为阳性,并送华大科技有限公司测序,应用DNAStar及Chrome等软件进行DNA 序列分析和蛋白氨基酸序列翻译,并在NCBI网站上BLAST进行序列比对。
1.9 重组表达质粒的构建及表达纯化 根据1.8 项中DNA 序列分析结果设计NoVscFv基因扩增引物,引物序列见表2,由华大科技有限公司合成。以阳性噬菌体菌液为模板扩增scFv基因片段,经BamHⅠ和NotⅠ酶切位点克隆至载体pGEX-4T-1,构建重组表达质粒pGEX-scFv,经菌落PCR鉴定。重组表达质粒pGEX-scFv转化感受态E.coliBL21(DE3),接种至LB 培养基,37 ℃培养至菌液A600约为0.5 时,加入IPTG 至终浓度1 mmol/L,22 ℃诱导表达12~16 h;4 ℃,2 570 ×g离心12 min,弃上清,用PBS重悬菌体,超声破碎1 h;4 ℃,14 800×g离心75 min,收集上清液。每管上清液加入2 mL GST-resin,室温缓慢摇匀结合,加样至亲和层析柱中,并用100个体积柱体积的PBS充分洗涤。每管加入1 mL GSH洗脱缓冲液,4 ℃孵育过夜;收集滤液,即scFv,进行10%SDS-PAGE分析。

表2 NoV scFv基因扩增用引物Tab.2 Primers for amplification of scFv gene against NoV
1.10 scFv 特异性鉴定 将1 μg/mL 的scFv 加至96孔板中,100 μL/孔,设阴性对照(GST蛋白),4 ℃孵育过夜;5%脱脂奶于37 ℃封闭2 h;分别加入GⅡ.4、GⅡ.6、GⅡ.17 NoV P蛋白(浓度分别为0.03、2.5、0.35 μg/mL),37 ℃孵育1 h;0.05% PBST 洗涤3次,加入相应的鼠抗GⅡ.4、GⅡ.6、GⅡ.17血清(均1∶3 500 稀释),37 ℃孵育1 h;0.05%PBST洗涤5 次,加入HRP 标记的羊抗鼠IgG(1∶5 000 稀释),37 ℃孵育1 h;TMB避光显色,用酶标仪检测A450。
1.11 scFv 中和性的鉴定 将明确HBGA 表型为B型的唾液进行1∶1 000稀释,加至96孔板,100 μL/孔,4 ℃包被过夜;5%脱脂奶于37 ℃封闭2 h;将55 μL GⅡ.4、GⅡ.6、GⅡ.17 NoV P蛋白(浓度分别为0.03、2.5、0.35 μg/mL)分别与55 μL scFv(共设40、20、10、5 和2.5 μg/mL 5 个浓度)混合,37 ℃孵育1 h,同时设结合对照(NoV P 蛋白)及阴性对照(确定无阻断能力的血清和P 蛋白混合液),37 ℃孵育1 h;混合液加入96孔板,再加入相应的小鼠抗GⅡ.4、GⅡ.6、GⅡ.17 血清(均1∶3 500 稀释),37 ℃孵育1 h;0.05% PBST 洗涤5 次,加入HRP 标记的羊抗鼠IgG(1∶5 000 稀释),37 ℃孵育40 min;0.05% PBST 洗涤5次,TMB避光显色10 min,用酶标仪测定A450。结合对照A450应为(1.0±0.3)。按下式计算阻断率。
阻断率(%)=(结合对照A450- 实验组各孔A450)/结合对照A450×100%
2 结 果
2.1 患者急性期血清IgG抗体及阻断抗体的滴度患者急性期血清GⅡ.4、GⅡ.6、GⅡ.17 NoV IgG 抗体滴度分别为250~32 000、250~8 000、250~8 000,见图1;患者急性期血清GⅡ.4、GⅡ.6、GⅡ.17 NoV阻断抗体滴度分别为400~12 800、12.5~25、25~200,GⅡ.4 和GⅡ.17 NoV 阻断抗体滴度均高于GⅡ.6 NoV。见图2。

图1 患者急性期血清GⅡ.4、GⅡ.6、GⅡ.17 NoV IgG 抗体滴度Fig.1 IgG antibody titers against NoV GⅡ.4,GⅡ.6 and GⅡ.17 in serum of patients at acute phase
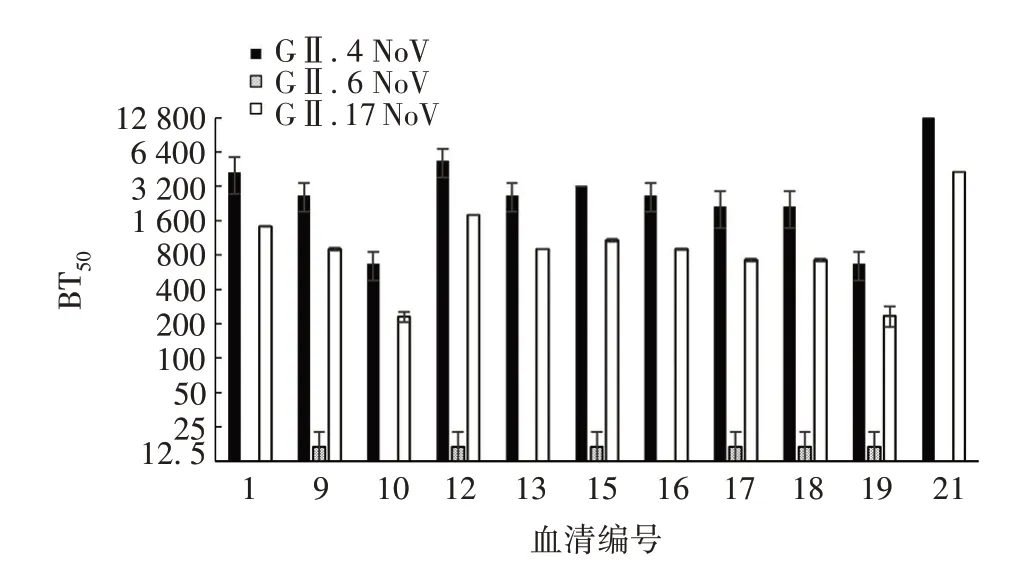
图2 患者急性期血清GⅡ.4、GⅡ.6、GⅡ.17 NoV 阻断抗体滴度Fig.2 Blocking antibody titers against NoV GⅡ.4,GⅡ.6 and GⅡ.17 in serum of patients at acute phase
2.2scFv抗体基因的合成 scFv 重轻链基因扩增产物经1%琼脂糖凝胶电泳分析,可见约350 bp的目的基因条带,大小与预期相符,见图3。拼接成的scFv基因片段经1%琼脂糖凝胶电泳分析,可见约750 bp的目的基因条带,大小与预期相符,见图4。

图3 scFv重链及轻链基因PCR产物电泳图Fig.3 Electrophoretic profile of PCR products of VH and VL genes of scFv
图4 scFv基因片段的电泳图Fig.4 Electrophoretic profile of gene fragments of scFv
2.3 全人源scFv 噬菌体抗体库的鉴定 全人源抗NoVscFv 噬菌体抗体库库容约为8.8×106PFU/mL。菌落PCR 产物经1%琼脂糖凝胶电泳分析,可见约750 bp 的基因片段,大小与预期相符,见图5。测序结果表明,获得的序列之间彼此不相重复,表明噬菌体抗体库重组率和多样性均良好。

图5 噬菌体抗体库菌落PCR产物电泳图Fig.5 Electrophoretic profile of colony PCR products of phage antibody library
2.4 全人源scFv 噬菌体抗体库的筛选 经4 轮筛选,噬菌体的投入量逐渐降低,产出量及产出率逐渐提高,见表3。表明与P蛋白结合的特异性scFv 噬菌体抗体得到了富集。

表3 scFv噬菌体抗体库的筛选结果Tab.3 Screening results of scFv phage antibody library
2.5 特异性scFv 噬菌体抗体的鉴定 第4 轮富集的噬菌体经hage-ELISA 鉴定共获得10 株噬菌体,编号分别为3C03、2H08、3F03、4A04、4A01、1A08、7A07、2D04、1A01 和4C03,与GⅡ.6 NoV P 蛋白的结合活性分别为0.51、0.19、0.25、0.20、0.20、0.22、0.22、0.20、0.21、0.30。经测序分析,其序列正确,且与不同的NoV P蛋白具有良好的亲和力。
2.6 scFv纯化产物的鉴定 10 株噬菌体scFv 纯化产物经10% SDS-PAGE 分析,均可见相对分子质量约57 000的GST-scFv蛋白,大小与预期相符,见图6。

图6 scFv纯化产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of purifired scFv phage
2.7 scFv的特异性 10株scFv噬菌体抗体与GⅡ.4、GⅡ.6、GⅡ.17 NoV P 蛋白均能特异性结合,且均有良好反应性,见图7。

图7 scFv噬菌体抗体与GⅡ.4、GⅡ.6、GⅡ.17 NoV P蛋白的特异性反应Fig.7 Specific reaction of scFv phage antibodies with NoV P proteins GⅡ.4,GⅡ.6 and GⅡ.17
2.8 scFv的中和性 10株scFv噬菌体抗体对GⅡ.4 NoV有较强阻断作用,在浓度为2.5 μg/mL 时阻断率均>50%,且2D04在浓度为40 μg/mL时,阻断率可达94.59%,见图8;3C03、3F03、1A08、1A01、4C03 5株抗体对GⅡ.6 毒株有较强的阻断能力,且3C03 在浓度为40 μg/mL 时阻断率可达62.66%,见图9;3C03、3F03、4A04、4A01 4 株对GⅡ.17 有一定阻断作用,当浓度为40 μg/mL 时,3C03 的阻断率可达52.8%,见图10。

图8 scFv噬菌体抗体对GⅡ.4 NoV的阻断能力Fig.8 Ability of scFv phage antibodies to block NoV GⅡ.4
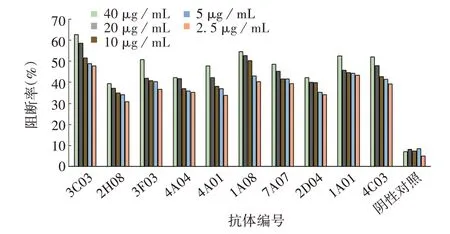
图9 scFv噬菌体抗体对GⅡ.6 NoV的阻断能力Fig.9 Ability of scFv phage antibodies to block NoV GⅡ.6

图10 scFv噬菌体抗体对GⅡ.17 NoV的阻断能力Fig.10 Ability of scFv phage antibodies to block NoV GⅡ.17
3 讨 论
NoV 是全球范围内各年龄段病毒性胃肠炎散发及暴发的重要病原体,对婴幼儿、老年人、免疫力低下等人群可危及生命[26-27]。NoV 中和性抗体介导的被动免疫预防或治疗可能是对高危人群的一种有效预防或治疗NoV 感染的方法[28]。有研究表明,经口服免疫球蛋白治疗后,器官移植患者和免疫力低下者NoV 感染症状均得到了有效缓解[29-31]。但传统的单克隆抗体多为鼠源性,易在人体内产生抗小鼠抗体,限制了其在临床上的应用[32-33],因此,全人源化抗体是目前抗体治疗的研发热点。全人源化抗体能克服种属异源性,大幅减少异源抗体在人体内形成的免疫副反应。人源抗体的制备技术主要包括噬菌体抗体技术、转基因鼠技术、核糖体展示技术等,其中噬菌体抗体技术是利用人PBMCs构建人源噬菌体抗体库,对目标抗原进行生物筛选,大量富集能与目标抗原结合的噬菌体,从而获得全人源抗体。噬菌体抗体库制备的抗体常用的分子形式有scFv、Fab、IgG、scFv-Fc 和双特异性抗体等,其中scFv 相对分子质量较小,且缺乏Fc 端,因此具有可避免补体炎性反应、组织穿透力强、耐受性好、免疫原性低、有效性高等优点[19-21]。
本研究利用抗体GⅡ.6 NoV 感染者恢复期外周血构建了人源噬菌体抗体库,能够反映NoV 自然感染人群免疫系统中产生的抗体库[34]。与健康人群比较,由NoV 感染者恢复期外周血构建的抗体库在后续筛选过程中,更易获得特异性高且具有中和能力的抗体。NoV 感染1 周后,人体内产生病毒特异性IgG 和IgA 抗体的浆母细胞会增加,感染2 周时特异性记忆B 细胞的浓度达到峰值[35]。本课题组前期研究中,测定了患者恢复期血清样本,发现有较高的GⅡ.6 NoV 特异性IgG 抗体和阻断抗体水平[20]。另外,若该人群既往感染过其他型别的NoV 毒株,再次感染时,可在人体内刺激既往感染的免疫记忆[36]。本研究在患者急性期血清中发现,抗GⅡ.4、GⅡ.6、GⅡ.17 NoV的IgG抗体水平均较高,GⅡ.4和GⅡ.17的阻断抗体滴度均较GⅡ.6 高,基于血清抗体数据及不同NoV 毒株的流行情况,表明该人群可能有GⅡ.4 和GⅡ.17 毒株的既往感染史。因此,利用该人群的恢复期外周血构建的噬菌体抗体库,不仅能筛选出自然感染NoV 个体中存在的基因型特异性抗体,还能获得在基因组内或组间具有交叉反应的抗体[36]。本研究构建的全人源噬菌体抗体库的库容约为8.8 × 106PFU/mL,经菌落PCR 和DNA 测序鉴定,该库的重组率和多样性均良好。通过对噬菌体抗体库的筛选及鉴定,获得了10 株与NoV 具有良好亲和力的scFv,均可与GⅡ.4、GⅡ.6 和GⅡ.17 NoV发生特异性结合,均对GⅡ.4 NoV P 蛋白有强阻断作用,其中5 株scFv 对GⅡ.6 NoV 毒株有较强的阻断能力,4株对GⅡ.17 NoV 毒株有一定阻断作用,提示scFv对NoV具有一定的广谱识别和中和作用。
综上所述,本研究获得的对GⅡ.4、GⅡ.6 及GⅡ.17 均具有中和能力的全人源抗NoV scFv 有望成为新的NoV 抗体治疗药物,为后续NoV 治疗性单抗药物的研发奠定了基础。
