结核分枝杆菌Ag85B DNA疫苗免疫效果的初步评价
2022-12-28王娜刘琼杨雨欣李慧张炜马国荣陈耀庚万巧凤
王娜,刘琼,杨雨欣,李慧,张炜,马国荣,陈耀庚,万巧凤
1.宁夏医科大学基础医学院病原生物学与免疫学系,宁夏 银川 750004;2.宁夏医科大学临床医学院,宁夏 银川 750004;3.宁夏医科大学理学院数学系,宁夏 银川 750004
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染所致的一种严重威胁人类健康的慢性传染病,约90%的TB 患者是成年人[1]。《2021年全球结核病报告》数据显示,2020年我国TB 新发患者数为84.2 万,发病率约为59/10 万[2],因此,寻找预防及治疗该传染病的方法十分重要。卡介苗(Bacillus Calmette-Guerin,BCG)是目前临床上唯一应用预防M.tb感染的疫苗,研究表明,BCG 免疫保护力仅可维持10~15年[3],且仅对新生儿有较好的免疫保护效果,对成人肺结核病的保护效果不明显[4]。鉴于该现状,研发可有效预防成人M.tb感染的疫苗具有重要意义。
DNA 疫苗可诱导更有效、保护效果更持久的广谱细胞免疫[5]。近年,基于M.tb免疫保护性抗原基因构建的DNA 疫苗是研究较多的新型疫苗[6-7]。抗M.tb的DNA 疫苗主要成分大部分是M.tb生长早期和对数生长期,即感染期高表达的抗原[8]。Ag85B作为M.tb早期高表达的分泌性蛋白[9],能激发机体较强的体液免疫和细胞免疫[10]。因此,本研究采用含HSV2-gD 信号肽基因和Rv1886c基因序列的真核表达质粒pcD-sRv1886c制备M.tbAg85B DNA 疫苗,经肌肉免疫小鼠,以评价该疫苗在体内产生的特异性体液免疫及细胞免疫效应,旨在为Ag85B DNA 疫苗的研制提供实验依据。
1 材料与方法
1.1 细胞、菌株及质粒 CHO细胞购自中国医学科学院;感受态E.coliDH5α 由宁夏医科大学马国荣老师惠赠;载体pcDNA3.1(+)及含HSV2-gD信号肽基因和Rv1886c基因(共963 bp 核苷酸)的重组质粒pcDsRv1886c由生工生物工程(上海)股份有限公司提供。
1.2 主要试剂 DNAmarkerDL15000购自日本TaKaRa公司;限制性内切酶HindⅢ和XbaⅠ购自英国NEB公司;硫酸卡那霉素、IPTG、琼脂糖、胰化蛋白胨及酵母提取物均购自宁夏科博生物科技有限公司;质粒小量抽提试剂盒和胶回收试剂盒均购自北京天根生化科技有限公司;无内毒素质粒大量提取试剂盒购自美国Omega Bio-Tek 公司;鼠抗Ag85B 单克隆抗体购自北京博奥森生物技术有限公司;Lipofectamine™3000转染剂、胞内固定破膜液、Protein Transport Inhibitor Cocktail(500X)、PE Anti-Mouse CD8a、FITC Anti-Mouse CD4、eFluor 450 Anti-Mouse CD3e 及APC Anti-Mouse IFNγ 均购自美国Thermo Fisher 公司;蛋白质marker购自北京全式金生物技术有限公司;HRP 标记的羊抗小鼠IgG 购自德国Merck 公司;HRP 标记山羊抗小鼠IgG1 购自美国Abcam 公司;CCK8 试剂盒购自碧云天生物科技有限公司;Ag85B 蛋白由宁夏医科大学基础医学研究所制备。
1.3 实验动物 SPF 级C57BL/6J小鼠,10只,雌性,6~7周龄,体质量(18±1)g,购自宁夏医科大学实验动物中心,动物合格证号为:SCXK(宁)2020-0001。本实验对C57BL/6J 小鼠的所有处理均以科研为目的进行养殖和使用,且按照宁夏医科大学动物伦理相关规定进行(文件号:2021-N019)。
1.4 重组质粒的鉴定 将重组质粒pcD-sRv1886c转化感受态E.coliDH5α,涂布于含50 μg/mL 卡那霉素的LB平板,37 ℃培养过夜;挑选单个白色菌落,接种至含50 μg/mL 卡那霉素的LB 液体培养基,继续培养过夜;采用小量质粒提取试剂盒提取质粒,对质粒进行HindⅢ单酶切、XbaⅠ单酶切及HindⅢ和XbaⅠ双酶切鉴定,将鉴定正确的重组质粒送北京睿博兴科生物技术有限公司测序。
1.5 重组质粒转染 用无内毒素质粒提取试剂盒提
取重组质粒pcD-sRv1886c和载体pcDNA3.1(+),测定浓度及纯度,用PBS调整至1 μg/μL,于-20 ℃保存。将CHO 细胞接种至12 孔板中,1.5 × 105个/孔,用含10%胎牛血清的DMEM 培养液于37 ℃培养,待细胞长满80%~90%单层时,弃上清,PBS 缓冲液洗涤2~3次,在Lipofectamine™3000转染剂的介导下将重组质粒pcD-sRv1886c和载体pcDNA3.1(+)分别转染CHO 细胞,于37 ℃,5% CO2培养箱中培养5 h;更换含5%胎牛血清的DMEM培养液,继续培养48 h。
1.6 重组蛋白的鉴定 采用Western blot法。收集CHO细胞培养液40 μL,经12%SDS-PAGE分离蛋白后,半干电转移至PVDF膜,以5%脱脂奶粉于37 ℃封闭1 h;TBST洗涤3次,每次10 min,加入鼠抗Ag85B单克隆抗体(1∶1 000稀释);TBST洗涤3次,加入HRP标记的兔抗鼠IgG(1∶2 000 稀释),37 ℃振荡培养60 min;加入ECL发光液,经显影、定影后分析结果。
1.7 动物免疫 小鼠适应性饲养1周后,随机分为2组,分别经小鼠大腿肌肉注射PBS(50 μL/只)和重组质粒pcD-sRv1886c(50 μg/只),每组5 只;间隔2 周进行第2 次免疫,免疫剂量及途径同上。首次免疫后14、28、42 d,经小鼠眼眶后静脉丛采血,分离血清。
1.8 小鼠血清中IgG 及IgG1 抗体效价的检测 采用间接ELISA 法。将2 μg/mL 的Ag85B 蛋白加入96孔板,0.1 mL/孔,4 ℃包被过夜;加入2%BSA 封闭液,0.1 mL/孔,37 ℃封闭2 h;TBST 洗涤4 次,加入小鼠血清(1∶100 ~1∶51 200 稀释),同时设PBS阴性对照,37 ℃孵育l h;用TBST 洗涤3次,分别加入HRP 标记的羊抗鼠IgG 及HRP 标记的羊抗鼠IgG1(均1∶1 000 稀释),0.1 mL/孔,37 ℃温育40 min;PBST 洗涤3 次,加入底物,0.1 mL/孔,37 ℃避光孵育15 min;加入2 mol/L 的H2SO4,50 μL/孔,终止反应,用酶标仪测定A450。以试验孔A450/阴性对照A450>2.1的最高样品稀释度为抗体滴度。
1.9 小鼠脾脏中分泌IFNγ的CD4+T及CD8+T淋巴细胞比例的检测 采用流式细胞术。首次免疫42 d采血后,经颈椎脱臼处死小鼠,无菌取脾脏,用淋巴细胞分离液分离淋巴细胞,制备为单细胞悬液,调整细胞浓度为2 × 106个/mL。取100 μL 细胞悬液于1 mL 含10%胎牛血清的DMEM 培养液中,加入2 μg/mL 的Ag85B 蛋白,于37 ℃刺激培养24 h;室温,500×g离心5 min,弃上清,用100 μL流式细胞染色液重悬细胞,加入4 μL eFluor450-CD3、0.5 μL FITCCD4、1.25 μL PE-CD8,4 ℃避光孵育30 min;加入400 μL流式细胞染色液,室温,400×g离心5 min,弃上清,加入500 μL破膜剂重悬细胞,4 ℃避光孵育1 h;室温,400×g离心5 min,再经300×g离心5 min,弃上清,用100 μL 流式细胞染色液重悬细胞,加入2.5 μL APC-IFNr 抗体,室温避光孵育30 min;加入400 μL破膜洗涤液,室温,300×g离心5 min,弃上清,用300 μL流式细胞染色液重悬细胞,用流式细胞仪检测分泌IFNγ+的CD4+及CD8+T细胞的比例。
1.10 小鼠脾淋巴细胞增殖情况的检测 将1.9 项制备的淋巴细胞(2×106个/mL)接种于96孔板,于37 ℃培养12 h;试验孔加入2 μg/mL的Ag85B蛋白,20 ng/孔,同时设阴性对照孔(不加蛋白)及调零孔(不加淋巴细胞),均设6 个复孔,37 ℃培养20 h,加入CCK8液,10 μL/孔,继续培养4 h;用酶标仪测定A450,并按下式计算淋巴细胞增殖刺激指数(simulation index,SI)[11]。
SI=试验孔A450/对照孔A450
1.11 统计学分析 应用GraphPad-Prism 5 统计作图软件和SPSS 20.0 统计分析软件对实验数据进行统计分析,计量资料以均数±标准差()表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的鉴定 重组质粒pcD-sRv1886c的双酶切(HindⅢ/XbaⅠ)产物经1%琼脂糖凝胶电泳分析,可见963 bp 的目的基因条带和5 428 bp 的载体条带,单酶切产物(HindⅢ或XbaⅠ)均可见6 391bp的条带,大小与预期一致,见图1。基因测序结果表明,获得的基因序列与HSV2-gD信号肽基因、M.tb Rv1886c基因序列完全一致。上述结果证明重组质粒构建正确。

图1 重组质粒pcD-sRv1886c的酶切鉴定Fig.1 Restriction map of recombinant plasmid pcD -sRv1886c
2.2 重组蛋白的鉴定 重组质粒转染组CHO 细胞表达的蛋白可与鼠抗Ag85B 单克隆抗体发生特异性结合,且于相对分子质量约35 000 处可见特异性结合条带,大小与预期相符;空载体转染组未见该条带。见图2。
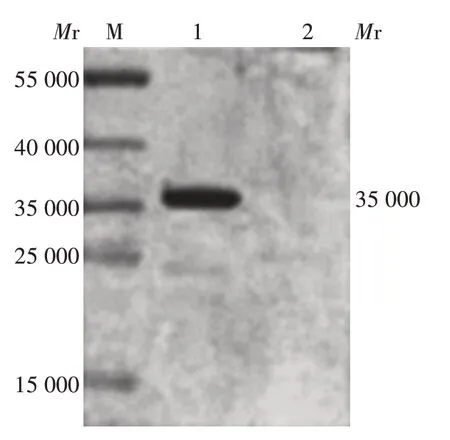
图2 重组蛋白的Western blot分析Fig.2 Western blotting of recombinant protein
2.3 小鼠血清中IgG 及IgG1 抗体的效价 首次免疫14 d,重组质粒免疫组小鼠血清中IgG和IgG1抗体效价分别为1∶1 720和1∶460,28 d时分别为1∶5 760和1∶2 560,42 d 时分别为1∶6 080 和1∶2 720;PBS 阴性对照组的小鼠血清中IgG 和IgG1 抗体效价为0。表明重组质粒pcD-sRv1886c可持续诱导体液免疫。
2.4 小鼠脾脏中分泌IFNγ的CD4+T及CD8+T淋巴细胞比例 重组质粒免疫组和PBS 阴性对照组小鼠脾细胞中CD3+CD4+IFNγ+细胞比例分别为(2.03±0.23)%和(0.14±0.02)%,CD3+CD8+IFNγ+细胞比例分别为(1.05 ± 0.08)%和(0.13 ± 0.01)%,差异均有统计学意义(t分别为18.38和11.58,P<0.001),见图3。

图3 流式细胞术检测小鼠脾脏中分泌IFNγ+的CD4+T及CD8+T淋巴细胞比例Fig.3 Flow cytometry of proportions of CD4+T and CD8+T cells secreting IFNγ+ in mouse spleen
2.5 小鼠脾淋巴细胞的增殖情况 重组质粒免疫组小鼠脾淋巴细胞SI 为5.02,明显高于PBS 对照组(1.06),且差异有统计学意义(t=15.66,P<0.001),表明重组质粒免疫小鼠的脾淋巴细胞经Ag85B 特异性抗原刺激后,能够产生显著的增殖能力。
3 讨论
DNA 疫苗又称“裸”DNA 疫苗、基因疫苗或核苷酸疫苗等,是近年来基因治疗研究中所衍生发展起来的一个新研究领域[12]。DNA疫苗是将一种抗原基因重组至真核表达载体,直接或经包装注入体内表达出相应抗原蛋白,该蛋白能刺激机体产生特异性体液免疫和细胞免疫应答,从而起到免疫保护机体作用[13]。与其他疫苗比较,DNA疫苗具有制备简便,成本低廉,稳定性及安全性好的优势[8]。
Ag85复合物是M.tb的分泌蛋白,占M.tb分泌蛋白总量的45%,该复合物包括Ag85A、Ag85B和Ag85C 3 种组分,其中Ag85B 占22%[14]。Ag85B 是由M.tb Rv1886c基因编码的早期分泌性蛋白,有研究表明,Ag85B 能够诱导机体产生良好的T 和B 细胞免疫反应[15]。本研究采用的含有HSV2-gD信号肽基因和Rv1886c基因的重组质粒pcD-sRv1886c具有2 个优点:①拥有启动真核基因表达最有效的CMV 启动子;②HSV2-gD信号肽可使胞浆内合成的Ag85B 蛋白不断地分泌至胞外,刺激机体产生持久的免疫反应。本研究将重组质粒pcD-sRv1886c免疫小鼠,首次免疫14 d 时,重组质粒免疫组能诱导产生IgG 及IgG1 特异性抗体,随着时间推移,IgG 及IgG1 的抗体效价呈上升趋势,表明Ag85B 可刺激机体产生持久的体液免疫效应。由于M.tb属于胞内寄生菌,细胞免疫抗M.tb感染非常重要,IFNγ 主要由活化T 细胞产生,其可上调节NK细胞和CD8+T 细胞的活性。本研究结果显示,首次免疫42 d,重组质粒免疫组小鼠能够有效诱导分泌IFNγ的CD4+T及CD8+T细胞,占比分别为(2.03±0.23)%和(1.05±0.08)%。另外,该重组质粒还能显著刺激脾淋巴细胞增殖,SI 为5.02,表明该DNA疫苗能够有效诱导及促进细胞免疫效应。
综上所述,重组质粒pcD-sRv1886c经肌肉免疫小鼠后,可有效产生体液免疫及细胞免疫效应,今后本课题将在此基础上进行多部位联合免疫,对免疫剂量及免疫途径进行优化,为预防M.tb感染DNA 疫苗的研发和应用奠定基础。
