15价肺炎球菌结合疫苗动物急性、长期毒性及免疫原性
2022-12-28胡小华王海伟李洁涵胡月凤朱卫华杜琳
胡小华,王海伟,李洁涵,胡月凤,朱卫华,杜琳
北京智飞绿竹生物制药有限公司 多糖和结合疫苗研发中心,北京 100176
肺炎球菌(Streptococcus pneumoniae)是定居于上呼吸道的条件致病菌,可导致人类罹患肺炎、菌血症、脑膜炎等严重疾病,是全球人口发病和死亡的主要原因之一[1]。据世界卫生组织(World Health Organization,WHO)报道,全球每年有160 万人死于肺炎链球菌感染[2],其对低收入国家、婴幼儿和老年人群及免疫功能低下人群产生了重大影响[3]。即使在发达国家,肺炎球菌疾病仍是一个重大公共卫生问题,每年有超过250 000人入院,且会带来严重的医疗和经济影响[4]。英国公共卫生部每年报告约5 000 例侵袭性肺炎球菌病(invasive pneumococcal disease,IPD)病例[5]。肺炎链球菌感染也是我国婴幼儿和老年人发病和死亡的主要病因[6-8],是出生20 d 后各年龄儿童社区获得性肺炎的重要病原[9-10]。在一些国家,如美国和日本,死于肺炎链球菌性肺炎的人数随着老年人口的增长而上升[11-12]。虽然有强效的抗菌药物,但肺炎链球菌耐药率的迅速增长增加了肺炎的治疗难度[13]。因此,使用疫苗来预防肺炎球菌疾病已成为最经济和有效的手段,肺炎疫苗被WHO 列为需极高度优先(very high priorities)使用疫苗[14]。
13价肺炎球菌结合疫苗(13-valent pneumococcal polysaccharide conjugate vaccine,PCV13)是目前使用最广泛的肺炎疫苗之一,其不仅显著降低了儿童中的肺炎链球菌病,对未接种的成人也产生了群体保护效果[15]。但PCV13不能预防疫苗血清型覆盖之外其他血清型肺炎球菌的感染,流行株的血清型替代已成为不可忽视的因素[16]。肺炎球菌2型和12F型侵袭力强,其中2 型在亚洲和非洲地区常见[17],而12F 是PCV13使用后最常见的替代血清型[18]。本公司研制的15价肺炎球菌结合疫苗(PCV15)除含有PCV13的13个血清型外,还包含了2型及12F型。本研究旨在评价该疫苗在小鼠中的急性、长期毒性和免疫原性,并针对共有的血清型,比较该疫苗与PCV13诱导的抗体水平变化。
1 材料与方法
1.1 疫苗 PCV13(沛儿13)购自辉瑞投资有限公司(批号:T24281S69938);PCV15 由北京智飞绿竹生物制药有限公司研发部自制。
1.2 实验动物 SPF级ICR小鼠,60只,雌雄各半,4 ~5 周玲,体质量17 ~19 g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2007-0005;SPF级SD大鼠,90只,4周龄,体质量70 ~90 g,购自上海市西普尔-必凯实验动物有限公司,实验动物生产许可证号:SCXK(沪)2008-0016;SPF 级NIH 小鼠,雌性,45只,4周龄,体质量12 ~17 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0011。本实验均以科研为目的对以下品系动物进行养殖和使用,且遵循实验动物饲养和使用指南第8 版(Institute of Laboratory Animal Resources,Commission on Life Sciences,National Research Council:National Academy Press,Washington,DC;2010)和美国农业部(USDA)动物福利管理条例(Public.Law99-198)开展。
1.3 主要试剂及仪器 HRP 标记的兔抗小鼠IgG 抗体、TMB、牛血清白蛋白、聚山梨酯-20 均购自美国Sigma 公司;磷酸铝佐剂、0.9% NaCl、15 个相关型的肺炎球菌多糖牛血清白蛋白结合物(牛白结合物)、包被液(0.02 mol/L 磷酸盐缓冲液,pH 7.2)、洗液(含0.05%Tween-20的0.9%NaCl溶液)、稀释液(含1%牛血清白蛋白的磷酸盐缓冲液,现用现配)、终止液(2 mol/L 硫酸溶液)均由北京智飞绿竹生物制药有限公司研发部自制;聚苯乙烯酶标板购自深圳市金灿华实业有限公司;酶标仪Spectra Max190购自美国Molecular Devices 公司;全自动血细胞分析仪(德国Bayer ADVIA2120)、全自动生化仪(日本日立7020)和组织病理学检查仪器均由第三方安全性评价研究中心提供,并协助检验。
1.4 急性毒性试验将检疫合格的60 只ICR 小鼠随机分为3组:PCV15组、磷酸铝佐剂对照组(铝离子浓度为0.25 mg/mL)和0.9% NaCl 对照组,每组20只,雌雄各半。所有小鼠均经肌肉注射相应免疫原1 mL(两后肢各0.5 mL)。注射第1天每30 ~60 min观察1 次动物反应情况,包括外观、行为活动、精神状态、有无异常分泌物及死亡情况。注射后2 ~14 d,每日观察并称重,记录动物毒性反应及死亡情况。死亡动物以及观察期结束处死的动物及时尸检,若有肉眼可见的病变脏器则进行病理学检查。
1.5 长期毒性试验 将检疫合格的90 只SD 大鼠随机分为3 组:PCV15 组、磷酸铝佐剂对照组和0.9%NaCl 对照组,每组30 只,雌雄各半。所有大鼠均经右后肢大腿肌肉注射相应抗原0.5 mL,间隔28 d 免疫1 次,共免疫5 次。在给药中期(第3 次给药后2周)、停药检查(第5 次给药后2 周)、恢复期结束(停药检查后4 周)分别对大鼠进行抽样全面检查,包括临床症状、血液学、血清生化和组织病理学检查。
1.6 免疫原性试验及免疫过程中安全性观察
1.6.1 动物分组及免疫 将检疫合格的45 只NIH 小鼠随机分为3 组:PCV13 组、PCV15 组和0.9% NaCl对照组,每组15 只。将PCV13 及PCV15 分别预先用0.9% NaCl 稀释4 倍,经小鼠颈背部皮下免疫,0.5 mL/只,即1/4人用剂量(含6B型糖1 μg,其他型0.5 μg),间隔2 周免疫1 次,共免疫3 次。每次免疫后2 周经小鼠眼眶采血,第3 次免疫后2 周采集全血,2 400×g离心5 min,分离血清,-20 ℃冻存。
1.6.2 小鼠体质量及状态观察 分别于每次小鼠免疫后2 周(即下次免疫之前)称量PCV15 组和0.9%NaCl对照组小鼠体质量,并观察2组小鼠状态。
1.6.3 小鼠血清抗体的检测 采用间接ELISA 法。分别包被PVC15 相关型的15 个型牛白结合物,包被浓度为10 μg/mL,100 μL/孔,2 ~8 ℃包被过夜;弃去包被液,洗板2 次,加入封闭液,200 μL/孔,37 ℃封闭1 h;弃去封闭液,洗板2 次,加入各组小鼠免疫血清(PVC13 与PCV15 组血清起始稀释倍数100,2 倍系列稀释;0.9%NaCl 对照组血清稀释倍数为100),100 μL/孔,37 ℃孵育1 h;弃去血清,洗板3 次,加入HRP 标记的兔抗鼠IgG 抗体(1∶10 000 稀释),100 μL/孔,37 ℃孵育1 h;弃去酶标抗体,洗板5 次,加入TMB 底物,100 μL/孔,避光显色20 min;加入终止液,50 μL/孔,于酶标仪波长450 nm 处读取吸光度值。以0.9%NaCl对照组A450均值的2.1倍为cutoff 值,A450≥cutoff 值孔血清的最大稀释倍数作为该抗体的滴度,并计算各组各针次抗体的几何平均滴度(geometric mean titer,GMT)及阳转率。
1.7 统计学分析 利用Microsoft Excel 2019 进行数据录入和统计分析。急性毒性试验及长期毒性试验中组间比较采用t检验;免疫原性试验及免疫过程中安全性观察中,PCV15 与0.9% NaCl 对照组小鼠各针次间体质量差异先通过F检验判断方差是否相等,再用双侧t检验进行统计学分析;因小鼠血清抗体滴度不符合正态分布,将其转换成以2 为底的常用对数值,再应用Microsoft Excel“数据分析模块”进行统计学分析,对PCV15 组免疫针次间的比较及各针次间PCV15 组与PCV13 组抗体水平的比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 急性毒性试验 单次肌肉注射两人份剂量PCV15未引起小鼠明显异常反应或死亡。小鼠体质量随试验时间的延长而增加,虽PCV15 组雄性小鼠给药后第3、4、5天和佐剂对照组雄性小鼠给药后第14天的平均体质量低于相应时间的0.9%NaCl 对照组(t分别为-3. 05、-2. 86、-2. 69 和-2. 85,P<0.05),但其他时间段PCV15 组、佐剂对照组小鼠体质量与相应时间的0.9% NaCl 对照组比较,差异均无统计学意义(P>0.05),且整个试验期间,PCV15组、佐剂对照组小鼠的体质量变化与0.9%NaCl对照组比较,差异也无统计学意义(P>0.05)。见表1。病理学结果显示,小鼠均无明显急性中毒靶器官,0.9%NaCl 对照组小鼠给药部位组织结构正常,肌纤维大小一致,肌浆红染、均匀,间质较少,未见异常变化;而PCV15与磷酸铝佐剂对照组小鼠给药局部肌纤维间质均出现异物肉芽种样结节,但其肌纤维病变不明显,对肌纤维实质无明显影响。见图1。
表1 PCV15最大给药剂量免疫小鼠的体质量变化(g,±SD,n=10)Tab.1 Changes of body weight of mice immunized with maximum administration dosage of PCV15(g,±SD,n=10)

表1 PCV15最大给药剂量免疫小鼠的体质量变化(g,±SD,n=10)Tab.1 Changes of body weight of mice immunized with maximum administration dosage of PCV15(g,±SD,n=10)
注:各组与0.9%NaCl对照组比较,a表示P <0.05,其余P均>0.05。
给药时间(d)给药前给药后PCV15雄性22.0±0.7雌性20.7±0.8磷酸铝佐剂对照雄性22.0±0.7雌性20.9±0.9 0.9%NaCl对照雄性22.1±0.7雌性20.8±0.8 1234567891 0 11 12 13 14 23.6±0.7 24.9±0.7 26.3±0.6 27.6±0.8 29.0±0.9 29.7±1.0 30.9±1.0 31.5±1.1 31.8±1.1 32.2±1.2 33.3±1.2 33.4±1.1 34.1±1.3 34.9±1.4 21.6±0.7 22.7±0.7 23.4±0.7 24.1±1.0 24.9±1.1 25.1±1.2 25.6±1.6 26.1±1.6 26.3±1.6 26.5±1.6 26.5±1.8 26.6±1.5 27.3±1.5 27.2±1.4 tP 22.9±1.1 24.2±1.0 25.1±1.4a 26.4±1.5a 27.5±1.8a 28.7±1.8 29.6±1.9 30.1±2.0 30.8±2.2 31.2±2.4 32.1±2.5 31.9±2.4 33.3±3.0 33.8±2.8-0.42 0.68 21.1±0.9 22.2±1.3 22.4±1.3 23.2±1.5 24.0±1.5 24.7±1.8 25.1±1.7 25.4±1.8 25.6±1.8 25.8±1.9 26.1±2.0 26.6±2.1 26.6±1.8 26.9±1.7-0.11 0.91 23.6±1.1 24.8±1.1 25.9±1.3 27.1±1.4 28.1±1.6 28.7±1.8 29.6±2.0 30.3±1.9 30.8±1.9 31.2±2.1 31.9±2.3 32.2±2.2 33.2±2.5 32.9±2.5a-0.77 0.45 21.8±0.9 22.3±1.4 23.1±1.4 23.8±1.5 24.4±1.4 24.9±1.4 25.1±1.9 25.4±1.6 25.6±1.4 25.9±1.4 26.5±1.4 26.8±1.5 26.9±1.1 27.1±1.4-0.12 0.90
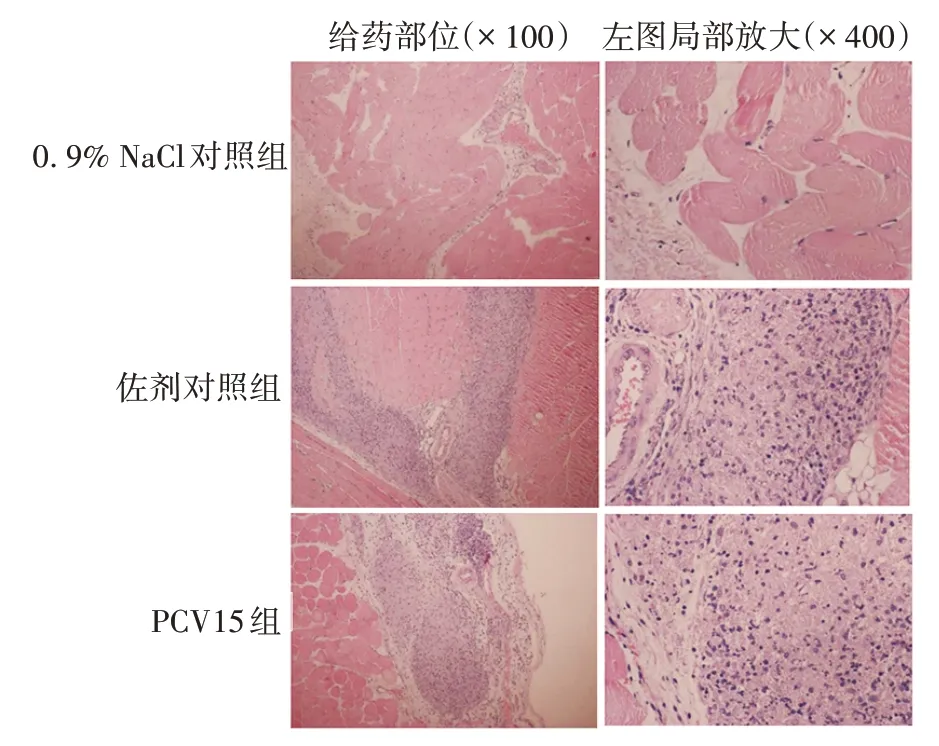
图1 急性毒性试验各组小鼠给药部位组织病理学检查(HE染色)Fig.1 Histopathological image of administration site of mice in various groups in acute toxicity test(HE staining)
2.2 长期毒性试验 整个试验期间,各组大鼠均未出现明显毒副反应,也无死亡。给药中期、停药检查、恢复期结束,部分血液学指标如平均血小板体积(mean platelet volume,MPV)、网织红细胞数(reticulocyte count,RETIC)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)以及生化学指标如门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酸磷酸激酶(creatine phosphokinase,CK)、葡萄糖(glucose,GLU)等与相应时间的0.9%NaCl对照组相比,差异有统计学意义(t=2.28 ~4.71,P<0.05或<0.01),但除RETIC 和GLU 外,均属于正常参考值范围。整个试验期间,PCV15 对大鼠的血液学、血清生化的其他指标均无明显影响,与0.9%NaCl对照组相比,差异无统计学意义(P>0.05)。见表2 和表3;3 期检查各组所检脏器均未见明显异常。组织病理学检查发现,PCV15 组和磷酸铝佐剂对照组所有大鼠给药部位均出现由注射试剂沉积引起的异物肉芽肿样结节和淋巴结反应性增生变化,同一试验组比较,给药中期与停药检查给药部位变化相似,恢复期结束呈减轻趋势,但对肌纤维实质无明显影响。0.9% NaCl 对照组大鼠给药部位未出现类似变化,组织结构正常。见图2。
表2 长期毒性试验PCV15对大鼠血液学的影响(±SD,n=10)Tab.2 Effects of long-term toxicity test of PCV15 on hematology of rats(x±SD,n=10)
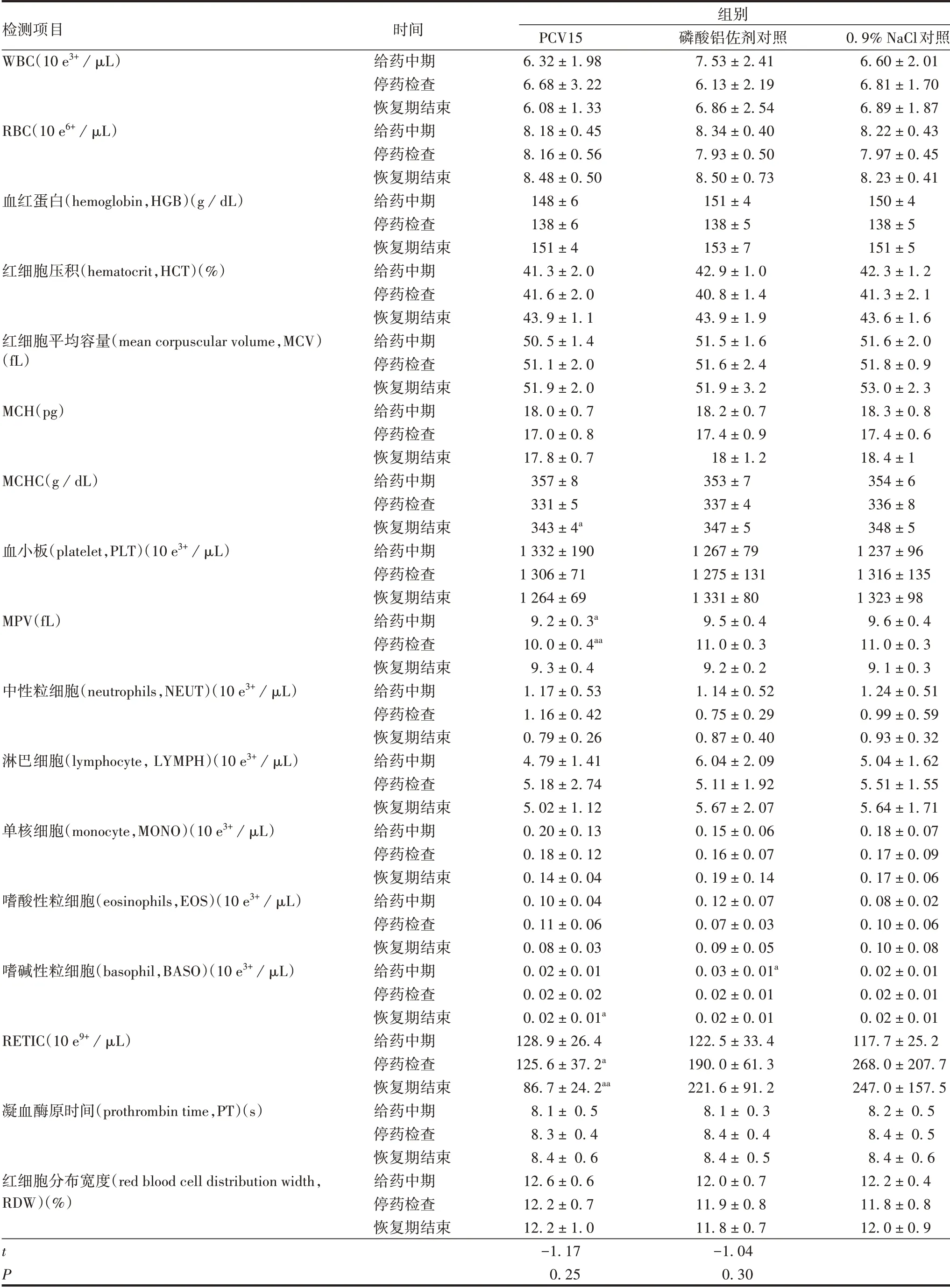
表2 长期毒性试验PCV15对大鼠血液学的影响(±SD,n=10)Tab.2 Effects of long-term toxicity test of PCV15 on hematology of rats(x±SD,n=10)
注:各组与0.9%NaCl对照组比较,a表示P <0.05,aa表示P <0.01,其余P均>0.05。
组别检测项目WBC(10 e3+/μL)RBC(10 e6+/μL)血红蛋白(hemoglobin,HGB)(g/dL)红细胞压积(hematocrit,HCT)(%)红细胞平均容量(mean corpuscular volume,MCV)(fL)MCH(pg)MCHC(g/dL)血小板(platelet,PLT)(10 e3+/μL)MPV(fL)中性粒细胞(neutrophils,NEUT)(10 e3+/μL)淋巴细胞(lymphocyte,LYMPH)(10 e3+/μL)单核细胞(monocyte,MONO)(10 e3+/μL)嗜酸性粒细胞(eosinophils,EOS)(10 e3+/μL)嗜碱性粒细胞(basophil,BASO)(10 e3+/μL)RETIC(10 e9+/μL)凝血酶原时间(prothrombin time,PT)(s)红细胞分布宽度(red blood cell distribution width,RDW)(%)时间给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束给药中期停药检查恢复期结束0.9%NaCl对照6.60±2.01 6.81±1.70 6.89±1.87 8.22±0.43 7.97±0.45 8.23±0.41 150±4 138±5 151±5 42.3±1.2 41.3±2.1 43.6±1.6 51.6±2.0 51.8±0.9 53.0±2.3 18.3±0.8 17.4±0.6 18.4±1 354±6 336±8 348±5 1 237±96 1 316±135 1 323±98 9.6±0.4 11.0±0.3 9.1±0.3 1.24±0.51 0.99±0.59 0.93±0.32 5.04±1.62 5.51±1.55 5.64±1.71 0.18±0.07 0.17±0.09 0.17±0.06 0.08±0.02 0.10±0.06 0.10±0.08 0.02±0.01 0.02±0.01 0.02±0.01 117.7±25.2 268.0±207.7 247.0±157.5 8.2± 0.5 8.4± 0.5 8.4± 0.6 12.2±0.4 11.8±0.8 12.0±0.9 tP PCV15 6.32±1.98 6.68±3.22 6.08±1.33 8.18±0.45 8.16±0.56 8.48±0.50 148±6 138±6 151±4 41.3±2.0 41.6±2.0 43.9±1.1 50.5±1.4 51.1±2.0 51.9±2.0 18.0±0.7 17.0±0.8 17.8±0.7 357±8 331±5 343±4a 1 332±190 1 306±71 1 264±69 9.2±0.3a 10.0±0.4aa 9.3±0.4 1.17±0.53 1.16±0.42 0.79±0.26 4.79±1.41 5.18±2.74 5.02±1.12 0.20±0.13 0.18±0.12 0.14±0.04 0.10±0.04 0.11±0.06 0.08±0.03 0.02±0.01 0.02±0.02 0.02±0.01a 128.9±26.4 125.6±37.2a 86.7±24.2aa 8.1± 0.5 8.3± 0.4 8.4± 0.6 12.6±0.6 12.2±0.7 12.2±1.0-1.17 0.25磷酸铝佐剂对照7.53±2.41 6.13±2.19 6.86±2.54 8.34±0.40 7.93±0.50 8.50±0.73 151±4 138±5 153±7 42.9±1.0 40.8±1.4 43.9±1.9 51.5±1.6 51.6±2.4 51.9±3.2 18.2±0.7 17.4±0.9 18±1.2 353±7 337±4 347±5 1 267±79 1 275±131 1 331±80 9.5±0.4 11.0±0.3 9.2±0.2 1.14±0.52 0.75±0.29 0.87±0.40 6.04±2.09 5.11±1.92 5.67±2.07 0.15±0.06 0.16±0.07 0.19±0.14 0.12±0.07 0.07±0.03 0.09±0.05 0.03±0.01a 0.02±0.01 0.02±0.01 122.5±33.4 190.0±61.3 221.6±91.2 8.1± 0.3 8.4± 0.4 8.4± 0.5 12.0±0.7 11.9±0.8 11.8±0.7-1.04 0.30

表3 长期毒性试验PCV15对大鼠血液生化学的影响(x±SD,n=10)Tab.3 Effects of long-term toxicity test of PCV15 on hematobiochemistry of rats(x±SD,n=10)
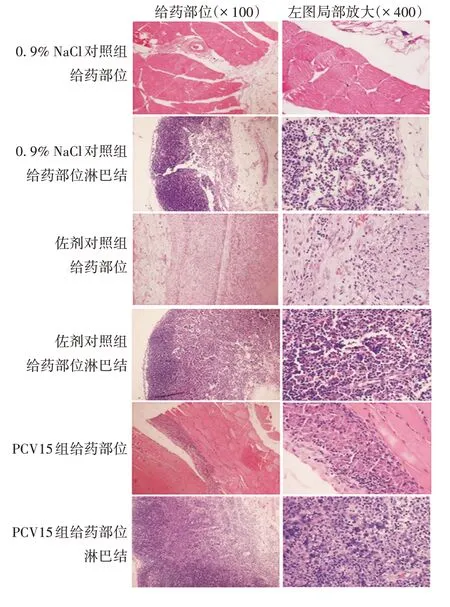
图2 长期毒性试验各组大鼠给药部位组织病理学检查(HE染色)Fig.2 Histopathological image of administration sites of rats in various groups in long-term toxicity test(HE staining)
2.3 免疫原性试验及免疫过程中安全性观察
2.3.1 免疫后小鼠体质量及状态 各次免疫后,PCV15组和0.9% NaCl 对照组小鼠均无死亡,且体质量呈增加趋势。各组小鼠毛色有光泽,对外界反应及进食正常,姿势和步态无异常情况。免疫前(0 d)、初次免疫后第14、28、42 天,PCV15 组与0.9% NaCl 对照组小鼠体质量差异均无统计学意义(t分别为0.94、1.00、0.62 和1.02,P分别为0.35、0.33、0.54 和0.32),见表4。1 人份剂量PCV15 对小鼠的生长(体质量增加)无抑制作用,且未引发明显不良反应,初步证明PCV15安全性良好。

表4 免疫后PCV15组和0.9%NaCl对照组小鼠的体质量变化(g,x±SD,n=15)Tab.4 Changes of body weight of mice of PCV15 group and 0.9%sodium chloride group after immunization(g,x±SD,n=15)
2.3.2 免疫后抗体滴度 PCV15 第1、2、3 次免疫后,小鼠血清中抗各型荚膜多糖抗体的GMT 均有不同程度的升高,阳转率均大于80%;GMT经对数转换后显示,第2 次免疫后各型特异性抗体水平均高于第1 次免疫,第3 次免疫后各型抗体水平基本高于第2次免疫,整体差异均有统计学意义(t分别为9.69 和7.56,P分别为6.88 E-08 和1.32 E-06),表明PCV15具有显著的免疫增强效应。见表5。

表5 PCV15组不同免疫针次的GMT和抗体阳转率(n=15)Tab.5 GMT and antibody seroconversion rate of different doses in PCV15 group(n=15)
免疫3次后,PCV13组和PCV15组小鼠血清特异性抗体GMT 均有不同程度的升高;GMT 经对数转换后显示,第1、2、3 次免疫后,PCV15 组的抗体整体水平明显高于PCV13 组(t分别为4.51、4.51 和4.28,P分别为0.000 7、0.000 8和0.001 1)。见表6。
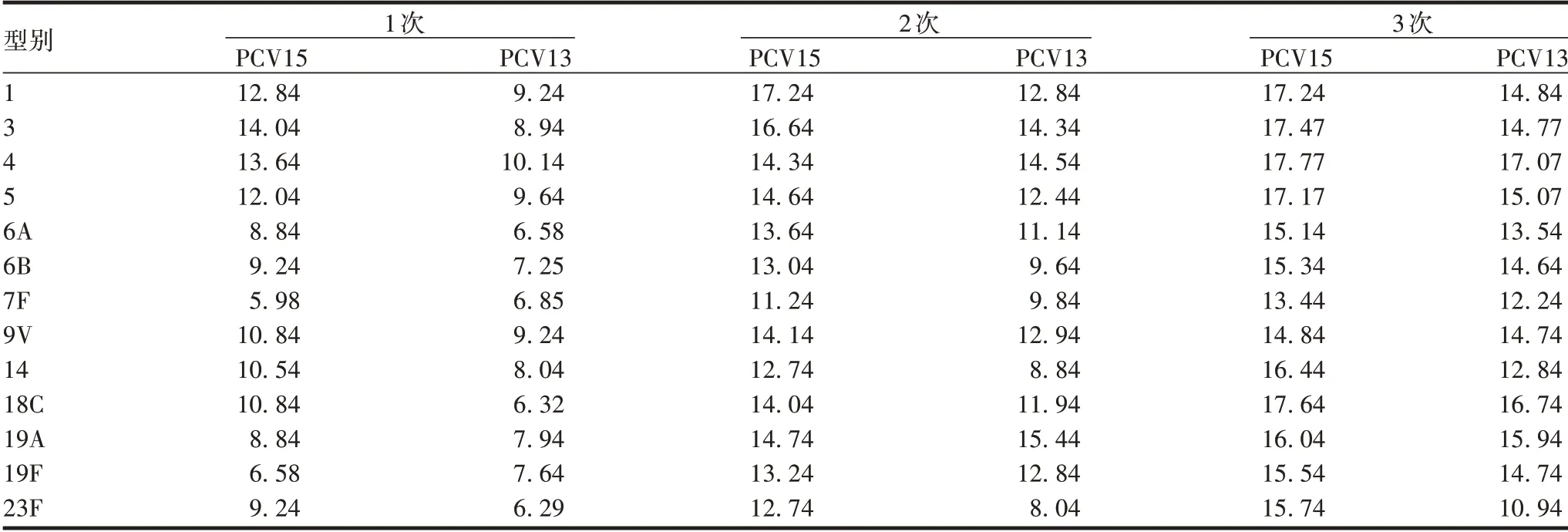
表6 各针次内两种疫苗诱导小鼠产生的针对共有血清型抗体GMT水平的比较Tab.6 Comparison of GMT of antibody against common serotypes in mice induced by two vaccines within each dose
3 讨论
目前报道的肺炎球菌血清型多达98 种[19],因地域和环境的不同,肺炎高发血清型在各个国家和地区均存在差异。目前在国内批准上市的PCV13为美国辉瑞公司和云南沃森公司产品,其包含的血清型参照欧美地区的肺炎流行菌群。鉴于不同地区的优势血清型别存在差异,且PCV疫苗应用后可能导致致病血清型的转换,新PCV疫苗选择血清型需有更多的考量。
为满足不同的市场需求,本公司参考肺炎球菌在亚洲和非洲的流行病学数据,开发了PCV15。由于结合疫苗在制备过程中所用的载体类型、结合方法、多糖的分子大小、多糖与蛋白的比例等均会最终影响结合疫苗的特性,需对PCV15 进行安全性和免疫原性评估。实验结果显示,PCV15 具有良好的安全性。急性毒性试验中PCV15 的2 人份/鼠剂量,以及长期毒性试验中1 人份/(鼠·次)剂量均为安全剂量,PCV15 不会引发临床症状异常现象及病理学组织异常。长期毒性试验结果表明,疫苗对动物临床症状、血液学和血清生化指标无明显影响。小鼠安全性试验表明,注射疫苗后小鼠无不良反应,体质量增加正常,也表明疫苗在小鼠体内安全性良好。
PCV15 具有良好的免疫原性。免疫后血清抗体水平显示,绝大多数型别每次免疫后抗各型荚膜多糖抗体水平均有不同程度的升高,抗体阳转率均达到自定的合格标准(不低于80%)。抗体水平在针次间显示出加强效果,表明PCV15 可诱导免疫记忆产生。针对共有的13 个血清型,PCV15 在各针次诱导的抗体水平组间差异均有统计学意义(P<0.05),显示PCV15对小鼠具有较好的免疫原性。
综上所述,本研究结果表明,PCV15 在不同动物模型中均表现出良好的安全性,在小动物体内的疫苗耐受剂量超过人用剂量;1/4 人用剂量可在小鼠中诱导良好的免疫应答,且表现出加强效果。本研究为PCV15在人体中安全性和有效性的验证奠定了良好的基础。
