加味丹玄口康通过Axin1 调节口腔上皮损伤细胞增殖活性
2022-12-27王宗康谭怡丝覃一杰周领航肖艳波胡兆勇
王宗康,谭怡丝,覃一杰,周领航,肖艳波,胡兆勇,谭 劲*
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
口腔黏膜下纤维化(oral submucosal fibrosis,OSF)是一种常见的口腔癌前病变。 7%~30%的OSF患者可能患上口腔鳞状细胞癌[1-2]。 OSF 常发生于颊黏膜、磨牙后区和软腭部位[2-3]。 其主要症状包括口干、疼痛、舌头活动受限、吞咽困难和活动性改变[3]。除了口腔,OSF 病变甚至涉及咽部和食管,严重影响患者的生活质量。调查研究表明,OSF 患者的患癌风险高于非OSF 患者[4],且OSF 的患病率正逐年增加[5]。目前,OSF 的治疗主要包括药物治疗、张口锻炼和手术。对于在晚期结束手术的OSF 患者,术后仍需使用药物辅助治疗[6]。 口腔锻炼因其低成本、方便和无创等优点,是患者最容易接受的治疗手段[7]。 但其治疗效果有限,需要患者自我控制。因此,寻找高效、价廉且方便的治疗药物已迫在眉睫。
加味丹玄口康(DXKK)颗粒由丹参、玄参、当归、红花、生地黄、白花蛇舌草、夏枯草、生黄芪、薄荷、白芍、茵陈、桔梗组成。 前期研究表明,DXKK 对OSF 的发生与发展有抑制作用[8]。 轴抑制蛋白1(axis inhibition protein 1, Axin1),分子量约95.6 kDa,是Wnt 信号通路的重要支架蛋白,且可通过β-catenin信号调节细胞的增殖活性[9-10]。 Wnt 信号通路与口腔癌病变显著相关[11]。 在口腔癌临床样本中,Axin1 基因常发生突变[12]。 Axin1 可能作为口腔癌的突变靶点,参与口腔癌的发生和发展。然而,Axin1 在口腔癌前病变OSF 中的作用尚不明确。 本研究通过探究DXKK对口腔上皮损伤细胞增殖活性的影响及Axin1 的作用,旨在为DXKK 的临床治疗应用提供数据支持。
1 材料
1.1 细胞株
人口腔上皮细胞(批号:CP-H203)购自武汉普诺赛生命科技有限公司。 在37 ℃、5% CO2和饱和湿度的环境条件下,细胞培养于人口腔上皮细胞完全培养基中。
1.2 实验动物
10 只健康的SD 雄性大鼠,体质量(200±20) g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004。在自由采食、(24±3) ℃、45%~50%湿度和SPF 条件下适应性饲养1 周后,进行药物干预处理。本研究经湖南中医药大学实验动物伦理委员会批准通过,审批号:LLBH-202103100002。
1.3 主要药物与试剂
DXKK 三九颗粒制剂:丹参10 g(批号:2017003C),玄参10 g(批号:2108005C),当归10 g(批号:2106029C),红花5 g(批号:2103003C),生地黄10 g(批号:2108020S),白花蛇舌草10 g(批号:2101001S),夏枯草10 g(批号:2109004S),生黄芪10 g(批号:2102003C),薄荷10 g(批号:2102001C),白芍10 g(批号:2105009S),茵陈10 g(批号:2108001C),桔梗10 g(批号:2107001S),购自湖南中医药大学第一附属医院门诊三九智能颗粒中药房。
氢溴酸槟榔碱(arecoline hydrobromide, AH,批号:300-08-3,成都德思特生物技术有限公司);人口腔上皮细胞完全培养基(批号:CM-H203,武汉普诺赛生命科技有限公司);过表达对照质粒(批号:2021062301)、Axin1 过表达质粒(批号:2021062302)、干扰小RNA(small interfering RNA, siRNA)阴性对照(批号:2021062308)、Axin1 siRNA-(1-3)(批号:2021062309)、RIPA 裂解液(批 号:01E220303)、脱脂奶粉(批号:12C211125)均购自长沙艾碧维生物科技有限公司;Lip 2000(批号:11668019)、Trizol(批号:343912)均购自赛默飞世尔科技有限公司;互补DNA 合成试剂盒(批号:26621,北京康为世纪生物科技有限公司);Axin1(批号:BA04288597,北京博奥森生物技术有限公司);β-catenin(批号:00048568)、Bax(批 号:00039968)、Bcl-2(批 号:00011619)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA,批号:00086617)、β-actin(批号:10011066)、辣根过氧化酶羊抗鼠IgG(批号:20000002)、辣根过氧化酶羊抗兔IgG(批号:20000003)购自美国Proteintech 公司;Caspase-3(批号:45,美国CST公司);细胞计数试剂盒(cell counting kit-8, CCK-8,批号:NU679, 日本同仁化学研究所);4%多聚甲醛(批号:N1012, 苏州新赛美生物科技有限公司);结晶紫(批号:G1062,北京索莱宝科技有限公司);碘化丙啶(批号:MB2920,大连美仑生物技术有限公司);EdU 检测试剂盒(批号:U0618,广州瑞博生物医药科技有限公司)。
1.4 主要仪器
倒置生物显微镜(型号:DSZ2000X,北京中显恒业仪器仪表有限公司);台式冷冻离心机(型号:H1650R,长沙高新技术产业开发区湘仪离心机仪器有限公司);荧光定量PCR 仪(批号:A51685,赛默飞世尔科技有限公司);电泳仪(型号:DYY-6C,北京六一生物科技有限公司);多功能酶标分析仪(型号:MB-530,深圳市汇松科技发展有限公司);流式细胞仪(型号:A00-1-1102,美国贝克曼库尔特有限公司)。
2 方法
2.1 质粒转染与分组
为筛选高效抑制靶点,将口腔上皮细胞随机分组为:空白对照组、干扰对照组(转染siRNA 阴性对照)、Axin1 干扰-1 组(转染Axin1 siRNA-1)、Axin1干扰-2 组(转染Axin1 siRNA-2)、Axin1 干扰-3 组(转 染Axin1 siRNA-3)。 siRNA 阴 性 对 照、Axin1 siRNA-1、Axin1 siRNA-2 和Axin1 siRNA-3 通 过Lip 2000 转染至上皮细胞。 在37 ℃培养24 h 后,通过qRT-PCR 检测Axin1 的基因表达水平。
为鉴定Axin1 对细胞增殖活性的影响,将对数期生长的细胞随机分组为:空白对照组、干扰对照组、Axin1 干扰组、过表达对照组、Axin1 过表达组。siRNA 阴性对照、Axin1 siRNA、过表达对照质粒或Axin1 过表达质粒通过Lip 2000 转染至上皮细胞。24 h 后,进行其他实验分析。
2.2 qRT-PCR 检测Axin1 的基因和mRNA 的表达水平
采用Trizol 法提取细胞中的总RNA。采用20 μL反应体系,根据HiFiScript 互补DNA 合成试剂盒说明书合成互补DNA。 以互补DNA 为模板,采用实时荧光定量PCR 检测各组细胞中的Axin1 的基因表达水平。 其中,实时定量PCR 采用30 μL 体系,40个循环。2-ΔΔCt被用来计算RNA 表达量。Axin1 采用βactin 作为内参。 引物序列见表1。

表1 引物序列
2.3 Western blot 检测蛋白表达
采用RIPA 裂解液提取细胞中的总蛋白。 在恒压75 V 条件下进行SDS-PAGE 电泳分离蛋白。 在恒流300 mA 的条件下,蛋白被转移到硝酸纤维素膜上。采用5%脱脂牛奶封闭,4 ℃过夜。Axin1(1 ∶1000)、β-catenin(1 ∶5000)、PCNA(1 ∶3000)、Bax(1∶6000)、Bcl-2(1∶3000)、Caspase-3(1∶1000)和βactin(1∶5000)室温孵育90 min,磷酸缓冲液清洗。辣根过氧化酶羊抗鼠IgG(1∶5000)和辣根过氧化酶羊抗兔IgG(1∶6000)室温孵育60 min。 清洗后加电化学发光显色液显色。 Quantity One 软件分析各条带的吸光度值。
2.4 CCK-8 分析细胞活性
取在96 孔板中培养好的细胞,去除含药培养基每孔加入100 μL 含有CCK-8 的培养基。 其中,以10 μL/孔的量,提前用完全培养基配制含CCK-8 的培养基。继续孵育4 h 后,采用Bio-Tek 酶标仪分析450 nm 下的吸光度值。
2.5 平板克隆鉴定细胞增殖能力
将各组培养好的细胞用0.25%胰酶消化液消化并制成细胞悬液,调整细胞密度约为1×105个/mL。每组各取200 个/mL 细胞接种于6 孔板,37 ℃、5%CO2的培养箱中,每3 d 换液1 次,培养约3 周。 将培养好的细胞用4%多聚甲醛固定30 min。 0.5%结晶紫染色5 min 后,用清水洗3 遍。 相机拍照后,用酶标仪测定550 nm 下的吸光度值。
2.6 流式细胞术分析细胞周期
取出培养好的细胞,加入低温PBS 漂洗细胞并使细胞重悬。加入1.2 mL 预冷的乙醇后,4 ℃放置过夜。采用PBS 去除乙醇。在4 ℃避光环境下,150 μL碘化丙啶工作液染色30 min。 流式细胞仪测定各细胞周期的百分率。
2.7 含药血清制备与分组
2.7.1 含药血清制备 如前期研究所述[13],制备含DXKK 血清。SD 雄性大鼠被随机分为空白对照组和DXKK 处理组,每组5 只。 DXKK 组的大鼠以组方12 g/kg(按大鼠与人的体表面积换算公式[14]计算,相当70 kg 成人剂量的3 倍)进行灌胃给药,持续1周。空白对照组的大鼠以生理盐水进行灌胃,持续1周。经腹腔麻醉后,在无菌条件下对大鼠进行腹主动脉采血。 血液室温静置2 h 后,进行离心、灭活和除菌。 分装后置于-20 ℃的冰箱中冻存。
2.7.2 细胞分组与处理 取对数期生长的细胞,随机分组为:空白对照组、AH 刺激组、空白血清干预组(AH 刺激+空白血清)、含DXKK 血清干预组(AH刺激+含DXKK 血清)、含DXKK 血清干预+Axin1过表达组。细胞通过AH(50 μg/mL)、空白血清或含DXKK 血清干预48 h 后,再进行其他实验检测。 其中,血清(空白血清或含DXKK 血清)与口腔上皮细胞完全培养基按体积1∶9 的比例被配制成含10%含药血清。含DXKK 血清干预+Axin1 过表达组的细胞在转染Axin1 过表达质粒后进行AH 和DXKK 干预。 空白对照组不做任何处理。
2.8 EdU 细胞增殖活性分析
取对数期生长的细胞,加入提前制备好的50 μmol EdU 培养基,37 ℃孵育过夜。 弃培养基,PBS 清洗2次。采用50 μL 4%多聚甲醛固定细胞。Apollo 染色液和Hoechst 33342 染色液分别在室温、避光条件下孵育30 min 染色后,PBS 清洗2 次。 采用显微镜观察和拍照。
2.9 统计学分析
采用SPSS 23.0 和GraphPad Prism 8.0.1 进行统计分析。 实验结果以“±s”表示。 采用One-way ANOVA 和Two-way ANOVA 分析多组间的数据。以P<0.05 代表差异有统计学意义。
3 结果
3.1 筛选Axin1 的干扰靶点
与干扰对照组比较,Axin1 干扰-1 组、Axin1 干扰-2 组和Axin1 干扰-3 组Axin1 的基因表达水平均显著降低(P<0.01)。其中,Axin1 干扰-2 组的抑制效果最明显。因此,选择Axin1 siRNA-2 进行后续实验。 干扰对照组Axin1 的基因表达水平与空白对照组比较,差异无统计学意义(P>0.05)。 详见图1。

图1 Axin1 干扰靶点的筛选
3.2 调控Axin1 影响口腔上皮细胞增殖活性
与干扰对照组比较,Axin1 干扰组Axin1 mRNA的表达水平显著下降(P<0.01)。与过表达对照组比较,Axin1 过表达组Axin1 mRNA 的表达水平显著升高(P<0.01)。空白对照组、过表达对照组和干扰对照组间Axin1 mRNA 的表达水平比较,差异均无统计学意义(P>0.05)。与干扰对照组比较,Axin1 干扰组细胞增殖活性显著升高(P<0.01)。 与过表达对照组比较,Axin1过表达组细胞增殖活性显著降低(P<0.01)。 详见图2。
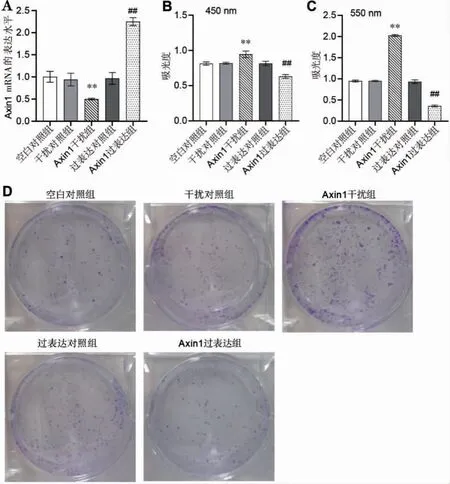
图2 调控Axin1 影响口腔上皮细胞增殖活性
3.3 Axin1 影响增殖、凋亡相关蛋白的表达
与干扰对照组比较,Axin1 干扰组Axin1、Bax、cleaved Caspase-3 蛋白表达显著降低(P<0.05 或P<0.01),β-catenin、PCNA、Bcl-2 蛋白表达显著升高(P<0.01)。 与过表达对照组比较,Axin1 过表达组Axin1、Bax、cleaved Caspase-3 蛋 白 表 达 显 著 升 高(P<0.01),β-catenin、PCNA、Bcl-2 蛋白表达显著降低(P<0.01)。 详见图3、表2。

表2 各组上皮细胞中凋亡相关蛋白的表达比较

图3 Axin1 影响凋亡相关蛋白的表达
3.4 过表达Axin1 促进G1/S 期细胞周期阻滞
与过表达对照组比较,Axin1 过表达组处于G1期的细胞比例显著降低(P<0.01),处于S 期的细胞比例显著升高(P<0.01)。 详见图4。
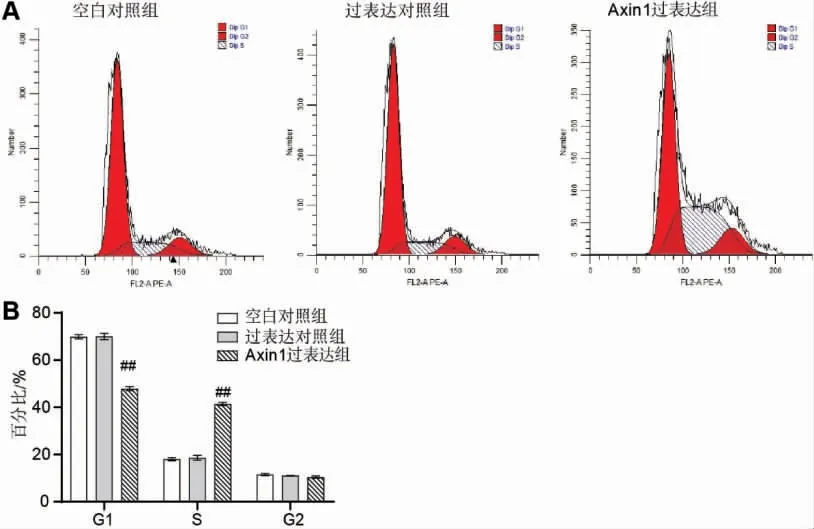
图4 过表达Axin1 影响口腔上皮细胞的周期调控
3.5 DXKK 调控Axin1 影响口腔上皮细胞增殖活性
与空白对照组比较,AH 刺激组Axin1 蛋白表达显著升高(P<0.01),细胞增殖活性显著降低(P<0.01)。 与空白血清干预组比较,含DXKK 血清干预组Axin1 蛋白表达显著降低(P<0.01),细胞增殖活性显著升高(P<0.01)。 与含DXKK 血清干预组比较,含DXKK血清干预+Axin1 过表达组Axin1 蛋白表达显著升高(P<0.05), 细胞增殖活性显著降低 (P<0.05)。 详见图5。
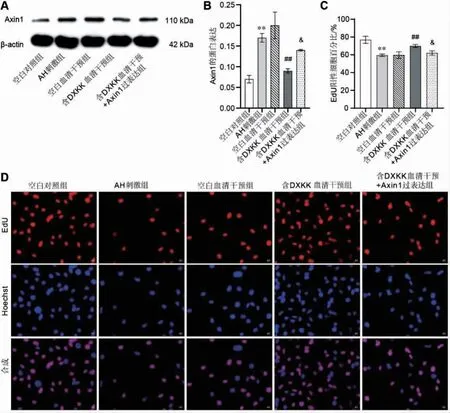
图5 DXKK 调控Axin1 影响口腔上皮细胞增殖活性
4 讨论
Axin1 的表达与细胞的增殖、凋亡密切相关[15-16]。本研究发现,在沉默/过表达Axin1 后,口腔上皮细胞的增殖活性随之发生改变。 蛋白水平上,增殖、凋亡相关指标(PCNA、Bax、Bcl-2 和Caspase-3)也同样受到影响,表明Axin1 参与口腔上皮细胞增殖、凋亡的生物学过程。 类似的,Axin1 作为肿瘤抑制因子参与肝细胞癌的增殖、侵袭、迁移和上皮间质转化[17]。靶向Axin1 可以调控细胞的增殖、凋亡水平,影响帕金森病的发展[18]。 在缺氧诱导的心肌细胞损伤模型中,miR-3574 可通过抑制Axin1 影响细胞凋亡水平[19]。这些与本研究的结论一致,Axin1 可影响细胞的增殖活性。在过表达Axin1 后,细胞发生G1/S 期阻滞。这与前期研究发现一致,过表达Axin1 可诱导G1/S期细胞周期停滞[20]。 Axin1,Axin 蛋白中的一种,作为β-catenin破坏复合物的中心支架,与破坏复合物的其他核心成分相互作用[21-22]。 经典的Wnt 信号通路参与并控制许多生物过程,包括细胞生长、增殖和分化[23-24]。 同样,失调的Wnt 信号通路影响OSF 的发展[25],促进口腔癌变[26]。 破坏复合物对细胞溶质βcatenin 的降解是Wnt 通路的关键调控步骤[21]。 其中,Axin1参与复合物的组装。 本研究证实,Axin1 沉默/过表达后,β-catenin 的蛋白水平发生改变。 这进一步表明,Axin1 可以通过β-catenin 信号影响细胞的增殖能力。
本课题组前期研究表明,DXKK 在治疗OSF 中具有明显的缓解效果[8]。 由丹参、玄参、当归、红花、生地黄、白花蛇舌草、夏枯草、生黄芪、薄荷、白芍、茵陈和桔梗等天然药物研制而成的DXKK,具有活血化瘀、扶正祛邪等功效[8]。 其中,丹参、当归和红花活血化瘀,生黄芪益气扶正,生地黄和玄参养阴清热,白花蛇舌草解毒散瘀,薄荷辛凉爽口、疏散风热[27]。临床研究表明,DXKK 可改善患者体内微循环、调整血液状态[27]。 本研究发现,OSF 可以调节Axin1 的表达。 在AH 诱导的口腔上皮细胞损伤模型中,Axin1的表达增加。而在DXKK 含药血清处理后,Axin1 的表达受到抑制,且伴随细胞增殖活性的上调,这表明DXKK 通过调控Axin1,缓解AH 诱导的细胞损伤。过表达Axin1 后,DXKK 对口腔上皮损伤细胞的增殖促进作用受到影响,提示Axin1 介导DXKK 缓解AH 诱导的上皮细胞损伤。
综上所述,Axin1 可能介导DXKK 缓解AH 诱导的口腔上皮细胞细胞损伤,这将为探究DXKK 治疗OSF 的内在机制提供可靠的科学线索。
