参苓白术散调节AMPK、ABCG2 改善高尿酸血症模型小鼠尿酸的实验研究
2022-12-27汪永辉江晓翠王武胜
汪永辉,萧 闵*,李 瑛,马 珑,江晓翠,王 岚,龚 健,王武胜
(1.湖北中医药大学黄家湖医院,湖北 武汉 430065;2.湖北中医药大学中医药实验中心,湖北 武汉 430065;3.湖北中医药大学,湖北 武汉 430065)
高尿酸血症(hyperuricemia, HUA)是内源性嘌呤代谢紊乱引起机体尿酸盐结晶析出,沉积于身体各部位,损伤机体功能的代谢异常综合征。临床最常见的表现为尿酸盐结晶沉积于关节,诱发痛风;并且血清长期高尿酸(uric acid, UA)状态也是糖尿病、高血压、慢性肾病、脑卒中等多种疾病发生发展的重要诱因[1-2]。 UA 排泄异常是HUA 主要发病机制,故影响UA 转运的蛋白是治疗HUA 的靶向分子之一。ATP 结合盒转运体G2(ATP-binding cassette transporter G2, ABCG2)是一类跨生物膜运输的蛋白,可利用ATP 水解释放的能量将细胞内UA 产物排出[3-4]。ABCG2 表达受AMP 活化蛋白激酶(AMP-activated protein kinase, AMPK)调节,有报道发现,通过AMPK/CREB 信号通路可影响ABCG2 表达,从而缓解2型糖尿病小鼠的HUA[5]。 因此,调节ABCG2/AMPK 通路改善UA 沉积是治疗HUA 的有效途径。
参苓白术散出自《太平惠民和剂局方》,具有益气健脾、渗湿止泻的功效。 临床运用显示,其能改善HUA 痛风性关节炎[6],治疗间歇期痛风性关节炎[7],调节血清白细胞介素-6、肿瘤坏死因子-α、C 反应蛋白、UA 及红细胞沉降率,改善关节肿胀及疼痛状况[8]。目前,尚无相关动物实验报道,并且是否能通过AMPK/ABCG2 改善UA 沉积尚不清楚。 本实验通过观察参苓白术散对HUA 小鼠模型血清UA 及肠组织AMPK、ABCG2 蛋白的影响,初步探索参苓白术散降UA 的作用机制。
1 材料
1.1 动物
SPF 级雄性昆明小鼠36 只,体质量18~22 g,购于三峡大学动物实验中心,许可证号:SCXK(鄂)2017-0012。 饲养于湖北中医药大学实验动物中心,许可证号:SCXK(鄂)2017-0067,饲养环境:温度为(22±2) ℃,相对湿度为50%~70%,适应性喂养1周。本实验操作严格遵守动物福利相关规定,由湖北中医药大学动物实验伦理委员会批准,伦理审批号:HUCMS202111013。
1.2 药物与试剂
参苓白术散组成:党参10 g,茯苓10 g,炒白术10 g,山药10 g,炒白扁豆7.5 g,莲子5 g,炒薏苡仁5 g,砂仁5 g,桔梗5 g,甘草10 g。生药均购自湖北中医药大学黄家湖医院,统一煎煮成生药含量为1 g/mL 的汤剂。 非布司他片(杭州朱养心药业有限公司,批号:20210805)。
氧嗪酸钾(合肥博美生物科技有限责任公司,批号:YZLCP0016);羧甲基纤维素钠(国药集团化学试剂有限公司,批号:CP300-800);UA(批号:GM1110)、谷丙转氨酶(glutamic pyruvic transaminase, ALT,批号:GM1102)、谷草转氨酶(aspartate transaminase,AST,批号:GM1103)均购自武汉赛维尔生物科技有限公司;CysC ELISA 检测试剂盒(批号:PC215)、RIPA 裂解液(批号:P0013B)、超敏电化学发光显影液(批号:P0018S-2)均购自上海碧云天生物技术有限公司;GAPDH(批号:P0018S-2)、兔多抗磷酸化的AMPK(phosphorylated AMPK, p-AMPK)抗体(批号:bs-3026R)、兔多抗ABCG2 抗体(批号:bs-0662R)均购自北京博奥森生物有限公司;BCA 蛋白定量试剂盒(武汉博士德生物科技有限公司,批号:G2026-200T);总RNA 提取试剂盒(批号:TSP413)、逆转录互补DNA 试剂盒(批号:TSK313S)、PCR 试剂盒(批号:TSE202)均购自北京擎科公司。 小鼠AMPK、ABCG2 引物均由武汉赛维尔生物科技有限公司合成。 详见表1。
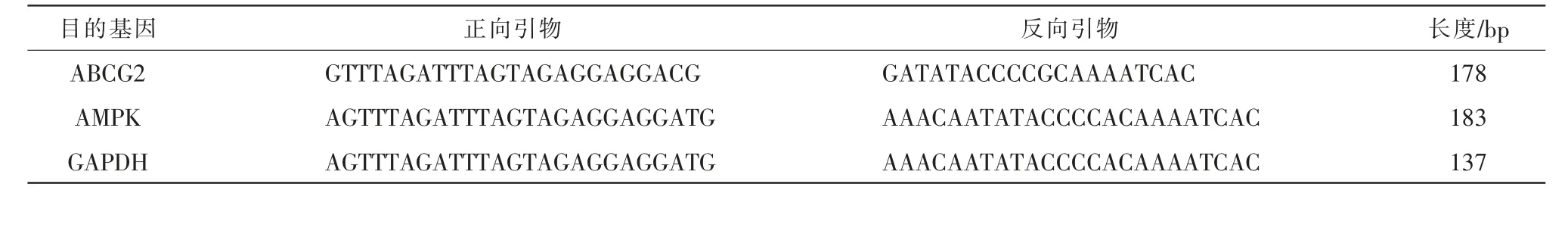
表1 引物序列
1.3 主要仪器
高速低温组织研磨仪(武汉赛维尔生物科技有限公司,型号:KZ-III-F);冷冻高速离心机(日本日立公司,型号:CR21G);电转仪(北京六一仪器厂,型号:DYCZ-40);RT-qPCR 仪(美国ABI 公司,型号:5900);显微镜(型号:E100)、成像系统(型号:NikonDS-U3)均购自日本尼康公司;全自动生化仪(深圳雷杜生命科学股份有限公司,型号:Chemray 800)。
2 方法
2.1 动物造模、分组及给药方法
36 只小鼠,随机分成4 组:空白组、模型组、中药组、西药组。空白组除外,其余各组每天腹腔注射氧嗪酸钾悬液0.6 g/kg,连续7 d,血清UA 升高提示造模成功[9]。 造模完成后,根据人给药剂量,1 剂/d(1 剂生药为77.5 g),配制1 g/mL 的参苓白术散悬液。按照小鼠与成人的体表面积换算公式[10]计算,中药组给予参苓白术散5 g/kg 灌胃,西药组给予非布司他0.25 g/kg 灌胃,空白组、模型组均给予生理盐水0.1 mL/kg。 各组均干预14 d。
2.2 取材方法
取材前12 h 禁食不禁水,末次给药1 h 后,2%戊巴比妥钠30 mg/kg 麻醉,心脏采血,室温静置1 h后,3000 r/min、半径13 cm、4 ℃离心10 min,收集上层血清,置于-80 ℃冰箱内冷冻保存。
小鼠安乐死后,快速剥离左叶肝、左侧肾、回肠组织,生理盐水冲洗干净,一部分置于4%多聚甲醛中固定,一部分组织,经液氮速冻后,置于-80 ℃低温冰箱内保存。
2.3 生化法检测血清UA
取4 μL 血清,加入250 μL 反应试剂,波长510 nm,上机,全自动生化仪自动测定UA。
2.4 ELISA 法检测血清CysC 含量
取血清,严格按照ELISA 试剂盒步骤操作,每孔50 μL 血清,依次加入标准品、加样加酶、温育、洗涤、显色、每孔加终止液50 μL,终止反应,450 nm波长依序测量各孔的光密度值,根据标准曲线,计算CysC 蛋白浓度。
2.5 HE 染色法检测肾、回肠组织病理变化
取4%多聚甲醛固定液中固定48 h 的肾、回肠组织,梯度乙醇脱水;二甲苯透明;浸蜡包埋;5 μm切片、脱蜡,HE 染色,光学显微镜下观察并采集图片。
2.6 Western blot 检测回肠组织AMPK、p-AMPK、ABCG2 蛋白表达
取50 mg 回肠组织,加入1 mL RIPA 裂解液及PMSF 蛋白酶抑制剂,高速组织研磨仪匀浆后置于冰上反应30 min,10 000 r/min、半径13 cm 离心15 min,取上清液蛋白,BCA 法测定蛋白浓度,制备蛋白样品。SDS-PAGE 电泳后湿转法转膜,10%脱脂牛奶室温下封闭2 h,TBST 洗膜3 次,加入兔多抗ABCG2、p-AMPK 于4 ℃冰箱内孵育过夜,次日辣根过氧化物酶标记羊抗兔二抗室温孵育1 h,TBST 洗膜3 次,超敏电化学发光液显影。采用Image J 图像处理软件计算出目标蛋白和内参GADPH 对应条带灰度值的比值,统计分析。
2.7 RT-qPCR 检测回肠组织ABCG2 mRNA 表达
取50 mg 回肠组织,加Trizol 1 mL 提取总RNA,超微量分光光度计测定RNA 浓度。 采用第一链互补DNA 合成试剂盒将RNA 转录为互补DNA,反应条件:25 ℃,5 min;52 ℃,15 min;83 ℃,5 min;4 ℃,10 min。 取稀释5 倍的互补DNA 4 μL,加入上、下游引物各0.2 μL,进行RT-qPCR,40 个循环。 绘制扩增曲线熔解曲线,结果采用2-△△Ct计算分析。
2.8 安全性评估
2.8.1 HE 染色观察肝病理变化 取4%多聚甲醛固定液中固定48 h 的肝组织,梯度乙醇脱水;二甲苯透明;浸蜡包埋;5 μm 切片、脱蜡,HE 染色,光学显微镜下观察并采集图片。
2.8.2 生化法检测肝功能 取12 μL 血清,加入240 μL 反应试剂,波长340 nm,上机,全自动生化仪自动测定AST;取12 μL 血清,加入240 μL 反应试剂,波长340 nm,上机,全自动生化仪自动测定ALT。
2.9 统计学方法
图片分析采用Image Pro Plus 5 软件分析,数据采用SPSS 21.0 软件分析。 计数资料以“±s”表示,数据先进行正态及方差齐性检测,若两项皆符合,采用单因素方差(ANOVA)分析;若数据不符合正态分布或者方差不齐,采用非参数检验。 以P<0.05表示差异有统计学意义。
3 结果
3.1 参苓白术散对血清UA、CysC 的影响
与空白组比较,模型组UA、CysC 含量均显著升高(P<0.01)。 与模型组比较,西药组和中药组UA 含量显著降低(P<0.01);中药组CysC 含量显著降低(P<0.01)。西药组CysC 含量与模型组比较,差异无统计学意义(P>0.05)。 中药组UA、CysC含量与西药组比较,差异均无统计学意义(P>0.05)。 详见图1。
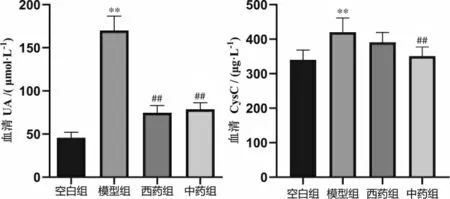
图1 参苓白术散对各组小鼠血清UA、Cysc 水平的影响
3.2 参苓白术散对回肠、肾组织病理变化的影响
空白组,肾小球大小均匀,肾小管结构清晰,边界明显,上皮细胞形态正常;模型组,肾间质有炎性细胞浸润,肾小球未见明显萎缩,肾小管结构可见,上皮细胞轻微脱落;中药组及西药组上皮细胞脱落症状有所改善。 详见图2。

图2 参苓白术散对各组小鼠肾组织的影响(HE 染色)
空白组回肠组织黏膜皱襞规则,肠绒毛完整、整齐、密集;模型组肠绒毛存在大量炎细胞团,肠绒毛短小,隐窝深度变浅,肠黏膜上皮细胞出现不同程度损伤;与模型组比较,中药组肠绒毛完整,排列较为稀疏,炎性细胞浸润和肠黏膜上皮细胞损伤有所改善;西药组炎性细胞浸润改善,肠黏膜上皮细胞损伤,微绒毛坏死脱落,未见明显好转。 详见图3。

图3 参苓白术散对各组小鼠回肠组织的影响(HE 染色)
3.3 参苓白术散对回肠组织p-AMPK、ABCG2 蛋白的影响
与空白组比较,模型组p-AMPK、ABCG2 蛋白含量均显著降低(P<0.01)。 与模型组比较,中药组和西药组p-AMPK、ABCG2 蛋白含量均显著升高(P<0.01)。 详见图4。
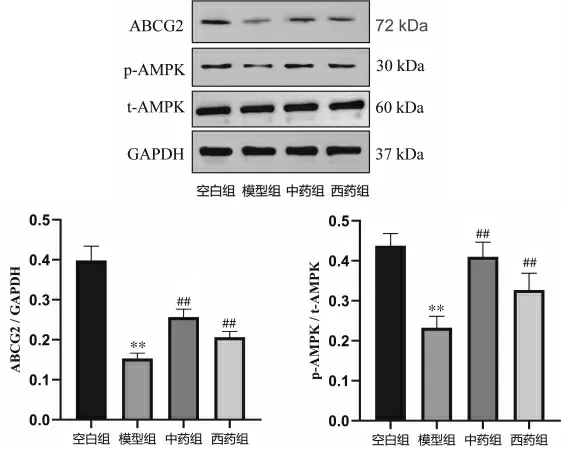
图4 参苓白术散对各组小鼠回肠组织p-AMPK、ABCG2 蛋白的影响
3.4 参苓白术散对回肠组织ABCG2 mRNA 的影响
与空白组比较,模型组ABCG2 mRNA 含量显著降低(P<0.01)。 与模型组比较,中药组和西药组ABCG2 mRNA 均显著升高(P<0.01)。 详见图5。
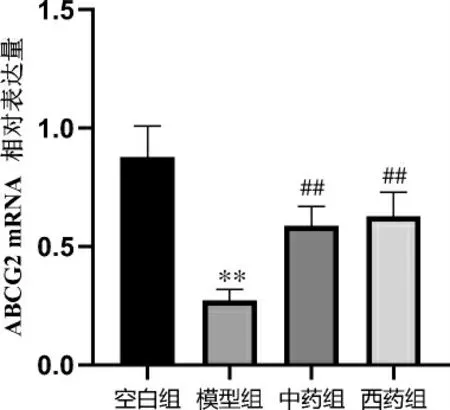
图5 参苓白术散对各组小鼠回肠组织ABCG2 mRNA表达的影响
3.5 参苓白术散药物安全性的评估
3.5.1 对肝功能的影响 各组间血清ALT、AST 比较,差异均无统计学意义(P>0.05)。 详见图6。
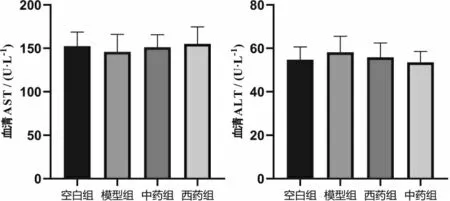
图6 参苓白术散对各组小鼠血清AST、ALT 水平
3.5.2 对肝组织病理的影响 肝板的细胞排列紧密,肝小叶结构清晰,从整体来看肝窦无规律性扩张。详见图7。
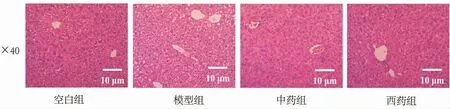
图7 各组小鼠肝组织病理变化(HE 染色,×40)
4 讨论
随着饮食结构及生活方式的改变,HUA 发病率呈逐年升高趋势[11]。 HUA 和痛风有明确的因果关系,是同一种疾病的不同病理过程[12]。 HUA 可引起急性痛风性关节炎、痛风石沉积、痛风石性慢性关节炎和关节畸形、UA 性肾病等,严重危害患者健康。
早期HUA 无临床症状,通过血清UA 判定其发病,中医学尚无明确辨证体系。若出现一些列UA 沉积后诱发症状,如关节红肿热痛等,HUA 则归属“痛痹”的范畴。究其病因,为平素多食高粱肥甘厚味,致脾失运化而痰浊内生;明其病机,乃为痰阻气血运行,而致气滞、血瘀;反之,气滞、血瘀,水津不布又可化生痰浊,正如李东垣《脾胃论·脾胃胜衰论》云:“百病皆由脾胃衰而生”。 《素问·至真要大论》云:“诸湿肿满,皆属于脾”,脾虚运化无力,则生湿邪,湿邪随经脉、肌肉、三焦等组织泛溢于四肢百骸,从而表现出关节肿胀、疼痛等不适。 因此,HUA 中医基本病因病机可概括为“肥甘厚味,脾失运化,诸湿肿满”。
参苓白术散出自《太平惠民和剂局方》,具有益气健脾的功效,由薏苡仁、甘草、桔梗、砂仁、白术、白茯苓、党参、山药组成。 方中党参、白术、茯苓、甘草,为四君子汤,益气健脾;加上山药、炒白扁豆,补土生金,兼有补肺的作用;薏苡仁祛湿,砂仁暖胃,莲子补心,陈皮燥湿,桔梗辛开宣肺,载药上行。该方益气健脾,针对痛痹的主要病机,具有一定疗效[13]。现代药理学研究表明,薏苡仁具有抗氧化、镇痛抗炎药理作用,能舒经除痹,改善关节疼痛[14];茯苓提取出茯苓多糖及三萜类成分,具有利尿、保肝、镇静、提高免疫力、抗炎、抗肿瘤以及降血脂等多种药理作用[15],茯苓可通过缓解肾脏损伤及调节肠道菌群来促进机体内UA 的排泄进而达到降UA 的效果[16]。 因此,提示参苓白术散具有改善痛风的物质基础。
UA 是碳、氮、氢和氧的杂环化合物,是存在于血液循环中的嘌呤代谢的氧化产物,体内的UA 水平通过其生成和排泄的平衡来维持,生成、排泄失衡是HUA 发生的根本原因[17]。 本实验结果显示,参苓白术散降低模型小鼠血清UA 沉积,证明参苓白术散具有调节UA 过量沉积的功能,具有防止HUA 的作用。UA 在生理pH 值下以尿酸盐阴离子的形式存在,不能透过细胞膜,需要转运蛋白。ABCG2 是一种在近端肾小管上排泄尿酸盐转运蛋白,其活性决定了细胞内UA 水平,ABCG2 也在肝和肠细胞中表达。 已有实验证实,小鼠肠道ABCG2 的功能障碍或活性丧失会增加尿中UA 的排泄[18]。 本实验结果显示,参苓白术散升高模型小鼠回肠组织ABCG2 表达,降低血清UA。 ABCG2 是利用ATP 水解释放的能量完成UA 转运,AMPK 是促进产生ATP 的分解代谢重要途径[19]。AMPK 激活依赖于苏氨酸172α 环位点的磷酸化,当AMPKA 磷酸化完成,才能发挥其正常功能[20]。 本实验结果显示,参苓白术散影响AMPK的磷酸化,调节ABCG2 蛋白表达。
综上所述,参苓白术散调节HUA 小鼠肠组织AMPKA 磷酸化,升高ABCG2 表达,降低血清UA 含量是治疗HUA 的关键环节。并且本实验通过血清肝功能、肝组织病理评估参苓白术散药物安全性,结果显示参苓白术散对肝功能及肝组织无影响,值得临床推广应用。 本研究不足之处,未能检测AMPK通路其他相关蛋白,进一步明确参苓白术散防治HUA的机制。
