ε-聚赖氨酸发酵工艺的研究进展
2022-12-26王月扶教龙张昳
王月,扶教龙,张昳
(苏州科技大学 化学与生命科学学院,江苏 苏州,215009)
同源多聚氨基酸是线性合成聚合物,由独特类型氨基酸的重复单元组成。迄今为止,已经发现了由微生物分泌的4种同源多聚氨基酸,包括聚ε-L-赖氨酸(ε-poly-L-lysine,ε-PL)、聚γ-谷氨酸、聚γ-L-二氨基丁酸和聚L-α,γ-二氨基丁酸[1-3]。其中,ε-PL是一种新型的天然同型单体聚合物,由25~35个L-赖氨酸通过α-羧基和ε -氨基形成的酰胺键连接而成。
由于其独特的结构,ε -PL具有很多优异的性能,例如可生物降解、水溶性、热稳定、抗菌、可食用和无毒等。此外,它还表现出良好的内毒素选择性去除和抗肥胖特性,改善细胞黏附,抑制胰腺脂肪酶活性,并防止口腔细菌毒素产生[4]。因此,ε-PL具有作为抗菌食品防腐剂,治疗基因或药物载体,酶稳定剂和化妆品成分的巨大潜力。ε-PL对单增李斯特菌、大肠埃希氏菌、金黄色葡萄球菌等微生物表现出优异的抗菌效果且抗菌谱广,这些优点使得ε -PL主要用作天然食品防腐剂[5]。日本在19世纪80年代首次将ε-PL批准作为食品防腐剂。后来,陆续被美国、韩国、中国等国家和地区批准使用。
目前,ε -PL主要通过白色链霉菌发酵生产。与化学方法相比,微生物法生产ε-PL具有条件温和、原料来源广、操作简便和绿色环保等优点[6]。ε-PL是1977年在SHIMA等[1]筛选Dragendorff-Positive(DP)化合物时首次发现的,至此为了开发ε-PL进行了越来越多的研究,包括产ε-PL菌株的选育[7]、ε-PL发酵工艺开发[8]以及ε-PL生物合成机制的探究[9]等。近年来,随着基因工程、代谢组学、蛋白质组学、生物信息学以及先进测试技术的发展,对ε-PL生物合成机理的研究越来越深入。当然,ε-PL的高效低成本生产是一个不变的主题,最近几年研究人员开发出了一些新型高效的发酵工艺用于ε-PL生产。本文对高产ε-PL菌株的选育方法和合成机理进行了简要概述,着重综述了其发酵工艺优化的最新研究进展。希望帮助相关研究者和生产技术人员了解这种新型聚合物的最新进展和未来发展趋势。
1 ε-聚赖氨酸的概述
1977年日本学者SHIMA和SAKAI从微生物中筛选DP物质时,筛选到1株稳定且能大量产生DP物质的放线菌(白色链霉菌Streptomycesalbulus),通过对其产物进行酸水解并进行结构解析得知该物质为一种通过α-羟基和ε-氨基之间脱水缩合而形成的聚合物——ε-聚赖氨酸[1]。ε-PL的抑菌谱非常广,对革兰氏阳性菌、革兰氏阴性菌及真菌都有较好的抑制效果。其抑菌效果主要受其表面阳离子量及聚合度影响,通过静电吸附与目标的细胞膜相结合,进而细胞丧失正常的流动性,细胞膜破裂,胞内物质外溢,最终导致细胞自溶死亡[5]。ε-PL分子质量在 3 600~4 300 Da 具有较好的抑菌性能,当分子质量低于1 300 Da 的时候,就会失去抑菌活性。对ε-PL的水溶液进行核磁共振和圆二色谱分析后发现,不同pH条件对ε-PL在溶液中的构型有很大的影响[10]。
目前,学界认可的合成途径为:ε-PL产生菌通过二氨基庚二酸途径合成前体L-赖氨酸,并将其用于ε-PL的组装,图1为其可能的简化生物合成途径。随后,研究人员尝试探究其生物合成机理。SHIMA等[11]用14C 放射性同位素标记证明L-Lys是ε-PL的前体。然而,赖氨酸单体组装成聚合物的机理尚不清楚。经过很长时间后,KAWAI等[12]在无细胞系统中实现了ε-PL生物合成,膜部分的合成活性主要依赖于ATP,不受核糖核酸酶、氯霉素或卡那霉素的影响。这些结果表明,膜中存在的非核糖体肽合成酶(non ribosomal peptide synthetase,NRPSs)最有可能催化ε-PL的生物合成。2008年,CHEN等[9]成功纯化并表征了ε-PL合成酶(Pls)。通过对Pls结构的分析,发现Pls是具有典型A域和T域的单模块NRPSs。其中A和T结构域负责L-赖氨酸的捕捉、活化和转化,而传统的C域变为C1、C2和C3结构域来负责将已活化的L-赖氨酸连接,这种新型的单模块 NRPS 结构可能是这些均聚氨基酸合成酶的共同特征,结构域的相互连接作用对酶活性至关重要。Pls是ε-PL合成途径中的主要限速酶之一,这些研究为进一步利用基因工程方法提高白色链霉菌生产ε-PL能力奠定了良好基础。
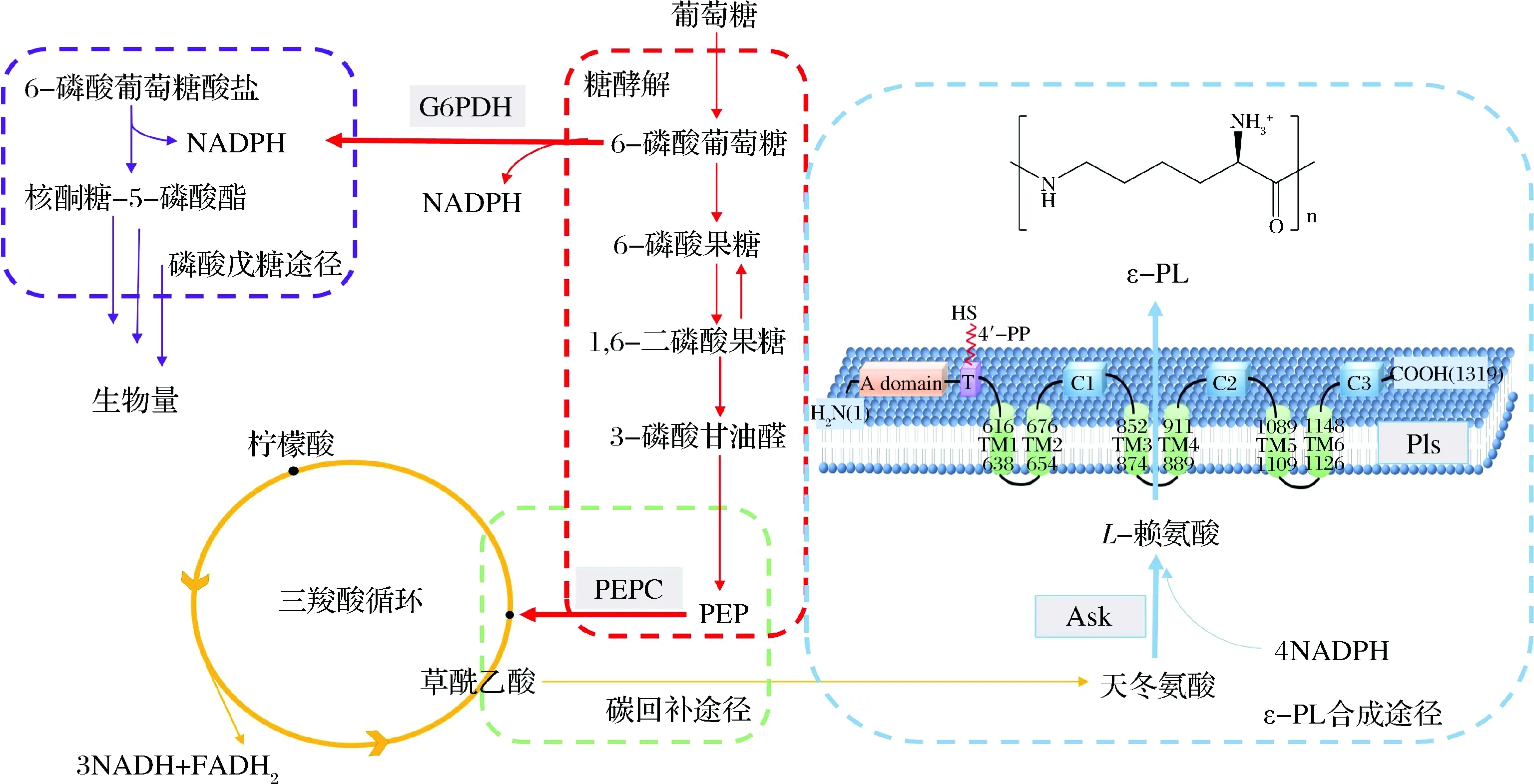
图1 ε-PL的合成途径示意图Fig.1 The synthetic route of ε-poly-L-lysine
2 产ε-PL菌株分离和改造
如引言部分所述,高产ε-PL菌株的筛选是实现ε-PL工业生产的关键。野生型产生菌的ε-PL产量极低[一般ρ(ε-PL)<0.2 g/L],故借助菌株选育方法提升其合成能力是实现ε-PL工业化生产的必经之路[13]。目前,已用于高产ε-PL生产菌选育的方法有检测碱性/酸性染料与培养基中分泌的聚阳离子ε-PL之间的相互作用。如NISHIKAWA等[14]采用Poly R-478酸性染料筛选的方法从土壤中发现了超过10种产生ε-PL的菌株。此后,根据这种方法或改进的方法筛选了其他几种高效产ε-PL的菌株,如S.albulusNK660[15]和S.griseofuscusH1[16]。另一种常用的菌株筛选方法是“两阶段控制法”。SHIMA等[17]基于细胞生长的最适pH值与S.albulusNo.346 中 ε-PL 积累之间的差异提出了这种方法。随后,HIROHARA等[18]开发了两阶段培养方法,其中每个菌落首先在生长培养基(pH 6.8)中培养20~48 h(细胞生长培养阶段),然后收集、洗涤、重悬菌丝体并在生产发酵液中培养(pH 4.5,ε- PL生产培养阶段)。“两阶段控制法”已经被广泛使用,许多产ε-PL菌株已成功分离和研究,例如Streptomycessp.USE-11[18]和StreptomycesahygroscopicusGIM8[19]。
为了提高ε-聚赖氨酸产生菌的合成能力,对菌株进一步改造具有重要意义。王靓[20]运用核糖体工程选育ε- PL高产菌株,并结合传统诱变和基因组重排,构建了单抗和多抗突变株,大幅提高了ε-PL的摇瓶产量。LIU等[21]引入链霉素抗性,通过1 631个突变体的筛选获得了产量最高的突变体S.albulusSS-62,其ε-PL摇瓶发酵的产量为3.04 g/L比亲本菌株高1.79倍。XIANG等[22]在细胞和分子水平上研究了常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变对白色链霉菌的影响,诱变后ε-PL产量增加了18.46%。越来越多研究表明通过引入耐药突变可以显著激活抗生素对链霉菌次级代谢产物的生产。近年来除了传统理化诱变育种,基因组重排、核糖体工程、基因工程和高通量筛选等方法也在提高菌株的初级和次级代谢物上广泛应用,加快了我们对ε-PL生物合成机制的深入了解和构建ε-PL高产菌株进程。
3 ε-PL生产的发酵工艺
3.1 培养基的优化
培养基成分可能会影响微生物的生长和产物代谢积累。早在2006年SHIH等[23]通过响应面法开发了一种适用于S.albulusIFO 14147的培养基。结果显示,S.albulusIFO 14147生产的ε-PL产量增加了约9倍。同样,BANKAR等[24]使用Placket-Burman设计方法优化的培养基成分,用于S.nourseiNRRL 5126生产,ε-PL产量从基础培养基中的41.81 g/L提高到98.07 g/L。CHHEDA等[25]使用正交设计方法确定了新型ε-PL生产者蜡状芽孢杆菌的最佳培养基组成,使得ε-PL产量从36.29 mg/L显著提高至83.49 mg/L。尽管培养基优化方法可能工作量繁重,但是对于ε-PL的生产非常有效。M3G培养基是第一个被报道用于ε-PL发酵的培养基,并且仍然常用。目前基于这种原始培养基设计了各种优化培养基的方法,例如单因子法,正交阵列法[25],响应面法[8,23-24]和人工智能神经网络[26]。
同时,在研究ε-PL的过程中,研究人员发现某些工业副产物可以替代ε-PL生产中常用的碳源和有机氮源,这不仅可以降低ε-PL生产的成本,而且将副产物转化为增值化合物。例如扶教龙等[27]发明了一种以木薯渣水解液为碳源生产ε-PL的方法,其特征在于以木薯渣水解液作为发酵培养基或补料培养基中的碳源。木薯渣是淀粉厂和酒精厂的下脚料,国内外每年废弃量相当大,严重污染环境,这种开发利用是环保和经济的,因为它将废弃的原料转化为高价值产品。另外一些研究人员尝试利用包括甘油和甘蔗糖蜜在内的替代碳源来生产ε-PL,特别是近年来大量开发的粗甘油基化学品与新材料研究具有广阔的发展前景[28]。甘油在ε-PL生产中应用最成功的是由REN等[19-20]进行的,他们首先优化了以甘油为碳源的ε-PL生产的培养基,基于该介质进行了一系列改进。最终,在5 L生物反应器中ε-PL的生产从最初的2.27 g/L提高到62.36 g/L。在另一项研究中,XIA等[31]尝试使用甘蔗糖蜜水解生产ε-PL,优化初始总糖浓度后,在1 t发酵罐中获得20.6 g/L的ε-PL。在这种情况下,制糖业的副产品可以被成功转化为ε-PL。培养基的价格占ε-PL工业发酵中运营成本的很大一部分,因此,低成本的工农业废物作为ε-PL发酵的替代碳源具有很大的前景。
3.2 pH控制策略
pH冲击策略能有效提高细胞的抗氧化能力,减少细胞的氧化损伤,这可能是信号转导系统在应对pH冲击中所起的重要作用,并导致代谢活力和细胞内氧化还原稳态的增强[32]。生产ε-PL最经典的发酵策略是两阶段pH控制法,据此方法报道的S.albulusS410的ε-PL的生产量为48.3 g/L[33]。直到最近,在提升ε-PL产率上才取得突破,并通过pH冲击策略超过了KAHAR的相关研究结果[29]。
在ε-PL的深层发酵中,研究人员发现如果不控制酸碱度,ε-PL发酵液的pH会自然从初始值约6.5~7.0连续降低至约3.0,同时有较低ε-PL的积累。进一步的实验表明,积累ε-PL的最佳pH为4.0,细胞生长的最佳pH为6.0。因此,pH控制策略通过自动进料碱溶液(即NaOH或NH4OH)是确保ε-PL高生物量充分积累的有效方法。在此基础上,KAHAR等[33]使用2个不同的pH阶段将S.albulusS410生产ε-PL的整体产量从5.7 g/L提高到40.3 g/L;在第一阶段中,将发酵液的pH值保持在5.0以上以促进细胞生长,而在第二阶段中,ε-PL积累时的pH值则保持在4.0。REN等[29]通过将其与酸性pH冲击相结合,改进了这种经典的pH控制策略。改良的发酵过程可分为3个阶段,即在pH 5.0下的预酸冲击适应阶段,在pH 3.0时进行酸性pH冲击以及pH恢复至4.0阶段生产ε-PL。最终,发酵液中ε-PL最大产量达到54.70 g/L。与KAHAR等[33]的经典两段pH控制策略相比,生产菌株的代谢活性在pH冲击期受到严重抑制,从而导致调节基因、生物合成基因和应激反应基因的过量产生。因此,当pH值回到4.0时,细胞的生长和ε-PL的产量显著增强。综上所述,pH是ε-PL生物合成的关键参数。无论采用哪种策略,pH 4.0最适合ε-PL的形成,而较高的pH(大于4.5)对细胞生长更好。
3.3 溶解氧控制策略
发酵液中的溶解氧(dissoved oxygen,DO)水平也是ε-PL生产中的另一个关键参数。ε-PL的生物合成和细胞生长都需要大量的ATP,这主要是通过有氧呼吸产生。这表明发酵液中的高溶解氧水平将有利于细胞生长和ε-PL的生物合成。然而,由于高耗氧量和细胞密度,ε-PL发酵液中的氧气供应通常受到限制。
在这方面,BANKAR等[34]通过研究不同的曝气搅拌条件,建立了适合生产S.nourseiNRRL 5126发酵动力学的两阶段DO控制策略。在此条件下,恒定的DO水平(细胞生长期为40%,ε-PL生产阶段为20%)有效地提高了ε-PL的产量和生物量,分别达到1.99 g/L和20.73 g/L。由于菌丝相互缠绕,细胞密度大和ε-PL的分子质量高,使得发酵液变得黏稠,并且氧转移效率低。因此,仅通过改善发酵过程中的搅拌和曝气来提高DO水平是困难的。此外,由于伴随着高剪切应力,搅拌转速的增加还可能导致对菌丝体形态、产物形成和ε-PL产量有不良影响。在这种情况下,XU等[35]尝试使用2种策略来改善S.albulusPD-1的氧气限制问题。第一种是将氧气载体添加到发酵液中,在发酵液中添加0.5%的正十二烷可以有效地使DO含量保持大于 32%的饱和度,在氧气升高的条件下,ε-PL产量从23.4 g/L提高至30.8 g/L。第二种是通过将透明颤菌血红蛋白基因引入S.albulusPD-1染色体,将氧气输送到末端呼吸氧化酶来帮助增强呼吸和氧化磷酸化增强其结合氧的能力,使得ε-PL的产量从22.7 g/L增加到34.2 g/L。细胞内ATP含量的测定表明,在供氧充足时S.albulusPD-1中产生了更多的ATP,这可能与更强的碳和能量代谢有关[36]。
3.4 生物反应器
优化生物反应器也可以提高发酵整体工艺效率。ε-PL生产中最常用的生物反应器是具有机械搅拌和常规通气的反应器。然而,研究人员并没有放弃设计用于ε-PL生产的新型生物反应器。早在2002年,KAHAR等[37]就对气升式生物反应器(airlift bioreactor,ABR)的ε-PL生产进行了评估,减少搅拌意味着细胞内核酸等物质的泄漏量减少,所以该反应器生产成本、能源消耗和下游加工成本都很低。因为ε-PL是天然阳离子聚合物,所以应用阴离子树脂吸附累积的ε-PL,原位产物去除(insituproduct removal,ISPR)通过克服积累的ε-PL反馈抑制作用和毒性效应极大地提高了ε-PL的最终产量[38]。细胞固定化是ε-PL生产的另一新策略,ZHANG等[39]将丝瓜络用作ε-PL生产的绿色固定材料,将ISPR与细胞固定技术相结合,最终ε-PL的产量和菌体量分别达到34.1和26.5 g/L。在这种条件下,固定化的细胞最多能使用5次,而且除第一批外几乎没有观察到滞后相,这大大缩短了发酵周期。这种新型的固定装置已经在新光生物科技公司中得到了应用。此外,目前报道的所有ε-PL生产都是通过深层发酵进行的,细胞固定化研究中使用的丝瓜络类似于固态发酵中的固态底物[40]。这些结果表明,固态发酵有希望在不久的将来应用于生产ε-PL。
3.5 其他生产工艺


表1 微生物生产ε-PL主要方法和筛选策略比较Table 1 Comparison of main methods and screening strategies for microbial production ε-PL

续表1
4 结论与展望
鉴于ε-PL天然和高效的阳离子特性,ε-PL及其衍生物在食品、生物医学和生物材料工业中具有独特的应用,例如用作膳食添加剂、药物载体、生物芯片等。为了满足ε-PL迅速增长的需求,其商业化生产必不可少。自从筛选出第1株生产ε-PL的菌株以来,研究人员一直在寻求多种发酵策略以提高ε-PL的生产率,每种方法都有其自身的优势,可以补充完善ε-PL的生产信息。当然,许多问题,如复杂代谢网络的调节,ε-PL生物合成的低生产率和转化率,阻碍了其广泛的商业应用[49]。
对于今后的研究探索有3点展望:(1)高产菌株的选育。链霉菌生长周期较长,传统的摇瓶方法筛选ε-PL正突变菌株耗时耗力,需要经过长期多轮诱变以积累稳定的优良性状,才能获得高产菌株。因此,可以结合高通量筛选建立一种快速、准确的选育方法。(2)生物合成机理的深入研究。阐明ε-PL生物合成及其在转录组学、蛋白组学和代谢组学上的抗菌活性机制,可以深层次、全方位解析某种ε-PL高产菌株高产机制及其代谢途径,并将为进一步提高ε-PL的产量提供理论依据。(3)发酵生产工艺的优化。ε-PL工艺优化是今后的发展趋势之一,制定合适的工业副产物综合利用策略既降低成本又废物利用。另一方面也可以减少发酵过程中有机试剂的加入从而获得环境友好型产物。希望本文,可以为解决和研究与微生物ε-PL相关的目前存在的问题提供借鉴,从而实现高效率、低成本ε-PL发酵生产。
