基于非靶向代谢组学研究砷酸盐胁迫下库德毕赤酵母代谢物的变化
2022-12-26戚晓雪徐莹汪东风
戚晓雪,徐莹,汪东风
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
随着工业发展,砷被越来越多地释放到环境中,进入食物链和生物圈,对人类、动物和环境造成严重威胁[1-3]。砷酸盐[arsenate,As(Ⅴ)]是海水中主要的砷化合物,能被浮游植物、藻类、甲壳动物、软体动物等海洋生物吸收[4],并通过多种方式进入食物链,影响食品安全。研究人员对昆山市农贸市场及超市所售食品随机抽样,211份检测食品中,砷的检出率是21.33%;其中发现3份海鱼样本砷超标,最高超过国家标准近3倍[5]。因而急需建立一种安全、高效、适用范围广的食品砷脱除方法,安全经济的微生物脱除法已成为砷脱除的优选方法之一。
一些关于酵母的研究显示了它们在砷生物修复方面的潜力[6-8]。库德毕赤酵母(Pichiakudriavzevii)作为一种多抗性酵母,可以抵抗高盐、高温和低pH值[9-10],已从果汁、浆果、茶啤酒和一些非洲发酵乳制品中被分离出来[11-14]。常被用来生产乳酸[10]、琥珀酸[15]和乙醇[16]等物质,在食品工业中有着广泛的应用前景。前期对P.kudriavzeviiA16的研究表明,其对镉、锌等多种重金属离子具有良好的抗性和脱除能力[17-18],具有从食品中脱除有害物质的应用潜能。
非靶向代谢组学技术可以尽可能多地定性以及相对定量生物体系中的代谢物,最大程度来反映总代谢物信息,常用于代谢表型的区分和差异代谢物的发现[19]。代谢组学是更接近于表型的组学,能够更直接、更准确地反映生物体的生理状态。因此,非靶向代谢组学技术有利于更直观地研究As(Ⅴ)胁迫下P.kudriavzeviiA16代谢物的变化。
本研究着眼于微生物脱砷技术在行业中广阔的应用前景,以P.kudriavzeviiA16为研究对象,基于非靶向代谢组学方法探讨As(Ⅴ)暴露24 h后P.kudriavzeviiA16细胞中代谢物的变化及可能的通路分析,该研究为如何提高生物体的砷脱除能力提供有益思路,并更好地应用于食品中砷的脱除。
1 材料与方法
1.1 试验菌株
P.kudriavzeviiA16为本实验室保藏菌株,分离自高温白酒酒醅[20]。
1.2 试剂与仪器
1.2.1 主要试剂
Na2HAsO4·7H2O(分析纯),湖北楚盛威化工有限公司;硝酸(优级纯);高氯酸(优级纯);砷标准液(GSB 04-1714—2004),国家有色金属及电子材料分析测试中心。
1.2.2 主要仪器
QYC 211型恒温振荡培养箱,上海福玛实验设备有限公司;LD5-10型低速离心机,北京雷勃尔离心机有限公司;LDZX-50KBS型高压蒸汽灭菌锅,上海申安医疗器械厂;Powerwave XS型酶标仪,美国BioTek仪器公司;EHD-24电热消解仪,北京东航科仪仪器有限公司;8800电感耦合等离子体质谱仪,安捷伦科技有限公司。
1.3 主要培养基
YPD培养基(g/L):20葡萄糖、20蛋白胨、10酵母浸粉。固体培养基添加20 g/L琼脂。含砷培养基中砷的浓度根据实验需要而定。
1.4 菌种活化
P.kudriavzeviiA16菌种先后进行固体活化及液体活化。首先将4 ℃保存的菌种接种到YPD斜面固体培养基上,28 ℃恒温培养24 h。从固体斜面上取少量菌体接种到50 mL YPD液体培养基中,在28 ℃恒温振荡(180 r/min)条件下培养24 h[20]。
1.5 As(Ⅴ)对P.kudriavzevii A16生长的影响和砷脱除率
取1 mL经过液体活化后的P.kudriavzeviiA16菌悬液接种于含不同质量浓度As(Ⅴ)(Na2HAsO4·7H2O 0、5、10、15、20 mg/L)的YPD培养基中,28 ℃、180 r/min恒温培养24 h。取酵母培养液稀释10倍后600 nm处测定吸光值,即用OD600来描述酵母菌生长情况。酵母培养液5 000 r/min离心5 min,取1 mL上清液加入到消化管中,并加入4 mL浓硝酸与1 mL高氯酸,加热使其充分消化,超纯水适当稀释后,使用电感耦合等离子体质谱仪测定总砷含量,砷脱除率R按照公式(1)计算[20]。
(1)
式中:ρ0,生物积累前YPD培养基中总砷的质量浓度,mg/L;ρt,生物积累后YPD培养基中总砷的质量浓度,mg/L。
1.6 代谢组学分析样品的制备
液体活化后的P.kudriavzeviiA16接种到YPD培养基(空白对照组,BK组);液体活化后的P.kudriavzeviiA16接种到含12 mg/L As(Ⅴ) YPD培养基(砷胁迫组,As组);P.kudriavzeviiA16的接种量均为4×108个,28 ℃、180 r/min恒温振荡培养24 h。
采用离心法收集菌体(保证离心后各样品菌体体积一致),用预冷的PBS快速冲洗2~3次,每次清洗后4 ℃、5 000 r/min离心5 min;弃去上清液,菌体收集在2 mL离心管中,液氮速冻15 min,-80 ℃保存。P.kudriavzeviiA16代谢物的提取及后续分析均委托北京Novogene生物信息科技有限公司完成。主要实验流程图如图1所示。
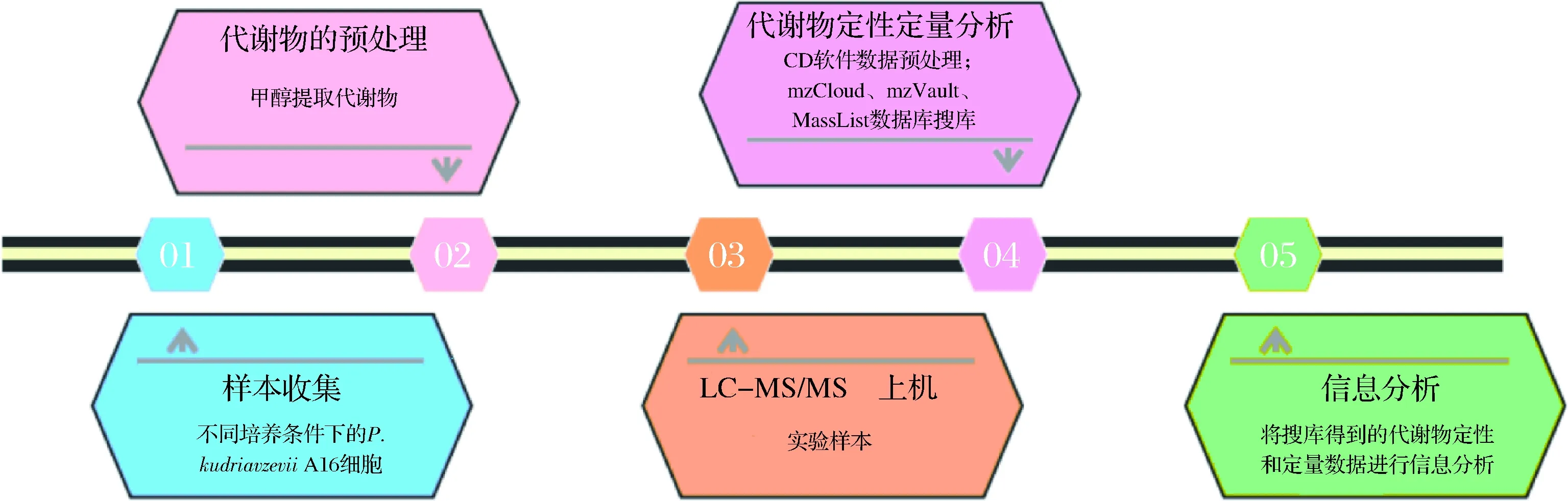
图1 主要实验流程图Fig.1 Main experiment flow chart
1.7 数据处理及分析
使用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(https://www.genome.jp/kegg/pathway.html)对鉴定到的代谢物进行注释。多元统计分析部分,使用代谢组学数据处理软件metaX对数据进行转换,再进行主成分分析(principal component analysis,PCA)和偏最小二乘法判别分析(partial least square discriminant analysis,PLS-DA),进而得到每个代谢物在PLS-DA模型中第一主成分的变量投影重要度(variable importance in projection,VIP)。单变量分析部分,基于t检验来计算各代谢物在两组间统计学显著性(P值),并计算代谢物在两组间的差异倍数(fold change,FC)。差异代谢物的筛选设定阈值为VIP>1.0,FC>1.5或FC<0.667且P<0.05。
2 结果与分析
2.1 As(Ⅴ)对P.kudriavzevii A16生长及砷脱除率的影响
不同浓度As(Ⅴ)对P.kudriavzeviiA16毒性有较大差异,P.kudriavzeviiA16培养液OD600及砷脱除率如表1所示。
正常培养条件下,P.kudriavzeviiA16的OD600为0.606,而5 mg/L As(V)胁迫下P.kudriavzeviiA16的OD600降低到0.502,10 mg/L As(V)胁迫下P.kudriavzeviiA16的OD600仅有0.063。随着砷质量浓度升高,生物量降低很多,这说明As(V)抑制了P.kudriavzeviiA16的生长。在As(V)的质量浓度为5 mg/L培养基中接种P.kudriavzeviiA16培养24 h后,该组砷的脱除率为61.84%。随着As(V)质量浓度的增加,培养液OD600值逐渐降低,同时各组砷脱除率也逐渐降低。P.kudriavzeviiA16的砷脱除率与P.kudriavzeviiA16的生长密切相关。

表1 不同质量浓度As(Ⅴ)条件下P.kudriavzevii A16培养液OD600及砷脱除率Table 1 OD600 and arsenic removal rate of P.Kudriavzevii A16 culture under different concentrations of As(Ⅴ)
2.2 PCA
通过PCA图可以观察到不同处理组间的差异。如图2所示,正负离子模式下As与BK组组内均平行性较好,组间均相隔较远,分离明显,这表明每个不同区域中的样本具有特定的代谢谱。与BK组相比,在As(Ⅴ)胁迫下的As组,P.kudriavzeviiA16产生了生物响应,代谢产物发生了明显的变化。

a-正离子模式;b-负离子模式图2 主成分分析图Fig.2 Principal component analysis
2.3 PLS-DA

a-正离子模式;b-负离子模式图3 PLS-DA得分散点图Fig.3 PLS-DA dispersion point diagram
R2和Q2通常用来衡量模型是否过拟合。如图4所示,正负离子模式下,As、BK组与POAs、As组,R2>Q2且Q2回归线与Y轴截距<0,可知该模型未“过拟合”,稳定性高。

a-正离子模式;b-负离子模式图4 PLS-DA排序验证图Fig.4 PLS-DA sorting verification diagram
2.4 差异代谢物热图分析
不同样品中代谢物的积累模式差异可以通过聚类热图进行分析,图5显示了正、负离子模式下As组与BK组的显著性差异代谢物层次聚类结果。说明两组样本中差异代谢物可明显区分,并且As(Ⅴ)胁迫P.kudriavzeviiA16下的代谢物与正常培养组BK组相比发生了显著变化。
2.5 差异代谢物的筛选与鉴定
搜库结果(mzCloud Results, mzVault Results,MassList Results)设定为full match,选择差异代谢物TOP 35进行列表,如表2和表3所示。

a-正离子模式;b-负离子模式;As1、As2、As3为As组中平行样品;BK1、BK2、BK3为BK组中平行样品图5 差异代谢物聚类分析图Fig.5 Cluster analysis of differential metabolites注:纵向是样品的聚类,横向是代谢物的聚类,聚类枝越短代表相似性越高

表2 正离子模式下As组与BK组差异代谢物Table 2 The significantly differential metabolites in the As group and BK group in positive ion modes

续表2
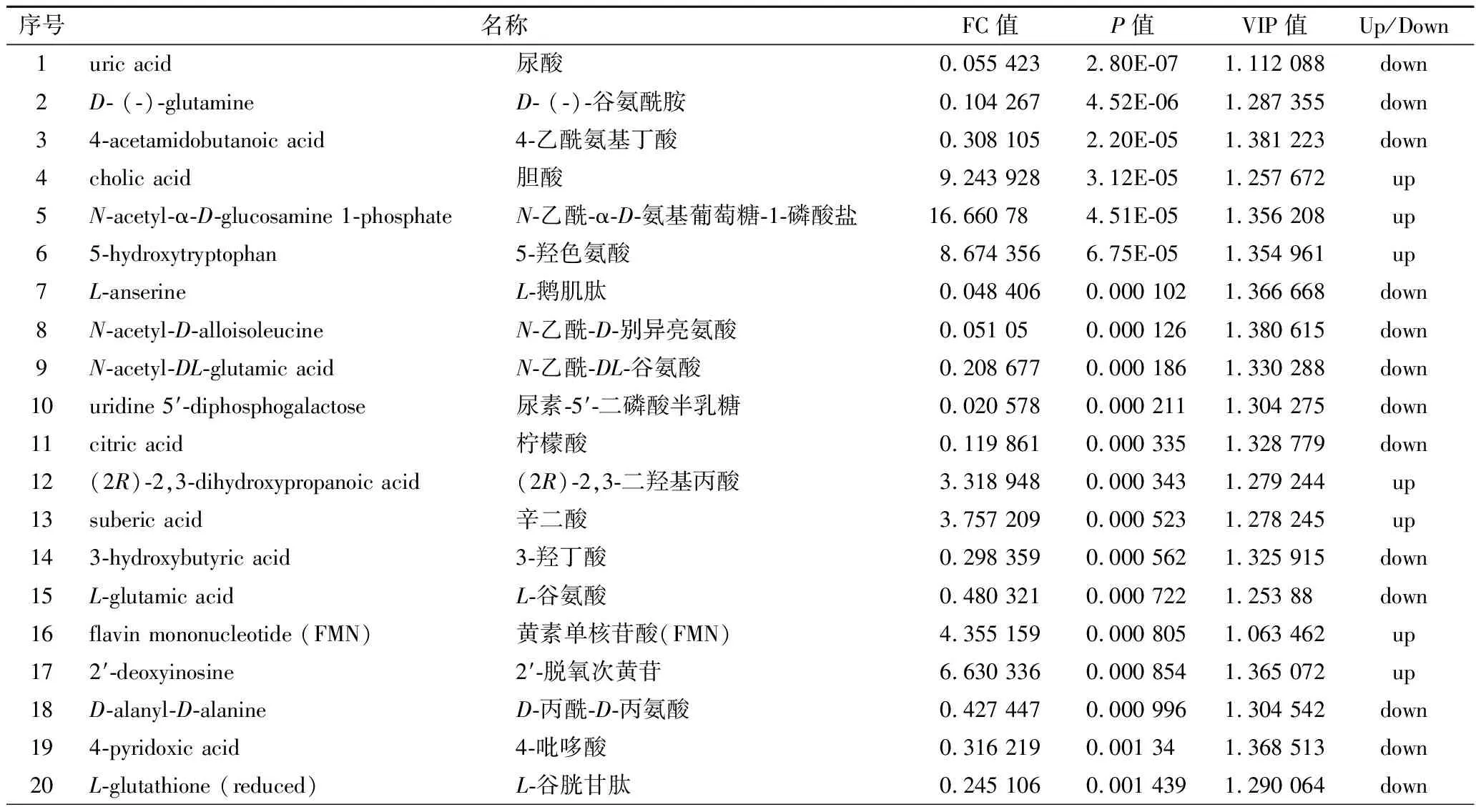
表3 负离子模式下As组与BK组差异代谢物Table 3 The significantly differential metabolites in the As group and BK group in negative ion modes

续表3
通过火山图可以直观显示代谢物在两组样品中含量的差异,以及差异的统计学显著性。火山图中每个点代表一个代谢物,显著上调的代谢物用红色点表示,显著下调的代谢物用绿色点表示,圆点的大小代表VIP值,如图6所示。
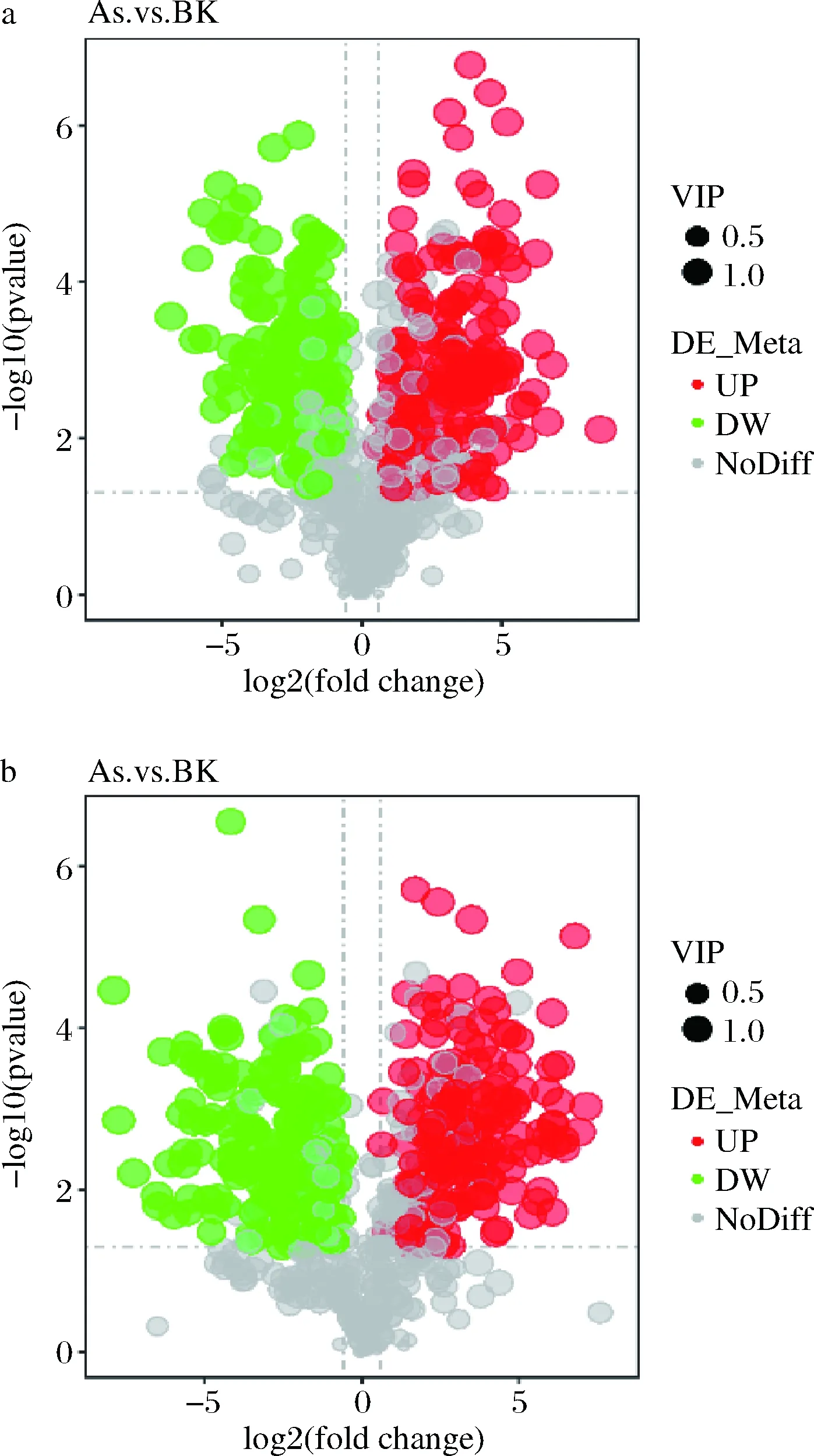
a-正离子模式;b-负离子模式图6 差异代谢物火山图Fig.6 Volcanic map of differential metabolites
正离子模式下,在As、BK两组样本之间共检测到差异代谢物317种,其中,有169种显著上调表达,其中包括鸟嘌呤、3’-磷酸腺苷、L-半胱氨酸、肌苷等,有148种代谢物显著下调表达,包括DL-谷氨酰胺、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、D-(+)-脯氨酸、精胺等;负离子模式下,在As、BK两组样本之间检测到差异代谢物329种,其中,有171种显著上调表达,其中包括胆汁酸、黄素单核苷酸(flavin mononucleotide,FMN)、磷酸烯醇式丙酮酸等,有158种代谢物显著下调表达,包括D-(-)-谷氨酰胺、柠檬酸、3-羟基丁酸、L-谷胱甘肽、琥珀酸、α, α-海藻糖等。
2.6 差异代谢物KEGG富集通路
将不同比较组中所有的差异代谢物匹配KEGG的数据库从而获得代谢物参与的通路信息。对注释完的结果进行富集分析,获得差异代谢物富集较多的通路。如图7所示,正离子模式下,As组与BK组差异代谢物主要注释和富集在谷胱甘肽代谢通路,氨酰tRNA生物合成代谢通路,甘氨酸、丝氨酸和苏氨酸代谢通路、氰基氨基酸代谢通路等;负离子模式下As与BK差异代谢物主要注释和富集在柠檬酸循环,乙醛酸和二羧酸代谢通路,丙酮酸代谢通路,谷胱甘肽代谢通路,丙氨酸、天冬氨酸和谷氨酸代谢通路等。
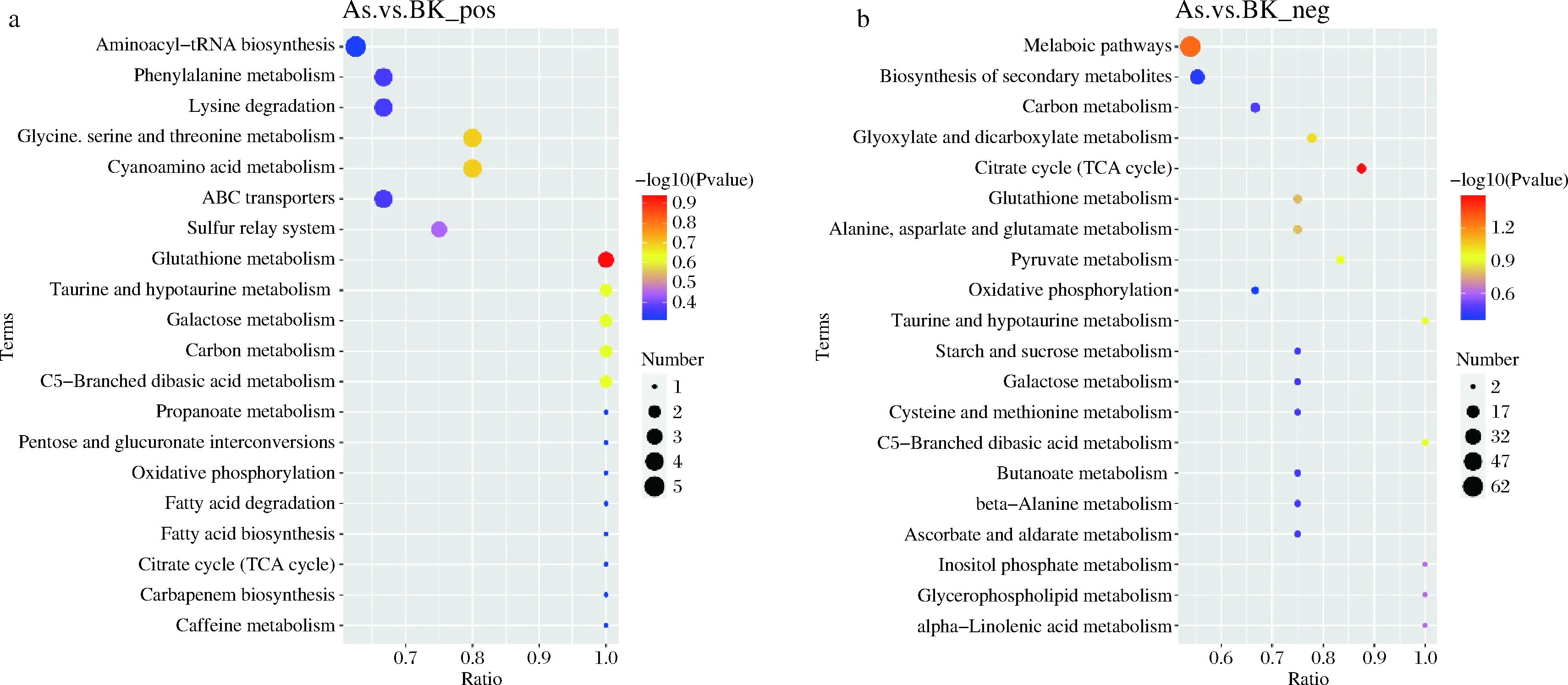
a-正离子模式;b-负离子模式图7 KEGG富集通路气泡图Fig.7 KEGG enrichment pathway bubble map
3 讨论
本研究采用先进的非靶向代谢组学技术对正常培养与砷酸盐胁迫条件下P.kudriavzeviiA16的代谢物进行比对,并筛选出关键的差异代谢物,研究As(Ⅴ)胁迫下P.kudriavzeviiA16的代谢物变化。
磷酸烯醇式丙酮酸等代谢物在P.kudriavzeviiA16中的下调表达,说明As(Ⅴ)可能促进了P.kudriavzeviiA16的糖酵解反应;脂肪酸羟基化可生成羟基丁酸,而在3-羟基丁酸脱氢酶的作用下羟基丁酸氧化生成乙酰辅酶A,进入三羧酸循环(tricarboxylic acid cycle,TCA)[21]。As(Ⅴ)胁迫使得3-羟基丁酸等物质的下调表明As(Ⅴ)可能会促进P.kudriavzeviiA16的脂肪酸代谢,上调TCA循环,同时3′-磷酸腺苷的表达量上调,可为细胞提供更多的能量供应。
位于线粒体的内膜上的电子传递链是氧化磷酸化反应及ATP合成的主要位点,As(Ⅴ)胁迫下P.kudriavzeviiA16胞内NAD+表达量的下调及FMN表达量的上调,表明As(Ⅴ)可能促进了P.kudriavzeviiA16细胞的氧化磷酸化反应。
氨基酸通过TCA循环可以为生物体供能[22],在本研究中,As(Ⅴ)胁迫下P.kudriavzeviiA16胞内甘氨酸、丝氨酸和丝氨酸代谢通路,氰基氨基酸代谢通路,丙氨酸、天冬氨酸和谷氨酸代谢通路显著上调,说明As(Ⅴ)胁迫导致了酵母细胞的能量代谢发生紊乱。LI等[23]以甘氨酸等氨基酸的含量变化阐明了斑马鱼受到砷胁迫会导致其能量代谢异常。另外有研究表明,生物体可以通过提高氨基酸的代谢速率来为机体提供应对外界胁迫所需的能量[24]。此外,氨酰基tRNA可以通过转运氨基酸影响核糖体蛋白的生物合成,氨酰tRNA生物合成代谢通路显著上调表达,表明As(Ⅴ)胁迫对P.kudriavzeviiA16胞内的蛋白质合成/降解产生干扰。这与当砷质量浓度大于5 mg/L时生长受到明显抑制的现象一致。
谷胱甘肽(glutathione,GSH)是防御细胞氧化应激关键因素,具有抗氧化的作用,可以缓解细胞的氧化应激;除此之外GSH可与蛋白质上的活性巯基结合,从而使其免于不可逆的氧化损伤[25]。GSH被认为是细胞抵抗有毒物质的一个重要组成部分,是无机砷氧化还原及砷解毒的重要物质[22],作为一种金属螯合剂,它在细胞抗砷毒性中发挥着重要作用[26]。谷胱甘肽代谢通路的显著富集表明GSH可能被催化为氧化型谷胱甘肽,参与细胞砷的解毒。因此GSH与P.kudriavzeviiA16的生长和对培养基中砷脱除率关系密切,提示今后可以通过基因工程手段或者发酵工艺优化来提高GSH的表达。
4 结论
砷酸盐对P.kudriavzeviiA16的生长有抑制作用;随着培养液中As(Ⅴ)浓度升高,P.kudriavzeviiA16对砷的脱除率下降。P.kudriavzeviiA16通过调节体内糖酵解反应、TCA循环、脂肪酸氧化代谢、氧化磷酸化和氨基酸代谢提高能量供给以应对As(Ⅴ)胁迫导致的毒性效应;此外,谷胱甘肽代谢通路的显著富集也表明P.kudriavzeviiA16胞内GSH参与As(Ⅴ)的解毒作用,以减轻As(Ⅴ)胁迫带来的细胞氧化损伤,降低As(Ⅴ)毒性。后续将利用其他组学联合分析,厘清关键性差异代谢物并进行验证性研究,为建立P.kudriavzeviiA16砷脱除技术提供有益参考。
