HPLC-RID 法测定生脉饮(党参方)中果糖、葡萄糖、蔗糖、麦芽糖
2022-12-25张璐张土金
张璐,张土金
1.南昌市检验检测中心,江西 南昌 330000;2.上高县妇幼保健院,江西 上高 336400
补益经典中药方生脉饮(党参方),为《医学启源》[1]中的古方生脉散的衍生配方,由麦冬、党参、五味子组成。品种收录于《卫生部药品标准》中药成方制剂第十册[2]。具有益气复脉、养阴生津的功效,被广泛用于心肌保护,心功能改善等方面的治疗。
生脉饮(党参方)制法中规定的矫味剂为单糖浆,单糖浆为蔗糖的近饱和水溶液,每1 000 mL 中含蔗糖850 g[3]。药用辅料蔗糖在制剂中主要发挥甜味剂或矫味剂的作用,广泛用于口服制剂中,是液体制剂(如糖浆剂、合剂)的主要成分[4]。现行质量标准中虽然对控制蔗糖添加量设置了相对密度检查项,但该方法缺乏专属性,无法准确体现样品中蔗糖的真实使用情况,不排除某些不法企业违反生产工艺规定,在蔗糖中掺杂其他糖类物质,以达到降低成本的目的。
目前,在药品、食品中检测糖类成分的分析方法较多,如HPLC-ELSD 法、HPLC-RID 法、HPLC-CAD 法、HPLC-FLD 法、UPC2-MS 法、拉曼光谱法、近红外光谱法等[5-12],其中HPLC-RID法以通用性好、灵敏度高成为目前糖类成分检测的主要方法。本实验通过系统研究构建了HPLC-RID测定果糖、葡萄糖、蔗糖、麦芽糖含量的检测方法,对生脉饮(党参方)是否存在利用其他糖类物质代替蔗糖进行投料的情况进行定向筛查。
1 仪器与试药
1.1 仪器
Agilent1260 高效液相色谱仪(安捷伦公司),配置RID 检测器;MettlerToledo XS105DU 电子天平、ME204E 电子天平(梅特勒-托利多公司);KQ-300DE 数控超声仪(昆山超声仪器有限公司)。
1.2 试药
果糖(CNW 4.460070.0005,上海安谱科技股份有限公司,含量100%);蔗糖(BW5011,坛墨质检技股份有限公司,含量99.9%);葡萄糖(110833-201908,含量99.8%);麦芽糖(100287-201905,含量94.4%)均购于中国食品药品检定研究院。乙腈为色谱纯(购于赛默飞公司);实验用水为娃哈哈纯净水。
14 批生脉饮(党参方)样品来自2 个生产厂家。企业1:批号20190501、20190214、20190628、20191123、20191018、20191015、20190808、20190306、20191018、20 190906;企 业2:批 号19072201、20012001、20040602、19 062101;以 上规格均为10 mL/支。
2 方法与结果
2.1 色谱条件
采用Agilent 5TC-C18 色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(70∶30);柱温:45 ℃;流速:1.0 mL/min;进样量:20 μL;示差折光检测池温度:40 ℃。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取适量果糖、葡萄糖、蔗糖和麦芽糖对照品,用水制备成浓度分别为2.452、4.503、2.042、3.524 mg/mL 的混合对照品溶液,摇匀,即得。
2.2.2 供试品溶液 精密称取混匀后的供试品1 g 于50 mL 量瓶中,加水约40 mL,超声处理10 min,放至室温,加水至刻度,摇匀,用0.45 μm 滤膜滤过,即得。
2.2.3 阴性供试品溶液 按照生脉饮(党参方)处方中各药比例制备缺单糖浆的阴性样品,按“2.2.2”项下方法操作,制得阴性供试品溶液。
2.3 系统适应性试验
取混合对照品溶液、供试品溶液及缺单糖浆的阴性供试品溶液按“2.1”项色谱条件进行测定分析。结果如图1 所示,果糖、葡萄糖、蔗糖、麦芽糖等4 种成分色谱峰分离良好,分离度均大于1.5;阴性样品中未见其他成分色谱峰对4 种成分产生干扰,表明该分析方法专属性良好,适用于果糖、葡萄糖、蔗糖、麦芽糖的定向筛查。
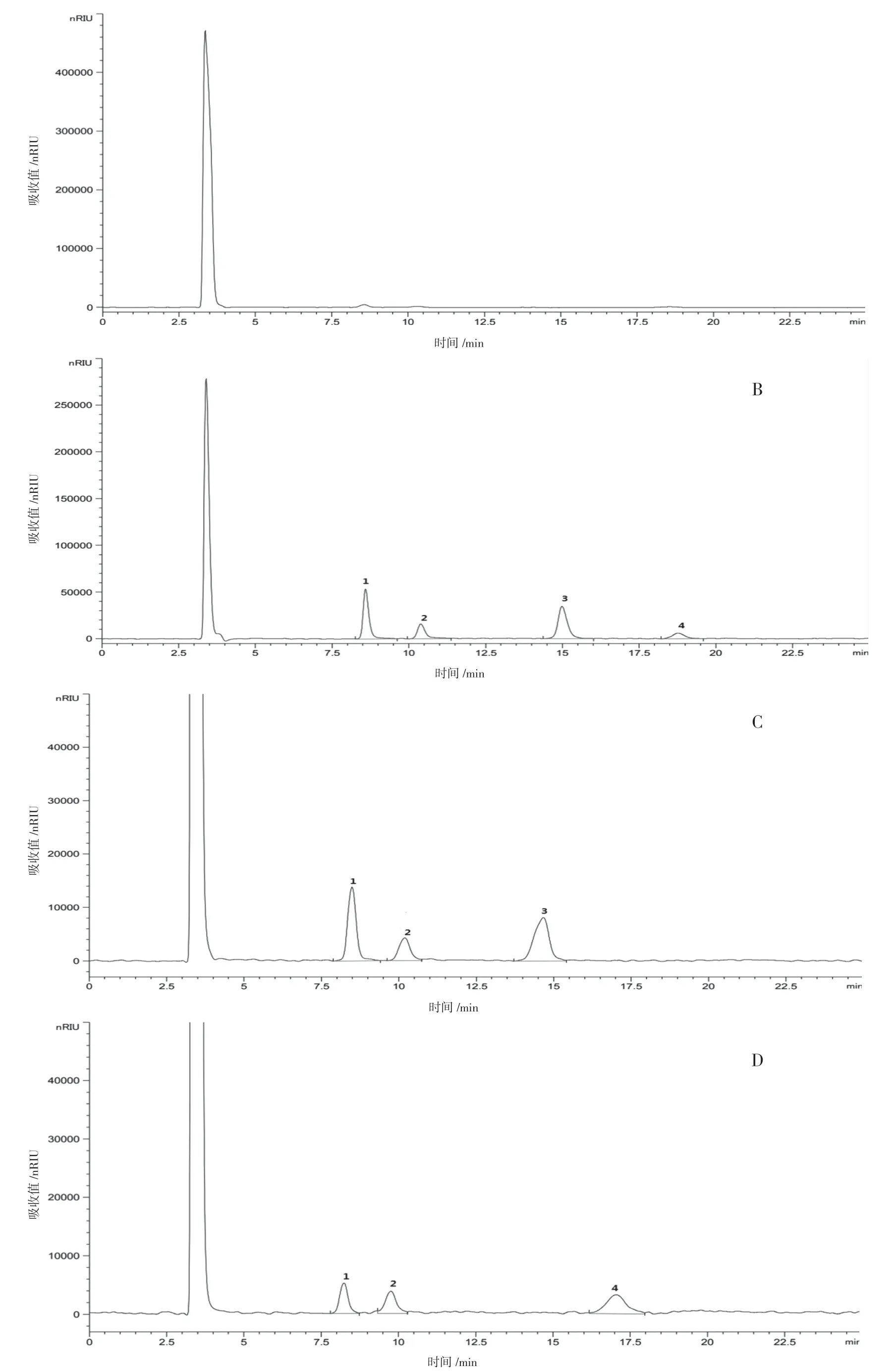
图1 高效液相色谱图:A.阴性供试品;B.混合对照品;C.供试品(批号:20190906);D.供试品(批号:20190501)
2.4 线性关系与检测限考察
精密吸取“2.2.1”项下混合对照品溶液0.1、0.5、1.0、2.0、3.0、5.0 mL 于5 mL 量瓶中,用水稀释,制备6 个浓度的对照标准溶液。按“2.1”项色谱条件进行测定,并绘制标准曲线,其中横坐标(X)为对照品的浓度(mg/mL),纵坐标(Y)为峰面积。取“2.2.1”中混合对照品溶液逐级稀释,检测限为3 倍信噪比。果糖、葡萄糖、蔗糖、麦芽糖的线性范围、线性回归方程、相关系数及检出限结果见表1。结果显示,4 种成分分别在各自浓度范围内线性关系良好,方法适用于不同浓度水平的替代糖浆的定量测定。
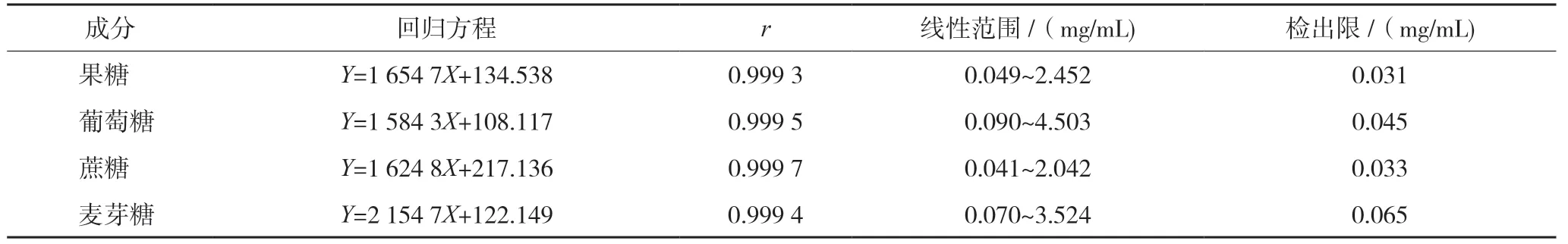
表1 4种成分的回归方程、相关系数、线性范围、检出限
2.5 精密度试验
取“2.2.1”项混合对照品溶液适量,按“2.1”项下色谱条件连续测定6 次,果糖、葡萄糖、蔗糖、麦芽糖成分峰面积的RSD 依次为1.07%、1.58%、2.42%、2.15%,表明该仪器具有良好的精密度。
2.6 稳定性试验
取同一供试品溶液(批号20190628),室温下放置,分别于0、4、8、12、16、20、24 h 取样,按“2.1”项下色谱条件进样测定。结果供试品中检出果糖,蔗糖,麦芽糖,RSD 依次为2.86%、2.58%、2.16%,表明该供试品溶液在24 h 内具有良好的稳定性。
另取供试品溶液(批号20190501),室温下放置,分别于0、4、8、12、16、20、24 h 取样,按“2.1”项下色谱条件进样测定。结果供试品中检出果糖,葡萄糖,麦芽糖,RSD 依次为2.37%、1.96%、2.03%,表明该供试品溶液在24 h 内具有良好的稳定性。
2.7 重复性试验
取同一批生脉饮(党参方)(批号20190628)样品,按“2.2.3”项方法平行制备6 份供试品溶液,按“2.1”项下色谱条件测定。结果供试品中果糖,蔗糖,麦芽糖的RSD 分别为1.15%、2.78%、2.81%,结果表明方法重复性良好。
另取生脉饮(党参方)(批号20190501)样品,按“2.2.3”项方法平行制备6 份供试品溶液,按“2.1”项下色谱条件测定。结果供试品中果糖,葡萄糖,麦芽糖的RSD 分别为1.87%、2.64%、1.91%,结果表明方法重复性良好。
2.8 加样回收试验
取已知含量的生脉饮(党参方)(批号20190628)9 份,每份约0.5 g,精密称定,分别置50 mL 量瓶中。分别按低、中、高3 种浓度水平精密加入果糖、葡萄糖、蔗糖、麦芽糖对照品(每个浓度各3 份),分别按“2.2.2”项下方法制备加样供试品溶液,按“2.1”项下色谱条件进行品测定,每批样品平行测定2 次,取平均值,依据测定结果计算各成分的加样回收率,结果见表2。结果表明该方法具有良好的准确度,可用于生脉饮(党参方)中果糖、葡萄糖、蔗糖、麦芽糖的测定。
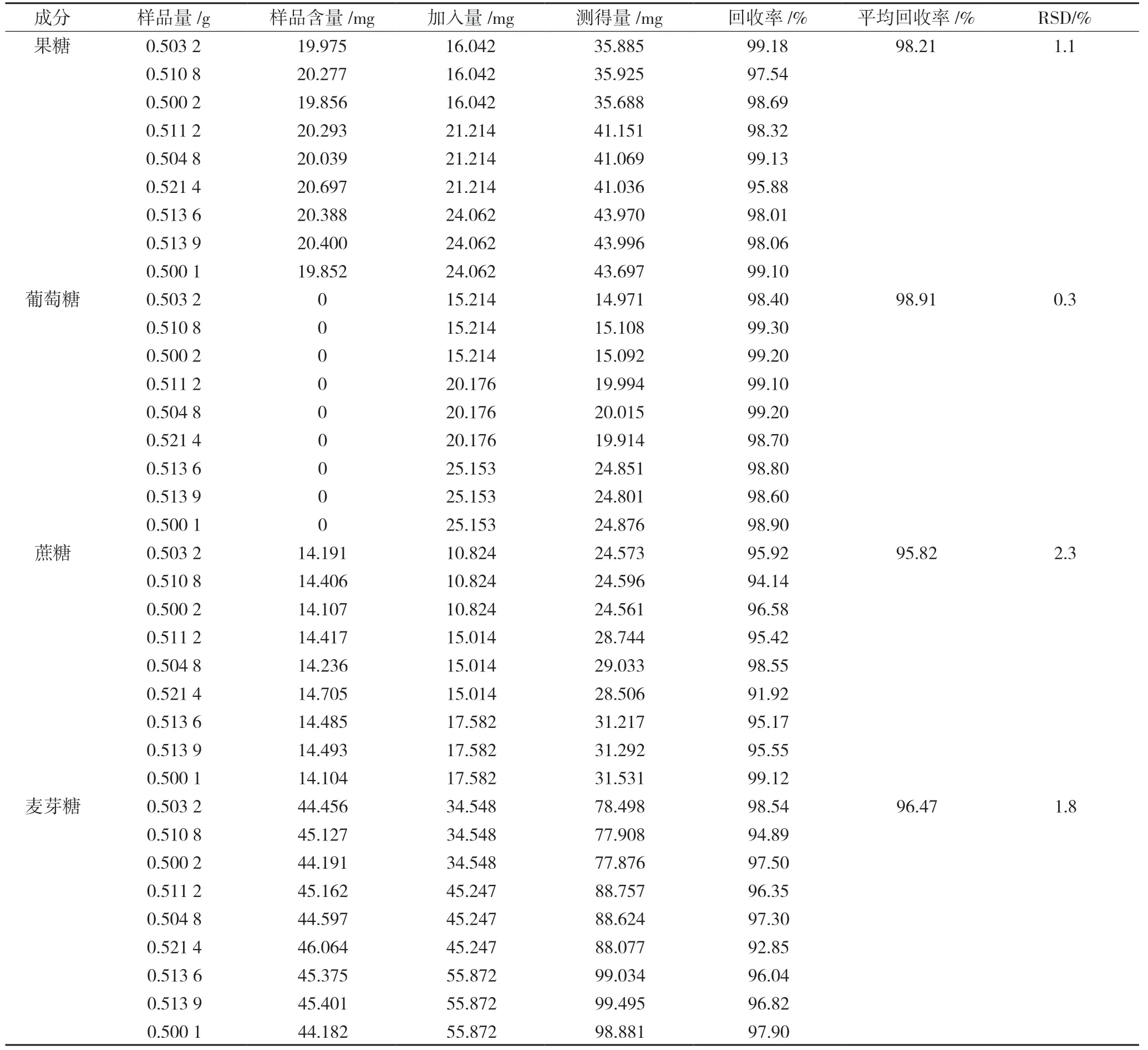
表2 加样回收率试验结果
2.9 样品含量测定
取14 批生脉饮(党参方)样品,按“2.2.2”项下方法制备供试品溶液。按“2.1”项下色谱条件进行样品测定,计算14 批次样品中4 种成分的含量,结果见表3。

表3 14批生脉饮(党参方)样品中4种成分的含量测定结果(n=2) mg/g
3 讨论
3.1 方法适用性考察
本实验考察了不同色谱柱[Thermo ScientificTMCarbopacTMPA100(250 mm×2.0 mm,5 μm),Agilent 5TC-C18(250 mm×4.6 mm,5 μm),Aminex HPX-87C(250 mm×4.0 mm,5 μm)];流动相中水溶液的比例(35%、30%、25%、20%);不同的色谱柱温度(35 ℃、40 ℃、45 ℃);不同流速(0.6、0.8、1.0 mL/min)对4 种成分分离效果的影响。当测定条件发生小幅度变化时,测定结果未发生显著变化,说明该方法耐用性良好。采用Agilent 5TC-C18(250 mm×4.6 mm,5 μm),柱温为45 ℃,流动相水溶液比例为30%,流速为1.0 mL/min 时,果糖、葡萄糖、蔗糖、麦芽糖分离效果最好。
3.2 结果分析
对检测数据进行分析后可知,企业2 的样品中检出果糖、葡萄糖、蔗糖,均未检出麦芽糖。蔗糖是经一分子葡萄糖与一分子果糖的半缩醛羟基彼此缩合失水而形成的二糖,其在酸性条件下遇热分解为葡萄糖和果糖(1∶1)[13]。企业2 所有样品中葡萄糖和果糖含量均大致相当,但经折算后可知,样品批间的蔗糖含量并不稳定,说明该企业对生产工艺控制不严。
企业1 的产品中有5 批样品检出了麦芽糖;有7 批样品检出葡萄糖,其中有3 批样品的葡萄糖含量为100%。说明该企业未遵守产品批准的生产工艺,添加麦芽糖、葡萄糖进行投料生产。且两个企业14 批样品经折算均远超其处方量23 mg/g 蔗糖的正常值,产品质量存在较大的安全风险。
本实验采用HPLC-RID 法对生脉饮(党参方)中4 种糖类成分进行分析,可真实反映生脉饮(党参方)中是否存在利用其他糖类物质替代蔗糖进行投料的情况。该方法具有简单快速、高效、准确、无干扰的优势,不仅为生脉饮(党参方)质量控制提供了有效的方法,同时也为其安全性风险评估提供了科学的依据。
