锌指蛋白488基因对肝细胞癌细胞增殖、凋亡、迁移和侵袭的影响△
2022-12-24黄凯达范鑫郑志高李雯雯林雨标
黄凯达,范鑫,郑志高,李雯雯,林雨标
厦门市海沧医院肿瘤科,福建 厦门 361026
肝细胞癌(hepatocellular carcinoma,HCC)是消化系统中常见的恶性肿瘤之一。中国恶性肿瘤流行病学数据显示,肝癌发病率居全部恶性肿瘤第四位,病死率居全部恶性肿瘤第二位[1]。肿瘤复发、侵袭和转移是导致HCC患者预后不良的重要因素。深入了解肿瘤复发、侵袭和转移的分子机制对于改善HCC患者预后具有重要意义。磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,又称AKT)是与肿瘤发生发展密切相关的信号通路,该信号通路通过多种生长因子与受体结合而被激活,介导肿瘤细胞的增殖、迁移以及自我更新等过程,进而影响肿瘤细胞的生长和转移,与HCC的发生发展密切相关[2]。阻断PI3K/AKT信号通路可以阻断细胞周期进程,促进肝癌细胞凋亡,抑制肝癌细胞的上皮-间充质转化以及肿瘤新生血管生成,进而抑制肝癌细胞增殖、迁移和侵袭[3-4]。锌指蛋白(zinc finger protein,ZNF)是最大的序列特异性DNA结合蛋白家族,通过调节下游基因的转录在恶性肿瘤的发生发展中发挥重要作用[5]。ZNF通过PI3K/AKT信号通路促进恶性肿瘤细胞生长和转移,有望成为治疗恶性肿瘤的靶点[6]。ZNF488是一种Krüppel样锌指转录因子,已被证实为致癌基因,可通过调控PI3K/AKT信号通路调节胰腺癌细胞的生物学行为[7],但其在HCC中的功能及作用机制目前尚不清楚。本研究探讨ZNF488对HCC细胞增殖、凋亡、迁移与侵袭的影响,期望能为HCC的靶向治疗提供新的思路,现报道如下。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2购自中国科学院细胞库。DNA提取试剂盒、pLL3.7-ZNF488 shRNA载体质粒及PI3K、AKT、磷酸化PI3K(phosphorylated PI3K,p-PI3K)、磷酸化AKT(phosphorylated AKT,p-AKT)抗体试剂盒、DH5α感受态细胞均购自上海信裕生物科技有限公司,Lipofectamin 3000、琼脂糖凝胶回收试剂盒、DMEM细胞培养基均购自赛默飞世尔科技(中国)有限公司,CCK8试剂盒、细胞周期检测试剂盒、细胞凋亡检测试剂盒均购自武汉普诺赛生命科技有限公司,限制性内切酶BbsⅠ和SacⅠ均购自美国NEB公司,Matrigel基质胶购自美国Corning公司。酶标仪购自迈瑞公司,显微镜购自美国FEI公司,流式细胞仪购自德国Partec公司,蛋白电泳仪购自美国Bio-Rad公司。
1.2 ZNF488稳定敲除细胞系的构建
利用麻省理工学院的规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)在线设计工具(http://crispr.mit.edu/)设计出靶向ZNF488的20 bp的靶向序列小向导RNA(small guide RNA,sgRNA),合成后的2条单链DNA退火形成双链DNA,pLL3.7-ZNF488 shRNA载体经BbsⅠ酶切后与双链引物连接,将连接产物转化DH5α感受态细胞,筛选出若干阳性克隆,测序验证后选取正确序列的质粒进行大提。利用Lipofectamin 3000试剂将构建好的质粒转染到HepG2细胞中,挑选若干绿色荧光蛋白(green fluorescent protein,GFP)阳性的细胞进行单克隆培养,提取基因组后扩增出相应靶基因序列,测序分析并对碱基缺失结果进行比对分析,选取基因缺失正确的细胞克隆,筛选出稳定敲除ZNF488的HepG2细胞(pLL3.7-ZNF488 shRNA-ZNF488组)。同时,将转染pLL3.7-ZNF488 shRNA空载质粒的HepG2细胞(pLL3.7-ZNF488 shRNA组)和正常的HepG2细胞(HepG2组)作为对照。
1.3 CCK8法检测细胞增殖能力
收集各组细胞,2000/孔接种于96孔板中,加入等量的DMEM完全培养液,培养0、24、48、72 h后,每 100 μl培养液中加入 10 μl CCK8 试剂,置于37℃培养箱中孵育2 h,采用酶标仪检测各孔在450 nm处的光密度(optical density,OD)值。上述步骤重复3次。以时间为横坐标、OD值为纵坐标绘制细胞增殖曲线。
1.4 流式细胞仪检测细胞凋亡情况及细胞周期
转染前16~24 h,以3×104/孔将细胞接种于6孔板中,转染后48 h收集细胞;采用含0.5%血清的磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2次;采用预冷的2%~4%多聚甲醛(pH=7.4)在-20℃条件下固定15 min,再在70%乙醇中固定过夜;离心去除上清后,用含0.5%血清的PBS冲洗2次,细胞重悬于RNase A缓冲液(50 μg/ml)中,37 ℃避光消化 30 min;加入 400 μl碘化丙啶(propidium iodide,PI)(100 μg/ml),室温染色 30 min,采用流式细胞仪检测细胞凋亡情况及细胞周期各时相的分布情况。上述步骤重复3次。
1.5 Transwell小室实验检测细胞迁移和侵袭能力
将Matrigel胶和无血清培养基混匀放入Transwell小室,对基底膜进行包被。3组细胞离心后用无血清的培养液重悬细胞后计数,置入Transwell小室中,放入培养箱中进行培养。24 h后,擦除多余的液体Matrigel胶,采用4%多聚甲醛固定,结晶紫染色,显微镜下观察结晶紫染色细胞数即为侵袭细胞数目。上述步骤重复3次。迁移实验:除了不对Transwell小室基底膜进行包被外,其余步骤同侵袭实验。
1.6 蛋白质印迹法(Western blot)检测ZNF488蛋白及PI3K/AKT信号通路相关蛋白的表达情况
将HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组细胞裂解、变性,提取细胞总蛋白。采用二喹啉甲酸(bicinchoninic acid,BCA)法检测蛋白浓度,蛋白样品中加入上样缓冲液,沸水浴变性5 min后,加至十二烷基硫酸钠-聚丙烯酰胺凝胶中,凝胶电泳后将分离的蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,封闭并进行抗体孵育,采用电化学发光(enhanced chemiluminescence,ECL)显色试剂盒进行显色。采用Quantity One图像分析软件对Western blot实验结果进行分析。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,计算p-AKT、AKT、p-PI3K、PI3K蛋白相对表达量,目的蛋白相对表达量=目的条带灰度值/GAPDH条带灰度值。每个蛋白样品设3个重复。
1.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,多组间两两比较采用Dunnettt检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同组别HepG2细胞中ZNF488蛋白相对表达量的比较
HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞中ZNF488蛋白相对表达量比较,差异有统计学意义(P<0.01)。pLL3.7-ZNF488 shRNA-ZNF488组 HepG2细胞中ZNF488蛋白相对表达量低于HepG2组和pLL3.7-ZNF488 shRNA组,差异均有统计学意义(P<0.05)。(表1)
表1 不同组别HepG2细胞中ZNF488蛋白相对表达量的比较(±s)

表1 不同组别HepG2细胞中ZNF488蛋白相对表达量的比较(±s)
注:*与pLL3.7-ZNF488 shRNA-ZNF488组比较,P<0.05
组别HepG2组pLL3.7-ZNF488 shRNA组pLL3.7-ZNF488 shRNA-ZNF488组F值P值0.98±0.11*0.97±0.15*0.13±0.01 57.744 0.01 ZNF488蛋白表达
2.2 不同组别HepG2细胞增殖情况的比较
培养24 h,HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞OD值比较,差异无统计学意义(P>0.05);培养48、72 h,HepG2组、pLL3.7-ZNF488 shRNA 组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞OD值比较,差异均有统计学意义(P<0.05)。培养48、72 h,pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞OD值均低于HepG2组和pLL3.7-ZNF488 shRNA组,差异均有统计学意义(P<0.05)。(表2)
表2 不同时间不同组别HepG2细胞OD值的比较(±s)
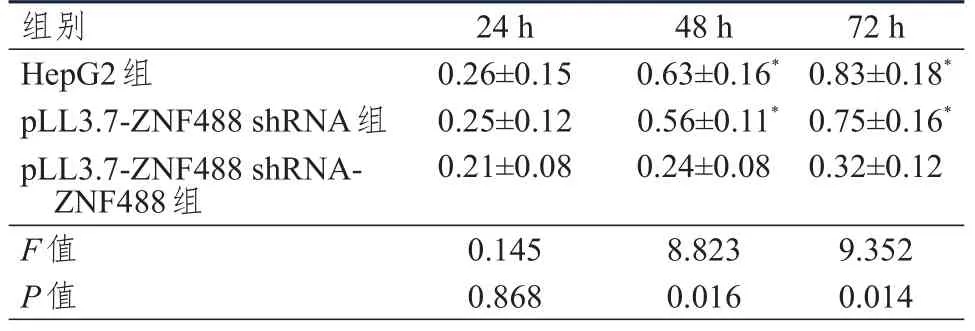
表2 不同时间不同组别HepG2细胞OD值的比较(±s)
注:*与同时间pLL3.7-ZNF488 shRNA-ZNF488组比较,P<0.05
组别HepG2组pLL3.7-ZNF488 shRNA组pLL3.7-ZNF488 shRNAZNF488组F值P值0.26±0.15 0.25±0.12 0.21±0.08 0.145 0.868 0.63±0.16*0.56±0.11*0.24±0.08 8.823 0.016 0.83±0.18*0.75±0.16*0.32±0.12 9.352 0.014 24 h 48 h 72 h
2.3 不同组别HepG2细胞凋亡情况和细胞周期的比较
HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞凋亡率、G2期细胞所占百分比比较,差异均有统计学意义(P<0.01)。pLL3.7-ZNF488 shRNA-ZNF488组细胞凋亡率、G2期细胞所占百分比均高于HepG2组和pLL3.7-ZNF488 shRNA组,差异均有统计学意义(P<0.05)。(表3)
表3 不同组别HepG2细胞凋亡情况和细胞周期的比较(%,±s)

表3 不同组别HepG2细胞凋亡情况和细胞周期的比较(%,±s)
注:*与pLL3.7-ZNF488 shRNA-ZNF488组比较,P<0.05
组别 凋亡率G2期细胞所占百分比?
2.4 不同组别HepG2细胞侵袭和迁移情况的比较
HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞侵袭细胞数目、迁移细胞数目比较,差异均有统计学意义(P<0.01)。pLL3.7-ZNF488 shRNA-ZNF488组 HepG2细胞侵袭细胞数目、迁移细胞数目均低于HepG2组和pLL3.7-ZNF488 shRNA组,差异均有统计学意义(P<0.05)。(表4)
表4 不同组别HepG2细胞侵袭和迁移情况的比较(±s)

表4 不同组别HepG2细胞侵袭和迁移情况的比较(±s)
注:*与pLL3.7-ZNF488 shRNA-ZNF488组比较,P<0.05
组别HepG2组pLL3.7-ZNF488 shRNA组pLL3.7-ZNF488 shRNA-ZNF488组F值P值46.21±3.63*43.57±3.79*15.23±1.52 88.935<0.01 68.52±6.72*53.28±5.96*19.61±2.76 63.843<0.01侵袭细胞数目 迁移细胞数目
2.5 不同组别HepG2细胞中PI3K/AKT信号通路相关蛋白相对表达量的比较
HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞中p-AKT、p-PI3K蛋白相对表达量比较,差异均有统计学意义(P<0.01);HepG2组、pLL3.7-ZNF488 shRNA组、pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞中AKT、PI3K相对表达量比较,差异均无统计学意义(P>0.05)。pLL3.7-ZNF488 shRNA-ZNF488组HepG2细胞中p-AKT、p-PI3K蛋白相对表达量均低于HepG2组和pLL3.7-ZNF488 shRNA组,差异均有统计学意义(P<0.05)。(表5)
表5 不同组别HepG2细胞中PI3K/AKT信号通路相关蛋白相对表达量的比较(±s)

表5 不同组别HepG2细胞中PI3K/AKT信号通路相关蛋白相对表达量的比较(±s)
注:*与pLL3.7-ZNF488 shRNA-ZNF488组比较,P<0.05
组别HepG2组pLL3.7-ZNF488 shRNA组pLL3.7-ZNF488 sh-RNA-ZNF488组F值P值p-AKT 1.00±0.13 0.97±0.15 0.23±0.078*38.648<0.01 AKT 0.97±0.12 0.99±0.13 0.93±0.11 0.194 0.829 p-PI3K 0.98±0.09 0.96±0.15 0.30±0.06*39.404<0.01 PI3K 0.99±0.18 0.97±0.11 0.95±0.12 0.061 0.941
3 讨论
肝癌是一种常见的消化系统恶性肿瘤,手术、射频消融治疗和化疗均能有效杀灭肿瘤细胞,但治疗后转移和复发的比例非常高,常导致患者治疗效果不佳及预后不良。恶性肿瘤侵袭转移过程与细胞外基质降解、细胞骨架变化、肿瘤细胞黏附和运动、上皮-间充质转化、转录因子激活、间充质基因的表达及血管生成等有关。分子靶向治疗作用于HCC发生发展过程中涉及的特异性分子及其调控的信号转导通路,在抑制肿瘤细胞增殖、延缓复发转移以及改善患者预后等方面具有一定的优势,正逐渐成为HCC治疗的重要手段。开发有效的肝癌生物标志物和治疗靶点对肝癌治疗具有重要意义。
PI3K/AKT是许多信号分子的下游信号转导通路,在促进细胞增殖、抑制细胞凋亡的过程中发挥重要作用,近年来,在许多种恶性肿瘤细胞中发现了PI3K/AKT信号转导通路的过度激活。研究表明,PI3K/AKT信号通路异常活化与肿瘤生长、增殖、凋亡、血管生成、侵袭及转移有关,并因此影响患者的预后[8]。PI3K/AKT信号通路通过与上下游靶点的协同作用调控肿瘤多重耐药,影响细胞对化疗药物的敏感性[9-10]。PI3K/AKT信号通路在肝癌的发生发展过程中扮演着重要角色。王开琼等[11]研究显示,微小RNA(microRNA,miRNA)-182过表达可能通过激活PI3K/AKT信号通路调控基质金属蛋白酶9、c-Myc和血管内皮生长因子的表达,从而促进HepG2细胞的增殖、迁移和侵袭。罗彩云等[12]研究显示,沉默脂肪细胞增强子结合蛋白2可通过影响PI3K/AKT信号通路抑制HCC细胞的增殖、迁移和侵袭,诱导HCC细胞凋亡。Liao等[13]研究显示,阿帕替尼可能通过阻断PI3K/AKT信号通路影响HCC细胞的放射敏感性。
ZNF可通过不同的功能性结构域、反式调控原件招募不同的染色体修饰因子及相互作用蛋白,在基因表达调控、细胞分化、胚胎发育、促进或抑制肿瘤的发生发展等方面具有重要作用[14]。ZNF在HCC组织和细胞中均存在异常表达,与HCC的发生、发展、侵袭、转移、凋亡和肿瘤复发等相关。He等[15]研究显示,ZNF384通过特异性靶向细胞周期蛋白(cyclin)D1的启动子区域并上调cyclin D1的表达来促进HCC细胞增殖,可能成为HCC的潜在治疗靶点。Yi等[16]研究显示,ZNF689在HCC组织中高表达,其阳性表达与肿瘤直径、微血管侵犯、肿瘤包膜浸润及不良预后显著相关。
ZNF488基因位于染色体10q11.22,其编码的蛋白分子量为38 kD,由340个氨基酸组成,是一种少突胶质细胞特异性转录抑制因子。ZNF488扮演着癌基因的角色,可通过激活AKT/雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)信号通路促进胰腺癌细胞增殖、迁移和侵袭,从而诱导胰腺癌细胞发生上皮-间充质转化[17]。ZNF488表达与鼻咽癌患者的总生存期、局部区域无复发生存期、无远处转移生存期和无进展生存期相关,其机制为ZNF488通过影响胶原蛋白Ⅳ/黏附斑激酶/AKT信号通路增强细胞黏附,从而上调cyclin D1的表达,促进细胞周期进程,并通过不依赖胱天蛋白酶(caspase)的方式抑制细胞凋亡[18]。本研究采用CRISPR基因编辑技术构建了稳定的ZNF488基因敲除HepG2细胞,流式细胞仪检测结果显示,ZNF488基因敲除的HepG2细胞在生长过程中阻滞在G2期的细胞比例增多,ZNF488基因敲除可阻滞HepG2细胞周期进展,同时促进细胞凋亡。CCK8法和Transwell小室实验检测结果显示,敲除ZNF488可以抑制HepG2细胞增殖、迁移和侵袭。PI3K/AKT信号通路可调控细胞周期,增加相关蛋白的表达会改变细胞周期分布。进一步研究发现,敲除ZNF488基因后,p-AKT、p-PI3K蛋白相对表达量均下降,表明敲除ZNF488基因可能阻断PI3K/AKT信号通路,降低HepG2细胞的增殖能力,诱导细胞周期阻滞,促进细胞凋亡,抑制细胞增殖、迁移和侵袭。敲除ZNF488对HCC的影响有可能是通过调控PI3K/AKT信号通路实现的,但其具体调控机制还有待进一步深入研究。
综上所述,本研究应用CRISPR基因编辑技术构建了稳定的ZNF488基因敲除HepG2细胞,发现抑制ZNF488的表达可抑制HepG2细胞增殖、迁移和侵袭,并促进细胞凋亡,其机制可能与阻断PI3K/AKT信号通路有关,为HCC的靶向治疗提供了新的靶点,同时也有助于评估靶向治疗的效果。
