氧化还原响应型聚合物在核酸药物递送系统中的应用研究进展
2022-12-23王薪默曾朝旺陈旺刘潇璇朱丹丹
王薪默 ,曾朝旺 ,陈旺 ,刘潇璇 ,朱丹丹
(1. 中国药科大学 天然药物活性组分与药效国家重点实验室,江苏 南京 210009;中国药科大学 药物科学研究院高端药物制剂与材料研究中心,江苏 南京 210009)
1 引言
基因治疗(gene therapy)是将核酸药物导入到患者特定的靶细胞中,以调控或纠正疾病相关基因的表达,从而在基因水平高效精准地治疗相关疾病,为癌症、遗传性疾病、自身免疫性疾病和传染性疾病等重大疾病的治疗带来了曙光[1]。目前为止,已有20余款核酸类治疗产品被批准用于疾病治疗(见图1)[2],包括质粒DNA(plasmid DNA,pDNA)、信使RNA(messenger RNA,mRNA)、反义寡核苷酸(antisense oligonucleotide,ASO)和小干扰RNA(small interfering RNA,siRNA)等。值得一提的是,新型冠状病毒肺炎(COVID-19)疫情发生后,mRNA疫苗得到快速研发并率先获批上市,为遏制疫情的扩散作出了巨大贡献,使得核酸药物被大众所熟知,也将核酸药物的研发与投资推向新的高潮[3]。
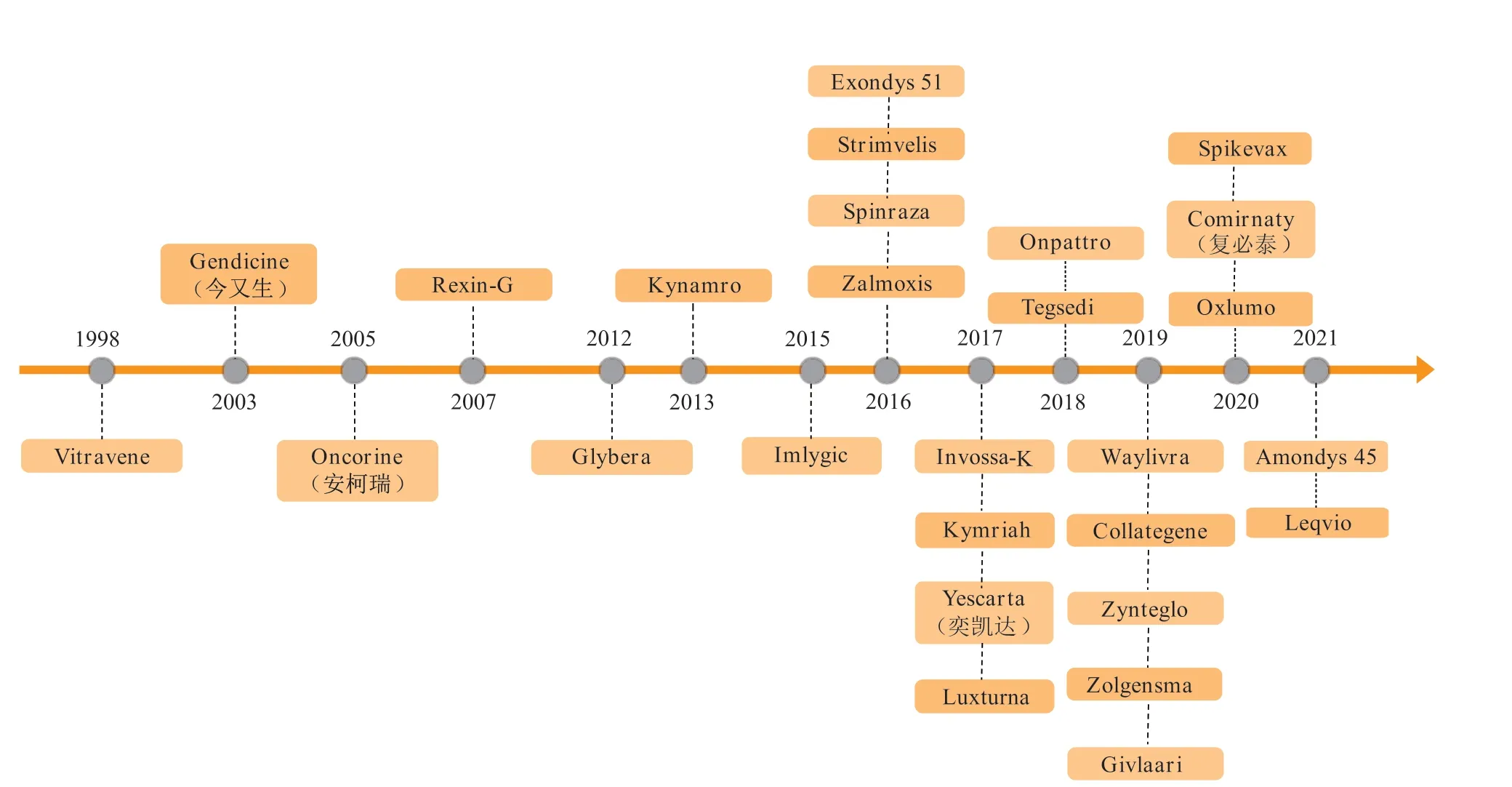
图1 已获批上市的核酸类治疗产品Figure 1 The approved nucleic acid therapeutics
核酸药物可以突破传统药物靶点的“难以成药性”和“不可成药性”,在新药研发中备受青睐。然而,核酸药物的研发和临床转化主要面临着以下3个挑战。1)体内不稳定性:核酸药物在血液循环中极易被核酸酶降解,也易被网状内皮系统(reticuloendothelial system,RES)识别并清除[4];2)入胞困难:核酸药物是带负电荷的亲水性分子,不易穿透同样带负电的细胞膜,因此难以进入靶细胞发挥相应的功能[5];3)免疫原性:外源性核酸在体内常被识别为病原相关分子模式(pathogenassociated molecular pattern,PAMP),作为病毒感染信号引起机体的先天免疫[6]。因此,开发高效安全的核酸药物递送系统是提高核酸药物成药性、推动基因治疗临床转化的关键步骤。
目前常见的核酸药物载体主要分为病毒类载体和非病毒类载体[7]。尽管病毒类载体的转染效率相对较高,但其存在免疫原性高、易整合到宿主基因序列、负载核酸药物分子大小受限、研发成本高、大规模生产困难等问题[8]。不同于病毒类载体,非病毒类载体具有免疫原性低、安全性高、易制备等优点[9]。它们能与核酸药物分子形成稳定的复合物,避免其被核酸酶降解和被RES系统识别清除,输送至病变部位后,即可进入靶细胞发挥治疗作用[10]。首个上市的siRNA药物Onpattro和COVID-19 mRNA疫苗都是基于脂质纳米颗粒的核酸药物制剂[2],进一步鼓舞人们致力开发安全高效的非病毒核酸递送载体。尤为重要的是,非病毒类载体还能根据药物递送需求进行定制,例如根据疾病病理特征设计刺激响应型的递送载体,实现核酸药物的按需递送,从而提高其疗效[11]。
疾病部位的氧化还原环境与疾病的发生发展密切相关,例如活性氧(reactive oxygen species,ROS)和谷胱甘肽(glutathione,GSH)的异常[12]。因此,研究者利用这一病理特征,借助于氧化还原敏感基团,开发了一系列氧化还原响应型药物递送系统,用于实现核酸药物在肿瘤治疗中的按需递送。这些敏感基团在病变部位异常氧化还原环境的刺激下,会发生断裂或性质的改变,使得递送系统解交联或解组装,特异性释放出负载的核酸药物,从而实现其按需递送,以提高其治疗效果[12-13]。本文将介绍疾病部位的氧化还原微环境,归纳和总结氧化还原响应型核酸药物递送系统在癌症及炎症等疾病治疗中的最新研究进展,并讨论氧化还原响应型核酸递送系统的合理构建与设计。
2 疾病部位的氧化还原微环境
生理状态下,细胞内的氧化还原反应通常会维持在相对平衡的状态,这对体内各种生理功能的调节十分重要[14]。当机体受到外界环境刺激或相关信号调控时,体内的氧化性物质或还原性物质随即发生相应的改变,进而打破氧化还原平衡稳态[15]。病理状态下,疾病部位细胞的线粒体功能紊乱、能量代谢异常以及内质网功能改变等均会导致其氧化还原状态失衡(见图2)[16]。
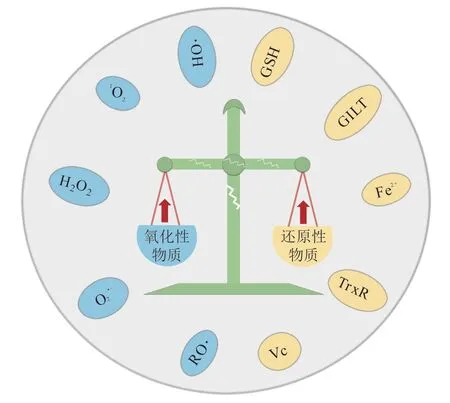
图2 疾病部位氧化还原微环境示意图Figure 2 Schematic illustration of redox microenvironment in diseased tissues
其中,作为细胞内典型的氧化性物质,ROS主要依赖于线粒体、内质网及还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶(NOX)家族产生,包括O2•-、H2O2、•OH、RO•及1O2等[15,17-18]。生理状态下,细胞内ROS往往维持在一个较低的水平(0.02 ~ 1 μmol · L-1);然而,在肿瘤或炎症等疾病组织,细胞内ROS水平会大幅上升(50 ~ 100 μmol · L-1),打破胞内原有的氧化还原稳态,使细胞转变为氧化应激(oxygen stress)状态[19-20]。过高的ROS水平通常会对胞内的功能分子造成不可逆的损伤,从而加剧疾病的进展,如肿瘤、炎症相关疾病、神经退行性疾病等[21]。
为了维持细胞内氧化还原状态的动态平衡,细胞内有相应的还原性物质可下调ROS,如GSH、Vc、TrxR、Fe2+和GILT等[22]。作为胞内主要的还原性物质,GSH结构中半胱氨酸上的巯基是主要的活性基团,其可以通过形成GSSG氧化态的方式消耗细胞中的ROS[23]。这对调控胞内氧化还原稳态和维持机体正常的生理功能至关重要。此外,许多疾病部位的GSH水平也较高,例如肿瘤组 织 中 的GSH浓 度 高 达2 ~ 10 mmol · L-1,至 少是正常组织中的4倍[24]。基于此,借助ROS和GSH在生理环境与病理环境中的浓度梯度差异,研究者开发了一系列氧化还原响应型递送载体并将其广泛应用于核酸药物的递送,为个性化治疗提供可能。
3 氧化响应型载体用于核酸药物递送
利用肿瘤和某些炎症等疾病微环境中高ROS水平特征,研究者们设计开发了一系列ROS响应型核酸药物递送载体,用于实现核酸药物的按需递送,进而提高相关疾病治疗效率[13,20,25]。其中,ROS响应部分的设计是实现核酸药物精准递送的关键,常见的ROS响应结构主要包括缩硫醛/酮、苯硼酸(酯)、二硒键和二茂铁(Fc)等[13](见表1)。这些敏感基团在疾病组织异常氧化环境的刺激下,发生断裂或性质改变,使得递送系统解交联或解组装,特异性释放出负载的核酸药物,从而精准递送核酸药物。以下将简要总结氧化响应型载体用于核酸药物递送的研究进展。
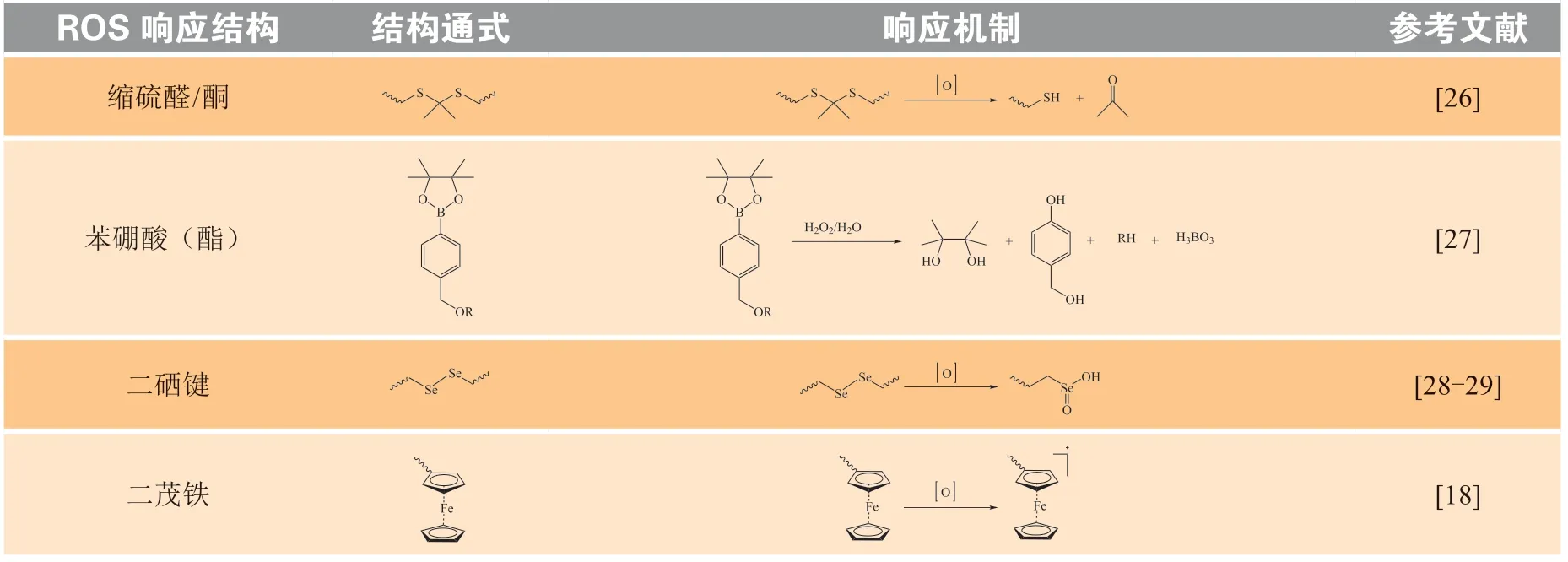
表1 代表性的ROS响应结构及其响应机制Table 1 Representative ROS-responsive structures and their mechanisms
3.1 缩硫醛/酮结构响应型核酸药物递送系统
缩硫醛/酮在ROS作用下会被氧化裂解并生成相应的硫醇和醛/酮[26],因此也常被用于构建ROS响应型核酸药物递送载体,如利用缩硫醛/酮基团作为结构单元来构建ROS响应型聚合物,这些聚合物在ROS作用下,其缩硫醛/酮结构断裂,使载体降解,实现核酸药物的按需释放,提高核酸药物的转染效率。2019年,Zhang等[30]通过氟苯取代的缩硫醛双环氧基化合物和三(2-氨基乙基)胺的开环聚合反应,得到了一系列含氟的ROS响应型阳离子聚合物TAEA-S-xF(1 ~ 5)。其中,优选载体TAEAS-4F(5)能有效提高复合物的细胞摄取和内涵体逃逸,且其可在ROS作用下发生结构断裂,在前列腺癌PC-3细胞中特异性释放出增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)质粒(pEGFP),且显著提高了pEGFP的递送效率,约为聚乙烯亚胺(polyethyleneimine,PEI)的5.4倍。Wang等[31]采用相似的策略开发了一种基于ROS响应型聚合物载体TISUH的还原型烟酰胺腺嘌呤二核苷酸脱氢酶4(NADH dehydrogenase 4,ND4)质粒(phND4)递送系统TPP-SUH(6),用于Leber遗传性视神经病变(Leber’s hereditary optic neuropathy,LHON)的线粒体原位基因治疗。缩硫醛/酮基团也可作为核心基团被引入到树形分子结构中。Liu课题组在聚酰胺-胺类树形分子(PAMAM)的核心中引入了缩硫酮基团用于荷载siRNA。此基团可以在肺癌A549细胞高浓度ROS的作用下发生断裂,促进siRNA的释放(12 h释放率约为80%)。与以乙二胺为核心的传统PAMAM相比,此策略不仅提高了PAMAM转染效果(其靶基因敲除率提升约1.6倍),同时降低了递送体系的毒性[32]。
聚阳离子核酸药物载体存在着一个共性问题:高相对分子质量阳离子载体能够有效递送基因药物,但通常存在毒性问题;低相对分子质量阳离子聚合物细胞毒性较低且生物相容性良好,然而其不能有效压缩和递送核酸药物[33]。交联策略是解决这一问题的方法之一,通过交联可在提高低相对分子质量聚合物递送效果的同时降低载体的细胞毒性。因此,研究者利用这一策略将含缩硫醛/酮结构的化合物作为交联剂,使低相对分子质量的聚合物交联成较高相对分子质量的ROS响应型聚合物,用作核酸药物载体。Zhang等[34]利用含缩硫酮的交联剂(TKNHS)将低相对分子质量聚乙烯亚胺(OEI,相对分子质量为800)交联成聚合物OEI-TKx(7),其可响应于人胚肾HEK293T细胞及宫颈癌HeLa细胞内的ROS,触发缩硫酮断裂,促进交联聚合物解体,降低细胞毒性。此外,另有研究者利用相似的策略构建了具有靶向功能的ROS响应型共聚物:聚乳酸-缩硫酮-聚乙二醇-叶酸(PLGA-TK-PEG-FA,8),其可响应于肝癌Huh7细胞内高浓度的ROS,触发缩硫酮断裂,促进PLGA-TK-PEG-FA解体,短时间内(4 h)释放大量荷载的靶向NEDD8结合酶(UBC12)的siRNA(siUBC12),显著提高其递送效果,下调癌基因UBC12以抑制蛋白类泛素化途径并促进Cullin-RING E3泛素连接酶(CRL)底物的积累,从而在体内有效抑制肿瘤细胞的增殖并促进其凋亡[35]。
3.2 苯硼酸(酯)结构响应型核酸药物递送系统
苯硼酸及其酯可在ROS的作用下快速被氧化降解成硼酸或硼酸酯以及烯醌中间体,后者进一步水解为对羟基苄醇[27](见表1)。与其他几种氧化敏感基团相比,苯硼酸及其酯的ROS响应性较好,因 此被广泛用于构建ROS响应型基因药物递送载体[18]。

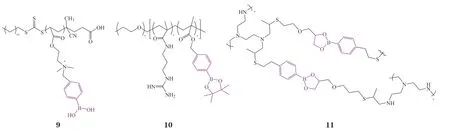
苯硼酸及其酯可被引入聚合物侧链,用于构建ROS响应型电荷翻转的基因载体。例如,Qiao等[36]利用季铵化反应将苯硼酸与聚[2-(二甲氨基)乙基丙烯酸酯](PDMAEA)聚合物侧链的叔胺共价连接得到聚合物[(2-丙烯酰基)乙基(对硼酸苄基)二乙基溴化铵](BA-PDMAEA,BAP,9),用于递送siRNA,来实现胶质母细胞瘤的诊断和治疗。在生理条件下,正电性的聚合物BA-PDMAEA可通过静电相互作用与带负电的siRNA结合形成复合物,当复合物被递送至肿瘤细胞后,载体中的苯硼酸被ROS氧化而脱离,从而加速载体中酯键水解生成羧酸,使载体表面电荷由正变负,致使载体与核酸分子间的静电相互作用转变为静电排斥作用,降低载体与核酸形成复合物的稳定性,促进核酸药物的释放,进而抑制肿瘤生长因子-β(transforming growth factor-β,TGF-β)的表达,显著改善胶质瘤小鼠的免疫抑制微环境,并延长小鼠生存期约2倍。此外,由于病变组织的异质性,异常ROS水平可能不足以完全触发苯硼酸结构响应断裂从而释放出负载的核酸药物,研究者将促进ROS生成的药物(如索拉菲尼[37])与ROS响应型核酸药物递送系统联用以升高肿瘤微环境中的ROS浓度,从而促进核酸药物的释放。
苯硼酸酯的疏水特性使其可作为载体的疏水部分用于构建两亲性的ROS响应型核酸药物递送载体。Zheng等[38]以乙二醇、N-(3-甲基丙烯酰胺基丙基)胍与含苯硼酸酯侧链的丙烯酸酯为重复单元设计合成了两亲性三嵌段共聚物PEG-b-P(Gu/Hb,10)。共聚物结构中的胍基可通过静电相互作用和氢键作用与靶向Polo样激酶1(Polo-like Kinase 1,PLK1)的siRNA(siPLK1)和靶向血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR2)的siRNA(siVEGFR2)结合,同时,苯硼酸酯之间的疏水作用使两亲性共聚物能稳定组装。该递送系统同样可在星形胶质母细胞瘤U87MG细胞内的高ROS水平下解体,从而提高核酸药物的释放效率。
除此以外,含有苯硼酸及其酯的结构可作为交联剂,将其与低相对分子质量阳离子聚合物交联以构建交联型ROS响应的核酸药物递送载体。例如,Ruan等[39]利用含苯硼酸酯基团的交联剂4-((烯丙氧基)甲基)-2-(4-乙烯基苯基)-1,3,2-二氧杂硼烷(VPBE)将低相对分子质量的支化聚乙烯亚胺(BPEI,相对分子质量为1 200)交联成高相对分子质量的ROS响应性PEI聚合物SP-Cross-Linked BPEI(11)。此聚合物能成功将siPLK1递送至人三阴性乳腺癌MDA-MB-231细胞,载体结构中的苯硼酸酯基团在ROS的作用下,发生氧化断裂并引起载体解体,释放出荷载的药物,对靶基因的敲除率约为60%。此外,该课题组尝试用PEG和靶向肽SP修饰载体以增加此递送体系的长循环和靶向功能,从而安全高效地将siPLK1靶向递送至肿瘤细胞,产生显著的抗肿瘤效果。
3.3 其他结构ROS响应型核酸药物递送系统
除了上述2种经典的ROS响应型核酸药物递送系统,二硒键和Fc因其较好的ROS响应性能,也被应用于构建ROS响应型核酸药物递送系统[13]。其中,二硒键较活泼,ROS响应灵敏度高[28],在低浓度ROS作用下即可快速被氧化裂解成硒酸[29](见表1),因此越来越多的研究利用二硒键构建ROS响应型载体,用于核酸药物的输送[25]。利用含二硒键的交联剂开发的一类基于低相对分子质量聚合物的交联阳离子载体,可以被胞内ROS氧化降解为低相对分子质量的片段,从而达到胞内核酸药物按需释放的目的。例如,He等[40]设计了一种可递送siPLK1的纳米递送系统UCNO,该递送系统利用含二硒键的交联剂将低相对分子质量PEI(相对分子质量为600)交联成相对分子质量较高的聚合物PEI-SeSe,并以上转换纳米粒子为核、光敏剂孟加拉玫瑰红(Rose Bengal,RB)共轭的PEI为内层、PEI-SeSe为中间层,然后利用穿膜肽R8和透明质酸(hyaluronic acid,HA)组成保护外壳以防止因二硒键的过高灵敏性造成的siPLK1泄露;在波长为808 nm的近红外光的照射下,UCNO产生约540 nm的发射光并激活RB,进一步促进ROS的生成,从而加速PEI-SeSe的分解以促进siPLK1释放(释放率约86%),基因沉默效率较未照射组提高约1.8倍,并显著抑制了肝癌荷瘤小鼠的肿瘤生长。
具有三明治结构的金属配合物Fc在高ROS浓度下可被氧化成带正电的亲水性二茂铁离子(Fc+)(见表1)[18]。利用Fc这一特性,Yue等[41]利用Fc修饰金纳米粒得到Au@Fc NP,并利用疏水性聚乳酸(PLA)和亲水性PEI与β-环糊精(β-CD)偶联制备了β-CD-PLA-PEI。疏水性Fc可进入β-CD的疏水空腔,通过主-客体相互作用连接Au@Fc NP和β-CD-PLA-PEI,组成ROS响应型金纳米粒Au NV。Au NV可以有效负载葡萄糖氧化酶(GOx)及可被ROS激活的质粒RTP801::p53。肿瘤细胞内高ROS可将疏水性Fc氧化为亲水性Fc+,Fc+即从β-CD疏水空腔中脱离而破坏了主-客体作用,使得Au NV部分解离并促进GOx的高效特异性释放。释放出的GOx可进一步提高胞内的H2O2水平,加速Au NV的解体,从而释放剩余的GOx及负载的质粒。同时,胞内高ROS水平将激活RTP801::p53的启动子,从而促进p53在黑色素瘤B16F10细胞特异性的表达,实现肿瘤的精准治疗。
4 还原响应型载体用于核酸药物递送
肿瘤细胞内还原性物质如GSH的浓度比胞外高100 ~ 1 000倍。同样地,借助于肿瘤组织和正常组织之间GSH浓度的差异,研究者将GSH敏感基团引入载体结构中,构建了各种还原响应型聚合物载体,用以实现核酸药物的按需递送。常见的GSH敏感型化学键(基团)有二硫键、二硒键[12]以及对二硝基苯醚[42]等(见表2)。以下将对还原响应型核酸药物递送系统的研究成果进行简要概述。
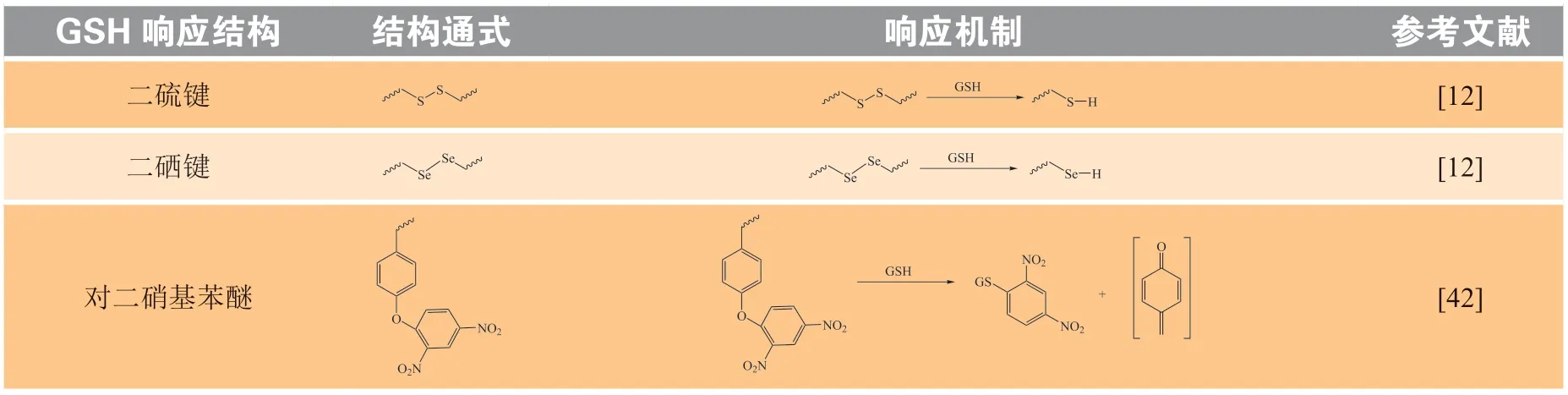
表2 GSH响应结构及其响应机制Table 2 GSH-responsive structures and their mechanisms
4.1 二硫键响应型核酸药物递送系统
二硫化合物在生理条件、氧化等环境下很稳定,但在一定量的GSH或二硫苏糖醇(dithiothreitol,DTT)等还原物质存在下会被还原生成硫醇。且二硫键的反应活性较高[43],被广泛地用于构建还原响应型核酸药物递送载体。常见的含有二硫键的化合物主要有吡啶二硫化物、胱胺、胱胺双丙烯酰胺、3,3'-二硫代二丙酸及2,2'-二硫代二乙醇等,它们可作为连接键或交联剂被引入递送系统,以实现核酸药物的特异性还原响应释放[44]。
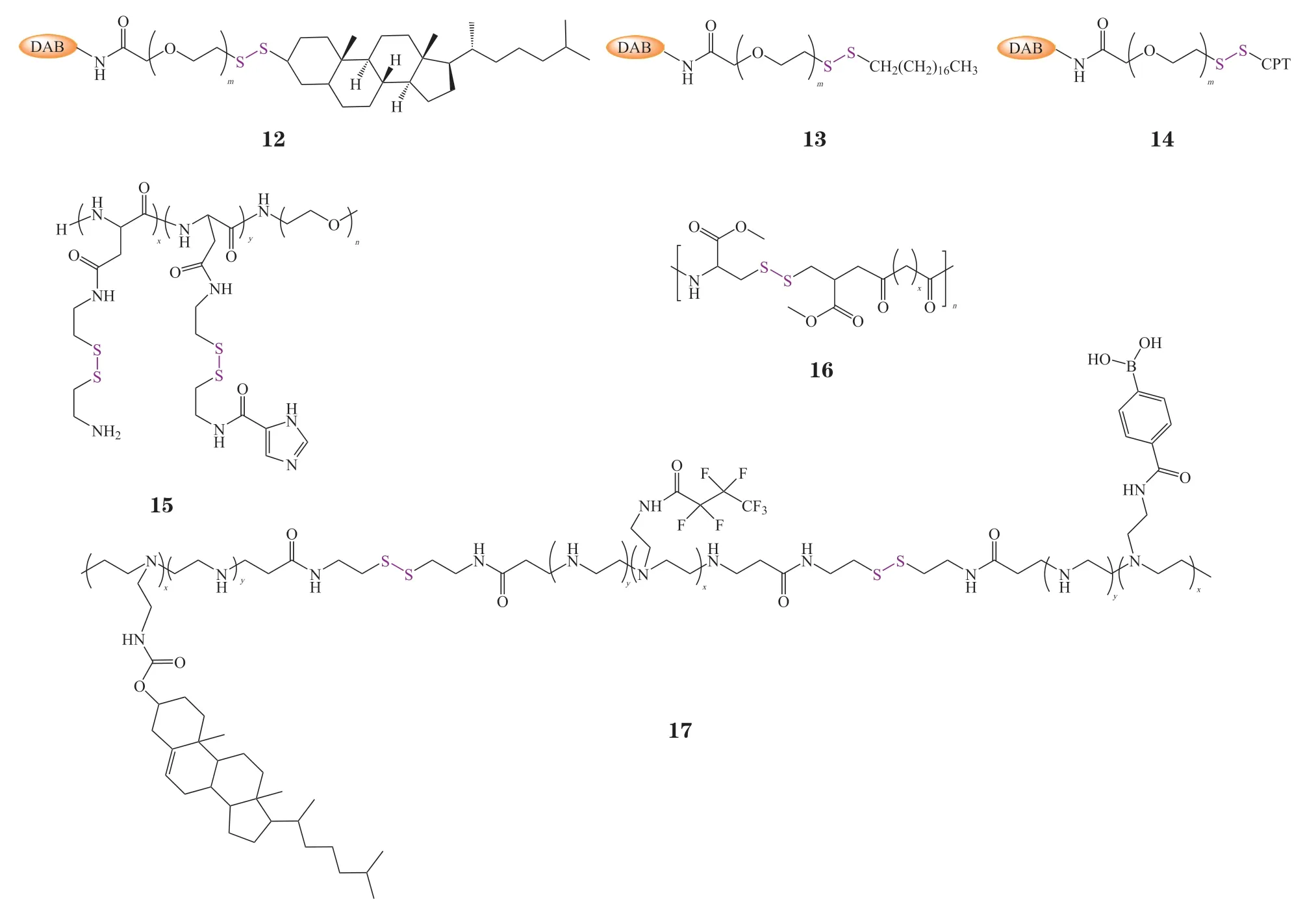
二硫键或者含二硫键的基团可作为连接键被用于在聚合物(树形分子[45-47]、PEI[48]、壳聚糖[49-50]等)表面上修饰PEG或疏水功能基团等,在胞内高GSH的水平下,二硫键的断裂促进递送载体快速释放核酸药物。Christine Dufès课题组利用吡啶二硫化物在PEG功能化的G3代聚丙烯亚胺树形分子DAB表面引入脂质(如胆固醇和疏水烷基链),构建了一系列功能化的DAB(12 ~ 13),用于编码β-半乳糖苷酶(β-galactosidase,β-gal)的质粒(pCMV β-gal)在PC-3细胞的递送。研究表明,此类分子可以在水溶液中自组装形成纳米囊泡,有效负载核酸药物分子;并且胆固醇或者疏水烷基链的引入有效增强该递送体系的细胞摄取,在胞内GSH的刺激下,该体系解散,快速释放荷载的质粒,发挥治疗作用。此外,该课题组还利用喜树碱(CPT)功能化GSH响应的PEG化DAB(14)以共递送质粒与CPT,达到协同抗肿瘤的效果[45-47]。采用类似的策略,Chen等[51]在中性聚合物PBLA-PEG的侧链引入含二硫键的阳离子片段胱胺(AED),随后在部分侧链的氨基表面修饰咪唑基团得到阳离子嵌段共聚物P(Asp-AEDICA)-PEG(15)。在肿瘤细胞内,咪唑基团质子化促进DNA的内涵体逃逸后,胱胺响应GSH断裂使载体由正电性转变为中性,从而促进DNA的释放;该递送载体不仅能高效递送DNA,还能成功递送mRNA和Cas9/sgRNA基因编辑体系,是一类极具潜力的可递送不同类型核酸药物的载体。
此外,含二硫键的结构(如L-胱氨酸二甲酯[52]、胱胺双丙烯酰胺[53])也可作为聚合物单体的组成成分之一,用于构建GSH响应型聚合物核酸药物载体。此类聚合物在胞内高GSH的环境下可降解为小片段的化合物,从而释放其负载的核酸。例如,Xu等[52]以含有二硫键的L-胱氨酸二甲酯和脂肪酸为聚合单元合成聚二硫酰胺PDSA(16)。PDSA、阳离子脂质(G0-C14)以及二硬脂酰磷酸乙醇胺(DSPE)-聚乙二醇(DSPE-PEG)通过纳米共沉淀法与siRNA形成一类GSH响应的壳核型siRNA递送系统。该体系具有较高的GSH响应siRNA释放性能,与10 mmol · L-1GSH孵育24 h后即可释放约80%负载的siRNA;同时,其能够高效荷载靶向驱动蛋白家族成员11(kinesin family member 11,KIF11)或癌基因MYC的siRNA并将其高效输送至PC-3细胞,并能有效抑制肿瘤组织中KIF11或MYC的表达,从而有效抑制前列腺肿瘤的生长。此外,含有二硫键的小分子前药[如10-羟基喜树碱(10-hydroxycamptothecin,HCPT)]也可以作为聚合物结构单元,实现siRNA药物与化疗药物协同治疗[54]。二硫键同样可作为交联剂交联低相对分子质量聚合物(如PEI[55-56]等),构建交联型GSH响应核酸药物递送载体。这类载体在GSH的作用下解交联,从而有效释放核酸药物。例如,Wu等[56]利用“模块交联”策略将PEI-X(X代表胆固醇、七氟丁酸酐和4-羧基苯基硼酸)3种功能结构通过二硫键相互交联,构建还原响应型PEI-X-SS-X-PEI共聚物。其中,胆固醇作为脂质锚可增强聚合物和细胞膜的相互作用并提高体系的稳定性,七氟丁酸酐修饰促进体系的细胞摄取和内体逃逸,而二硫键可以在肿瘤胞内高GSH催化下断裂,释放荷载的siRNA,提高递送体系的转染效率。优选的载体PEI-Ch-SS-FPEI-SS-PBA-PEI(17)在乳腺癌4T1细胞及MDAMB-231细胞中基因沉默率高达60%。
4.2 其他结构GSH响应型核酸药物递送系统
除二硫键之外,对二硝基苯醚结构也逐渐被用于构建GSH响应型核酸药物递送系统。Shen课题组利用对二硝基苯醚开发了一种基于(2,4-二硝基苯氧苄基)-铵阳离子的GSH响应型电荷翻转聚合物(PADDAC),将其用于DNA的递送。在胞内高GSH作用下,PADDAC中的对二硝基苯醚与GSH结构中游离巯基反应,使得醚键断裂生成苯酚阴离子并迅速转化为羟甲基苯酚,最终水解为带负电的聚丙烯酸,实现电荷翻转,从而在HeLa细胞内快速释放负载的肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)质粒(pTRAIL),在体内外均有较好抗肿瘤活性,体内抑瘤率高达82%[57]。含对二硝基苯醚结构的GSH响应型递送载体用于核酸药物递送还处于起步阶段,需要进一步的研究。
5 调控病理氧化还原微环境的聚合物核酸药物 递送系统
细胞内氧化还原稳态对维持细胞正常生理功能至关重要,而这主要取决于ROS和GSH之间的动态平衡,使得一定水平的自由基既能够维持细胞正常的生理功能,却又不会导致细胞损伤。相较于正常细胞,肿瘤细胞和炎症细胞内异常的氧化还原稳态十分脆弱,更容易被打破,引发ROS在细胞内的过量累积,加速疾病的进程[58]。基于此,研究者通过联合光动力疗法、放射疗法构建了一系列调控病理氧化还原微环境的聚合物核酸药物递送系统,如促进ROS生成或耗竭GSH、清除ROS等,协同基于核酸药物的基因治疗,以达到高效治疗疾病的目的。
利用阳离子聚合物核酸递送系统包载光敏剂(如Ce6),可联合光动力疗法促进ROS生成,调控病理部位的氧化还原微环境,进一步实现疾病的精准定点治疗。例如,Zhou等[59]利用Ce6修饰了具有靶向功能的O-羧甲基壳聚糖(O-carboxymethyl chitosan,CMCS),并将其包覆在PEI/DNA复合物表面,构建了一种可促进ROS生成的核酸药物递送系统PD@CCPNR。该体系中的柠檬酸酐及CMCS在内涵体中发生断裂,促进Ce6的释放,使其在660 nm的光照下产生适量的ROS,加速复合物的内涵体逃逸,又可避免DNA损伤,有效协同光热疗法和基因治疗。此外,利用聚合物核酸递送系统包载氧化剂[如六价钨离子(W6+)],可联合放射疗法既促进ROS生成又耗竭胞内的GSH,协同放大疾病组织的氧化应激,进而提高疗效。例如,Yong等[60]设计了一种含有钆(Gd)和W的多金属氧酸盐偶联壳聚糖GdW10@CS系统,用于递送以缺氧诱导因子(hypoxia-inducible factor-1α,HIF-1α)为靶点的siRNA(siHIF-1α)。其中,GdW10@CS中的Gd和W作为外源辐射增敏剂,经X射线照射,可在肝癌BEL-7402细胞内产生大量的ROS;同时,W6+又作为内源性氧化剂,与GSH发生氧化还原反应,从而耗竭胞内的GSH,进一步放大细胞内的氧化应激,促进BEL-7402细胞凋亡;该体系可成功将siHIF-1α靶向递送至肝癌细胞,下调HIF-1α的表达,减轻肿瘤乏氧,并协同内外源性放射增敏,提高肿瘤治疗效果。
利用核酸递送系统包载ROS清除剂[如表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)],可清除疾病部位过量ROS,改善疾病的进程。例如,肿瘤中高水平的ROS可影响同源性磷酸酶-张力蛋白基因(phosphatase and tensin homolog,PTEN)的表达,进而加速肿瘤细胞增殖。针对这一问题,Wang等[61]设计了一种可共载质粒pPTEN和EGCG的纳米粒,该纳米粒由DSPE修饰的PEI(DSPE-PEI)、胆固醇和二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine,DPPC)组成。该体系中的EGCG可有效清除PC-3细胞中过量的ROS,从而促进PTEN的表达,恢复相关蛋白质功能,从而通过负反馈调节PI3K-AKT信号通路,发挥强效的抗肿瘤作用。
6 结语与展望
近几年,随着研究者对疾病部位氧化还原微环境的了解以及对纳米材料的探索,氧化还原响应型核酸药物递送系统取得了许多鼓舞人心的研究成果。研究者针对疾病组织氧化还原环境的差异,利用各种氧化还原响应型基团,设计了一系列氧化还原响应型纳米递送系统。这些递送系统中的ROS敏感基团[缩硫醛/酮、苯硼酸(酯)、二硒键和二茂铁等]或GSH敏感基团[二硫键、对硝基苯醚等]在异常的氧化还原环境下被氧化或被还原,使得递送系统即可通过结构断裂或亲疏水性质转变实现解离或解组装,或利用电荷翻转策略减弱载体与核酸分子的静电相互作用以促进荷载核酸药物的释放,成功实现核酸药物在疾病部位的按需递送,从而有效提高核酸药物的递送效率,同时增强递送系统的安全性。
然而,这类递送系统在设计开发过程中仍存在以下挑战,值得进一步探索。1)各类氧化响应型载体在核酸药物递送中的研究较为深入,而还原响应型载体的研究主要为基于二硫键所构建的载体,其他还原敏感基团所构建的还原型载体在核酸递送中的应用还有待进一步开发。2)载体的结构、氧化还原响应性、核酸药物递送效率三者之间的关系需要进一步阐明。不同敏感基团的响应机制各异,并且其在载体中的位置对递送体系的敏感性的影响也尚不清晰,仍需建立合适的评价机制来探究。3)疾病组织的复杂性和异质性对递送系统在体内的响应性能的影响还需要深入研究。此外,这些载体在病理微环境中的特异性释药过程可能会调控细胞的氧化还原水平,具体机制仍有待研究。4)氧化还原响应型载体的响应后降解产物在体内的代谢机制尚不清晰,仍需要深入研究。
总之,氧化还原响应型递送系统在核酸药物按需输送方面极具潜力,尤其是氧化响应型核酸递送系统被广泛用于炎症性疾病和肿瘤治疗的基础研究,但其进一步的临床应用仍任重道远,迫切需要从载体开发、递送系统体内毒理学和药代动力学研究,以及工业化转化等多方面联合攻关。希望本综述可以为氧化还原响应型递送载体的合理化设计提供一定的参考和帮助。
