智能刺激响应型基因编辑工具递送系统研究进展
2022-12-23郭家晶平渊
郭家晶,平渊
(浙江大学药学院,浙江 杭州 310058)
1 引言
在过去的几年中,由于成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)-CRISPR相关蛋白9(Cas9,也称Cas9核酸酶)技术的普及,全球基因编辑研究呈现井喷式的发展[1]。2020年CRISPRCas9技术被授予诺贝尔化学奖,凸显了该技术在基因治疗方面的非凡潜力[2]。这一新兴的基因工程技术从基础生物学到生物医学工程、食品科学和医疗保健等诸多领域都展现出了巨大的应用前景[3-5]。由于CRISPR-Cas9技术在国内外获得了广泛的认可和关注,基于CRISPR-Cas9技术的基因组编辑相关产品在全球市场中也获得了爆炸性的增长[6]。
CRISPR-Cas9基因组编辑技术依赖于Cas9定向切割,引发DNA双链断裂(double-strand break,DSB),需要预先设计的单链引导RNA(single guide RNA,sgRNA)分别与Cas9和需要切割的DNA结合形成三元复合物,引导Cas9到特定的基因位点产生切割[7-8]。DNA发生双链断裂后,细胞内存在的2种内源性DNA修复途径,会对断裂位点进行非同源末端连接(NHEJ)或同源定向修复(HDR,需要模板DNA),从而实现特定基因的敲除或者敲入[9-10]。与前两代基因编辑工具锌指蛋白核酸酶(ZFN)和转录激活因子样效应物核酸酶(TALEN)相比,基于CRISPR-Cas9的基因编辑工具有明显的优势[11-12](见图1):首先,在CRISPR-Cas9系统中,Cas9是固定的,只需要针对特定的目标基因设计sgRNA即可,sgRNA长度只有约100个碱基对,很容易定制设计,而使用ZFN或TALEN工具需要设计和合成一个庞大的引导蛋白[13-14](锌指蛋白DNA结合域或转录激活子样效应子),更为复杂;其次,与前面2种方法相比,CRISPR-Cas9技术在基因组编辑方面具有更高的精度和效率[15];最后,CRISPR-Cas9系统可以同时编辑多个基因位点,这是前面两代基因编辑技术无法实现的[16]。
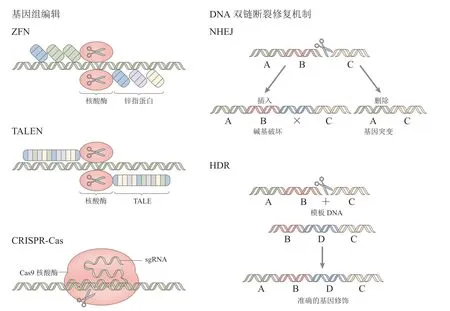
图1 基因组编辑和双链断裂修复示意图[11]Figure 1 Schematic diagram of genome editing and double-strand break repair
递送CRISPR-Cas9基因编辑工具可以通过3种形式实现,包括同时编码Cas9蛋白和sgRNA的质粒(Cas9/sgRNA-质粒)、编码Cas9蛋白和sgRNA的mRNA(Cas9/sgRNA-mRNA)或核糖核蛋白[17-19](RNP,Cas9蛋白和sgRNA的复合物)。3种CRISPR-Cas9工具递送形式具有各自的特点[20],质粒的稳定性较好,可以实现较长时间的编辑,但也伴随着起效慢、编辑效率低、脱靶率高并且有基因组整合风险等缺陷;mRNA避免了DNA插入的风险,但由于其不稳定、容易被降解,也可能降低整体的编辑效率;RNP具有稳定性较高、作用快速、脱靶率低、免疫原性低,同时没有基因插入突变的风险等优势,但也存在成本较高、基因编辑作用时间较短的问题[21-23]。
DNA、mRNA和RNP均带有较高的电荷和较大的体积,导致它们很难穿过细胞膜进入细胞中[24]。因此,发展新的胞内递送CRISPR-Cas9工具的策略一直是拓展基因编辑应用领域的核心问题[25]。目前,病毒和非病毒载体都被用于CRISPR-Cas9工具的递送[26-27]。病毒载体,如腺相关病毒(adeno-associated virus,AAV)和慢病毒(lentivirus,LV)等,是用于高效胞内递送基因编辑工具的常用载体,但由于装载能力的限制、免疫原性以及诱导突变的风险,使得它们的应用受到限制[28-29]。此外,病毒递送会导致细胞内长时间的编辑作用,这可能引起较严重的脱靶效应[30](见表1)。
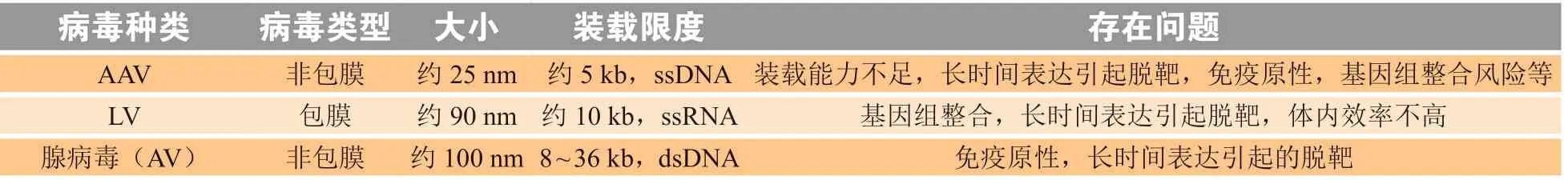
表1 用于递送CRISPR-Cas9工具的病毒载体Table 1 The viral vectors for delivery of CRISPR-Cas9 tools
非病毒载体与CRISPR-Cas9系统形成的纳米粒子(NP)用于基因编辑工具的递送有望解决上述问题。多种非病毒载体如脂质、聚合物、硅基材料,以及金纳米粒子等已被报道用于CRISPR-Cas9的胞内递送[22]。然而,非病毒载体用于CRISPR-Cas9系统的递送仍然存在2个关键的问题。首先,与病毒载体相比,非病毒载体的递送效率仍然较低,主要原因在于非病毒载体用于CRISPR-Cas9的递送需要克服多种屏障[31-32](包括细胞外和细胞内屏障)。具体来说,细胞外的障碍包括纳米粒子与血清蛋白的非必要相互作用、免疫细胞的吞噬作用、血管表皮细胞的质密连接导致纳米粒子难以渗透以及靶向等;细胞内屏障包括纳米粒子容易在内涵体/溶酶体中降解,进入细胞质后难以将CRISPR-Cas9工具释放,释放后的工具还需要进入细胞核才能发挥作用。其次,靶向递送CRISPR-Cas9系统、实现精准基因组编辑仍然是一个大问题[33]。
因此,为了应对上述提到的挑战,实现高效且精确的基因组编辑,研究人员开发了多种刺激响应型载体系统用于CRISPR-Cas9工具的胞内递送,这些新一代载体也代表着CRISPR-Cas9递送领域的未来发展方向[32]。刺激响应型纳米递送系统能从时间和空间上对特殊的反应发生感知和应对,从而触发释放出CRISPR-Cas9工具并产生相应的作用。这些触发开关有多种,比如内源性的生物因素(pH值、酶、氧化还原因子水平等),或者外源性的因素(声、光、电、小分子、磁场等)[34]。在本文中,笔者对刺激响应性材料用于CRISPR-Cas9工具的胞内递送的研究进展进行综述。这些特殊材料与CRISPR-Cas9工具形成稳定的纳米复合物后,能在时间和空间上实现CRISPR-Cas9工具的控制释放。此外,重点介绍了这些载体的设计原理和可能的生物应用方向。
2 内源性刺激响应载体
随着生物科学、材料科学、生物医学工程等学科的快速发展,内源性刺激响应型智能药物递送系统被研发问世,深刻地影响了医疗技术的发展,极大地提高了现有药物的临床表现和治疗潜力[35]。这些研究成果也能应用于CRISPR-Cas9工具的体内外递送。智能响应型药物递送的概念起源于20世纪70年代,当时有人利用热响应的脂质体实现了药物的控制释放[36]。从那时起,大量的工作开始聚焦于智能递送材料的设计与研究,这些材料可以通过感知特殊生物化学因素的变化从而实现药物时空释放,应用于临床患者[37]。内源性因素包括pH值、酶、氧化还原水平的变化等,同时多种疾病(如恶性肿瘤、自身免疫疾病、神经退行性疾病、心脑血管疾病和感染等)的病理过程也伴随着相应生理因素的变化[34]。智能药物递送材料与CRISPR-Cas9工具(质粒、mRNA和RNP)形成稳定的纳米复合物后,通过感知这些内源性生理因素的变化,实现CRISPRCas9工具的控制释放,发挥基因组编辑作用[22]。
2.1 pH响应的CRISPR-Cas9递送系统
生物体内某些特殊的器官具有不同的pH值,比如胃中pH值1.5 ~ 3.5、小肠中pH值5.5 ~ 6.8、结肠中pH值6.4 ~ 7.0;细胞内的细胞器,如内涵体/溶酶体中pH值4.0 ~ 6.5;此外,一些疾病微环境(如肿瘤或者炎症部位)中,与正常组织相比,pH值也会发生变化。这一特点已被广泛用于设计智能刺激响应型药物递送系统[38]。CRISPR-Cas9递送的一个关键障碍就是细胞内涵体/溶酶体系统,里面较低pH值和大量酶会迅速使CRISPR-Cas9工具降解失活[39]。因此,考虑到内涵体/溶酶体系统中较强的酸性环境,一些研究者在将pH响应纳米复合物用于CRISPR-Cas9工具的递送时,通过载体材料的质子化来打破溶酶体膜,实现内涵体逃逸,从而发挥作用。2019年,Liu等[40]开发了一种苯硼酸(phenylboronic acid,PBA)修饰的树形高分子材料P4。一方面,PBA上的芳香环可以通过阳离子-π相互作用与蛋白质表面的阳离子和阴离子基团相结合;另一方面,蛋白质上的阴离子羧酸酯基团可以通过离子相互作用与带正电荷的P4有效结合。因此,P4能与多种蛋白质(包括RNP)结合形成稳定的纳米粒子(见图2)。同时,由于P4上面还有大量的氨基基团,可以结合质子,具有很强的pH缓冲作用。纳米粒子被细胞摄取后,能快速地质子化,打破溶酶体膜,实现内涵体逃逸进入细胞质中。细胞实验结果表明,P4递送RNP可以高效敲除AAVS1和HBB基因,效率最高分别能达到29.6%和22.5%。
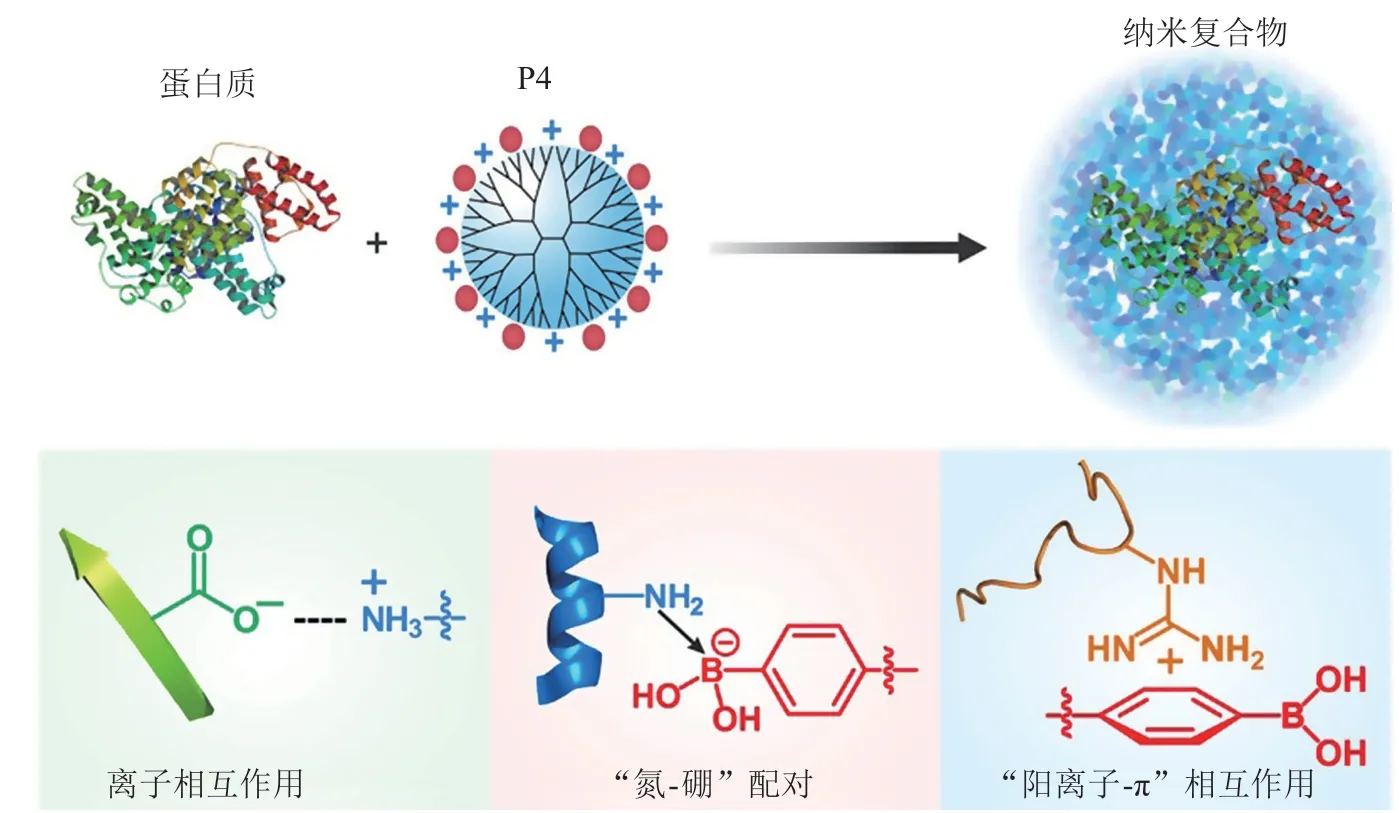
图2 P4与蛋白质相互作用形成纳米粒子的示意图[40]Figure 2 Schematic diagram of P4 interacting with proteins to form nanoparticles
Chen等[41]设计合成了不同长径比(长度与直径的比值)的金纳米棒(gold nanorod),通过在金纳米棒表面包裹一层支链的聚乙烯亚胺(PEI)形成新的阳离子金纳米棒(AuNR-PEI,ARP,见图3),其能络合Cas9质粒形成稳定的纳米粒子,同时具有优良的细胞内化能力和内涵体逃逸能力。该课题组合成了一系列不同长径比(1 ~ 9)的ARP,筛选后发现其长径比为8时(对应的ARP即ARP-8)具有最好的基因递送效率。细胞实验表明,以ARP-8负载Cas9质粒,对AAVS1和PLK1这2种不同基因都有较好的敲除效率。随后,课题组用半乳糖(Gal)修饰ARP-8得到了具有肝脏靶向能力的Gal-ARP,通过递送CRISPR/Cas9的质粒靶向敲除肝细胞的肿瘤坏死因子基因Fas,成功保护了急性肝损伤小鼠,体内对小鼠肝细胞的Fas基因敲除效率能达到7.6%。Lee等[42]制备了一种基于金纳米粒子的载体,用来递送Cas9 RNP和模板DNA(该递送系统命名为CRISPR-Gold)。通过硫醇可以将模板DNA附着在金纳米粒子上面,同时用pH响应性的聚合物——聚(N-(N-(2-氨基乙基))-2-氨基乙基)天冬酰胺[PAsp(DET)],通过杂交或静电相互作用将Cas9 RNP和金纳米粒子包裹起来,此外,聚合物中的二乙烯三胺(DET)功能基团也使得纳米粒子具有较好的内涵体逃逸性能。纳米粒子被细胞摄取后,PAsp(DET)聚合物通过质子海绵效应破坏内涵体,进入细胞质。在杜氏肌营养不良(DMD)模型小鼠(mdx小鼠)中进行的体内实验结果表明,CRISPR-Gold能诱导肌萎缩蛋白(dystrophin)基因的同源定向修复(HDR),治疗组mdx小鼠的肌萎缩蛋白基因定向修复率达5.4%。
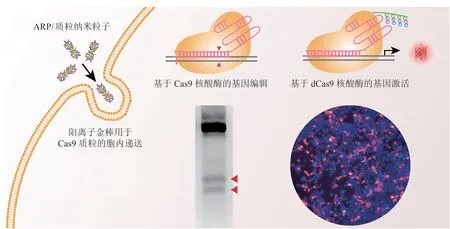
图3 阳离子金纳米棒用于Cas9质粒递送的示意图[41]Figure 3 Schematic diagram of cationic gold nanorods for Cas9 plasmid delivery
2.2 氧化还原反应响应的CRISPR-Cas9递送系统
众所周知,细胞内外的氧化还原环境是不一样的。例如,还原剂谷胱甘肽(GSH)在细胞内的水平比在细胞外高2 ~ 3个数量级[38],因此,将GSH可断裂的二硫或二硒键整合到递送载体中可以实现特定位点的CRISPR-Cas9胞内递送[43]。另外,能对细胞内活性氧[ROS,如过氧化氢(H2O2)和羟基自由基]响应的载体也可用于CRISPR-Cas9的递送。体内多种病理条件下都能产生活性氧,包括癌症、卒中、动脉粥样硬化和组织损伤等[44]。
Chen等[45]研制了一种可被GSH降解的聚合物纳米胶囊,用于递送RNP。RNP纳米胶囊是由阳离子单体和阴离子单体混合在RNP表面并通过原位聚合交联而成,中间由一种含二硫键的N,N'-双(丙烯酰)胱胺作为交联剂,使得胶囊被细胞摄取后可以被GSH降解,导致交联聚合物分解,从而释放RNP用于基因组编辑。该胶囊RNP制剂具有良好的生物相容性和稳定性。在多种体外(293T细胞和干细胞)实验和体内[Ai14小鼠的视网膜色素上皮(RPE)组织和骨骼肌]实验中,都具有良好的基因组编辑效果。2021年,Guo等[46]设计了一种含双硫主链的阳离子聚合物材料DET-CPD,该材料由含DET功能基团的单体M1和精氨酸甲酯的单体M2通过巯基引发的开环聚合反应聚合而成,获得了一系列的聚双硫阳离子载体(见图4)。课题组通过筛选获得了效果最好的材料DET-CPD-12,其能通过分子间的氢键、静电相互作用等弱的相互作用力与3种CRISPR-Cas9基因编辑工具(Cas9/sgRNA-质 粒、Cas9/sgRNA-mRNA和RNP)形 成稳定的纳米粒子。不仅如此,DET-CPD-12能与细胞外膜上的巯基发生一种独特的“硫硫交换”反应(disulfide-exchange reaction),能绕开细胞内吞途径直接进入胞内,同时在胞内高浓度的GSH作用下DET-CPD-12双硫主链被迅速降解,将包载的基因编辑工具释放出来发挥作用,因此,DET-CPD-12能高效地将基因编辑工具递送到细胞内,同时大大降低了材料的毒性。细胞实验表明,在293T细胞内,DET-CPD-12分别将3种基因编辑工具递送到胞内后,对CCNE1基因均具有较好的敲除效率,最高能达到39.2%。体内实验表明,DET-CPD-12与CRISPR-Cas9基因编辑工具形成的纳米复合物能被动靶向递送到小鼠肝脏部位、被肝细胞吸收,通过敲除CCNE1基因有效发挥对急性肝损伤小鼠的肝脏保护作用,显著延长了小鼠的生存期。
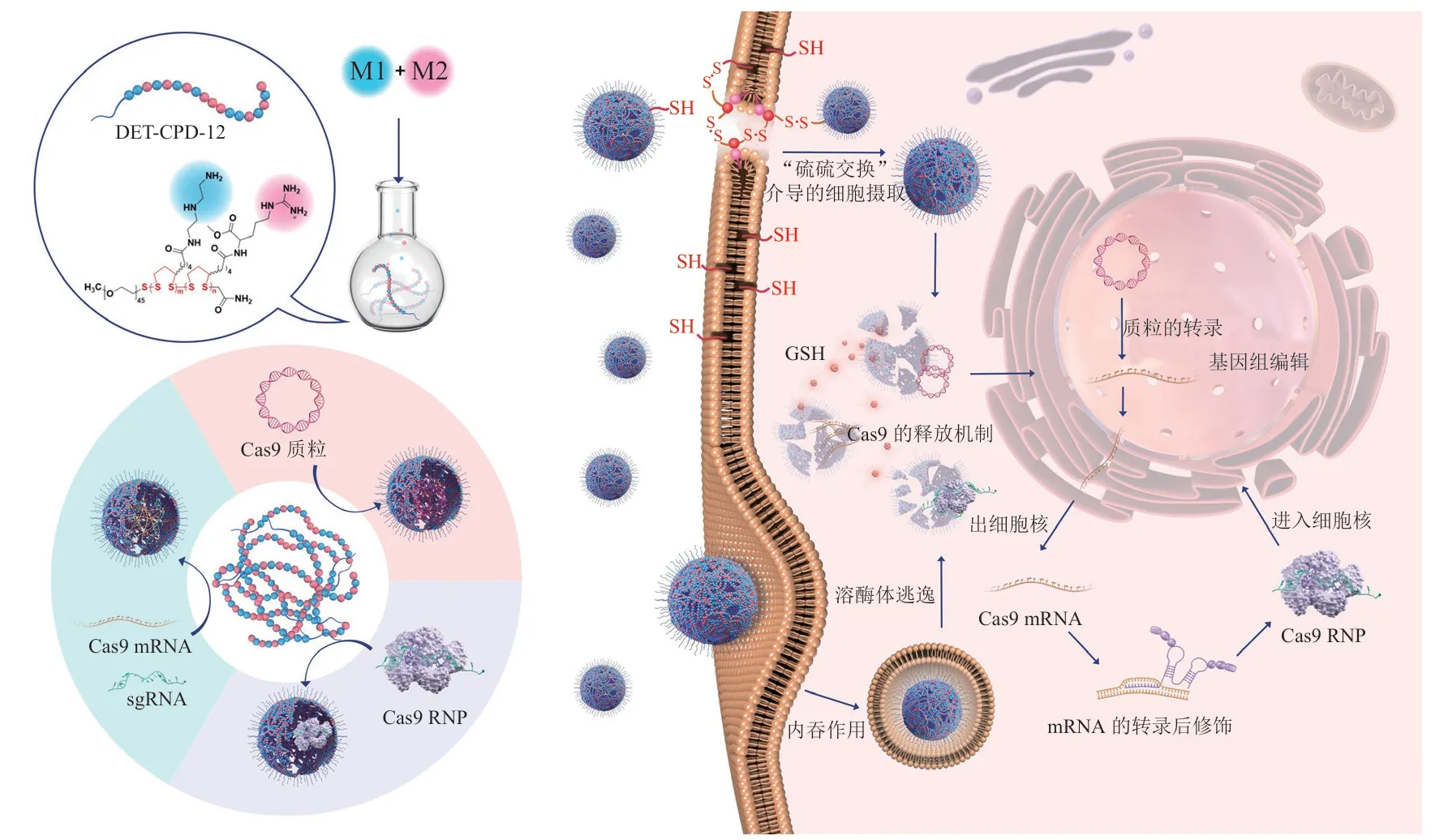
图4 DET-CPD-12用于3种基因编辑工具胞内递送的示意图[46]Figure 4 Schematic diagram of DET-CPD-12 for intracellular delivery of three kinds of gene-editing tools
2021年,Yan等[47]报道了一种用于靶向炎症部位的CRISPR-Cas9基因编辑前药递送系统(NanoProCas9,见图5)。课题组先构建了一种编码不稳定Cas9(destabilized Cas9,dsCas9)蛋白的质粒,dsCas9上面带有一个二氢叶酸还原酶(DHFR)的结构域。然后用阳离子聚(β-氨基酯)聚合物(PBAE)络合dsCas9质粒形成稳定纳米复合物。接着,用巨噬细胞膜包被于PBAE/质粒复合物表面,使得纳米粒子具有靶向炎症部位的能力。最后,课题组将dsCas9的小分子稳定剂甲氧苄啶(TMP)通过硫代酮连接剂(TK)与油基醚改性聚乙二醇(OE-PEG,BAM)结合,得到ROS响应的BAM-TK-TMP,BAM-TK-TMP上面疏水的尾部可以通过脂融合插入到巨噬细胞膜上面。在正常生理环境下,上述质粒所表达的结构不稳定的dsCas9被泛素依赖的蛋白酶所降解;而在炎症部位等ROS丰富的内环境中,BAM-TK-TMP被激活并释放能够稳定dsCas9的TMP小分子。在右旋糖酐硫酸钠诱导的结肠炎小鼠模型中,ROS依赖的NanoProCas9系统实现了高效的体内递送和CRISPR-Cas9的靶向激活,通过响应高水平的ROS,起到基因组编辑作用,从而发挥对急性结肠炎小鼠的治疗效果。
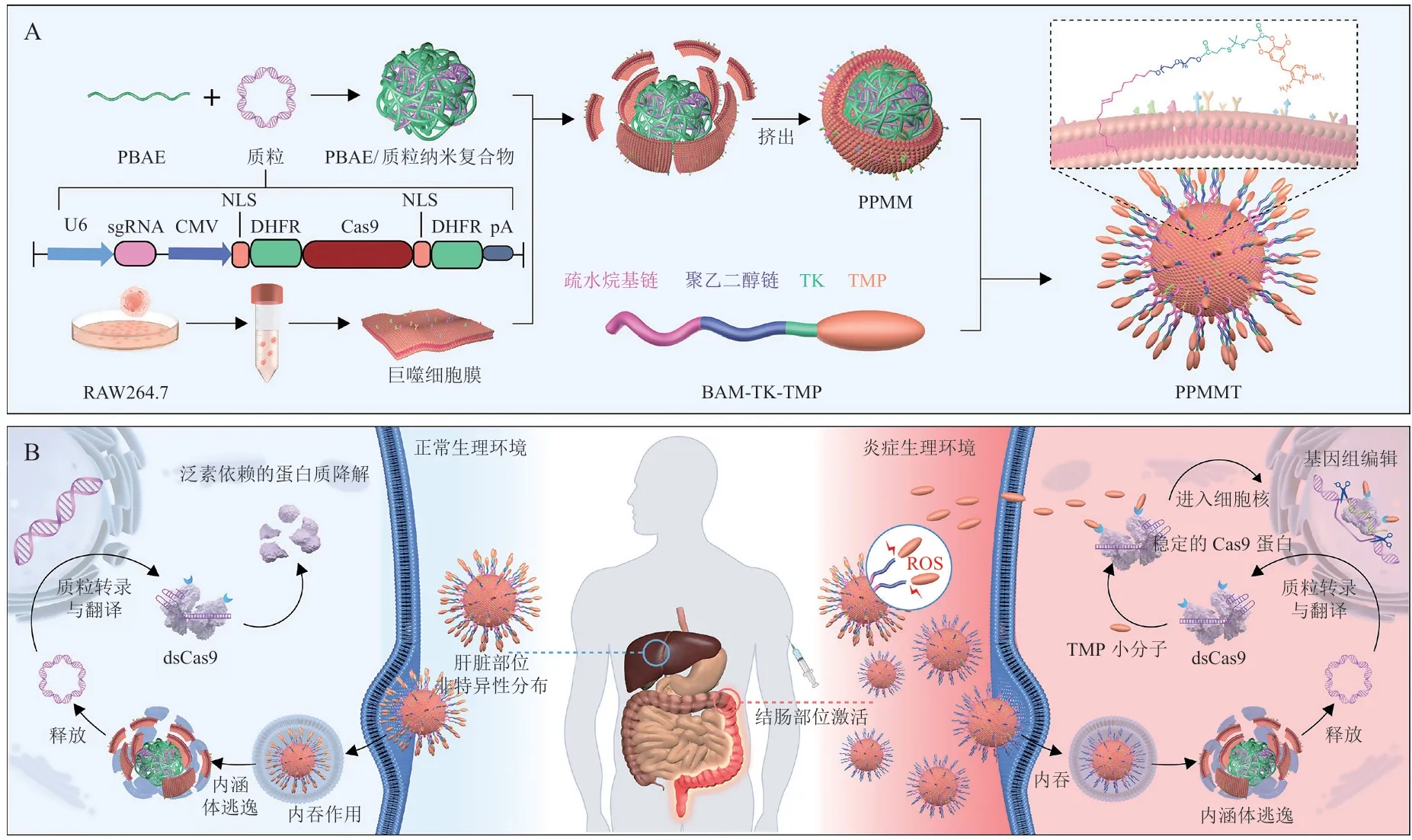
图5 NanoProCas9靶向递送至炎症部位的示意图[47]Figure 5 Schematic diagram of targeted delivery of NanoProCas9 to the site of inflammation
2.3 组织特异性响应的CRISPR-Cas9递送系统
一般来说,靶向给药是基于细胞特异性受体和配体识别,触发靶细胞内吞作用。组织特异性CRISPR-Cas9递送对于基因编辑工具的递送非常重要,目的是对靶点组织或细胞产生编辑作用,减少身体其他部位不需要的基因编辑,减少脱靶。通过设计具有组织特异性启动子的Cas9-质粒或Cas9-mRNA,只有当基因编辑工具被递送到对应的组织才可以启动Cas9的表达从而发挥作用;也可以针对特定的靶组织或细胞设计对应的配体,用于CRISPRCas9的靶向递送,以减少非靶细胞的摄取[48]。Cheng等[49]开发了一种选择性器官靶向性(SORT)脂质纳米颗粒(LNP)递送系统,用于Cas9-mRNA和RNP的靶向递送。通过改变和调控组成纳米粒子的小分子组分的物质的量比例和内部电荷分布,然后加入第5组分SORT分子,就能改变纳米粒子在体内不同组织和器官中的分布。利用此项技术,研究团队已经分别实现了CRISPR-Cas9工具对小鼠肺、肝、肾等器官的靶向递送。体内实验结果显示,该课题组研制的肝脏靶向SORT-LNP可共递送Cas9 mRNA和sgPCSK9,使高胆固醇血症模型小鼠血清中PCSK9蛋白含量降低了90%。
2022年,Xu等[50]报道了可靶向肝脏炎症病灶部位的双重纳米编辑系统。首先,课题组构建了含有肝脏特异性启动子(P3)Cas编辑器(Cas9或者CasRx)的质粒,其中P3启动子是一种合成的肝脏特异性启动子,仅在肝实质细胞中具有活性,可启动下游质粒编辑元件的表达。他们用可以被动靶向到肝脏的聚双硫阳离子高分子材料(PD)包裹上述质粒,通过弱的相互作用压缩质粒,形成稳定的纳米复合物(PD/P)。最后,在PD/P纳米粒子的表面包覆一层仿生巨噬细胞膜,组成了仿生纳米粒子,从而将质粒递送到肝脏炎症病灶部位(见图6)。小鼠通过全身给药后,巨噬细胞膜可以将多聚纳米粒子靶向递送到肝脏炎症病灶,在那里,含有肝特异启动子的质粒启动基因编辑器(Cas9或CasRx)的表达,实现肝脏特异性的基因编辑,干扰靶点基因的表达或下调与肝脏疾病进展相关基因的mRNA表达。尽管有小部分Cas编辑器会分布到非靶点组织或者器官中,但由于P3启动子控制的基因编辑器只在肝脏表达,导致基因编辑器在非靶部位的表达会受到极大的限制,从而最大程度地减少脱靶效应,提高了安全性和编辑的准确性。课题组研制的这种双重特异性CRISPR-Cas9纳米编辑系统能有效地聚集于肝脏部位,通过P3启动子的控制表达,使基因编辑工具只在肝脏部位表达。在3种小鼠疾病模型(肝脏缺血再灌注、急性肝损伤、肝纤维化)中进行的体内实验结果显示,相比于未给药的小鼠,使用本策略有效敲除了肝脏缺血再灌注模型小鼠肝脏的12-脂氧合酶(Alox12)基因(敲除率27.7%)与急性肝损伤模型小鼠的Fas基因(敲除率22.3%),以及使肝纤维化模型小鼠Alox12基因mRNA的表达下调约50%。
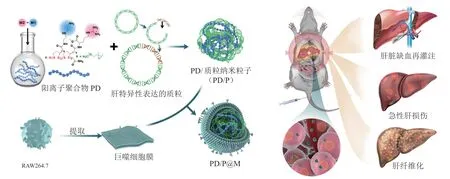
图6 双特异性CRISPR/Cas纳米系统在肝病治疗中的应用[50]Figure 6 Application of dual-specific CRISPR/Cas nanosystem in the treatment of liver diseases
2.4 酶响应的CRISPR-Cas9递送系统
在病理条件下,体内某些蛋白酶的表达会发生改变。基于此,一些研究者设计了特定酶响应的载体,用于药物靶向递送。目前,大多数酶响应的给药系统基本都是利用存在于细胞外的酶,例如基质金属蛋白酶(MMP)和透明质酸酶(HAase)这2种在肿瘤微环境中高表达的酶[51]。MMP在肿瘤微环境、肿瘤信号通路以及肿瘤发生、发展和转移等一系列过程中都发挥着重要作用。肿瘤微环境中高水平的透明质酸(HA)会降低肿瘤组织的弹性,增加间质液体压力,同时与肿瘤的不良预后密切相关[52]。
Yang等[53]设计了一种可编程的层层响应的纳米CRISPR递送系统PUN@Cas-PT,用于靶向调控细胞程序性死亡配体1(PD-L1)和蛋白酪氨酸磷酸酶N2(PTPN2)。PUN@Cas-PT同时包含可对MMP和HAase响应的底物,纳米粒子含有的HA还能延长纳米复合物的血液循环时间,增加纳米粒子在肿瘤部位的滞留和吸收,同时促进了纳米粒子的内涵体逃逸和胞内释放。PUN@Cas-PT通过层层响应的方式递送CRISPR-Cas9工具。首先,在肿瘤微环境中,过表达的MMP会降解PEG外层连接的MMP的底物,暴露出RGD肿瘤靶向肽和HA,促进肿瘤细胞对纳米粒子的识别和摄取。然后,溶酶体中的HAase降解HA,使得纳米粒子电荷发生反转,实现内涵体逃逸。最后,由对ROS敏感的聚乙烯亚胺衍生物和Cas9质粒组成的核心进入细胞后,在肿瘤细胞中高水平ROS作用下,纳米粒子裂解释放Cas9质粒,通过下调PD-L1和PTPN2改善肿瘤组织的免疫抑制微环境,从而增强机体对肿瘤细胞的免疫应答。
3 外源性刺激响应载体
近年来,研究人员尝试通过外部刺激进行CRISPR-Cas9工具的递送,使基因编辑在时间和空间上的精确控制成为了可能。通常能实现外部刺激响应的方法包括光控制、超声波控制和磁场控制等。
3.1 光响应的CRISPR-Cas9递送系统
光是一种无创的、时间和空间的控制开关,可用于基因编辑系统的精确控制递送。在光照射下,某些材料可以产生一些物理或化学的变化,包括光诱导光热剂的光热效应、光敏物质的ROS产生以及上转化材料的光子转换等。这些独特的光响应材料也被应用于CRISPR-Cas9系统的控制递送[54]。
近红外光(NIR,波长范围为800 ~ 2500 nm)由于其安全性良好同时具有较好的组织穿透性(可达3 cm),是一种理想光源。相比之下,紫外光或可见光穿透深度只有不到1 mm。通过光敏材料产生的光热转换在生物医学工程应用中比较常见,比如光热治疗。光热剂(包括有机的吲哚菁绿和聚多巴胺,无机的金纳米粒子和石墨烯等)可以将光能转化为热能,导致局部温度升高。值得一提的是,已有研究表明,光热效应还可以促进纳米粒子的内涵体/溶酶体逃逸,并且可以通过打断热敏化学键实现内容物的释放和激活[55]。2020年,Chen等[56]报道了可被近红外二区的光(NIR-II,1 000 ~ 1 700 nm)激活的CRISPR-Cas9纳米系统(nanoCRISPR)的递送研究(见图7),用于可编程的基因组编辑。作者首先合成了β-环糊精(β-cyclodextrin)-聚乙烯亚胺(PEI)包裹的金纳米棒(APC)材料,然后用这种材料包裹含有特异性热启动子HSP70的Cas9质粒(HSP-Cas9-质粒),形成稳定的纳米复合物nanoCRISPR。阳离子聚合物能够吸附和携带质粒到目标细胞,APC作为光热转化器能将外部的光能转为细胞内的局部热能,启动质粒的表达,因此,APC不仅可以作为质粒递送的载体,还可以作为细胞内的光热转换器来启动Cas9和sgRNA的转录和表达,光信号就可以通过APC转换为热源来调节Cas9表达和活性。在1 064 nm的光照射下,APC在细胞内微环境中迅速产生局域热,诱导热休克因子(HSF)从非活性单体转化为活性三聚体,并能使活性三聚体进入细胞核。然后,核内三聚体与HSP70启动子的热休克元件(HSE)结合,导致转录激活。但是,一旦关闭光照,温度迅速降低,三聚体将从HSE上解离下来并重新转化为单体,从而抑制转录过程。因此,将APC作为光遗传开关调节Cas9的表达,可实现时间和空间上的调控。体内实验结果显示,该递送策略对PLK1基因的敲除效率最高可达28.3%。不仅如此,相比于近红外一区,采用二区的光也具有更深的组织穿透性。体内和体外数据表明,APC介导的光控制Cas9基因的表达能以精确和可编程的方式指导Cas9的基因编辑作用,并显著减少脱靶效应。
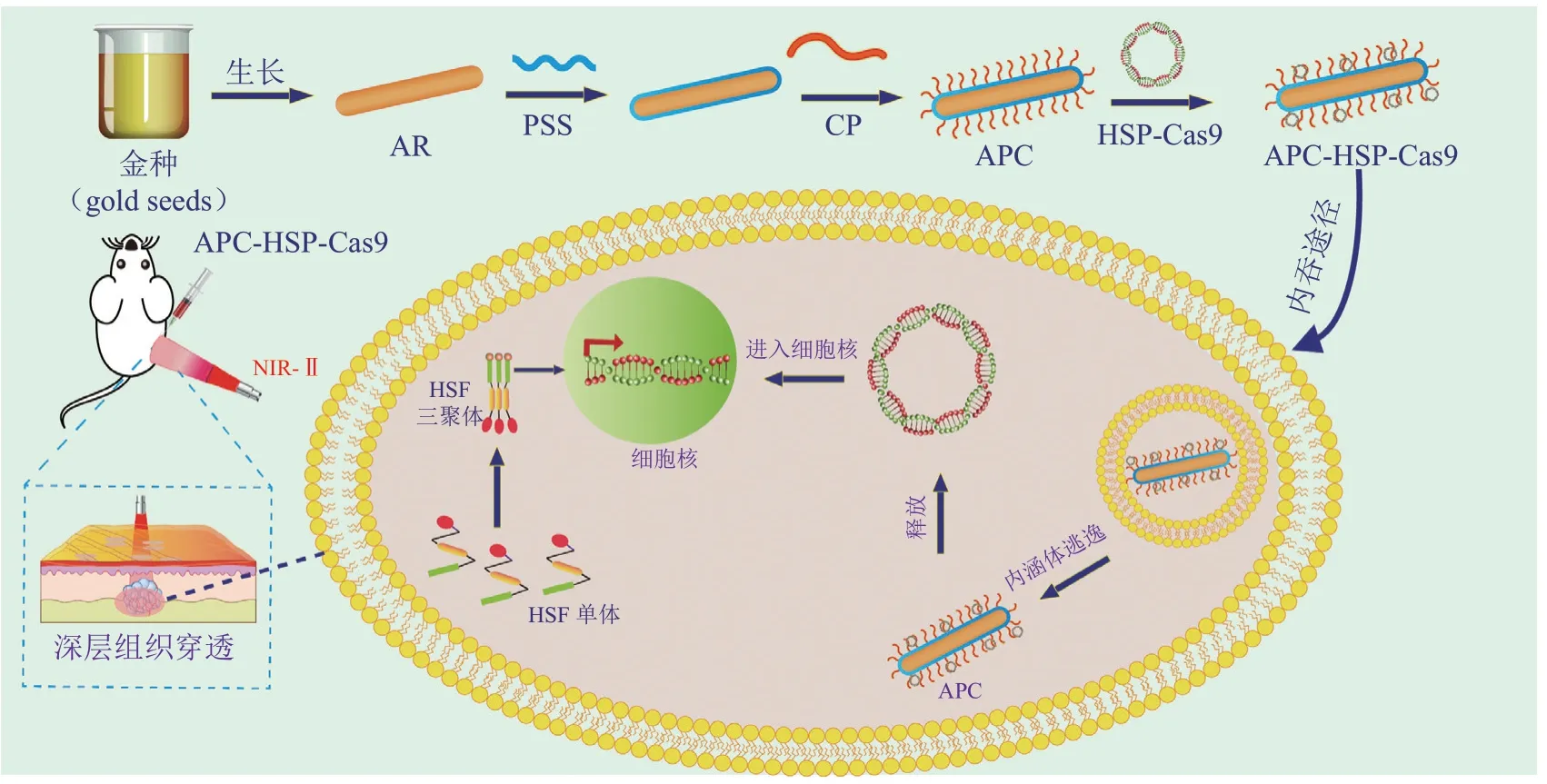
图7 光响应的nanoCRISPR纳米系统在Cas9质粒递送中的应用[56]Figure 7 Application of light-responsive nanoCRISPR nanosystem in Cas9 plasmid delivery
光照除了能诱导光热效应外,在光敏剂(如二氢卟啉)存在下,还能引发ROS[如单线态氧(1O2)]的产生,用于某些疾病的治疗,这种光介导的疗法称为光动力疗法(photodynamic therapy,PDT)。当产生的ROS浓度足够高时,就可以杀死肿瘤细胞或细菌,从而发挥抗肿瘤或抗菌疗效。另一方面,生成的ROS也可以用于诱导内涵体/溶酶体膜破裂或者对ROS敏感的化学键的断裂,使纳米粒子中的药物释放[57]。Deng等[58]开发了一种将Cas9/sgRNA的RNP和二氢卟酚e6(Ce6)共同递送的近红外GSH响应递送系统。该课题组用氮基三乙酸(NTA)-二硫二丙酸酯(SS)-聚乙二醇(PEG)-聚己酸内酯(PCL)共聚物胶束与Ce6通过自组装生成纳米粒子,其中用组氨酸标记的Cas9/sgRNA和用iRGD修饰的NTA-SS-PEG-PCL包覆在纳米粒子表面。Ce6作为光敏剂在671 nm光照下产生1O2,破坏内涵体/溶酶体膜,将纳米粒子释放到胞浆中,然后在细胞质中GSH作用下打断双硫键释放RNP。体内实验表明,该递送策略能通过靶向敲除Nrf2基因显著降低细胞中Nrf2蛋白的表达,具有治疗CNE-2型鼻咽癌的潜在价值。
稀土掺杂的上转化纳米粒子(UCNP)是一种独特的无机纳米粒子,可以将低能量的近红外光转化为高能的可见光或者紫外光,利用这一特点可以在深层次的组织区域中发生光化学反应[59],而直接使用紫外线或可见光是无法实现的。Pan等[60]设计了一种基于UCNP的RNP递送系统。RNP通过一种可以被紫外线切断的光敏分子4-(羟甲基)-3-硝基苯甲酸(ONA)结合到UCNP的表面。在980 nm近红外光照射下,UCNP产生紫外光,降解ONA并释放RNP,实现了近红外光控制的体外和体内基因组编辑,显著延长了A549荷瘤小鼠的生存期。
3.2 小分子响应的CRISPR-Cas9递送系统
最近,通过有机小分子调控Cas9功能的相关研究也为在转录和转录后水平对Cas9活性的调控开辟了新的途径。通常情况下,对Cas9功能的化学控制是利用量身定制的小分子激活或抑制Cas9核酸酶的活性。为了提高CRISPR-Cas9基因组编辑的时空特异性,研究人员尝试了一些化学控制策略来调控Cas9的活性,如dsCas9系统、自剪接内嵌Cas9系统,以及分裂Cas9系统(split-Cas9)的二聚体等[61-62]。与光调控的Cas9功能相反,小分子可以通过器官特异性的方式从给药部位到达深层组织,解决了光调控存在的穿透深度问题,从而实现对Cas9的精准调控。Davis等[63]设计了一种通过小分子特异性调控Cas9活性的基因编辑系统。作者开发了一种新的Cas9核酸酶,在Cas9的特定位置嵌入4-羟基他莫昔芬(4-HT)响应基团。在4-HT存在的情况下,Cas9的编辑活性显著提升。4-HT可以通过渗透作用直接进入细胞,激活Cas9,产生编辑作用。该课题组尝试在Cas9不同位置插入活性内基并进行筛选,最终发现活性内基在Cys574位置时Cas9特异性最高,通过4-HT控制激活的该Cas9的编辑能力是野生型核酸酶的25倍。
3.3 超声波响应的CRISPR-Cas9递送系统
除了光以外,超声波也能用于基因编辑工具的胞内递送。与光相比,超声波通常具有更深层次的组织穿透性,同时还显示出与超声波强度和频率相关的生物效应。高强度的超声波能通过分子共振产生热能,而低频率的超声波能产生空穴效应。此外,将声敏剂暴露于低强度的超声波下可以观察到ROS的产生,这也被称为声动力疗法(sonodynamic therapy)[64]。Pu等[65]利用对ROS敏感的硫醚键将Cas9的RNP连接到集成了声敏剂的纳米金属有机框架(nMOF)上,通过超声波触发nMOF中的声敏剂5,10,15,20-四(4-羧基苯基)卟啉(TCPP),产生ROS打断硫醚键从而释放RNP,有效敲除A549细胞中的MTH1基因。体内实验结果表明,这种通过超声波控制的基因编辑工具递送系统可有效敲除癌基因从而抑制肿瘤生长,提高小鼠的生存率。
3.4 磁场响应的CRISPR-Cas9递送系统
磁场响应的递送系统通常由带有磁性的纳米材料组成。由于磁场具有优异的组织穿透能力,外部磁场可以引导载体向目标区域移动,实现远程控制的靶向给药[66]。具有磁性的材料与CRISPR-Cas9形成纳米粒子,在磁场的引导下可以减少非靶点区域的编辑作用,提高了基因组编辑的精确性。Zhu等[67]报道了一种纳米颗粒-病毒杂合递送系统,这种系统由含有Cas9/sgRNA-质粒的杆状病毒(BV)和磁性氧化铁纳米颗粒(MNP)组成(即MNP-BV)。大体积的BV提高了DNA的装载能力,由于BV在哺乳动物细胞中没有复制能力,所以递送的质粒只能在短时间内起作用,同时,BV也会被体内的免疫系统清除而失活。BV的清除可以被视为基因组编辑活性的关闭,而外部磁场由于可以促进MNPBV复合物沿着磁场进入靶点组织,产生特异性的基因组编辑,可以被视为基因编辑活性的激活。
4 结语与展望
与病毒载体相比,非病毒载体用于CRISPRCas9系统的递送显示出巨大的优势,通过设计不同的非病毒载体,将CRISPR-Cas9的质粒、mRNA或RNP封装于相应的载体中,既提高了生物稳定性又提升了基因组编辑效率,同时在一定程度上降低了脱靶效应。然而,目前的非病毒纳米递送系统仍然有很多需要改进的地方,以实现安全、精准且高效的基因组编辑。正如本文所总结的,智能响应的纳米制剂通过生物体内部信号或者外部刺激实现了基因编辑工具的递送,并能在时间和空间上对CRISPR-Cas9工具予以控制[68]。虽然已经有不少智能材料成功用于质粒、mRNA、RNP的系统递送,但由于CRISPR-Cas9/sgRNA工具的特殊性,设计刺激响应纳米材料时仍需要多加考虑[22]。
虽然近年来智能刺激响应性材料用于CRISPRCas9递送的研究已经取得了一系列卓有成效的结果,但仍然存在着诸多挑战。首先,虽然目前开发出了高效且具有器官或组织靶向能力的CRISPRCas9刺激响应型递送系统,但其精度不高,导致效率低下,仍然不能应用于疾病的临床治疗。未来可以考虑设计具有多种刺激响应性的材料来提高递送的靶向精确性和编辑能力。其次,共递送基因编辑工具和模板DNA用于基因定向修复的递送材料仍然偏少,这可能是共递送提升了刺激响应型系统设计的难度。同时,对于材料的设计要充分考虑到实验结果的可重复性和工业转化应用的可能性。再次,设计智能刺激响应型非病毒递送系统并用于其他最新报道的一些基因编辑工具[如单碱基编辑器(base editors)和先导编辑器(prime editors)等[30]]递送的研究仍然较少。最后,目前报道的智能刺激响应型CRISPR-Cas9递送系统绝大部分仍然局限于临床前研究,要将CRISPR-Cas9介导的基因组编辑技术真正应用于临床治疗,还有很长的路要走。提高靶点基因的编辑效率、提升向靶细胞或靶组织递送的特异性、减少潜在的脱靶效应是当务之急。此外,CRISPR-Cas9工具导致潜在的机体免疫反应也是不可忽视的问题。但可以相信,随着CRISPR-Cas9技术的不断进步和创新以及智能刺激响应型递送技术的不断发展,两者结合将实现更为精准的基因组编辑,并应用于临床,造福广大患者。
