环黄芪醇对端粒功能障碍疾病的药理作用及其机制研究进展
2022-12-23何梦婷车浩洁王惠芳李婷李绿洲王进欣
何梦婷,车浩洁,王惠芳,李婷,李绿洲,王进欣
(中国药科大学药学院,江苏 南京 211198)
中药材黄芪最早被记录在《神农本草经》中,黄芪甲苷Ⅳ(astragaloside IV,AS-IV,1)是黄芪的主要活性成分之一,且作为黄芪的质量控制指标被列入中国和欧洲药典。皂苷元环黄芪醇(cycloastragenol,CAG,2)由AS-IV水解得到,也可从豆科植物蒙古黄芪或膜荚黄芪的干燥根中直接提取分离,CAG和AS-IV具有类似的药理作用[1]。

CAG是目前天然产物中唯一被报道的端粒酶激活剂,能有效对抗端粒缩短,具有抗衰老、抗凋亡、抗纤维化、免疫调节、促进细胞增殖和伤口愈合等药理作用,从而对端粒功能障碍相关疾病具有潜在治疗效果(见图1)[2]。本文重点总结CAG治疗端粒功能障碍相关疾病的药理作用及相关机制研 究进展。

图1 环黄芪醇治疗端粒功能障碍相关疾病的机制Figure 1 Mechanism of cycloastragenol in the treatment of telomere dysfunction related diseases
1 环黄芪醇的相关特性及其活性
1.1 环黄芪醇的理化性质
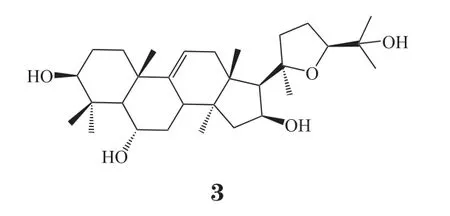
CAG是四环三萜类中的环阿屯烷型,由AS-IV的2个糖苷键断裂得到。相比于AS-IV,CAG的脂溶性增强,更易透过细胞膜而被吸收;但其水溶性较差,口服生物利用度较低[3]。此外,CAG的结构中含有环丙烷基团,其耐酸性较差,在酸性条件下可转化为黄芪醇(astragenol,AG,3)[4]。
1.2 环黄芪醇的药代动力学
2010年,Zhu等[5]使用Caco-2细胞模型和肝微粒体对CAG的肠道吸收和代谢进行了初步研究,结果显示:CAG以被动扩散的运输方式快速通过Caco-2细胞单层,同时检测到CAG的4种不同葡糖苷酸结合物和2种氧化的代谢产物,提示CAG通过肠上皮时可能发生首过代谢;此外,CAG在大鼠和人肝微粒体中孵育30 min后分别仅剩17.4%和8.2%,由此可见,CAG会在体内发生快速代谢。
Ma等[6]通过大鼠经口给药或静脉注射实验对CAG的药代动力学、代谢和排泄进行了进一步的研究,结果表明,以10 mg · kg-1剂量口服给予CAG时,生物利用度仅为25.7%;课题组通过LC-MS方法鉴定CAG代谢产物,仅发现CAG的肝Ⅰ期代谢产物,并无Ⅱ期代谢产物。虽然CAG可以有效通过肠上皮吸收,但由于广泛的肝Ⅰ期代谢,CAG口服生物利用度较低。
1.3 环黄芪醇的生物活性
CAG具有抗衰老、抗炎、抗菌、抗氧化应激、肝脏保护和内皮保护等良好的生物活性[2]。近年来,研究者们通过体内外实验对CAG的药理作用进行了广泛研究。研究发现,CAG对银屑病样皮肤炎症、肺纤维化、腹主动脉瘤、胃癌、非酒精性脂肪肝等疾病具有一定的治疗潜力[7-11]。在心血管系统疾病治疗中,CAG被发现对心力衰竭、心肌纤维化、心肌梗死等有预防和治疗作用[12-14]。此外,CAG对神经与精神类疾病同样有较好的疗效,例如抑郁症、阿尔茨海默病、缺血性脑损伤等[15-17]。
基于多种生物活性,CAG有望成为众多疾病的潜在治疗药物。值得一提的是,CAG与紫杉醇联合给药可以减轻紫杉醇治疗胃癌时产生的毒副作用[10]。联合用药可以在维持药效作用的同时降低毒性,已成为天然产物相关新药研发的新方向。
2 端粒、端粒酶与端粒功能障碍相关疾病
2.1 端粒和端粒酶
1938年,Muller[18]首先发现染色体末端存在的独特结构,并以希腊语“telos”将这段特殊染色体结构命名为“端粒”。1941年,McClintock[19]发现有丝分裂时部分染色体出现丢失,导致染色体复制不完全,从而推断端粒的存在可以保护染色体末端不被降解或融合。随着研究的深入,人们对端粒的认知越来越明确:端粒位于真核生物染色体末端,由一段TTAGGG重复碱基序列和相关蛋白组成[20]。
端粒酶的发现比端粒晚了近50年。1985年,Greider等[21]首次发现了端粒酶,且这种新发现的酶能将DNA重复序列添加到染色体末端,以此来维持端粒长度。端粒酶是一种核糖核蛋白复合物,其催化核心包括TERT和TERC,其中TERT是调节端粒酶活性的关键[22]。
端粒长度随着细胞分裂而不断缩短,当达到临界值时,会诱发DNA损伤信号,导致细胞周期缩短并引发一系列以短端粒为特征的组织衰竭疾病[23-24]。而端粒酶的活性随着年龄的增长出现降低,因此迫切需要研发具有端粒酶激活作用的新型药物[25]。
2.2 端粒功能障碍相关疾病
通常在人类血液淋巴细胞中测量的平均端粒长度被认为是衰老、存活和死亡率的生物标志物[25]。端粒酶活性在延长体细胞寿命方面发挥着重要作用,极短的端粒会引发衰老最终导致细胞死亡[26]。越来越多的研究者对端粒与相关疾病的关联进行了深入研究。
第一种被发现与人类端粒酶突变相关的疾病是先天性角化不良[27]。1999年,Mitchell等[28]在患有罕见的多系统疾病即先天性角化不良的患者中,观察到短端粒。根据这项发现,Vulliamy等[29]进一步提出,先天性角化不良患者的TERC和TERT发生突变。此外,Vulliamy等[30-31]还在再生障碍性贫血和其他骨髓衰竭症患者中发现TERC和TERT突变。
2007年的流行病学调查表明,短端粒长度与心血管疾病及其死亡率密切相关[32]。2011年,Huzen等[33]在内皮细胞和动脉粥样硬化的动脉壁中观察到较短的端粒。2012年,Armanios[34]总结了短端粒诱发的特发性肺纤维化和肝纤维化等多种疾病。2016年,Yeh等[26]发现端粒酶的活性受到抑制时会导致卒中、急性心肌梗死、心力衰竭以及心脏性猝死等心血管疾病。同年,Zhang等[35]发现慢性炎症与端粒缩短相关,而炎症和氧化应激会进一步加速神经退行性疾病以及心血管疾病的进展。
2011年,Saeed等[36]通过实验发现,端粒酶缺失的小鼠会出现成骨细胞分化缺陷,从而促进破骨细胞形成,导致年龄相关的骨量减少,表现出骨质疏松等症状。此外,多项研究发现,端粒缩短与自身免疫性疾病如系统性红斑狼疮、斯耶格伦综合征、肉芽肿病、硬皮病、脊椎关节炎以及类风湿性关节炎有关[37-38]。
端粒和端粒酶对人类来说至关重要,端粒的缺失或端粒酶活性的降低都会引发一系列疾病,开发以端粒酶为靶标的药物对于端粒功能障碍相关疾病的预防或治疗有着重要意义。
3 环黄芪醇激活端粒酶的机制
研究表明,多种信号通路参与了端粒酶活性的调节,例如,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路和磷酸肌醇3-激酶(phosphoinositol 3-kinase,PI3K)/蛋 白 激 酶B(protein kinase B,PKB)级联反应信号通路等[39-41]。PKB通过催化TERT的磷酸化参与端粒酶的激活,可增强组织修复和再生过程[40]。此外,表皮生长因子(epidermal growth factor,EGF)通过激活Ras/细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)激酶(ERK kinase,MEK)/ERK通路和Ets因子,从而上调人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)表达,hTERT通过在端粒DNA 3'端添加短的重复TTAGGG序列来扩展DNA,进而延长端粒长度[41]。
Yung等[42]研究了CAG和参与端粒酶活性调节的信号通路之间的关系,从而明确CAG激活端粒酶的信号转导机制:CAG可以增强人胚胎肾HEK293成纤维细胞中的端粒酶活性,但未在细胞中检测到Ca2+、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、肌醇磷酸(PI3)表达水平和AKT磷酸化的变化,推测CAG对端粒酶作用的影响与经典的第二信使途径或PI3K/AKT信号通路无关;在对MAPK信号通路进行研究时,发现CAG可以诱导ERK磷酸化。
该课题组使用不同抑制剂进行药理实验,进一步探讨CAG诱导ERK磷酸化的机制,结果显示,MEK1/2抑 制 剂PD98059和U0126、EGF受体(EGFR)抑 制 剂AG1478和c-Src抑 制 剂PP2显著减弱了CAG诱导的ERK磷酸化;CAG可使c-Src蛋白的845位酪氨酸发生磷酸化,进而激活EGFR,随后激活Ras/MEK/ERK信号通路;CAG通过诱导ERK磷酸化激活Ets转录因子(Ets2和ER81),进而上调hTERT基因表达,起到激活端粒酶的作用(见图2)[42]。
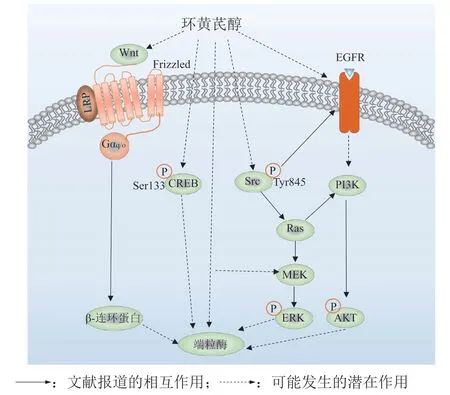
图2 环黄芪醇激活端粒酶的作用机制Figure 2 Mechanism of telomerase activation by cycloastragenol
然而,CAG对各类疾病的潜在作用机制稍有不同,以下将具体介绍CAG在端粒功能障碍相关疾病中激活端粒酶的作用机制以及CAG激活端粒酶产生的药理作用。
4 环黄芪醇在端粒功能障碍相关疾病中的作用 研究
4.1 细胞衰老相关疾病
DNA损伤和端粒磨损的积累会导致组织和器官中衰老细胞的增加,导致细胞功能退化,进而引发一系列与细胞衰老相关的疾病,例如再生障碍性贫血、骨髓增生异常综合征、常染色体显性角化不良症、X连锁型先天性角化不良症等[43-47]。CAG被发现具有抗细胞衰老及抗细胞凋亡的作用[1]。
2013年,Molgora等[48]评估了CAG延缓人T细胞衰老的功能。课题组通过CAG刺激健康供体纯化的T细胞,观察到CAG处理后细胞的端粒酶活性明显增强且T细胞显著增殖,而具有衰老表型的T细胞比例出现下降;且他们通过实验发现,MAPK抑制剂减弱了CAG诱导的端粒酶活性,表明CAG激活端粒酶有可能通过MAPK途径介导。2016年,Dow等[49]评估了CAG对早期年龄相关性黄斑变性的治疗作用。38名患者口服CAG后黄斑功能显著改善;在显微视野观察到CAG通过激活端粒酶,将端粒DNA添加到视网膜色素上皮染色体末端,延缓相应的细胞衰老,起到治疗黄斑变性的作用。2021年,Xu等[50]发现CAG通过激活培养的牛颗粒细胞中的TERT,显著抑制D-半乳糖诱导的细胞衰老和凋亡,且增强β-Klotho蛋白表达,从而抑制与年龄相关的卵母细胞质量下降,具有改善低生育率的潜在作用。
4.2 糖尿病并发症
难治性伤口愈合是糖尿病的并发症,伤口愈合过程涉及炎症反应、凝血、上皮再生、新生血管形成以及伤口闭合,表皮干细胞(epidermal stem cell,EpSC)被认为是伤口愈合的重要组成部分,而端粒功能障碍会导致EpSC增殖和迁移能力下降,从而延迟伤口愈合[51-52]。Cao等[53]于2019年通过人表皮干细胞实验,证实CAG通过上调TERT的表达促进EpSC的增殖和迁移能力,且进一步发现CAG可以通过激活Wnt/β-catenin通路协同TERT表达,最终发挥对糖尿病伤口愈合的促进作用。
糖尿病患者体内的高葡萄糖(high-glucose,HG)浓度可能诱导椎间盘细胞衰老、凋亡和异常的基质代谢[54]。端粒的缩短会恶化椎间盘,研究发现端粒酶是椎间盘退行性变的潜在治疗靶点[55]。2021年,Hong等[56]通过HG诱导的大鼠原发性髓核细胞(nucleus pulposus cell,NPC)应激模型观察了CAG对衰老、凋亡、端粒和端粒酶的调节作用。结果表明,CAG减缓了HG诱导的细胞活力下降趋势,明显提高了NPC的生存能力;研究还发现,CAG通过抑制凋亡相关蛋白和活性氧的生成增强TERT表达,抑制NPC细胞衰老和凋亡,进而在预防HG介导的椎间盘退行性病变方面发挥作用。
4.3 神经退行性疾病
端粒酶在大脑发育中具有重要作用,与神经退行性疾病也有密切关联,端粒长度被作为抑郁症、精神分裂症、阿尔茨海默病以及痴呆症中认知能力下降等的生物标志[57-59]。
新生儿缺氧缺血性脑病造成远期神经系统损害,是新生儿期常见的疾病。Meng等[60]选用氧糖剥夺(oxygen-glucose deprivation,OGD)的大鼠神经干细胞模型,探讨了端粒酶激活对缺血缺氧神经干细胞状态的影响。研究发现,CAG通过上调TERT表达水平,减少活化后的caspase-3和凋亡相关蛋白表达,从而促进细胞增殖、减少细胞死亡且增加神经干细胞数目和存活率,对缺氧缺血后脑损伤具有潜在治疗效果。
Ip等[15]首次证明CAG表现出抗抑郁作用。该课题组发现,CAG通过激活神经元细胞中的CREB信号通路诱导TERT表达,发挥端粒酶激活功能,并且促进细胞存活和调节中枢神经系统中的TERT和bcl2基因表达,提示CAG对抑郁症具有潜在治疗作用。
4.4 特发性肺纤维化
特发性肺纤维化是复发性肺泡损伤后异常的伤口愈合反应,成为肺端粒功能障碍最常见的表现[34,61]。2013年,Le Saux等[62]通过博来霉素诱导的特发性肺纤维化小鼠模型,发现CAG通过激活肺组织中的端粒酶和延长端粒长度,减缓博来霉素损伤肺的肺泡上皮细胞的衰老,从而减弱肺部纤维化表型的发展;端粒酶抑制剂GRN163L可减弱CAG的作用,提示CAG抑制特发性肺纤维化的活性取决于其激活端粒酶的能力。
4.5 骨质疏松症
长期使用糖皮质激素会对骨骼产生严重的副作用,最终诱发骨质疏松症[63]。端粒酶活性降低和端粒缩短会导致骨形成障碍,加速骨细胞受损和骨量减少,而端粒酶的激活可以促进成骨细胞分 化[36,64]。2020年,Wu等[65]通 过 在 地 塞 米 松(dexamethasone,DEX)处 理 的MC3T3-E1细 胞中进行的实验发现,CAG可以上调骨损伤细胞的TERT表达水平,增加碱性磷酸酶活性,从而促进成骨细胞分化,同时可以缓解DEX对成骨细胞分化的抑制作用;此外,课题组发现端粒酶抑制剂TMPyP4会抑制CAG作用的发挥,进一步证明CAG对骨质疏松症的作用靶点是端粒酶。
4.6 慢性HIV-1感染
在慢性HIV-1感染者中,CD8+T淋巴细胞的比例增加,端粒缩短且增殖能力降低[66]。Fauce等[67]研究发现,21名受试者(包括健康受试者和HIV-1感染者)在接受CAG后,其T淋巴细胞中的端粒酶活性显著提高,进而增强了细胞的抗病毒能力,改善了受试者的免疫力,潜在信号通路是MAPK途径;更为重要的是,课题组观察到CAG对端粒酶活性的上调作用是短期且可逆的,不会对细胞活力产生不良影响。
5 结语
CAG是目前天然产物中唯一被报道的端粒酶激活剂,具有抗衰老、抗凋亡、抗纤维化、免疫调节、促进细胞增殖和伤口愈合等良好的药理作用,且疗效温和,安全性较高。CAG通过Src/MEK/ERK等信号通路激活端粒酶,从而对端粒功能障碍相关的疾病具有潜在的治疗作用。然而CAG和端粒酶的结合位点尚未明确,需开展更多的研究。
目前CAG单体来源昂贵,且存在水溶性较差、代谢时间短、口服生物利用度较低等问题,使CAG的临床应用受到限制。因此,基于CAG良好的药理作用与研究价值,迫切需要开展对CAG的化学结构改造以及全合成、生物合成等研究。从未来发展趋势看,CAG有望为衰老、神经退行性疾病、糖尿病并发症、骨质疏松症、特发性肺纤维化等疾病的临床治疗提供有价值的选择。
