mRNA检测技术研究进展
2022-12-23高芙涵宋贞王怀松丁娅
高芙涵,宋贞,王怀松,丁娅
(中国药科大学药学院药物分析系,江苏 南京 210009)
mRNA是一类携带遗传信息且能指导蛋白质合成的单链核糖核酸,满足合成各种蛋白质的所有遗传信息的要求。自1989年起,以mRNA作为新型治疗药物的概念兴起,由mRNA编码出的抗原决定簇不仅数量众多且类型丰富[1-3]。与DNA药物相比,mRNA药物不会插入基因组之中[2-8],可通过正常代谢途径分解,安全性更高[5-6];mRNA药物无需进入细胞核便可发挥其功能,既可以通过体外转录,也能够在患者体内合成所需的治疗性蛋白质,设计和起效更加灵活快速,为个性化治疗开辟了新的道路;mRNA疫苗编码的蛋白可通过激活免疫细胞触发机体免疫反应,可用于癌症免疫治疗、传染病疫苗或蛋白质替代等生物医学和临床医学领域[7]。目前,针对晚期黑色素瘤的mRNA疫苗Ⅰ期临床试验已经完成[8]。此外,新冠肺炎mRNA疫苗的开发与研究也成为近期研究的热点[2]。
除了作为疫苗抗原的表达模板外,mRNA药物还具有多种功能。首先,mRNA可以作为癌症治疗的生物标志物[9]。mRNA直接或间接地影响体内细胞变化,发生相应的基因表达,反映组织的病理状态。因此通过检测细胞内mRNA的变化,可以为早期疾病的检测提供线索和生理依据。其次,mRNA动态检测可作为组织检测的有效补充,且在无症状人群中的检测效率较高,可以对多种疾病进行诊断和评估,有潜力替代直接的组织取样检测[9-10]。
在上述mRNA药物研究过程中,对体内外mRNA水平的准确检测能反映基因的表达情况,时刻监测mRNA药物的疗效和毒性。因此快速、灵敏、特异性强的mRNA检测方法非常重要。常见的mRNA检测方法有:逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)、恒温扩增技术、细胞成像技术等(见图1)。本文根据近期发表的主要相关文献,总结了mRNA检测方法,并评价了各类方法的优缺点。

图1 mRNA的主要检测技术Figure 1 The main mRNA detection techniques
1 mRNA定量检测方法
1.1 逆转录聚合酶链式反应
在mRNA的检测中,最常用的是RT-PCR技术,其操作简单、成本低廉、可快速、有选择性地扩增核酸,是微量DNA或mRNA的高效检测方法,已广泛应用于生物技术、微生物和疾病诊断等领域[11-12]。RT-PCR的检测原理是以mRNA为起始原料,采用逆转录引物与mRNA进行互补杂交,在逆转录酶的作用下生成总的cDNA文库。随后,利用热稳定DNA聚合酶以cDNA作为模板进行PCR扩增(见图2)。在PCR扩增过程中,加入TaqMan探针或荧光染料,可以对产生的荧光信号强度进行实时定量检测,结合计算机软件进行分析,能够计算待测样品的初始浓度[11-13]。例如,在新冠病毒的检测中,利用RT-PCR技术,将病毒的mRNA进行逆转录得到cDNA模板,然后通过荧光定量PCR仪检测出荧光强度到达预先设定阈值所经历的循环数(Ct值),从而反映病毒核酸浓度[12]。
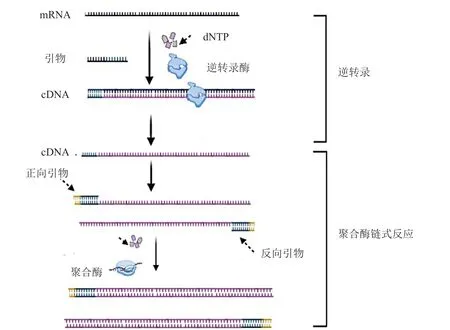
图2 RT-PCR扩增mRNA的示意图Figure 2 Schematic diagram of mRNA amplification by RT-PCR
尽管RT-PCR具有较高的灵敏度和特异性,但其逆转录以及PCR时间较长。此外,由于扩增过程中引物对单碱基的区分能力不足,不能有效分辨mRNA序列中的单碱基变异,容易出现假阳性[12-14]。
Zogchel等[14]将RT-PCR技术进行改进,研究出一种多重实时荧光定量PCR(RT-qPCR),用于检测神经细胞瘤中的mRNA。课题组使用同一内标RNA结合特异性引物对多种mRNA进行定量检测。利用这种改进的RT-qPCR技术可以同时检测7种不同的mRNA,从而减少样品的用量,克服肿瘤的异质性,提高检测的灵敏度,在节省资源和时间的同时也有助于引入临床实践。
1.2 基于恒温扩增的检测
恒温扩增检测技术不需要快速频繁的温度变化,具有高特异性、高灵敏度、对仪器的要求较低等特点。目前常见的基于恒温扩增的mRNA检测方法有LAMP、HCR、RCA和恒温指数扩增反应等。
LAMP相较于PCR具有更高的扩增速率,可在恒温下进行,不需要热循环仪。LAMP反应可分为2个阶段:非循环扩增和循环扩增。其原理较为复杂,基于靶基因的3'和5'端设计了3对特异性引物,包括一对外引物(上游外引物F3和下游外引物B3)、一对环状引物(上游环引物和下游环引物)和一对内引物(上游内引物FIP和下游内引物BIP),3种特异性引物在具有高度链置换活性的DNA(BstDNA)聚合酶的作用下,合成DNA并不断自我循环[15]。在mRNA的检测中,使用逆转录酶合成与靶mRNA互补的cDNA,并通过自退火在其两端形成哑铃结构。非循环扩增阶段,哑铃状的茎环结构作为模板,以F3和B3为引物进行延伸扩增,形成单茎环结构。在BstDNA聚合酶的作用下,单茎环结构与内引物结合转换成具有茎环结构的DNA,从而启动LAMP反应的第2阶段——循环扩增阶段。循环扩增阶段由环引物引导,经过多次循环扩增最终形成长度不一的茎环状DNA[16-17]。
LAMP技术反应时间短,操作简单,Meng等[15]开发了一种新的单细胞逆转录环介导等温扩增(single-cell reverse transcription-loop-mediated isothermal amplification,scRT-LAMP)的工作流程(见图3),将LAMP技术和微流体系统相结合,确保反应物的精准添加,在1 h内可以检测到数百至数千个单细胞中的靶mRNA。
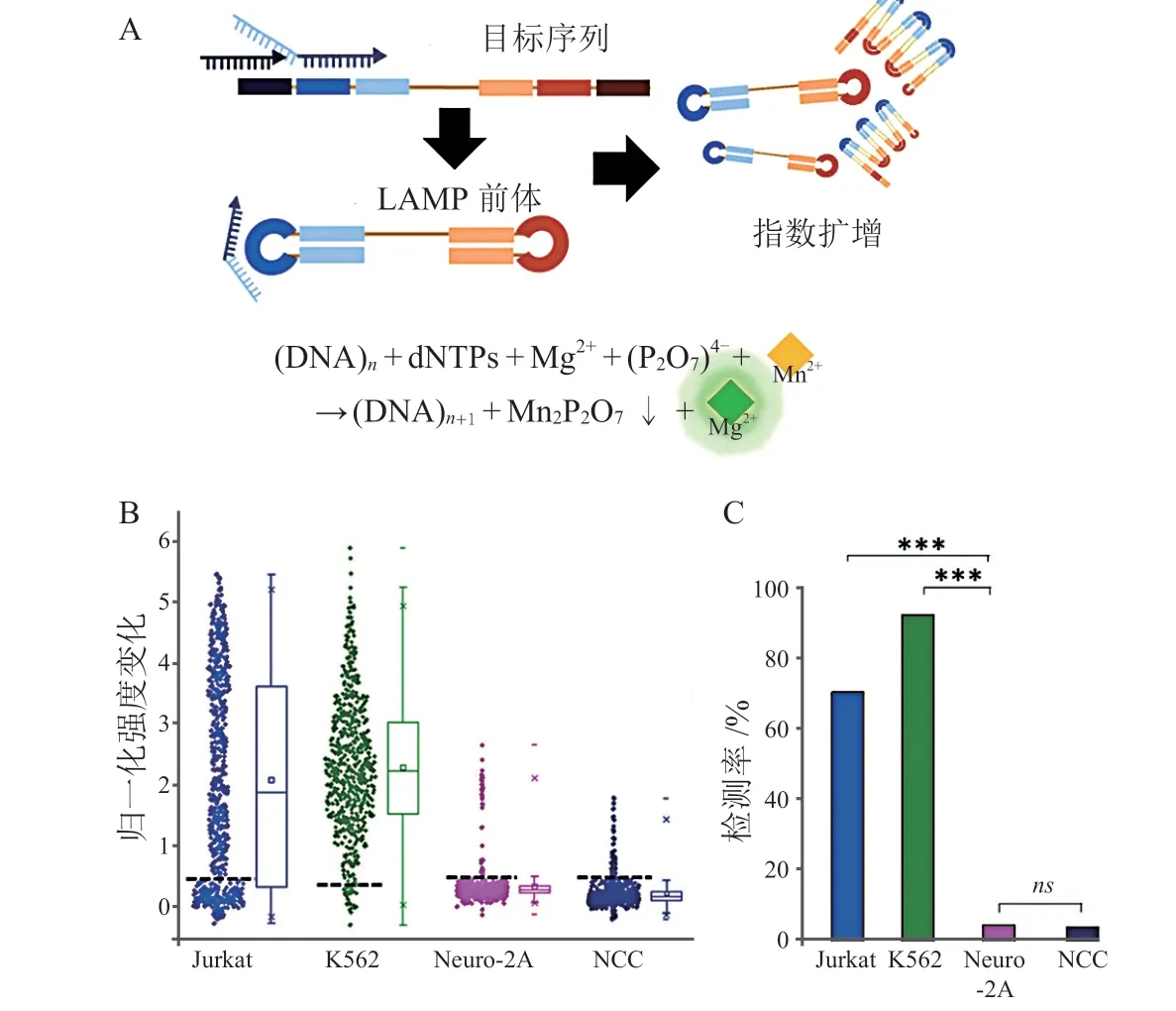
图3 RT-LAMP的反应原理及不同细胞中羟甲基胆素合酶mRNA的检测[15]Figure 3 The reaction principle of RT-LAMP and the detection of hydroxymethylcholine synthase mRNA in different cells
HCR是一种基于自组装的核酸扩增方法,不需要酶的参与,可在温和的条件下进行快速的扩增和检测[18-20]。其原理如下:根据靶标mRNA设计2个自催化的DNA发夹探针H1和H2。H1和H2发夹结构中的黏性末端分别与对方的环互补,并且两者的茎序列一致。由于茎的结构较长,在没有靶标mRNA时,发夹结构中黏性末端的序列较短,不足以打开发夹;而在靶mRNA存在的条件下,mRNA与H1的1-2部分结合,打开H1的发夹结构,H1结构暴露出3-2'部分与H2的3'-2部分结合,使H2的发夹结构打开。H2发夹结构打开暴露出1'-2'部分,与mRNA的序列相同,从而不断地与H1、H2结合形成一条长缺口的双链DNA(见图4)[19]。通过设计具有不同荧光标记的正交发夹放大器,可同时检测不同的mRNA[20]。HCR相较于其他几种恒温扩增反应而言更为简单和快速,不需要逆转录酶的参与,降低了实验成本。
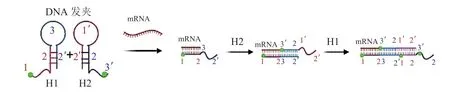
图4 杂交链式反应检测mRNA的原理[19]Figure 4 Principle of hybridization chain reaction for mRNA detection
RCA广泛地应用于DNA、RNA与蛋白质的检测。该技术可实现局部等温扩增,能够原位检测靶分子,提供靶分子定位的相关信息,具有细胞水平原位检测mRNA的优势,可作为单分子荧光原位杂交的替代检测技术[21]。其原理为:以环状DNA作为聚合模板,设计与之互补的短DNA或RNA引物,将引物与环形模板探针杂交,在无5'→3'端外切酶活性的聚合酶的作用下扩增延伸。由于使用的是此种聚合酶,引物会沿着环形模板一直延伸,而先前生成的序列会被替换下来,最终生成一条长的重复序列(见图5)[21-23]。

图5 RCA检测mRNA的原理图[21]Figure 5 Principle of RCA for mRNA detection
然而,RCA的特异性和检测效率并不理想。为此,研究人员将RCA与纳米材料进行结合来提高反应的灵敏度。Liu等[24]引入苯胺修饰的金纳米颗粒(Au-TPP)和“C”形靶向特异性寡核苷酸探针,由于Au-TPP的光热效应,当探针、功能化的金纳米粒子与相同的靶mRNA结合时会启动光热介导的RCA,形成环状结构并进行滚环扩增,从而可以获得更可靠、更具体的mRNA表达信息,并且此过程无需逆转录酶,提高了RCA的特异性,可以更容易应用到常规的病理诊断中。
1.3 Northern印迹杂交
Northern印迹杂交是在Southern印迹杂交的基础上建立的,其特点是简单易行,不需要复杂的仪器设备。该方法通过放射性的P32标记的RNA与寡核苷酸探针杂交,检测固定在尼龙膜上的RNA分子,也可用来检测参与真核细胞基因转录的RNA的数量和大小。根据RNA样本的大小,将总RNA经过变性凝胶电泳进行分离,分离后通过毛细管转移技术、真空印迹技术、TurboBlotter系统的重力转移技术、电印迹技术等将其转移到尼龙膜、硝酸纤维素薄膜或聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。再经紫外照射,将分离的RNA固定到膜上,然后用预杂交液将滤膜上的非特异核酸结合位点阻塞,最后利用DNA探针进行选择性的杂交并利用化学发光技术定量检测(见图6)[25]。Northern印迹杂交与其他方法相比,缺乏扩增步骤,是一种半定量的检测方法,在检测操作过程中需要注意酶污染和mRNA的降解问题,而且灵敏度有限,操作较为繁琐,费时费力。
1.4 纳米通道传感检测
基于纳米通道的新型生物传感器平台具有高度的特异性和灵敏度。阵列纳米通道结构的多孔阳极氧化铝膜具有良好的稳定性,常用于构建纳米通道生物传感器。通过将多孔阳极氧化铝膜与电化学方法相结合,可建立纳米流体平台,用于DNA和胰岛素的无标记检测,相比于单个纳米通道灵敏度可提高多个数量级。Zhao等[26]通过纳米通道-离子通道杂交体固定探针识别靶miRNA。该工作将探针(ssDNA)通过化学偶联的方法固定在离子通道的外表面,再与多孔阳极氧化铝膜表面修饰的3-氨丙基三甲氧基硅烷(APTMS)进行化学偶联。当靶标miRNA存在时,探针能特异性识别靶标,与其杂交形成双链。随后,纳米通道-离子通道杂交体的质量传输性质会随着外表面的电荷密度及有效离子通道尺寸的变化而发生相应的变化,可通过化学电池实时检测(见图7)。
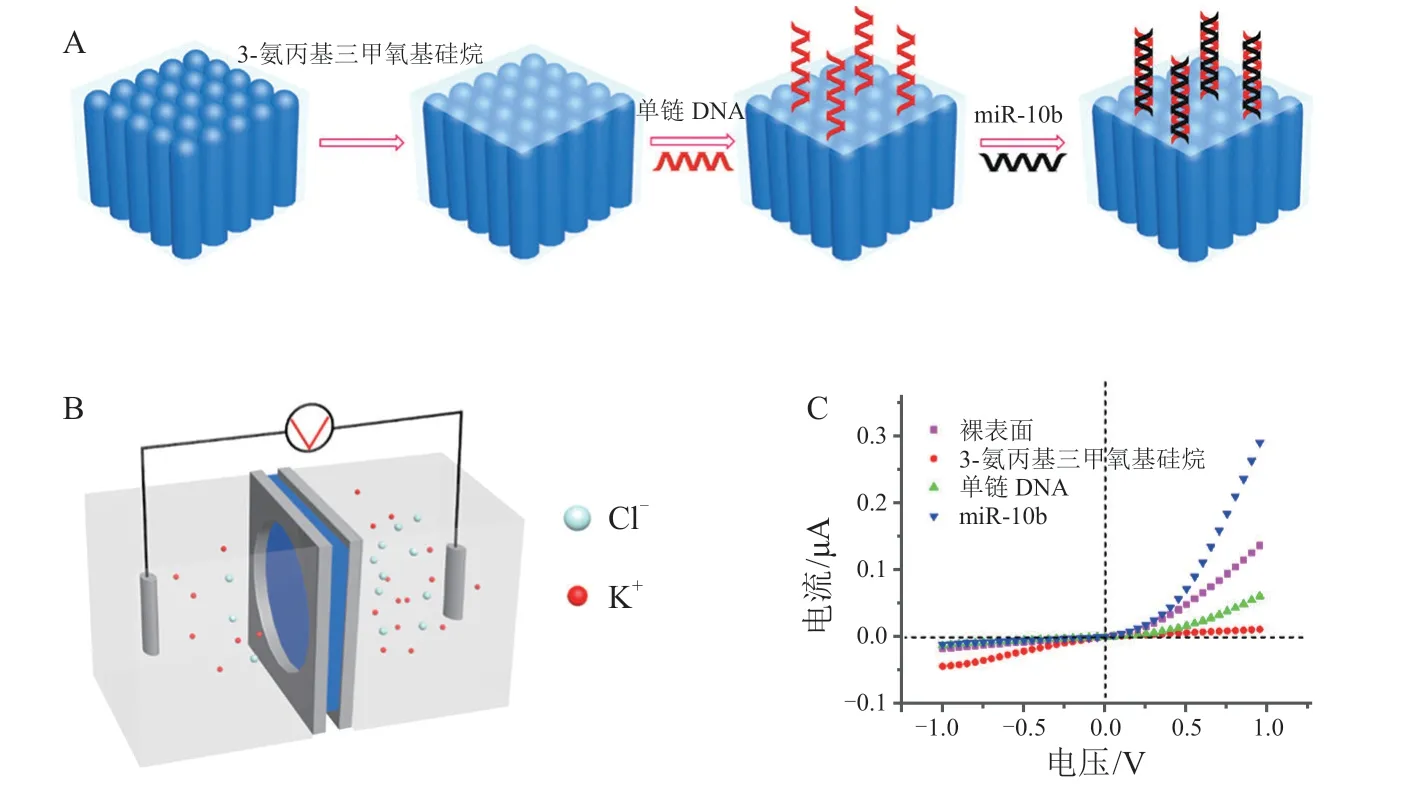
图7 纳米通道-离子通道杂交体的表面修饰及修饰产物在miRNA检测中的应用[26]Figure 7 Surface modification of nanochannel-ion channel hybrids and application of the modified product in miRNA detection
2 mRNA细胞成像技术
2.1 纳米探针
纳米探针和成像技术的发展为动态观察mRNA活性奠定了基础,可用于准确描述基因调控机制,高分辨追踪单个mRNA并呈现mRNA的动态调控过程,更好地探索活细胞mRNA动态特征及其对翻译过程所产生的影响。
纳米探针作为细胞内成像的一种有力工具,包括金纳米簇、银纳米簇(AgNC)、量子点、金纳米颗粒(AuNP)等。其中,AuNP具有各向异性和表面等离子共振光学特性,吸收高、散射面积大,并且具有良好的生物相容性和化学稳定性,被广泛地应用于生物成像领域。例如,AuNP可被一层致密的高度定向的核酸功能化,与被标记的寡核苷酸链杂交形成纳米耀斑。当荧光基团靠近AuNP表面时荧光被淬灭,不需要转染剂的参与即可被摄取入胞,可用于检测细胞内的mRNA。
Lin等[27]设计了一个由AuNP和光响应DNA发夹探针组成的新型纳米耀斑。在没有紫外线照射的情况下,DNA发夹可以保持不被唤醒并且对靶探针无反应;在紫外线照射激活后,发夹结构被破坏并暴露出充当调节链置换反应立足点的黏性末端,使耀斑从AuNP表面释放,引起荧光信号增加。这种光活化的纳米耀斑具有高度的时间可控性,可以在单细胞水平上检测到mRNA。并且,这种方法也可以感知癌细胞中mRNA表达水平的变化。
此外,基于AgNC斯托克斯位移大、生物相容性好、粒径小、易于和生物分子偶联的特性,Tang等[28]建立了一种无酶且无标记的基于DNA发夹和AgNC组装的荧光检测方法。研究人员使用了2个发夹探针,尾部分别包含DNA稳定的银纳米簇捕获序列和富鸟嘌呤序列。当靶mRNA存在时,发夹探针会触发催化发夹组装(catalytic hairpin assembly,CHA)循环反应,并捕获生成的暗色组装产物。AgNC与富含鸟嘌呤的序列紧密连接后,暗色组装物转变为明亮的红色荧光,从而点亮CHA组装物。这种新型的荧光金属纳米材料具有广泛的应用潜力,且催化发夹的组装物不使用外源酶,操作经济、简单、灵敏度高,具有良好的选择性。
2.2 SunTag系统
SunTag系统是一种在活细胞中进行的单分子成像技术,用于单个mRNA分子实时动态翻译过程的成像[29-30]。其原理为将含有dCas9蛋白片段的靶向基因与串联重复的绿色荧光蛋白基因融合表达,以提高荧光信号强度。通过识别包含Vp64的多肽和超折叠GFP蛋白的单抗片段scFV,以实现对单个mRNA进行荧光标记。Vinter等[30]采用SunTag系统,研究了果蝇胚胎mRNA在固定胚胎和活体胚胎中的翻译动态,揭示了果蝇胚胎mRNA翻译在早期胚胎中的时间规律(见图8)。基于抗体的SunTag系统具有非常高的亲和力和识别短肽的能力,但抗体在细胞质中的表达能力不强,且成像技术还需要不断改进。
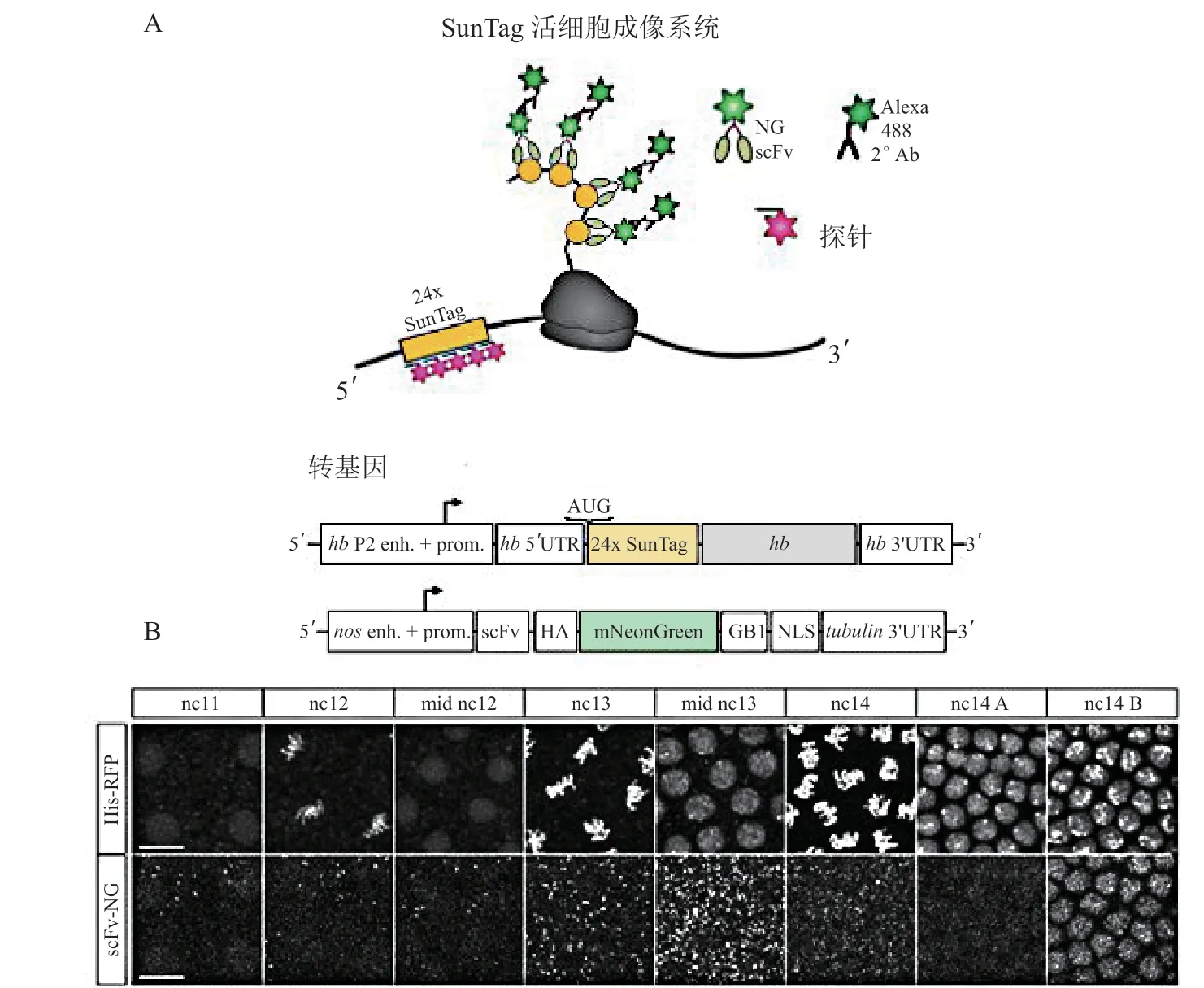
图8 SunTag法在果蝇胚胎mRNA检测中的应用[30]Figure 8 Application of SunTag method in detection of mRNA in drosophila embryos
2.3 原位杂交技术
DNA放大器是一种可响应分子或环境信号执行相应功能的DNA组装体,其生物相容性良好、细胞摄取量高且具有信号放大的能力。因而,该类成像技术可用来检测低丰度的生物标志物(如mRNA)[31-33]。
Meng等[33]将 金 属 有 机 框 架(metal-organic framework,MOF)与熵驱动的DNA放大器结合,形成一种纳米传感器,可响应细胞中的磷酸并释放出DNA放大器。如图9所示,5'端携带荧光基团的R链与3'端被淬灭剂修饰的Q链以及用以连接MOF结构的P链组合成EB结构。在该系统中DNA分子与MOF结构以共价键相连接,在靶mRNA存在时,能够通过响应细胞内无机磷酸盐释放DNA链,触发链置换反应,从而产生一种强烈的荧光。该方法提高了检测的灵敏度和特异性,可同时检测1个以上的mRNA目标,适用于早期癌症检测和生物过程的基因成像[33]。
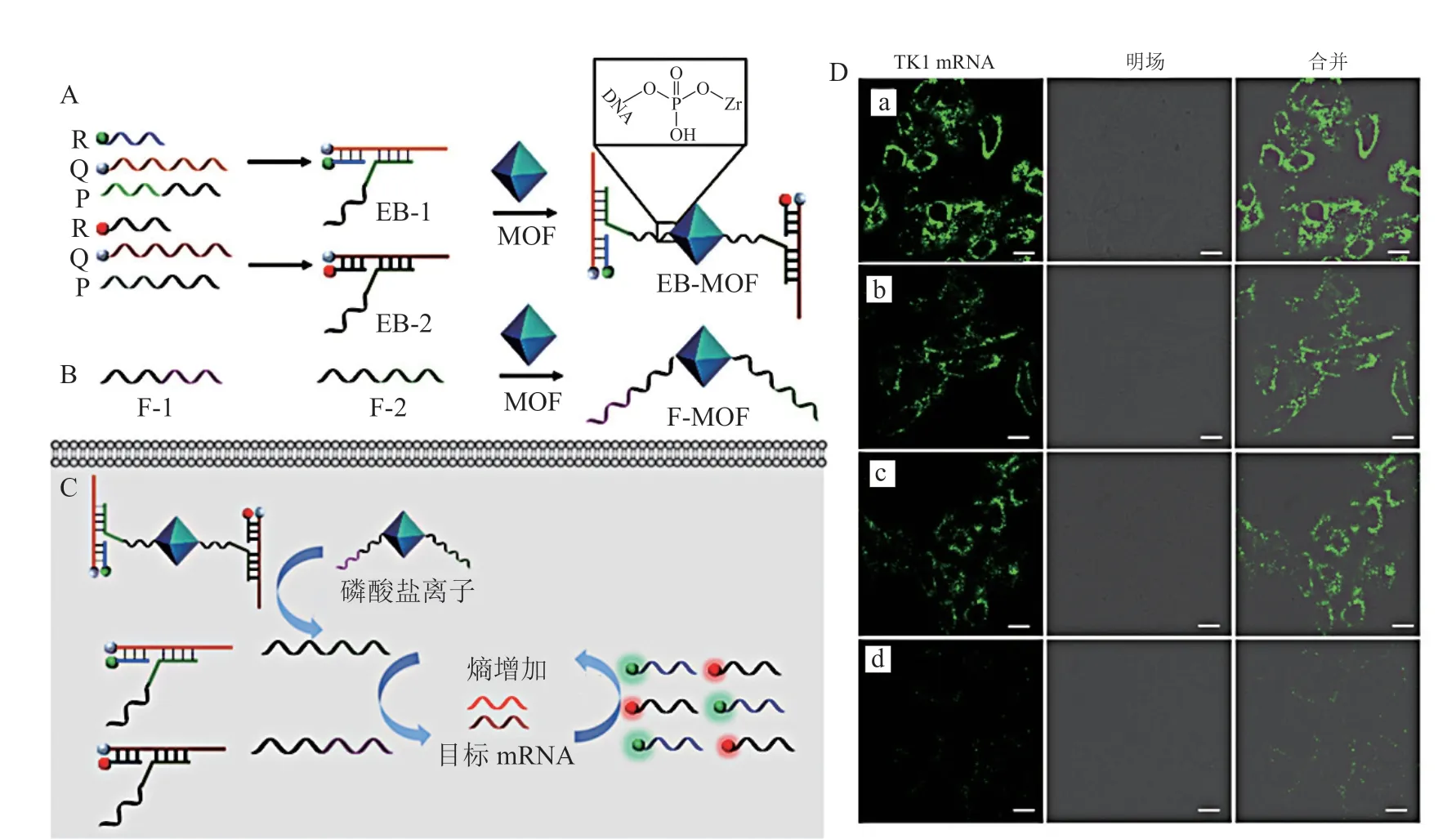
图9 DNA-MOF扩增器的组装及其在mRNA检测中的应用[33]Figure 9 Assembly of DNA-MOF amplifier and its application in mRNA detection
RNAscope是一项用于检测细胞中mRNA的原位杂交技术。该方法允许在各种样品类型中可视化观察单一细胞中的单个mRNA。在肿瘤细胞中mRNA转录效率较低且非功能性的RNA转录物会影响检测的结果。RNAscope技术能够放大特异性信号而不放大噪音信号。其原理如图10所示,基于碱基互补配对原则,利用一个Z型探针结合目标RNA序列,2个相邻的探针上的特异性酶与前置放大器及显色剂结合,从而原位显示mRNA的表达部位和相对丰度。同时,结合非特异性位点的单个探针不会产生完整的信号,且会在杂交过程中被洗脱,从而保证了高度的特异性[34]。
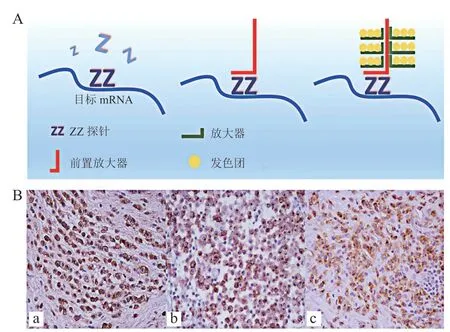
图10 RNAscope在肿瘤细胞mRNA检测中的应用[34]Figure 10 Application of RNAscope in detection of mRNA in tumor cells
单个RNA分子荧光原位杂交(single-molecule RNA fluorescence in situ hybridization,smFISH)是单细胞mRNA空间定位的强有力的工具。其精确测量基因表达的能力可以用来研究基因调控在各种生理过程中的作用,例如细胞迁移和极化。smFISH利用多个荧光标记的DNA探针,同时杂交到长的靶向mRNA片段上,可获得增强的荧光信号。Wadsworth等[35]介绍了一种新的单探针荧光原位杂交法,将单个酵母细胞中的mRNA与Cy5或Cy3染料标记的单个探针进行杂交,使用甲醇固定细胞后,以倾斜的激光进行照射来增加从单个探针捕获荧光所需的信噪比,从而检测单一细胞中的单个mRNA分子,这种方法显著提高了探针的特异性和检测信号强度。
在新冠病毒的检测中,原位杂交技术也提供了一种快速检测的思路。Wang等[36]基于杂交捕获荧光免疫测定(hybrid capture fluorescence immunoassay,HC-FIA)技术,将杂交和免疫荧光分析结合,开发出了一种新型无需扩增的SARS-CoV-2核酸检测平台,能够在1 h内完成对SARS-CoV-2的检测。首先,在反应管中,优化的DNA探针与SARS-CoV-2病毒基因组保守的开放阅读框1ab(ORF1ab)、包膜蛋白(E)和核衣壳(N)区域结合,形成DNARNA复合物,进而被荧光纳米颗粒标记的S9.6抗体捕获;然后,在免疫荧光分析阶段,将S9.6抗体以及抗兔IgG抗体分别喷涂在试纸条的测试线(T)和对照线(C)上,将反应液滴在样品垫上,在毛细管张力的作用下,复合物到达T区,被S9.6抗体捕获,逐渐产生荧光信号。在C区,荧光纳米粒子(fluorescent nanoparticles,FNP)标记的兔IgG被抗兔IgG捕获,也产生荧光;最后,使用荧光阅读器读取T/C荧光值来进行定量分析。相比当前常用的qPCR技术,这种新型技术的检测限能达到每毫升500拷贝,且已被开发成用于诊断SARS-CoV-2的检测试剂盒。
3 结语与展望
mRNA在基因调控和遗传信息的表达方面起着重要的作用。一方面,基于中心法则,mRNA将细胞核内DNA的遗传信息按照碱基互补配对原则抄录并传送到细胞质的核糖体中,是蛋白质合成的模板,决定着蛋白质合成的氨基酸排列顺序。另一方面,mRNA是细胞动态遗传表达变化的理想指标,可作为生物标志物应用于疾病的诊断、检测和治疗。因此研究mRNA生物标志物检测方法具有重大意义。
本文对常见的几种mRNA的分析方法进行了综述,主要包括各种核酸扩增技术、mRNA成像技术、印迹杂交技术和原位杂交成像技术等。核酸扩增技术如RT-PCR、RCA等线性范围宽,灵敏度极高,为RNA生物标志物的简便、高灵敏度体外检测提供了新的平台;基因测序等高通量的分析方法适合于大量样本的快速检测,但同时也会提高实验的成本;mRNA分子成像技术主要指荧光成像,步骤简单、快速且不需要昂贵的仪器,能够实时高分辨地追踪mRNA的动态过程。
尽管目前已开发出很多mRNA的检测方法,但是针对提高检测方法的适用性、特异性以及灵敏度等问题还有待进一步探索。1)虽然核酸扩增技术灵敏度高,但其特异性还有待进一步提高。而且,核酸扩增技术对引物的设计要求较高,引物二聚体等因素会对检测结果造成影响。2)mRNA具有不稳定性、易降解,在检测过程中需要严格控制温度和pH条件并保持无核酸酶的环境。3)常见的mRNA检测方法大多需要专业的设备仪器,因此低成本的即时化检测试剂盒和设备开发还面临挑战。4)应更加关注mRNA的动力学特征以及翻译模板与翻译产物之间相互联系的机制,深入探究活细胞mRNA的动态特征及其对翻译的影响。
