ZnO-PDMS超双疏薄膜对腐败希瓦氏菌生物被膜的抑制机制
2022-12-15黄海涛魏旭青杨峻乙黄艳茹王莉丽励建荣
黄海涛, 魏旭青,2, 杨峻乙, 黄艳茹, 王莉丽, 杨 旭,励建荣, 孙 彤,*
(1.渤海大学 食品科学与工程学院/海洋食品精深加工关键技术省部共建协同创新中心/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心, 辽宁 锦州 121013; 2.成都先导药物开发股份有限公司, 四川 成都 610000;3.民泽龙羊峡生态水殖有限公司, 青海 海南州 811800)
微生物污染是影响水产品加工运输过程中食品安全的重要因素,会影响食品品质,造成经济损失,甚至危及人体健康[1]。腐败希瓦氏菌(Shewanellaputrefaciens)属于革兰氏阴性菌,能在低温条件下良好生长,代谢水产品的肌肉蛋白,释放臭味气体,并且导致水产品发黏,是水产品优势腐败菌之一[2]。
生物被膜是微生物应对逆性环境衍生出的针对性生长状态,具有较强的机械强度和屏障性能,能够使细菌获得良好的抗清洗能力和耐药性[3-4]。生物被膜的形成受细菌生长环境及细菌接触材料表面性质的影响。传统抗菌剂或者抗生素对已经在材料表面定植的生物被膜的抑制效率较低,目前新兴的无机纳米材料(碳纳米材料、金属及金属氧化物等)、水溶性大分子物质(肽、酶和合成聚合物等)均能凭借其独特的性质杀灭细菌[5-6]。Rago等[7]研究发现,ZnO纳米粒子能够造成细菌细胞壁损伤;Sin等[8]通过计算胞外多糖(exopolysacchari-des, EPS)的含量变化证明了ZnO-羟基磷灰石具有优异的抗生物被膜性能。超双疏材料具有较低的表面能并能形成三相界面,拥有良好的疏水疏油和抑制生物被膜黏附性能,具有成为抗生物被膜新材料的潜能[9],若能防止细菌黏附的同时杀灭细菌,将是构建抗菌材料的绝佳选择[10-11]。纳米ZnO是安全无毒的金属氧化物,具有持久的抗菌性能和生物相容性,已被广泛应用于食品行业[12]。相较于昂贵的氟硅烷修饰的超疏水材料,二甲基硅氧烷(PDMS)具有无氟环保、价格低廉、制备方法简单等特点,是构建超双疏表面的良好选择[13]。目前同时利用ZnO纳米颗粒构建超双疏表面和抗菌表面的研究较少。
为充分利用微纳米粒子构建薄膜的超双疏微观结构,并借助ZnO的抗菌性能增强薄膜的抗生物被膜性能,本研究拟采用流延法制备聚PDMS薄膜及超双疏ZnO-PDMS薄膜,分析薄膜的理化性能,进而揭示ZnO-PDMS薄膜抗水产品腐败希瓦氏菌生物被膜的机理,旨在为食品储运过程中微生物污染的防治提供技术支持。
1 材料与方法
1.1 材料与试剂
无水醋酸锌(CP,质量分数99.0%~101.0%),广州市左克生物科技发展有限公司;PDMS(CAS:68083-19-2),天津希恩思奥普德科技有限公司;正己烷(AR,体积分数97%),上海麦克林生化科技有限公司;腐败希瓦氏菌(ATCC8071),美国微生物菌种保藏中心;PVC板,0.2 mm,东莞市巨邦塑料材料有限公司;XTT溶液、考马斯亮蓝G250、超微量Na+/K+-ATP酶测定试剂盒,北京华夏远洋科技有限公司;碱性磷酸酶(AKP/ALP)测试盒,北京润泽康生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Rigaku Ultima Ⅳ型X射线粉末衍射仪,日本理学公司;Scimitar 2000 Near型傅里叶变换红外光谱仪,美国安捷伦公司;S- 4800型场发射扫描电子显微镜,日本日立公司;Jem- 2100F型场发射透射电子显微镜,日本电子株式会社;OCA15EC型接触角测量仪,北京东方德菲有限公司;SW- CJ- 2FD型洁净工作台,苏净集团苏州安泰空气技术有限公司;Victor X3型酶标仪,上海珀金埃尔默仪器有限公司;TCP- SP5Ⅱ型激光共聚焦显微镜(CLSM),德国徕卡仪器有限公司。
1.3 实验方法
1.3.1超双疏ZnO-PDMS薄膜的制备
参考魏旭青[14]的方法制备了棒状、绒球状和花状的ZnO微纳米粒子。参考Li等[15]的方法改性ZnO微纳米粒子,制备超双疏ZnO微纳米粒子。
配制体积比为1∶10的PDMS-正己烷溶液,分别称取0.100 0 g不同微观形貌的ZnO超双疏微纳米粒子加入至2.0 mL PDMS-正己烷溶液中,磁力搅拌18 min混匀。将混匀的溶液流延在超声去油后的PVC板上,于60 ℃烘干,得到ZnO-PDMS超双疏薄膜。采用相同方法,制备不加ZnO超双疏粉末的PDMS薄膜。
1.3.2ZnO微纳米粒子及ZnO-PDMS薄膜的表征和表面润湿性测定
采用X射线粉末衍射仪对不同形貌的ZnO微纳米粒子及ZnO-PDMS薄膜进行表征,进行X射线衍射(XRD)分析。测试条件为40 kV、50 mA,靶材CuKα,步宽0.02°,扫描范围20°~80°。对ZnO微纳米粒子进行KBr压片处理,测定其傅里叶变换红外光谱(FTIR),测试条件为步宽2 cm-1,波长范围4 000~400 cm-1。采用场发射扫描电子显微镜(SEM)观察PDMS薄膜和ZnO-PDMS薄膜表面的微观形貌;采用SEM、透射电子显微镜(TEM)、高分辨率透射电镜(HRTEM)观察ZnO微纳米粒子的微观形貌,并进行选区电子衍射(SAED)和电子能谱(EDX)分析。以去离子水和丙三醇为疏水疏油测定介质,用接触角测量仪测定PDMS薄膜和ZnO-PDMS薄膜表面的水和油静态接触角,接触角测定结果用平均值±标准偏差表示。
1.3.3薄膜表面腐败希瓦氏菌黏附性能测定
1.3.3.1 生物被膜的培养
将保藏的腐败希瓦氏菌菌悬液活化处理至OD595≈0.5,配置0.000 3 g/mL的氯化钠碱性蛋白胨水,将菌悬液稀释200倍。将3 mL稀释后的菌悬液和PDMS薄膜或ZnO-PDMS薄膜(0.5 cm×0.5 cm)置于无菌离心管中,28 ℃培养一定时间后得生物被膜。
1.3.3.2 薄膜表面被膜菌生长曲线的测定
采用Saral等[16]的方法测定薄膜表面被膜菌生长曲线。取对应培养时间的薄膜置于无菌离心管中,注入1 mL无菌磷酸盐PBS缓冲溶液(0.1 mol/L,pH=7.4)摇晃清洗3次,洗去表面浮游菌,取出薄膜置于10 mL灭菌PBS中,室温超声(53 kHz,224 W)10 min。将超声后的菌悬液梯度稀释并涂布于培养基,置于培养箱(28 ℃,24 h)培养,根据菌落数量绘制生长曲线。
1.3.3.3 生物被膜微观形貌观察
采用Bumunang等[17]的方法观察生物被膜的微观形貌。取对应培养时间的薄膜置于无菌离心管中,用 1 mL 0.008 5 g/mL的无菌生理盐水SPSS清洗3次,用体积分数2.5%戊二醛固定液溶液于4 ℃固定4 h。固定后的薄膜用PBS溶液清洗3次,依次于体积分数30%、50%、70%、80%、90%乙醇水溶液中浸泡30 min,最后用无水乙醇浸渍脱水2次,每次脱水30 min,取出后置于无菌超净台内风干。经喷金处理后,使用SEM观察生物被膜的表面微观形貌。
1.3.4ZnO-PDMS薄膜对腐败希瓦氏菌生物被膜抑制机制的研究
1.3.4.1 生物被膜生物被膜及被膜菌状态观察
采用Dai等[18]的方法用激光共聚焦显微镜观察生物被膜,取对应培养时间的薄膜置于无菌离心管中,用1 mL无菌PBS溶液(0.1 mol/L,pH=7.4)清洗3次,配制10 μL含有质量分数2%的碘化丙啶和质量分数0.2%的吖啶橙混合PBS溶液,将清洗后的薄膜置入混合溶液避光染色15 min,而后用灭菌PBS清洗3次,用吸水纸吸干多余水分,滴加10 μL抗荧光猝灭封片剂,置于4 ℃下避光保存。使用激光共聚焦显微镜观察生物被膜形成及活菌和死菌的分布情况。
1.3.4.2 被膜菌代谢活性测定
采用XTT比色法测定生物被膜中被膜菌的代谢活性变化[20],取对应培养时间的薄膜置于无菌离心管中,用1 mL无菌PBS溶液(0.1 mol/L,pH=7.4)清洗3次,分别加入100 μL LB营养肉汤和50 μL XTT试剂,放入恒温培养箱(28 ℃,24 h)培养后用酶标仪测OD490值。
1.3.4.3 生物被膜中胞外多糖测定
采用硫酸- 蒽酮法测定生物被膜中胞外多糖含量[19],配制0.2 mg/mL 葡萄糖标准溶液和0.02 g/mL的蒽酮溶液。分别吸取葡萄糖标准溶液(0、50、100、200、300、400、500 μL)于10 mL比色管中,加入无菌水至1.0 mL,然后依次加入250 μL蒽酮溶液和2.5 mL 940 mL/L的浓硫酸,混匀后置于沸水浴中恒温处理6 min,冷却至室温,测定600 nm波长下的吸光度,以标准溶液质量浓度(mg/mL)为横坐标,吸光度为纵坐标绘制标准曲线。取对应培养时间的薄膜置于无菌离心管中,用1 mL无菌PBS溶液(0.1 mol/L,pH=7.4)冲洗3次后,置入10 mL灭菌PBS中室温超声处理(53 kHz,224 W)10 min,取1.0 mL液体相同方法测量吸光度,根据标准曲线计算生物被膜中胞外多糖的含量。
1.3.4.4 生物被膜中总蛋白质测定
采用考马斯亮蓝比色法测定生物被膜中蛋白质含量的变化[21],将标准蛋白质溶液(50 mg/mL,1.25、2.50、3.75、5.00、6.25、7.50 μL)加入到96孔板中,用0.008 5 g/mL PBS补充至10 μL,分别加入200 μL考马斯亮蓝染色液,混匀后于室温静置5 min,用酶标仪测定OD595,并绘制标准曲线。取对应培养时间的薄膜置于无菌离心管中,用1 mL无菌PBS溶液(0.1 mol/L,pH=7.4)清洗3次,室温超声处理(53 kHz,224 W)10 min后加入20 μL细胞裂解液,混匀后4 ℃静置20 min,于冰浴中超声(53 kHz,224 W)40 min,9 500 r/min、4 ℃离心15 min后备用。吸取离心后上清液5 μL至96孔板中,加5 μL生理盐水,测定OD595,根据标准曲线计算生物被膜中总蛋白质含量。
1.3.4.5 ATP和AKP酶活性测定
生物被膜菌中ATP和AKP酶活性的变化采用ATP和AKP酶活性试剂盒测定,依照试剂盒方法要求配制试剂并进行实验。
1.4 数据处理
采用SPSS 21.0和Origin 9.1软件进行数据处理和绘图,采用沃勒- 邓肯比较法进行数据分析。所有实验均重复3次,P<0.05表示有显著差异。
2 结果与分析
2.1 ZnO微纳米粒子的化学表征
ZnO改性前后微纳米粒子的XRD和FTIR分析见图1。由图1(a)可知,在2θ=31.78°、34.42°、36.24°、47.52°、56.60°、62.79°、67.91°、69.06°处出现的衍射峰与ZnO[PDF(36-1451)]的(100)、(002)、(101)、(102)、(110)、(103)、(112)和(201)晶面相对应,即制备的ZnO微纳米粒子均为六方纤锌矿型ZnO。各衍射峰峰型尖锐,表明样品晶粒尺寸较大,结晶状态良好。经超双疏改性后,各样品中的衍射峰仍然对应于六方纤锌矿型ZnO晶体的衍射峰,且衍射峰强度与位置均未改变。改性后样品在2θ=22.82°、30.02°、31.02°、32.60°、46.45°处出现了衍射峰且各衍射峰强度不同,分别对应于单斜晶体SiO2[PDF(51-1377)]的(113)、(-253)、(- 413)、(204)和(175)晶面,说明在ZnO微纳米粒子超双疏改性后,PDMS中的Si以单斜晶体SiO2的形式附着到了ZnO微纳米粒子表面。改性后棒状ZnO微纳米粒子在2θ=30.02°、31.02°、32.60°处出现了强衍射峰,说明SiO2在(-253)、(- 413)、(204)晶面处优势生长;改性后绒球状ZnO微纳米粒子在2θ=22.82°、32.60°、46.45°处出现了强衍射峰,说明SiO2在(113)、(204)和(175)晶面处优势生长;改性后花状ZnO微纳米粒子在2θ=32.60°处出现了强衍射峰,说明SiO2仅在(204)晶面处优势生长。结果表明:改性剂与ZnO微纳米粒子作用并在其表面形成了单斜晶体SiO2,但各样品晶体的优势生长方向有很大差异,这可能是由于不同形状ZnO微纳米粒子有不同优势生长晶面,使ZnO晶体的表面经改性剂附着生长形成的晶体产生了差异。
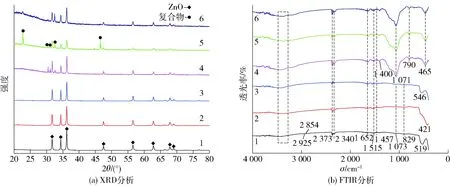
1、2、3分别为改性前棒状、绒球状、花状ZnO微纳米粒子,4、5、6分别为改性后棒状、绒球状、花状ZnO微纳米粒子。

ZnO微纳米粒子的微观形貌及晶格结构见 图2。由图2可知,棒状ZnO微纳米粒子长约 1.7 μm,宽约0.3 μm;绒球状ZnO微纳米粒子是由厚20~30 nm的纳米片交错组成的直径2~3 μm的微球;花状ZnO微纳米粒子是由直径约130 nm、长0.8~1.0 μm的纳米棒组成的直径约2 μm的微球。不同形貌的ZnO微纳米粒子均形貌均一,分散性良好,无团聚。由HRTEM分析可见,不同微观形貌ZnO微纳米粒子具有相同的相邻平面之间的晶格条纹间距,均为0.52 nm,与ZnO(0001)的晶面间距对应。SAED分析结果表明:各形状的ZnO微纳米粒子均具有单一的六方纤锌矿晶体结构,与XRD、HRTEM的表征结果一致。EDX分析结果表明:粒子的组成元素为O元素和Zn元素,无杂质,且Zn元素略多于O元素,这可能是因为ZnO晶格中存在Zn填位和O空位等缺陷[31]。
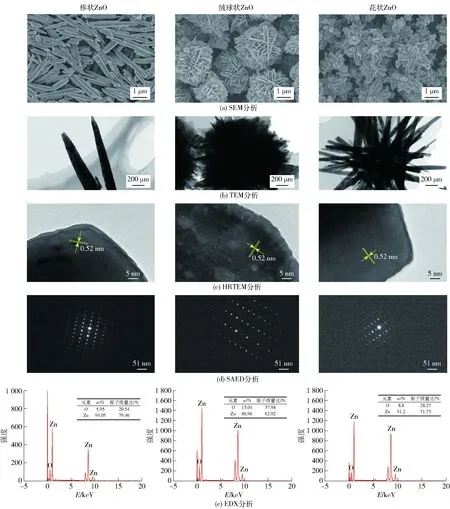
图2 ZnO微纳米粒子的微观形貌及晶格结构
2.2 PDMS薄膜及ZnO-PDMS薄膜表面湿润性表征
薄膜表面湿润性的分析和疏水疏油性能模式分析见图3。由图3(a)可见,ZnO微纳米粒子的特征衍射峰未在ZnO-PDMS薄膜的XRD谱中出现,可能是因为制备时PDMS包裹在ZnO微纳米粒子表面,只有少量ZnO能暴露在薄膜表面导致未能被检出。在2θ=22.06°、24.46°、27.26°、28.42°存在强峰,可能是因为PDMS包裹在微纳米粒子表面后经过干燥固化后形成晶体产生了衍射峰。3个样品的衍射峰大小位置无差异,表明PDMS膜晶体的形成不受ZnO微纳米粒子微观结构的影响。
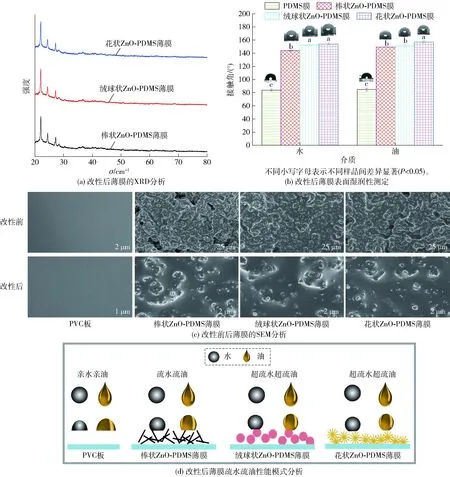
图3 ZnO-PDMS薄膜表面湿润性分析和微观形貌分析
根据材料表面的水接触角和油接触角可判断其亲水亲油性能,通常水和油接触角均大于150°为超双疏材料,均小于90°为亲水亲油材料[32]。由图3(b)薄膜润湿性能检测结果可知,PDMS薄膜对水和油的接触角分别为83.9°和84.9°,具有亲水亲油性;棒状ZnO-PDMS薄膜的水接触角和油接触角的分别为144.0°和149.4°,均小于150°,为疏水疏油薄膜;绒球状和花状ZnO-PDMS薄膜对水和油的接触角均高于150°,两者均具有超双疏性能。
由图3(c)可知,PDMS薄膜表面光滑,无褶皱。加入ZnO微纳米粒子后,PDMS薄膜表面出现不同程度的孔洞和凸起。棒状ZnO-PDMS薄膜表面形成的凸起大小不均,孔洞最多;绒球状ZnO-PDMS薄膜次之;花状ZnO-PDMS薄膜表面的孔洞和凸起分布相对均匀,均形成了超双疏薄膜的粗糙微纳米结构。ZnO-PDMS薄膜表面的不规则凸起能够包含空气形成固- 气- 固的空间结构,当液滴接触到薄膜表面时,能够形成一个立体三相接触结构,薄膜与液滴的接触面积明显减小[33]。此外,由于ZnO微纳米粒子均匀分散于薄膜表面,使成功接枝到ZnO微纳米粒子表面的改性剂非极性基团均匀分布于薄膜表面,进而使ZnO-PDMS薄膜的疏油性能增强,表现出良好的双疏性能。由于各涂膜采用的改性ZnO微纳米粒子形貌不同,其疏水疏油性能略有差异。
2.3 PDMS薄膜及ZnO-PDMS薄膜对腐败希瓦氏菌生物被膜的抑制性能分析
PDMS薄膜和ZnO-PDMS薄膜表面生物被膜菌生长曲线见图4。由图4可知,随着培养时间的延长,各样品薄膜表面被膜菌数量均呈现先增加后减少的趋势。在0~2 h,细菌通过鞭毛接触薄膜表面,进入初始可逆黏附阶段;在2~8 h,细菌数量继续增加并通过分泌黏附蛋白紧密粘连在薄膜表面,此时生物被膜由可逆黏附阶段转化为不可逆黏附阶段;在8~12 h,薄膜表面腐败菌稳定增长,表明黏附的腐败希瓦氏菌开始形成微菌落,生物被膜进入生长期;在12~24 h,薄膜表面被膜菌快速繁殖,细菌总量迅速增加,生物被膜进入成熟期;在24~48 h,各样品被膜菌总量均减少,生物被膜进入衰退期。由于对照组PDMS薄膜中无任何抗菌成分,且表面亲水亲油,能够充分被菌悬液浸润,为细菌提供充足的附着位点,有利于细菌的黏附及黏附后胞外基质的分泌,形成的生物被膜对黏附的被膜菌有保护作用,故该薄膜表面的被膜活菌数量最多。ZnO-PDMS薄膜表面具有超双疏性能,具有优异的抗黏附能力,不利于被膜菌的初始黏附及生长,薄膜表面初始黏附细菌数量较少,且被膜菌总数与薄膜的疏水疏油性能呈正相关,且花状ZnO-PDMS薄膜表面初始细菌数最少。由于PDMS薄膜中的ZnO微纳米粒子的抗菌有效成分向薄膜表面迁移需要一定的时间,不能立即杀灭与薄膜表面接触或黏附的细菌[34],在生物被膜形成的初始可逆黏附阶段,ZnO-PDMS薄膜表面的被膜菌数量与PDMS薄膜差异不大,而在不可逆黏附阶段至被膜成熟期,ZnO-PDMS薄膜表面的被膜菌数量显著低于PDMS薄膜。在生物被膜的形成和成熟阶段,随着游离出的Zn2+数量逐渐增多并直接接触细菌细胞膜,导致细胞膜损伤,细胞塌陷,内容物流出,抑制细菌的进一步增殖。在生物被膜衰退期,各样品表面被膜活菌总数均表现出下降趋势,是因为此时存在大量的被膜菌,其中部分被膜老化脱落,并且营养物质经过长时间的消耗已经不能满足细菌生长繁殖的需要,导致被膜菌因缺乏营养而脱落和死亡。
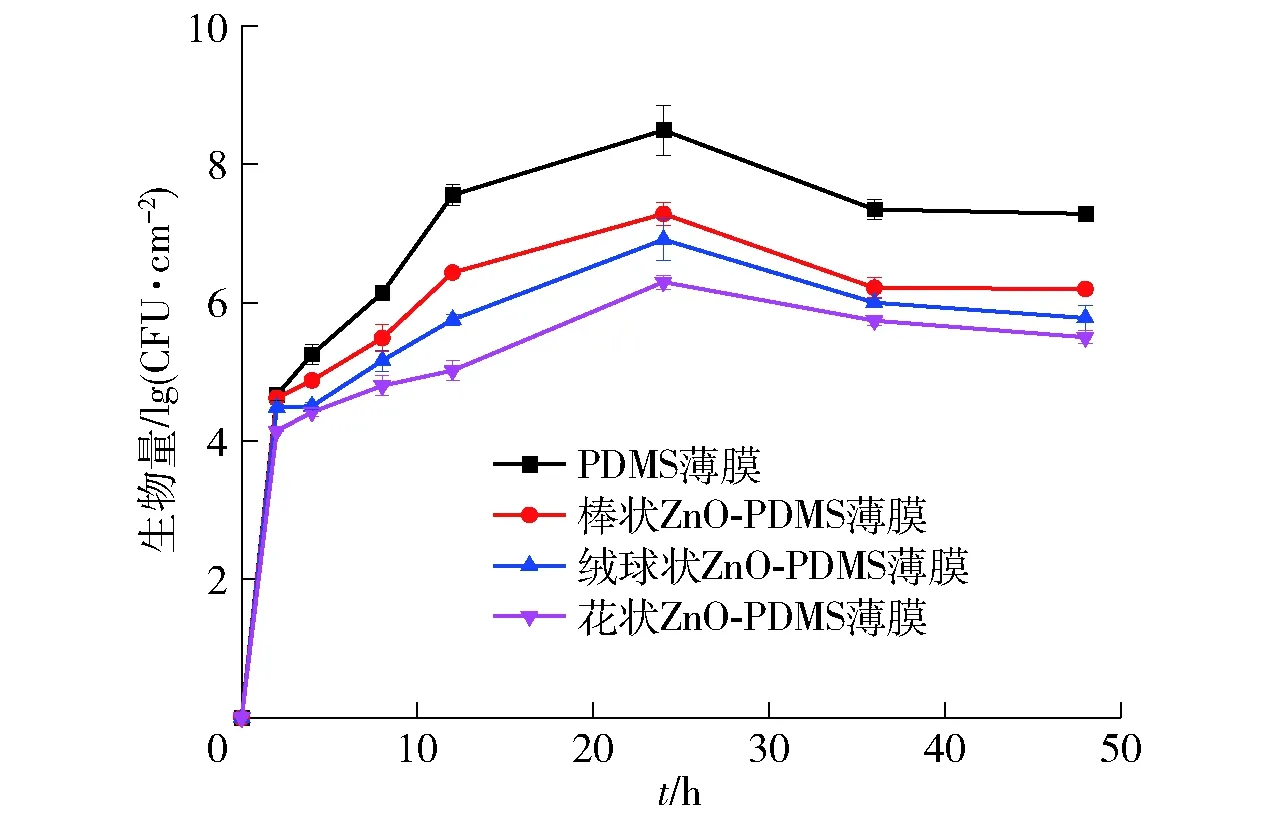
图4 PDMS薄膜和ZnO-PDMS薄膜表面 生物被膜菌生长曲线
2.4 PDMS薄膜及ZnO-PDMS薄膜对腐败希瓦氏菌生物被膜的抑制机制分析
PDMS薄膜及ZnO-PDMS薄膜表面生物被膜菌SEM分析见图5。由图5可知,在生物被膜培养至2 h时,少量游离菌黏附于薄膜表面,菌体表面光滑,无褶皱,形态完整。培养至12 h,薄膜表面的细菌数量增多,有胞外基质分泌。PDMS薄膜表面的菌体完整,数量较多。ZnO-PDMS薄膜表面部分细菌的细胞膜出现褶皱,菌体表面附着较多颗粒状物质,可能是由于薄膜中Zn2+溶出,破坏并穿透细胞膜,导致其蛋白质变性和细胞增殖能力丧失,并破坏了菌体结构[35]。培养至24 h,薄膜表面细菌数量继续增多,PDMS薄膜表面的菌体仍完整,无被破坏的迹象。此时,ZnO-PDMS薄膜表面的不完整菌体增多,说明有大量被膜菌被杀死,这是薄膜中ZnO微纳米粒子较强的抗菌作用的结果。培养至48 h,PDMS薄膜表面的菌体数量增多,有部分不完整菌体出现,这是由于生物被膜菌进入衰退期,被膜菌生长繁殖所需的养分不足。此时,ZnO-PDMS薄膜表面的大部分菌体呈破裂状,说明生物被膜菌进入衰退期,且薄膜中ZnO微纳米粒子具有较强的抗菌性能,抑制了被膜菌的生长繁殖。
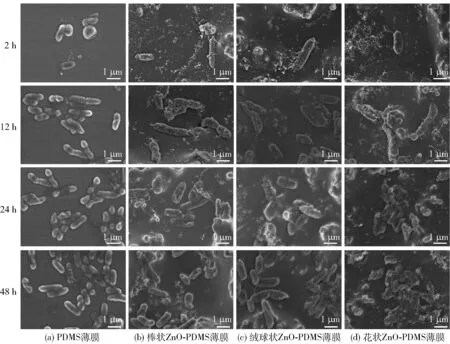
图5 PDMS薄膜及ZnO-PDMS薄膜表面生物被膜菌SEM分析
PDMS和ZnO-PDMS薄膜表面生物被膜的CLSM分析见图6。由图6可知,PDMS薄膜表面的被膜菌中活菌最多,在生物被膜菌成熟期后开始有部分被膜菌死亡;至生物被膜菌衰退期,被膜菌死亡数量增多,但其中的活菌数量仍较大。ZnO-PDMS薄膜表面细菌的初始黏附量较少,且在生物被膜菌开始进入生长期时就有大量被膜菌死亡;在生物被膜菌衰退期,被膜菌数量增多,但活菌很少。其中花状ZnO-PDMS薄膜表面被膜菌死菌比例最大,该结果与SEM分析结果一致。
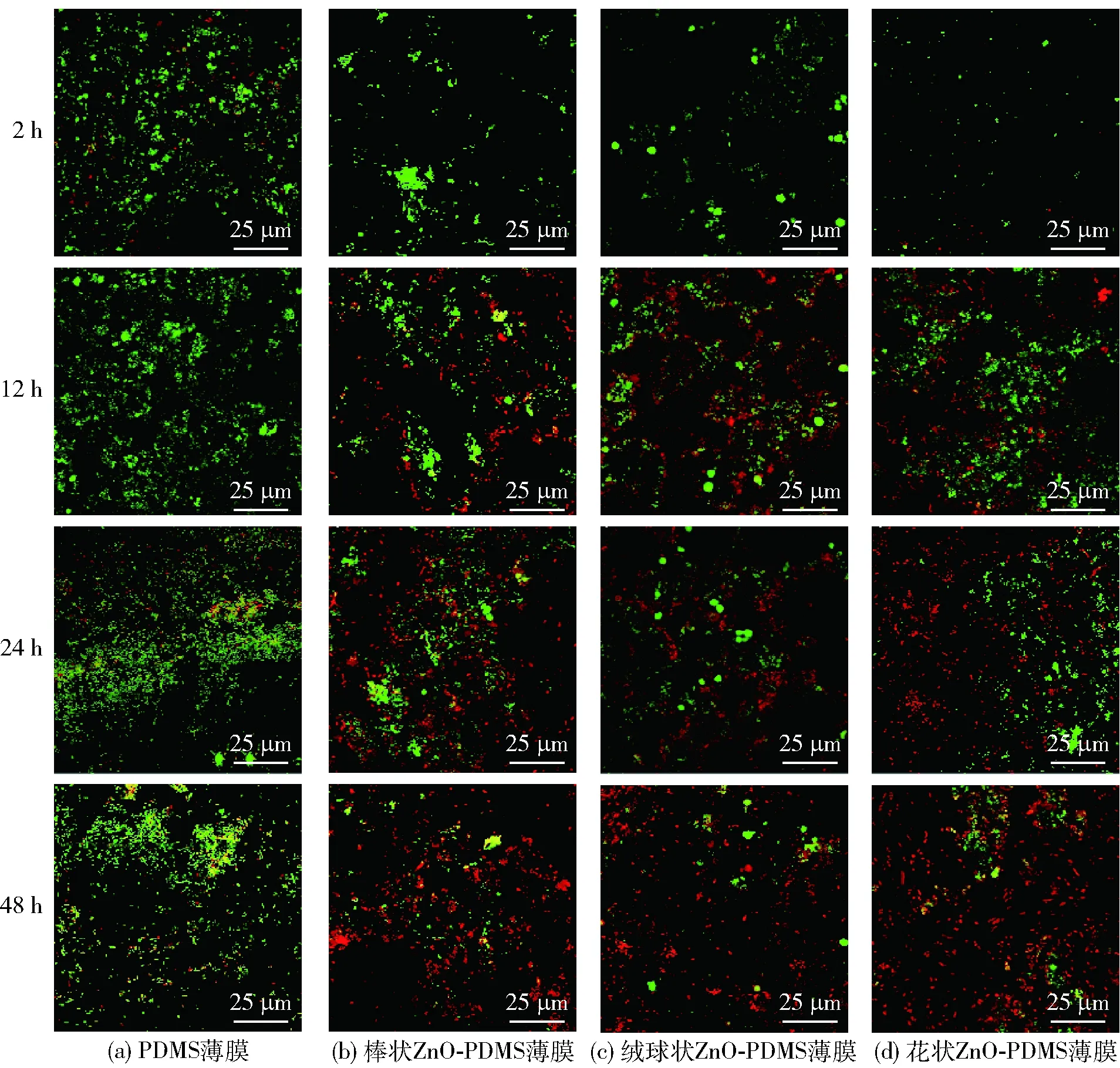
绿色为活菌,红色为死菌。
PDMS薄膜及ZnO-PDMS薄膜表面生物被膜的生化指标及抗菌、抗黏附机理见图7。EPS是组成生物被膜的主要成分之一,因此,抑制EPS的分泌是控制生物被膜的关键之一。由图7(a)~(c)可知,具有超双疏性能和抗菌性能的ZnO-PDMS薄膜中腐败希瓦氏菌的代谢活性、分泌的EPS和蛋白质含量均低于PDMS薄膜,其中花状ZnO-PDMS薄膜表面的各项指标最低,说明其抗腐败希瓦氏菌生物被膜的性能最强。由图7(d)可见,在PDMS薄膜上,腐败希瓦氏菌生物被膜菌ATP和AKP酶活性最高。棒状、绒球状和花状ZnO-PDMS薄膜上生物被膜的ATP和AKP酶活性依次下降,表明ZnO微纳米粒子的加入降低了腐败希瓦氏菌生物被膜菌ATP和AKP酶活性,且其抑制能力与ZnO微纳米粒子的微观形貌有关,Babayevska等[36]同样发现抑菌能力与ZnO的形态有关。这是由于薄膜中溶出的Zn2+破坏了细菌细胞膜,进入菌体,抑制了细菌的ATP和AKP酶活性,使其活性降低,破坏细菌的主动运输和氨基酸代谢,从而使细菌的正常生理代谢紊乱,导致细菌死亡[37]。并且ZnO的抗菌能力和Zn2+含量有关,与棒状和绒球状的ZnO-PDMS相比,花状ZnO颗粒及ZnO-PDMS薄膜表面具有更大的比表面积,更有利于Zn2+作为杀菌剂的溶出和释放,因此,表现出最好的抗生物被膜活性[38]。
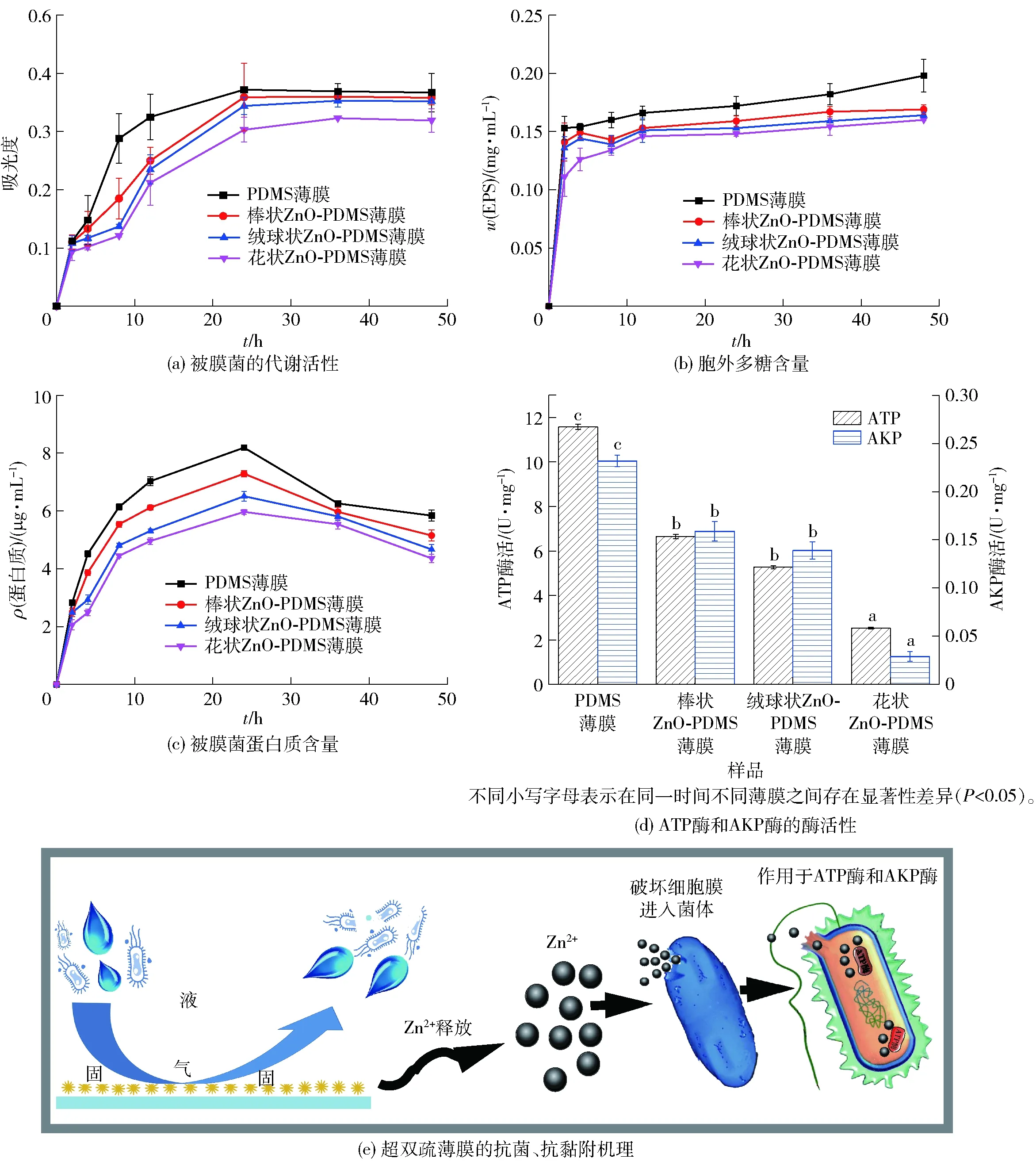
图7 PDMS薄膜及ZnO-PDMS薄膜表面生物被膜的生化指标及抗菌、抗黏附机理
3 结 论
将不同微观形貌的ZnO微纳米粒子与PDMS结合,成功制备了具有超双疏性能的ZnO-PDMS薄膜。水产品优势腐败菌——腐败希瓦氏菌在超双疏ZnO-PDMS薄膜表面的黏附能力下降,ZnO-PDMS薄膜缓释Zn2+,破坏细菌细胞膜并使菌体死亡。此外,ZnO-PDMS薄膜可以显著抑制被膜菌的代谢活性,减少EPS和蛋白质的分泌,并降低生物被膜内被膜菌ATP和AKP酶活性。ZnO微纳米粒子的微观形貌影响ZnO-PDMS薄膜的疏水疏油性能和抗生物被膜性能,其中以花状ZnO颗粒为改性剂的ZnO-PDMS薄膜具有超双疏性能,且对腐败希瓦氏菌的抗生物被膜效果较优。本研究揭示了不同形貌ZnO对PDMS薄膜抗菌、抗黏附性能的影响机制,但还需要深入探究ZnO的抗菌途径对PDMS薄膜抑制希瓦氏菌生物被膜性能的影响机制,在基因层面解析PDMS薄膜的生物被膜抑制机制,并进一步探究其食品保鲜性能。由于ZnO-PDMS超双疏薄膜具有优良的抗生物被膜性能,在抗菌、抗黏附领域具有良好的表现,有望应用于食品的抗菌包装及器械加工中。
