不同纯化程度香菇柄多糖的乙酰化修饰及降血糖活性
2022-12-15李顺峰许方方崔国梅王安建魏书信刘丽娜田广瑞高帅平
李顺峰, 许方方, 崔国梅, 王安建, 魏书信, 刘丽娜, 田广瑞, 高帅平
(河南省农业科学院 农副产品加工研究中心, 河南 郑州 450002)
香菇(Lentinusedodes)是中国栽培面积和产量最大的食用菌[1],不仅富含营养物质,还含有大量多糖、酚酸类以及活性蛋白等生物大分子物质,具有药用保健功效[2]。香菇柄是香菇商品化处理中的副产物,占香菇总重的20%~30%[3-4];由于其呈纤维化,适口性差,只有少量被加工利用,大部分被废弃,造成极大的资源浪费。香菇柄同菌盖一样由菌丝组成,同样含有丰富的碳水化合物、蛋白质、氨基酸等[5]。
研究表明,多糖具有提高免疫力、抗病毒等多种生物活性,而多糖的理化性质、分子量、聚合度、主链糖苷键连接方式、支链的分枝数目以及多糖的空间构象等与其药理作用关系密切[2]。将某些化学基团引入多糖大分子链中,不仅可改变多糖的理化性质,增强生物活性,而且还可以产生新的活性,如乙酰化青钱柳多糖可激活树突细胞,提高抗突变能力[6];硫酸化修饰枸杞多糖可显著促进免疫淋巴细胞增殖提高免疫力[7]等。目前,常用的化学修饰多糖方法有乙酰化、硫酸酯化、羧甲基化等[8-12]。许多研究结果证实,多糖经过乙酰化修饰后生物活性显著提高[8,13-14]。Tang等[15]研究发现,羊肚菌多糖经乙酰化修饰后的抗氧化活性以及对肝癌细胞和结肠癌细胞的抑制活性高于其硫酸酯化修饰多糖和羧甲基化修饰多糖。α-淀粉酶抑制剂和α-葡萄糖苷酶抑制剂可减缓人体肠道对淀粉等物质的降解和葡萄糖的消化吸收。体外抑制α-淀粉酶和α-葡萄糖苷酶活性试验可以测定多糖降血糖生理活性[16]。生物活性成分纯化有利于明晰生物活性物质的作用机理,但可能会由于其他成分的去除而降低多糖活性[2,17]。尚未见纯化程度对乙酰化修饰的多糖影响方面的报道。因此,本研究主要对香菇柄多糖进行脱蛋白和柱层析分离纯化,对纯化前后多糖含量及乙酰化修饰前后香菇柄多糖进行初步结构分析,并对其体外降血糖活性进行评价,以期为香菇柄多糖的利用提供参考。
1 材料与方法
1.1 材料与试剂
香菇柄购自郑州信基调味品市场,经50 ℃烘干至含水率低于8%,粉碎过40目筛后备用。
α-淀粉酶、α-葡萄糖苷酶、3,5-二硝基水杨酸、4-硝基苯-α-D-吡喃葡萄糖苷,上海源叶生物科技有限公司;重蒸酚、葡萄糖、无水乙醇、氯化钠、氢氧化钠、溴化钾等均为国产分析纯。
1.2 仪器与设备
FA2004C型分析天平,上海越平科学仪器有限公司;UV- 1800型紫外可见分光光度计,岛津仪器(苏州)有限公司;RV8V- C型旋转蒸发仪,德国IKA集团;LD- Y300A型高速万能粉碎机,上海顶帅电器有限公司;DF- 10型恒温磁力搅拌器,巩义市予华仪器有限公司;H2050R型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Nicolet iS5型傅里叶红外光谱仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1香菇柄多糖的制备及多糖和蛋白质含量的测定
1.3.1.1 香菇柄粗多糖的制备
香菇柄粉加入体积分数为85%的乙醇回流脱脂。挥干乙醇后,将香菇柄粉与蒸馏水按照料液比1∶15(g∶mL)进行混匀,沸水浸提2 h,4 000 r/min离心10 min,收集上清液,沉淀再重复浸提1次,合并2次上清液。将上清液减压浓缩后,加入3倍体积无水乙醇,置4 ℃过夜沉淀,再经4 000 r/min离心10 min(4 ℃),沉淀用无水乙醇淋洗3次,经干燥后即为香菇柄粗多糖。
1.3.1.2 脱蛋白多糖的制备
称取粗多糖粉5.0 g,溶于250 mL水中,调pH值为7.0,加入质量浓度为7 mg/mL中性蛋白酶,50 ℃搅拌酶解3 h,沸水灭酶15 min,冷却后4 000 r/min离心10 min,取上清液,加入3倍体积无水乙醇,4 ℃沉淀多糖,在4 ℃环境经5 000 r/min离心10 min,收集沉淀,干燥后即为脱蛋白多糖[17]。
1.3.1.3 柱层析纯化多糖
DEAE Sephadex A- 25经预处理后装柱( 1.5 cm×60 cm)、平衡,将多糖样品用蒸馏水溶解后配成质量浓度为4 mg/mL的溶液,取3 mL过柱子。洗脱液分别为蒸馏水、0.1 mol/L的NaCl溶液、0.3 mol/L的NaCl溶液和0.1 mol/L的NaOH溶液,流速为2 mL/min,每管收集5 mL,每种洗脱液分别收集40管[18]。每管多糖的含量采用苯酚- 硫酸法[19]测定,根据洗脱曲线收集各洗脱组分。蒸馏水洗脱组分得率最高,其余各洗脱组分得率较低。因此,以蒸馏水洗脱组分为柱层析多糖进行后续试验。
1.3.1.4 多糖和蛋白质含量测定
采用苯酚- 硫酸法[19]测定多糖含量;采用考马斯亮蓝G- 250法[20]测定蛋白质含量。
1.3.2香菇柄多糖的乙酰化修饰
采用NaOH- 乙酸酐法对香菇柄多糖进行修饰[21],乙酸酐溶液用量5 mL,反应结束后经透析、醇沉、干燥,即为乙酰化多糖,分别标记为乙酰化粗多糖、乙酰化脱蛋白多糖、乙酰化柱层析多糖,用于后续测定。
1.3.3乙酰基取代度的测定
采用酸碱滴定法测定乙酰化取代度[22]。
1.3.4紫外光谱分析
将香菇柄多糖及其乙酰化多糖制成质量浓度为0.2 mg/mL的水溶液,于190~800 nm波长处进行扫描,获得紫外光谱图。
1.3.5红外光谱分析
称取香菇柄多糖及其乙酰化多糖样品各5 mg,分别与200 mg经过干燥的溴化钾在玛瑙研钵中研磨均匀,压片后用傅里叶红外光谱仪在4 000~400 cm-1范围内进行光谱扫描。
1.3.6刚果红实验
按照参考文献[23]进行刚果红实验,测定三螺旋结构。移取2.0 mL质量浓度为1.0 mg/mL的香菇柄多糖及其乙酰化多糖样品溶液,加入80 μmol/L的刚果红试剂2.0 mL,摇匀。加入一定量的2.0 mol/L NaOH溶液,使各样品溶液的NaOH浓度达到0~0.5 mol/L。扫描各溶液在190~800 nm波长处的紫外可见光谱,得到最大吸收波长。
1.3.7多糖的降血糖活性测定
体外抑制α-淀粉酶和α-葡萄糖苷酶活性试验测定香菇柄多糖与香菇柄乙酰化多糖的降血糖作用。
1.3.7.1 α-淀粉酶抑制活性测定
采用3,5-二硝基水杨酸(DNS)比色法[12],测定多糖和乙酰化多糖的α-淀粉酶抑制活性。具体步骤:在各个试管中加入一定量不同质量浓度梯度的样品溶液,补充浓度为0.2 mol/L的磷酸钠缓冲液(pH值6.8)至1.0 mL,加入α-淀粉酶溶液(10 U/mL)1 mL,37 ℃水浴15 min,加入质量浓度为10 g/L淀粉溶液1 mL,37 ℃水浴15 min,加入DNS试剂1 mL置于沸水浴中反应15 min,迅速冷却至室温,随后加入3 mL蒸馏水稀释,在540 nm波长处测定吸光度值,计算酶活性抑制率。
1.3.7.2 α-葡萄糖苷酶抑制活性测定
用4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)作底物,在各试管中加入不同质量浓度梯度的样品溶液,补充0.2 mol/L的磷酸钠缓冲液(pH值6.8)至3.0 mL,加入α-葡萄糖苷酶(7.5 U/mL)与PNPG(5 mmol/L)各0.5 mL,摇匀,37 ℃水浴反应30 min后,加入1 mol/L的碳酸钠溶液1 mL终止反应,于405 nm波长处测定吸光度值,计算酶活性抑制率[24]。
1.4 数据处理
所有实验重复3次,数据用平均值±标准偏差(mean±SD)表示。采用SPSS软件对实验数据进行差异显著性分析,用GraphPad Prism软件绘图。
2 结果与分析
2.1 纯化对多糖和蛋白质含量的影响
香菇柄多糖乙酰化修饰取代度及多糖和蛋白质含量见表1。由表1可知,随着多糖纯化的不断进行,多糖含量(纯度)不断增加,质量分数由纯化前的36.42%(粗多糖)和41.87%(乙酰化粗多糖)升高至纯化后的88.57%和81.27%(经脱蛋白和柱层析后的多糖、乙酰化多糖)。但多糖得率却显著降低,如粗多糖及其乙酰化多糖经脱蛋白后得率由83.25%和48.83%降至56.67%和40.17%,再经柱层析后得率降至21.85%和35.42%;而蛋白质含量由纯化前的17.12%降低至纯化后的0.69%。乙酰化多糖的变化趋势与未乙酰化多糖相似,且乙酰化后多糖和蛋白质含量均有不同程度降低。各多糖乙酰化取代度均在0.3左右,说明纯化对乙酰基取代度无显著影响。
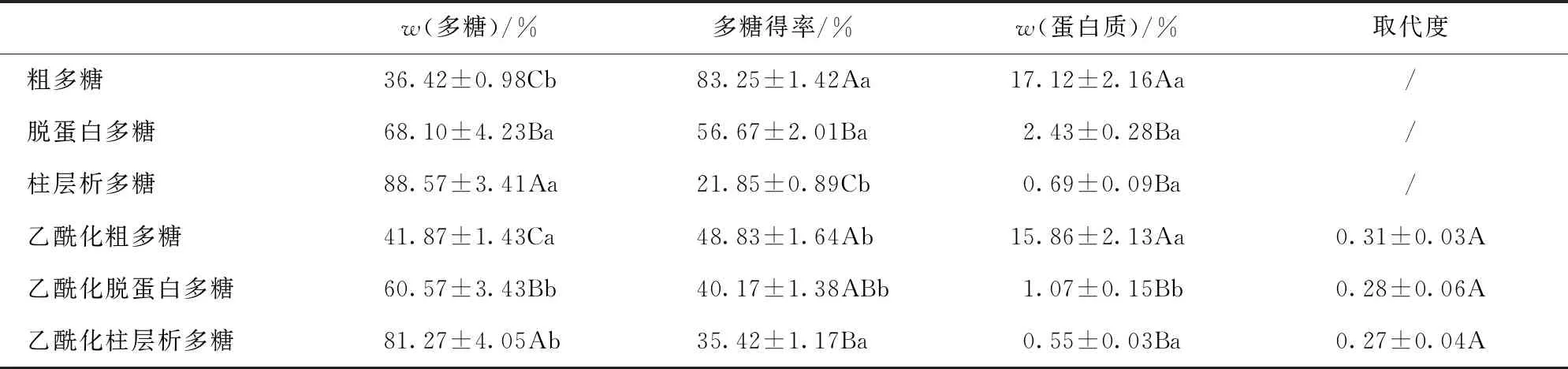
表1 香菇柄多糖乙酰化修饰取代度及多糖和蛋白质含量
2.2 纯化对多糖紫外光谱和红外光谱的影响
香菇柄多糖及其乙酰化多糖的紫外光谱见 图1。由图1可知,与粗多糖相比,脱蛋白多糖和柱层析多糖在260、280 nm处的紫外吸光值均呈现出明显的下降趋势,尤其是柱层析纯化多糖在260、280 nm处无明显的紫外吸光值,并且乙酰化多糖与未乙酰化多糖结果相似。图1结果与表1中蛋白质含量测定结果一致。
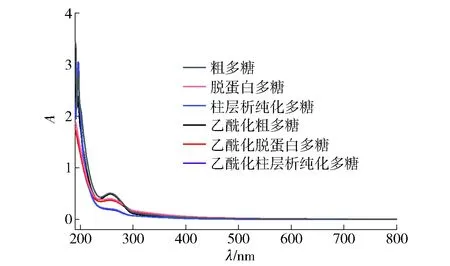
图1 纯化对香菇柄多糖及其乙酰化多糖紫外光谱的影响

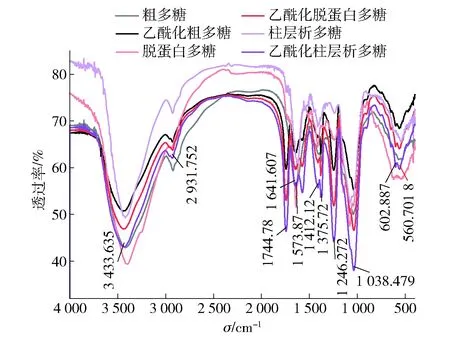
图2 纯化对香菇柄多糖及其乙酰化多糖红外光谱的影响
2.3 纯化对多糖三螺旋结构的影响
香菇柄多糖及其乙酰化多糖与刚果红在不同浓度NaOH溶液中的最大吸收波长λmax的变化见 图3。由图3可知,对照溶液(水)与刚果红的混合溶液λmax未发生红移,香菇柄粗多糖、脱蛋白多糖和柱层析多糖及其对应的乙酰化多糖与刚果红的混合溶液λmax均发生了红移。实验结果表明:香菇柄粗多糖、脱蛋白多糖和柱层析多糖及其对应的乙酰化多糖均具有三螺旋结构;在NaOH浓度范围内,随着纯化的不断进行,粗多糖、脱蛋白多糖和柱层析多糖λmax分别红移了11.73、5.90、5.73 nm,其对应的乙酰化多糖分别红移了8.67、6.90、5.83 nm,多糖及其乙酰化多糖的红移幅度逐渐减小。
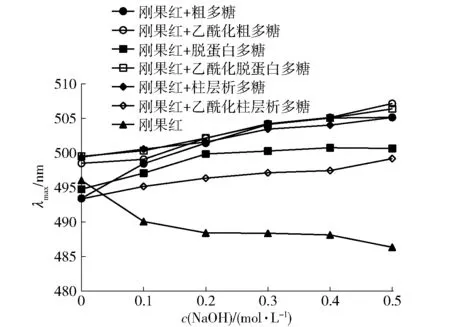
图3 纯化对不同NaOH浓度下香菇柄多糖及其 乙酰化多糖与刚果红配合物λmax变化的影响
2.4 纯化对多糖降血糖活性的影响
α-淀粉酶和α-葡萄糖苷酶抑制剂作为糖尿病患者的口服降血糖药引起了很多关注,其能够延缓葡萄糖或果糖的释放,抑制餐后血糖的上升[12,23]。香菇柄多糖及其乙酰化多糖对α-淀粉酶和α-葡萄糖苷酶的抑制活性结果见图4。
由图4(a)可知,在1.0~5.0 mg/mL质量浓度内,香菇柄多糖及其乙酰化多糖对α-淀粉酶的抑制活性均随着质量浓度的增大而增加,但在相同质量浓度下各多糖及其对应乙酰化多糖对α-淀粉酶的抑制活性无显著差异(P>0.05)。香菇柄粗多糖、脱蛋白多糖、柱层析多糖及其对应乙酰化多糖对α-淀粉酶的IC50值分别为3.03、3.08、2.94、2.79、2.81、2.69 mg/mL。α-淀粉酶抑制率结果表明,乙酰化多糖对α-淀粉酶的抑制活性高于未乙酰化多糖,但纯化并未能显著提升多糖对α-淀粉酶的抑制活性。
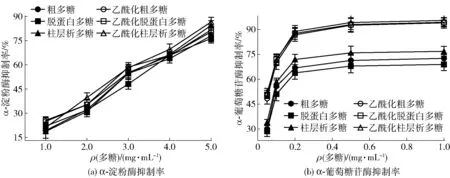
图4 乙酰化修饰香菇柄多糖对α-淀粉酶和α-葡萄糖苷酶的抑制作用
从图4(b)可知,在试验浓度范围内,随着多糖质量浓度的增大,多糖对α-葡萄糖苷酶抑制率也逐步增加。当多糖质量浓度达到0.2 mg/mL时,粗多糖及其乙酰化粗多糖对α-葡萄糖苷酶的抑制率分别为67.55%±2.38%和87.83%±0.60%;继续增大多糖质量浓度,其对α-葡萄糖苷酶的抑制活性并未表现出显著的增高。脱蛋白多糖对α-葡萄糖苷酶的抑制活性低于粗多糖和柱层析多糖,而乙酰化可显著提高多糖对α-葡萄糖苷酶的抑制活性。徐雅琴等[23]对黑穗醋栗果实多糖乙酰化修饰和张丽程等[16]对茯砖茶多糖乙酰化修饰后也得到了与本研究相似的结果。
研究结果表明,香菇柄多糖及其乙酰化多糖对两种酶具有剂量依赖性抑制活性,且乙酰化可显著提高多糖对α-葡萄糖苷酶的抑制活性。结合表1结果可知,纯化虽提高了多糖的纯度,但多糖损失严重,且多糖活性未能得到大幅的提高,这可能是由于纯化过程造成了与多糖具有协同作用的其他活性成分含量的减少。
3 结 论
1)随着多糖纯化的不断进行,香菇柄多糖及其乙酰化多糖中多糖得率均显著降低。纯化对乙酰基取代度无显著影响,未造成多糖结构的破坏。多糖经乙酰化修饰后均出现了乙酰基的特征吸收峰。不同程度纯化后,香菇柄多糖及其对应的乙酰化多糖均具有三螺旋结构。
2)香菇柄多糖及其乙酰化多糖对α-淀粉酶和α-葡萄糖苷酶具有剂量依赖性抑制活性。乙酰化可显著提高多糖对α-葡萄糖苷酶的抑制活性。
