不同部位孤立性纤维性肿瘤患者临床病理特征和预后影响因素分析
2022-12-15高云鹤姚佳楠曹岚清许传杰
高云鹤, 姚佳楠, 曹岚清, 许传杰
(吉林大学第二医院病理科, 吉林 长春 130041)
孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是一种相对少见的间叶源性肿瘤, 主要发病人群为中年人[1-2]。SFT 多发于胸膜, 起初学者认为SFT 起源于间皮细胞。近年来研究[3-4]显示:SFT 是来源于CD34 阳性的树突状间质细胞, 具有向纤维母细胞、肌纤维母细胞、血管外皮细胞和血管内皮细胞分化的特性。该肿瘤构成成分复杂, 表现形式多种多样, 并且可以发生于全身多部位, 易与相关部位常见间叶源性肿瘤混淆。SFT 的生物学行为也存在较明显的异质性, 10%~20%的SFT 患者在首次手术切除后5~10 年会复发并发生转移[5-7]。研究[8]显示:SFT 可以发生去分化, 组织学特征较难预测其生物学行为。目前有关SFT的临床特征和预后相关因素的研究多见于单一部位的肿瘤, 对于不同器官或系统SFT 患者的临床特征的异同及采用分级模式分析患者相应预后的报道较少。本文作者选择86 例原发于不同部位的SFT患者, 探讨不同部位SFT 患者的临床特征、诊断与鉴别诊断, 并分析SFT 相关预后影响因素, 旨在提高临床医生对该病的认识。
1 资料与方法
1.1 一般资料收集2013 年6 月—2021 年10 月吉林大学第二医院经手术治疗确诊为SFT 患者86 例。本研究通过本院伦理委员会审批。所有切片均由3 名以上病理医师复查。记录指标包括患者的年龄、肿瘤直径、核分裂象计数、是否并发坏死、免疫组织化学染色情况和危险度分级。
1.2 组织学染色和免疫组织化学染色所有标本经4%中性甲醛固定, 行常规脱水、石蜡包埋、4 μm 厚度切片和HE 染色, 中性树胶封片, 光镜观察。免疫组织化学染色采用EnVision 法, DAB 显色, 仪器采用罗氏全自动免疫组织化学仪。抗体包括信号转导及转录激活蛋白6 (signal transducer and activator of transcription-6, STAT-6)、CD34、B 细 胞 淋 巴 瘤2 (B-cell lymphoma-2, Bcl-2)、Ki-67、 CD99、 Vimentin、 平 滑 肌 肌 动 蛋 白(smooth muscle actin, SMA)、S-100、上皮膜抗原(epithelial membrane antigen, EMA) 和孕酮受体(progesterone receptor, PR)等均购于中国北京中杉公司。对于未行STAT-6 免疫组织化学染色的患者均补行染色。所有操作严格按照抗体说明书和实验室规范进行, 设立阳性对照和阴性对照组。
1.3 危险度分级2020 版WHO 软组织肿瘤分类[8-10]中根据患者年龄、肿瘤大小、核分裂数和是否并发坏死, 将SFT 分为低、中和高3 种危险度级:①年龄<55 岁为0 分, ≥55 岁为1 分;②肿瘤直径<5 cm 为0 分, 5 cm≤肿 瘤 直 径<10 cm 为1 分, 10 cm≤肿瘤直径<15 cm为2 分, 肿瘤直径≥15 cm 为3 分;③核分裂象<1 个/10 高倍镜视野(high power field, HPF) 为0 分, 1 个/10 HPF<核分裂象<3 个/10 HPF 为1 分, 核分裂象≥4 个/10HPF 为2 分;④坏死率<10%为0 分, 坏死率≥10%为1 分。最后将上述4 项评分相加计算总分, 总分0~3 分为低危险组, 总分4~5 分为中危险组, 总分6~7 分为高危险组。
1.4 随 访随访信息来自电子病理系统记录或通过电话方式进行沟通。随访内容包括是否复发和转移, 复发和转移部位及时间, 复发后是否手术切除及患者是否健在。
1.5 统计学分析采用SPSS 22.0 统计软件进行统计学分析。患者年龄、肿瘤直径和核分裂像计数以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用SNK-q检验;患者性别构成比、是否并发坏死、危险度分级及复发情况组间比较采用χ2检验。采用Kaplan-Meier 生存曲线法分析不同的单一临床病理因素与患者无进展生存期的关系, 采用Cox 回归分析进行多因素与患者无进展生存期的关系分析。 以P<0.05 为差异有统计学意义。
2 结 果
2.1 临床资料不同部位SFT 的患者性别构成比比较差异无统计学意义(P>0.05)。患者年龄为25~89 岁, 平均年龄为(53.79±15.06) 岁。不同部位SFT 的患者年龄比较差异无统计学意义(P>0.05)。发病部位分别为肺及胸膜24 例、眼眶16 例、上呼吸道11 例、腹腔11 例、皮下软组织11 例、女性生殖道8 例、中枢神经系统5 例。肿瘤直径0.5~33.0 cm。不同部位肿瘤直径比较差异有统计学意义(P<0.01), 中枢神经系统、上呼吸道及眼眶肿瘤直径明显小于女性生殖道、腹腔、皮下软组织、肺及胸膜肿瘤。不同部位肿瘤细胞是否存在坏死及核分裂象计数比较差异无统计学意义(P>0.05)。低危险组65 例、中危险组14 组、高危险组7 例。中枢神经系统和上呼吸道SFT 患者均位于低危险组, 而女性生殖道、腹腔、皮下软组织、肺和胸膜SFT 在高、中、低危险组中均有分布, 不同部位SFT 在高、中、低危险组的分布情况比较差异均无统计学意义(P>0.05)。随访时间2~139个月, 平均随访时间为(41.11±28.48)个月。复发患者10例, 分别为女性生殖道SFT 3 例, 腹腔、皮下软组织、肺和胸膜SFT 各2 例, 眼眶SFT 1 例。临床表现与肿瘤的发生部位有关, 表现为局部肿块及相应压迫症状。86 例SFT 患者临床病理资料见表1。

表1 86 例SFT 患者临床病理资料Tab. 1 Clinicopathological data of 86 SFT patients
2.2 SFT 大体形态表现肿瘤大体形态呈结节样或不规则形状。大部分肿瘤边界较清(73/86, 84.9%), 部分肿瘤有完整包膜(40/86, 46.5%), 少部分肿瘤与周围组织分界不清, 有推挤式浸润包膜或周边固有组织(13/86, 15.1%)。大部分肿瘤切面灰白色质硬, 部分肿瘤切面灰黄、灰红或灰褐色, 质软或质韧, 可有囊性变、出血及坏死(图1A~1C)。体积大的肿瘤更易出现囊性变、出血及坏死, 更易浸润周围组织;体积小的肿瘤大多数边界清, 有完整包膜。不同部位肿瘤在大体形态、质地和切面颜色方面无明显不同。

图1 SFT 大体形态表现Fig.1 General morphology of SFT
2.3 HE 染色检测SFT 镜下形态表现肿瘤细胞位于纤维胶原背景中, 由梭形细胞、卵圆形细胞组成, 细胞疏密不等, 呈杂乱性或交织状生长, 大部分肿瘤细胞形态温和、胞浆嗜酸性, 核仁、异型性及核分裂象不明显(71/86, 82.6%), 常伴特征性的鹿角样分枝状薄壁血管(图2A), 可见血管周围玻璃样变性(图2B), 部分可见反应性多核巨细胞(图2C)、间质明显的黏液变性(图2D)及粗大绳索状胶原纤维(图2E)。肿瘤细胞密度明显增加, 异型性显著、核分裂象多见(9/86, 10.5%)(图2F), 并可见有出血和坏死。不同部位肿瘤细胞形态表现无明显差异。
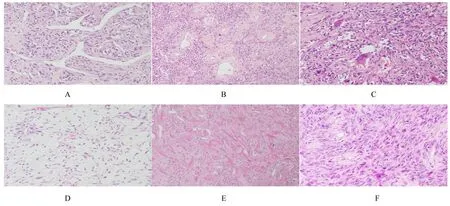
图2 HE 染色观察镜下SFT 形态表现Fig.2 Morphology of SFT under microscope observed by HE staining
2.4 免疫组织化学染色检测结果STAT-6(86/86, 100%) 核弥漫强阳性(图3A);CD34(70/86, 81.4%)、Bcl-2(42/56, 75%)、CD99(32/45, 71.1%)、Vimentin (42/42, 100%) 不同程度 阳 性(图3B 和3C); SMA (4/57, 7.0%)、CD117 (1/21, 4.8%)、 S-100 (3/67, 4.8%)、EMA(2/29, 6.9%)、PR(1/13, 7.7%)均为局灶 阳 性;DOG-1、Desmin 和CK (AE1/AE3) 均为阴性, Rb 无表达缺失, Ki-67 阳性率为1%~30%。
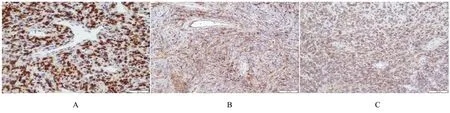
图3 SFT 免疫组织化学染色检测结果Fig.3 Immunohistochemical staining detection results of SFT
2.5 随访和预后61 例SFT 患者获随访信息, 随访时间为2~139 个月, 平均随访时间为(41.11±28.48)个月。其中10 例复发(女性7 例, 男性3 例), 低风险组6 例(9%, 皮下组织、肺和胸膜各2 例, 眼眶和女性生殖道各1 例), 中风险组2 例(14%, 均为女性生殖道), 高风险组2 例(28%, 均为腹腔)。10 例复发病例中有8 例在5 年内复发, 2 例在10 年内复发。采用Kaplan-Meier 生存曲线法分析核分裂象<4 个/10 HPF 与核分裂象≥4 个/10 HPF 患者复发时间比较差异有统计学意义(P<0.05), 核分裂象≥4 个/10 HPF 患者复发时间明显缩短(图4A)。其他因素(患者年龄、肿瘤直径和是否并发坏死)均与患者无进展生存期无关(P>0.05);高危险组与低和中危险组患者复发时间比较差异有统计学意义(P<0.05), 高危险组患者复发时间明显短于低和中危险组(图4B)。多因素Cox 回归分析结果显示:是否并发坏死以及危险度分组未纳入变量, 其他因素包括性别、年龄、肿瘤直径和核分裂象计数均非患者无进展生存期的独立预测因素。

图4 Kaplan-Meier 生存曲线法分析SFT 患者预后相关影响因素Fig. 4 Analysis on prognosis-related factors of SFT patients detected by Kaplan-Meier survival curve method
3 讨 论
SFT 是一种间叶来源纤维母细胞性肿瘤, 其发病部位广泛, 好发部位分别为胸膜、腹膜后、盆腔、四肢及头颈部的深部软组织[11]。生物学行为难以确定, 多呈惰性, 少部分SFT 具有侵袭性生物学行为。本文作者探讨了同一时期发生于不同部位的SFT 患者的临床特征, 并根据新版WHO 提出的SFT 危险度分级模式分析其预后相关因素。
不同发病部位患者性别构成和年龄分布比较差异无统计学意义。SFT 患者性别构成和发病年龄分布与文献[12]报道结果相似。SFT 可以发生在全身的任何部位, 临床表现与肿瘤的发生部位有关, 主要为肿块所致的局部压迫症状。86 例SFT 患者中, 发生于肺及胸膜者最多(24/86, 27.9%), 肿瘤直径为0.5~22.0 cm, 可有咳嗽、咳痰、呼吸困难、胸痛和胸腔积液等一系列呼吸系统相关症状;发生于眼眶者(16/86, 18.6%), 肿瘤直径为0.5~5.0 cm, 通常表现为缓慢进展的、单侧、无痛性上睑下垂, 可伴有眼睑肿胀、视力障碍以及可触及的肿块, 视神经功能障碍发生较少, 主要取决于肿物位置和直径;发生于上呼吸道者(11/86, 12.8%) 肿瘤直径为1.0~5.0 cm, 主要表现为鼻塞、流涕、打鼾和嗅觉减退等, 肿瘤逐渐增大, 可压迫临近骨组织;发生于腹腔者(11/86, 12.8%)肿瘤直径为4.5~33.0 cm, 主要以腹部包块、腹胀和腹痛为主, 少数可有腹水;发生在女性生殖道者(8/86, 9.3%), 肿物直径为3.0~21.0 cm, 有不明原因下腹痛、尿痛、阴道流血和经量增多等症状;发生于中枢神经系统者(5/86, 5.8%) 肿瘤直径为2.5~7.5 cm, 主要表现为头痛、眩晕、腰痛、抽搐和意识不清等。不同部位SFT 患者肿瘤直径比较差异有统计学意义。中枢神经系统、上呼吸道及眼眶肿瘤直径小于女性生殖道、腹腔、皮下软组织、肺及胸膜, 提示中枢神经系统、上呼吸道及眼眶部位由于特殊的解剖部位, 所以临床症状出现较早, 这与患者就医及时有关。
SFT 典型形态表现主要集中于低和中危险组, 表现为肿瘤细胞形态温和, 呈梭形、卵圆形, 核仁不明显, 分为丰富区和稀少区, 两区交替出现, 呈杂乱性交织状或条束状生长, 有明显的血管外皮瘤样或特征性的鹿角样分枝状薄壁血管。高危险组肿瘤细胞密度明显增加, 异型性显著, 核分裂像多见。中枢神经系统、上呼吸道和眼眶SFT 主要出现在低危险组, 女性生殖道、腹腔、皮下软组织、肺与胸膜SFT 出现在中和高危险组。发生于不同部位的相同危险组肿瘤组织学形态无明显差异。有研究[13]显示:在中枢神经系统复发的SFT 中常并发明显的黏液变性。86 例患者中, 在中枢神经系统、女性生殖道、腹腔、皮下软组织、肺及胸膜间质中均见不同程度的黏液变性。近年来研究[14-18]显示:SFT 可出现特有的NAB2-SATA6融合基因,而且免疫组织化学染色阳性表达STAT-6 被确定为NAB2-SATA6 的替代标志物。86 例患者STAT-6 免疫组织化学染色均为核弥漫强阳性表达, 表明STAT-6 是SFT 病理诊断中敏感及特异的免疫表型。肿瘤细胞还不同程度阳性表达CD34、Bcl-2 和CD99, 阳性率依次为81.4%、75%和71.1%, 说明三者是SFT 病理诊断的辅助免疫表型。
组织病理学上, SFT 需要与许多具有梭形细胞的良恶性肿瘤相鉴别, 主要依据所在的部位而定, SFT 主要与下列疾病鉴别:①单相性滑膜肉瘤。形态一致的梭形细胞致密片状或条束状排列, 局灶呈现血管外皮瘤样, 肿瘤细胞胞浆稀少, 核仁不明显。免疫组织化学标志物Keratin 和(或)EMA 可以呈现不同程度阳性, TLE-1 弥漫阳性表达有助于鉴别诊断, 且大部分肿瘤可检测到SS18基因重排。②富于细胞性血管纤维瘤。形态和免疫表型与SFT 均有重叠, 温和梭形细胞呈栅栏状、旋涡状或短条束状排列, 可有绳索状胶原纤维及间质黏液变性, 有明显的中小血管, 并常伴玻璃样变性, 大多数患者CD34 阳性, 但STAT-6 阴性, 且Rb 表达缺失。③软组织血管纤维瘤。肿瘤边界清, 常有纤维性包膜, 温和一致的梭形细胞分布于黏液样至胶原化间质中, 小血管丰富, 可有鹿角样血管, 核分裂像罕见, EMA 灶状阳性, CD34 和STAT-6 阴性。④纤维性脑膜瘤。梭形细胞平行、席纹状或束状交叉排列, 间质富于胶原纤维, 细胞形态相对温和, 常表达PR、EMA 和SSTR2, 不表达CD34 及STAT-6。⑤胃肠道间质瘤。梭形细胞呈条索、交织状、旋涡状或片状排列, 瘤细胞形态相对一致, 无明显异型性, 也可见鹿角样分枝状血管, 且CD34 可以阳性表达, 但大部分病例CD117 和DOG-1 阳性, STAT-6 阴性。⑥双表型鼻腔鼻窦肉瘤。肿瘤界限不清, 浸润性生长, 丰富的梭形细胞呈束状生长, 细胞形态单一, 核纤细、常有重叠, 间质可有纤细的胶原纤维, S-100 和SMA 阳 性, β-catenin 核 阳 性, CD34 及STAT-6阴性。
61 例患者获得随访信息, 其中10 例患者出现复发, 女性7 例, 男性3 例。低危险组6 例, 复发部位分别为皮下组织、肺及胸膜、眼眶及女性生殖道SFT;中危险组2 例, 均为女性生殖道SFT;高危险组2 例, 均为腹腔SFT。高危险组患者复发最早且复发比例最高, 中和低危险组也出现复发病例, 说明危险度分级不能完全反映预后, 同时也再次证实学者[19]的观点, 即使是低危险组的SFT 也不排除有复发和转移的可能性。复发患者中女性多于男性, 分析原因可能为发生于女性生殖道的肿瘤复发率最高。10 例复发病例中有8 例在5 年内复发, 复发率为9%, 2 例在10 年内复发, 复发率为2%。研究[20]显示:5 年内复发率为10%~40%, 而15 年以后很少复发。本研究结果显示:复发病例中肿瘤平均直径为7.8 cm、平均核分裂象为4.8 个/10 HPF, 与文献[21-24]报道相近。目前一致认为手术切除是治疗SFT 的主要方法, 切缘阴性已经被证明可以降低局部复发率和提高总生存率。对于切除某些具有高风险特征的SFT, 如手术切缘阳性及核分裂象计数高, 辅助放疗可以防止局部复发[25]。本研究结果显示:3 例SFT 患者因手术切缘阳性行术后辅助放疗, 原发部位分别是肺部2 例和腹腔1 例, 其中1 例患者肺部复发2 次、腹腔复发4 次。孤立性纤维性肿瘤复发不仅与病理指征(肿瘤直径、核分裂象计数和是否并发坏死)有关, 还与发病部位及切缘情况息息相关。因此, 综合认识和处理SFT 对患者预后有重要意义, 无论术后危险度分级情况如何, 均应长期定期随访。
本文作者总结了86 例原发生于不同部位的SFT 患者临床资料显示:不同部位的肿瘤直径比较差异有统计学意义。发生于颅内的肿瘤比发生于盆腹腔的肿瘤直径小且不易出现出血、坏死。这均与肿瘤发生的特殊部位息息相关。核分裂象≥4 个/10 HPF 和高危险组是患者无进展生存期缩短的危险因素。多因素综合分析结果显示:患者的性别、年龄、肿瘤直径、核分裂象、是否并发坏死和危险度分级均非患者无进展生存期缩短的独立危险因素。肿瘤危险度分级不能完全反映预后。由于失访病例较多, 且不同部位的患者数较少, 所以本文作者未对不同部位SFT 患者的预后进行比较, 在未来研究中将继续积累并随访相关患者, 提供更为全面的预后分析。
