健脾化瘀祛痰法对apoA-Ⅰ/AMPK/CPT1A 信号通路介导的脂肪酸β 氧化改善血脂异常的调控作用及其机制
2022-12-15赵秋宇隋国媛刘慧慧翟亚荣裘雪莹孟嘉伟贾连群
张 琦, 赵秋宇, 隋国媛, 刘慧慧, 翟亚荣, 于 宁, 王 杰, 裘雪莹, 孟嘉伟, 贾连群
(1. 辽宁中医药大学 中医脏象理论及应用教育部重点实验室, 辽宁 沈阳 110847;2. 辽宁中医药大学中西医结合学院, 辽宁 沈阳 110847)
《中国心血管健康与疾病报告2020》[1]显示:我国心血管疾病患病人数高达3.3 亿。2018 年, 心血管病位居城乡居民总死亡原因的首位。心血管疾病正逐步危害国民健康, 防治心血管疾病迫在眉睫。
影响心血管疾病的因素众多, 其中, 血脂异常被认为是最主要危险因素之一[2]。血脂异常通常指血清中胆固醇和(或) 甘油三酯(triglyceride, TG)水平升高, 实际上血脂异常也泛指包括低高密度脂蛋白胆固醇 (high-density lipoprotein cholesterol, HDL-c)血症在内的各种血脂异常[3]。脂肪酸β 氧化减弱导致TG 水平升高是血脂异常发生的病理学基础之一。脂肪酸β 氧化是指肝细胞脂肪酸活化成脂酰辅酶A 后通过肉毒碱棕榈酰转移酶ⅠA(carnitine palmitoyl transferase 1A, CPT1A)转运至线粒体中进行氧化的过程[4]。有研究[5]显示:载脂蛋白AⅠ(apolipoprotein AⅠ, apoA-Ⅰ)可能通过单磷酸腺苷激活蛋白激酶(adenosine monohposphate-activated protein kinases, AMPK)通路对CPT1A 进行调控, 进而影响脂肪酸β 氧化, 改善TG 水平。中医学中无血脂异常的概念, 有学者提出高血脂为血中之痰浊[6]。脾虚运化失司, 水谷精微无法正常输布, 在体内聚而为痰, 痰浊阻滞脉道, 痰瘀互结, 发生血脂异常[7]。本课题组前期研究[8]显示:以健脾化瘀祛痰为基础进行组方的 化 瘀 祛 痰 方 (Huayu Qutan Precription, HYQTP)对于改善脂代谢紊乱效果显著。因此本研究选用高脂血症大鼠探讨健脾化瘀祛痰法是否可以通过apoA-Ⅰ/AMPK/CPT1A 信号通路影响脂肪酸β 氧化继而改善TG 水平, 为健脾化瘀祛痰法临床防治高脂血症提供可能。
1 材料与方法
1.1 实验动物、主要试剂和仪器32 只清洁级健康SD 大鼠, 体质量170~210 g, 动物生产合格证号:SCXK(辽)2015-0001, 购于辽宁长生生物科技有限公司。动物饲养于辽宁中医药大学实验动物中心, 动物使用许可证号:SYXK (辽) 2013-0009, 室内湿度保持为(55±15)%, 温度保持为(20±2)℃, 光照条件为12 h 光照、12 h 黑暗。本实验在辽宁中医药大学实验动物伦理委员会批准下进行, 实验动物伦理审查编号:21000092018017。HYQTP(专利号:ZL200710010845.9)组成:炙黄芪20 g、党参15 g、茯苓15 g、丹参15 g、绞股蓝15 g、法半夏10 g、郁金10 g、石菖蒲10 g 和川芎10 g, 以上药物均由辽宁中医药大学附属医院实验中心提供并煎煮。辛伐他汀(批号L036325)购于杭州默沙东制药有限公司, BCA 蛋白定量试剂盒(批号CW0014S)、蛋白裂解液(批号CW2333)反转录试剂盒和实时荧光定量PCR 试剂盒购于北京康为世纪生物科技有限公司, 总RNA 提取试剂盒(批号287896)购于美国Promega 公司, 水合氯醛(批号S24149)购于上海源液生物科技有限公司, HE 染色试剂盒(批号MB9898-Jun-11G) 购于大连美仑生物科技有限公司, 油红O 染色试剂盒(批号052521210730)购于北京碧云天生物科技有限公司, B 类Ⅰ型清道夫受体(scavenger receptor class B type-1, SR-B1)(货号bs-23976R) 和磷酸化腺苷单磷酸活化蛋白激酶抗体(phospho rylated AMP-activated protein kinases, p-AMPK)(货号bs-4002R) 购于北京博奥森生物技术有限公司, AMPK (货号5832) 购于美国Cell Signaling Technology 公司, CPT1A(批号66039-1-Ig)购于武汉Proteintech 公司, 总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇 (low density lipoprotein cholesterol, LDL-c) 和TG 试剂盒购于南京建成生物工程研究所有限公司, apoA-Ⅰ(货号ml059546-1)试剂盒购于上海酶联公司。化学发光成像系统(型号Tanon-5200) 购于上海天能科技有限公司, 全自动生化分析仪(型号7180) 购于日本日立电子公司, 垂直电泳槽(型号1658001)和电泳仪(型号PowerPacTMBasic)购于美国Bio-Rad 公司, 高速冷冻离心机(型号ThermoST16R)购于美国赛默飞世尔科技有限公司,实时荧光定量PCR (real-time fluorescence quantification PCR, RT-qPCR)仪(型号7500)购于美国AppliedBiosystems 公司。
1.2 实验动物模型制备和分组32 只SPF 级SD大鼠适应性喂养2 周后, 随机分为空白对照组、模型组、HYQTP 组和辛伐他汀组, 每组8 只。空白对照组大鼠每日给予基础饲料, 模型组、辛伐他汀组和HYQTP 组大鼠每日给予高脂饲料(15.0%猪油、20.0% 蔗糖、1.2% 胆固醇、0.2% 胆盐和0.2%甲基硫氧嘧啶并配合83.3%普通饲料), 对大鼠饮水和摄食不设限制, 制备高脂血症大鼠模型。8 周后, 喂食方法不变, 按照人和动物的体表面积折算系数并换算给药剂量, 进行灌胃给药, 辛伐他汀组大鼠给予药物剂量为1.575 mg·kg-1·d-1, 化瘀祛痰方组大鼠给予药物剂量为13.846 g·kg-1·d-1, 空白对照组与模型组大鼠每日给予等体积的生理盐水灌胃, 连续4 周。
1.3 生化分析仪检测各组大鼠血脂水平实验动物在空腹后12 h 进行取材, 实验取材当天称质量, 10% 水合氯醛麻醉后取腹主动脉血, 将血液装入促凝试管中, 在4 ℃冰箱静置30 min 后, 3 500 r·min-1离心15 min, 分离上层上清置于1.5 mL 管中, 采用全自动生化分析仪检测各组大鼠TC、TG、LDL-c 和HDL-c 水平, 剩余样本储存于-20 ℃待用。
1.4 HE 染色检测各组大鼠肝组织病理形态表现
将各组大鼠肝组织置于4%多聚甲醛中固定, 梯度乙醇脱水、二甲苯透明后制备石蜡切片, 切片厚度4 μm。采用HE 染色试剂盒进行染色, 二甲苯脱蜡、梯度乙醇水化, 苏木素染色液浸染20 min, 自来水浸泡20 min, 伊红染色液浸染2 min, 分化液分化30 s, 自来水冲洗3 次, 二甲苯透明, 梯度乙醇脱水, 中性树胶封片, 光镜下观察各组大鼠肝组织病理形态表现。
1.5 油红O 染色检测各组大鼠肝脏脂质沉积情况制备肝组织冰冻切片, 切片厚度10 μm。将切片置于染色洗涤液, 吸出染色洗涤液, 加入适量油红O 染色液, 染色15 min, 洗涤液清洗, 苏木素染色液复染20 min, 自来水清洗, 水性封片液封片, 光镜下观察各组大鼠肝组织脂质沉积情况。
1.6 各组大鼠肝脏组织中TG 水平检测取0.1 g肝组织按照1∶9 的比例加入0.9 mL 无水乙醇, 机械匀浆后以2 500 r·min-1离心10 min, 取上清。按照试剂盒说明书要求在96 孔细胞培养板中加入工作液, 随后37 ℃水浴10 min, 采用酶标仪测定吸光度(A) 值, 并根据公式计算TG 水平。TG 水平=(样本A 值-空白A 值)/(校准A 值-空白A 值)×校准品浓度/(肝组织质量/处理组织时加入的无水乙醇的总体积)。
1.7 ELISA 法检测各组大鼠肝组织中apo A-Ⅰ水平在组织标本中以1∶9 的比例加入预冷的PBS溶液, 离心取上清。在96 孔细胞培养板中设置标准品孔、空白孔和样品孔后加样, 并采用样品稀释液将样品进行5 倍稀释。加入酶标试剂后, 37 ℃水浴60 min, 并在此期间将浓缩洗涤液稀释20 倍备用。水浴后撕掉封板膜, 甩干, 加入洗涤液, 反复5 次拍干。加入显色剂, 避光孵育15 min 后终止显色。采用酶标仪测量A 值, 根据标准曲线计算肝组织中apoA-Ⅰ水平。
1.8 RT-qPCR 法检测各组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA 表达水平取0.02 g 肝组织, 采用试剂盒提取肝组织总RNA, 检测总RNA浓度, 当RNA 纯度为1.8~2.1 时, 将样品总RNA浓度稀释为200 mg·L-1, 之后将RNA 逆转录为cDNA。按照说明书要求设定好PCR 反应条件后, 检 测mRNA 表 达 水 平, 采 用2-ΔΔCt法[ΔΔCt=(实验组目的基因Ct 值-实验组内参基因Ct 值)-(对照组目的基因Ct 值-对照组内参基因Ct 值)]进行相对定量分析。引物由赛默飞世尔科技(中国)有限公司设计, 引物序列见表1。
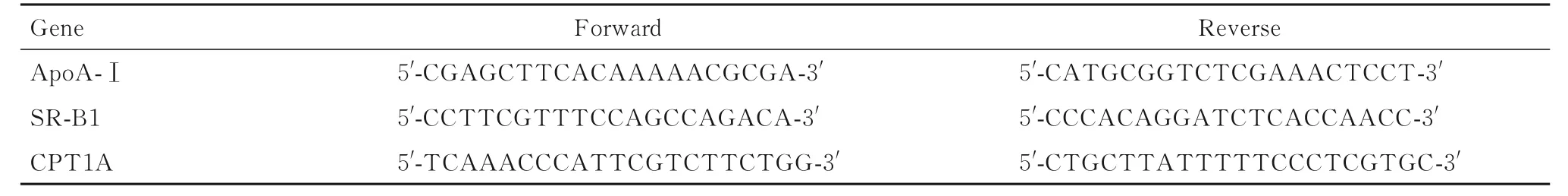
表1 目的基因引物序列Tab.1 Primer sequences of target genes
1.9 Western blotting 法检测各组大鼠肝组织中SR-B1、AMPK、p-AMPK 和CPT1A 蛋 白 表 达 水平取0.1 g 肝组织, 加入1 mL 裂解液后在冰上进行机械匀浆, 4 ℃、13 000 r·min-1离心10 min, 取上清。采用BCA 法定量测算蛋白表达水平。根据定量结果, 计算上样体积, 上样后, 进行电泳操作以及转膜, 转膜后采用5%脱脂奶粉在室温条件下封闭1 h。封闭结束后加入一抗, 4 ℃摇床封闭过夜。第2 天采用TBST 缓冲液清洗2 次, 每次10 min。TBST 缓冲液将一抗洗净后加入二抗, 采用1∶7 000 比例稀释二抗, 在室温条件下摇床孵育1 h, 再次采用TBST 缓冲液清洗3 次, 每次10 min。滴加曝光液对条带进行曝光, 计算条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.10 统计学分析采用Prism 8.0 统计软件对数据进行统计学分析。各组大鼠血清TC、TG、LDL-c 和HDL-c 水平, 肝组织中TG 和apoA-Ⅰ水平, 肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA表达水平及SR-B1、AMPK、p-AMPK 和CPT1A蛋白表达水平均符合正态分布, 以-x±s 表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠血清血脂水平与空白对照组比较, 模型组大鼠血清TG、TC 和LDL-c 水平升高, 血清HDL-c 水平降低(P<0.05);与模型组比较, 辛伐他汀组和HYQTP 组大鼠血清TG、TC 和LDL-c 水平降低(P<0.05), 血清HDL-c 水平升高(P<0.05);HYQTP 组大鼠血清TG、TC 和LDL-c 水平与辛伐他汀组比较差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清TC、TG、LDL-c 和HDL-c 水平Tab. 2 Levels of TC, TG, LDL-c, and HDL-c in serum of rats in various groups [n=8, -±s, cB/(mmol·L-1)]
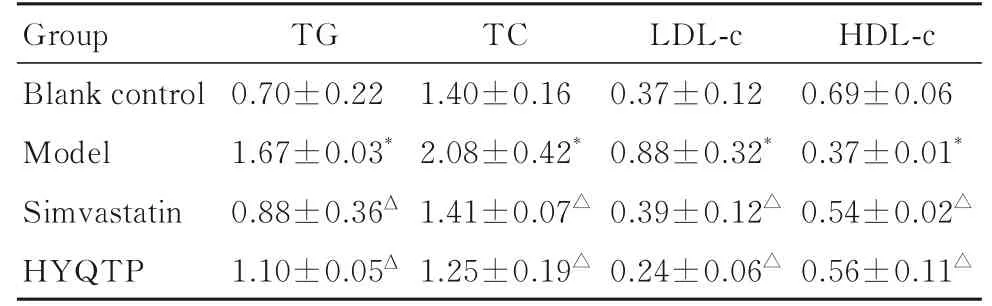
表2 各组大鼠血清TC、TG、LDL-c 和HDL-c 水平Tab. 2 Levels of TC, TG, LDL-c, and HDL-c in serum of rats in various groups [n=8, -±s, cB/(mmol·L-1)]
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
HDL-c 0.69±0.06 0.37±0.01*0.54±0.02△0.56±0.11△Group Blank control Model Simvastatin HYQTP TG 0.70±0.22 1.67±0.03*0.88±0.36Δ 1.10±0.05Δ TC 1.40±0.16 2.08±0.42*1.41±0.07△1.25±0.19△LDL-c 0.37±0.12 0.88±0.32*0.39±0.12△0.24±0.06△
2.2 各组大鼠肝组织病理形态表现空白对照组大鼠肝组织结构完整, 肝细胞无明显变性, 胞质内无空泡, 肝索排列整齐;模型组大鼠出现脂肪变性, 肝细胞肿大, 细胞质内含有大量脂肪滴空泡;HYQTP 组和辛伐他汀组大鼠肝脏中可见少量肝细胞体积增大, 肝小叶结构较清晰, 胞质内散在少量圆形脂滴, 病理改变程度明显减轻。见图1。
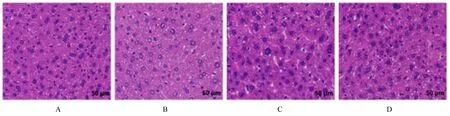
图1 各组大鼠肝组织病理形态表现(HE, ×200)Fig.1 Pathomorphology of liver tissue of rats in various groups (HE,×200)
2.3 各组大鼠肝组织脂质沉积情况空白对照组大鼠肝细胞结构正常, 肝细胞无脂滴沉积;模型组大鼠肝细胞脂肪变性明显, 可见大量红色脂滴和空泡存在于包浆及细胞边缘;HYQTP 组和辛伐他汀组可见少量肝细胞脂肪变性, 脂滴分布明显减少。见图2。
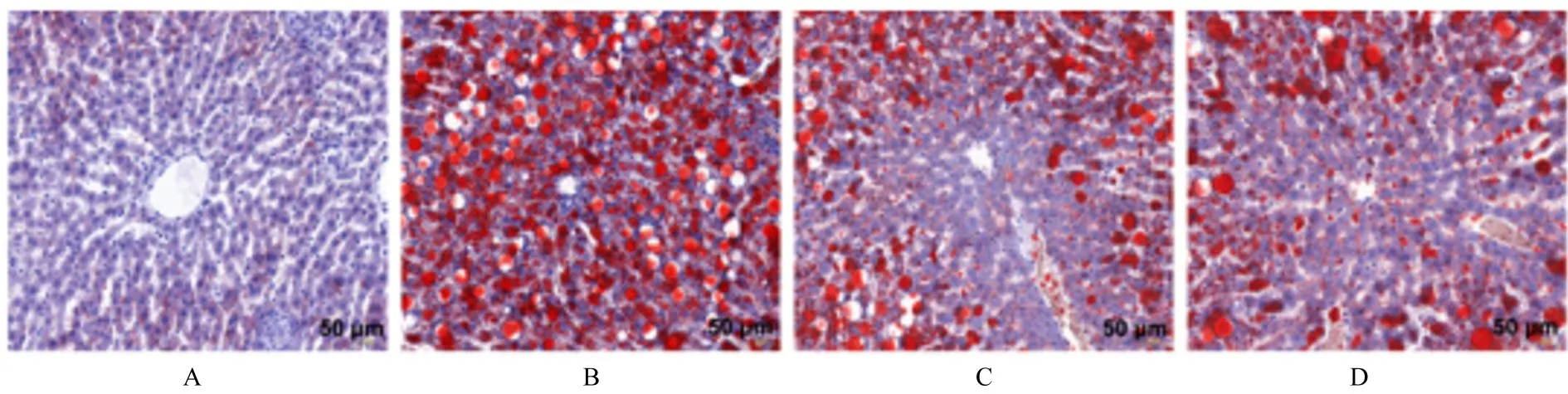
图2 各组大鼠肝组织脂质沉积情况(油红O, ×200)Fig.2 Lipid deposition in liver tissue of rats in various groups (Oil red O,×200)
2.4 各组大鼠肝组织中TG 和apoA-Ⅰ水平与空白对照组比较, 模型组大鼠肝组织中TG 水平升高(P<0.05), apoA-Ⅰ水平降低(P<0.05);与模型组比较, HYQTP 组与辛伐他汀组大鼠肝组织中TG 水平降低(P<0.05), apoA-Ⅰ水平升高(P<0.05);与辛伐他汀组比较, HYQTP 组大鼠肝组织中TG 水平差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠肝组织中TG 和apoA-Ⅰ水平Tab. 3 Levels of TG and apoA-Ⅰin liver tissue of rats in various groups (n=8, -±s)

表3 各组大鼠肝组织中TG 和apoA-Ⅰ水平Tab. 3 Levels of TG and apoA-Ⅰin liver tissue of rats in various groups (n=8, -±s)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
apoA-Ⅰ[ρB/(ng·L-1)]8.166±0.223 7.006±0.170*7.930±0.454△7.747±0.183△Group Blank control Model Simvastatin HYQTP TG [mB/(mmol·g-1)]0.009±0.001 0.017±0.001*0.011±0.002△0.013±0.002△
2.5 各组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA 表达水平与空白对照组比较, 模型组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA 表达水平降低(P<0.05);与模型组比较, 辛伐他汀组和HYQTP 组大鼠肝组织中apoA-Ⅰ、SR-B1和CPT1A mRNA 表达水平升高(P<0.05);与辛伐他汀组比较, HYQTP 组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA 表达水平差异无统计学意义(P>0.05)。见表4。
表4 各组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA表达水平Tab.4 Expression levels of apoA-Ⅰ,SR-B1,and CPT1A mRNA in liver tissue of rats in various groups (n=8, -±s)
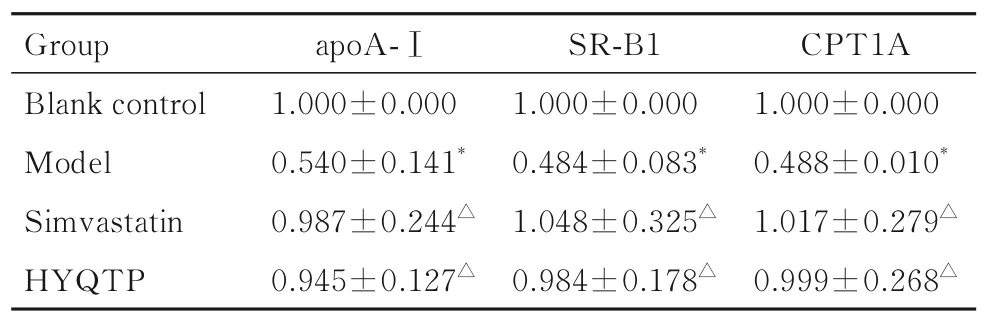
表4 各组大鼠肝组织中apoA-Ⅰ、SR-B1 和CPT1A mRNA表达水平Tab.4 Expression levels of apoA-Ⅰ,SR-B1,and CPT1A mRNA in liver tissue of rats in various groups (n=8, -±s)
*P<0.05 compared with blank control group;△P<0.05 compared with model group.
CPT1A 1.000±0.000 0.488±0.010*1.017±0.279△0.999±0.268△Group Blank control Model Simvastatin HYQTP apoA-Ⅰ1.000±0.000 0.540±0.141*0.987±0.244△0.945±0.127△SR-B1 1.000±0.000 0.484±0.083*1.048±0.325△0.984±0.178△
2.6 各组大鼠肝组织中SR-B1、AMPK、p-AMPK和CPT1A 蛋白表达水平与空白对照组比较, 模型组大鼠肝组织中SR-B1 和CPT1A 蛋白表达水平降低, p-AMPK/AMPK 比值降低(P<0.05);与模型组比较, 辛伐他汀组和HYQTP 组大鼠肝组织中SR-B1 和CPT1A 蛋白表达水平及p-AMPK/AMPK 比值升高(P<0.05);与辛伐他汀组比较, HYQTP 组大鼠肝组织中p-AMPK/AMPK 比值和CPT1A 蛋白表达水平差异无统计学意义(P>0.05), 而大鼠肝组织中SR-B1 蛋白表达水平降低(P<0.05)。见图3 和表5。
表5 各组大鼠肝组织中SR-B1 和CPT1A 蛋白表达水平及p-AMPK/AMPK 比值Tab. 5 Expression levels of SR-B1 and CPT1A proteins and p-AMPK/AMPK ratios in liver tissue of rats in various groups (n=8, -±s)
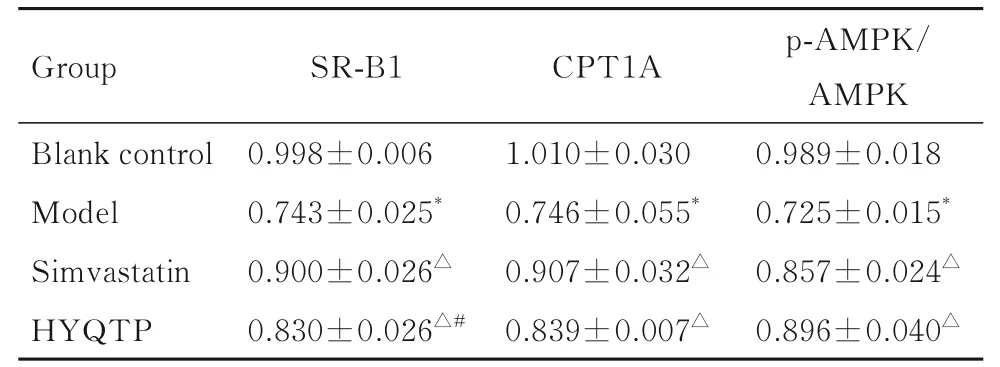
表5 各组大鼠肝组织中SR-B1 和CPT1A 蛋白表达水平及p-AMPK/AMPK 比值Tab. 5 Expression levels of SR-B1 and CPT1A proteins and p-AMPK/AMPK ratios in liver tissue of rats in various groups (n=8, -±s)
*P<0.05 compared with blank control group;△P<0.05 compared with model group;#P<0.05 compared with simvastatin group.
p-AMPK/AMPK 0.989±0.018 0.725±0.015*0.857±0.024△0.896±0.040△Group SR-B1 CPT1A Blank control Model Simvastatin HYQTP 0.998±0.006 0.743±0.025*0.900±0.026△0.830±0.026△#1.010±0.030 0.746±0.055*0.907±0.032△0.839±0.007△
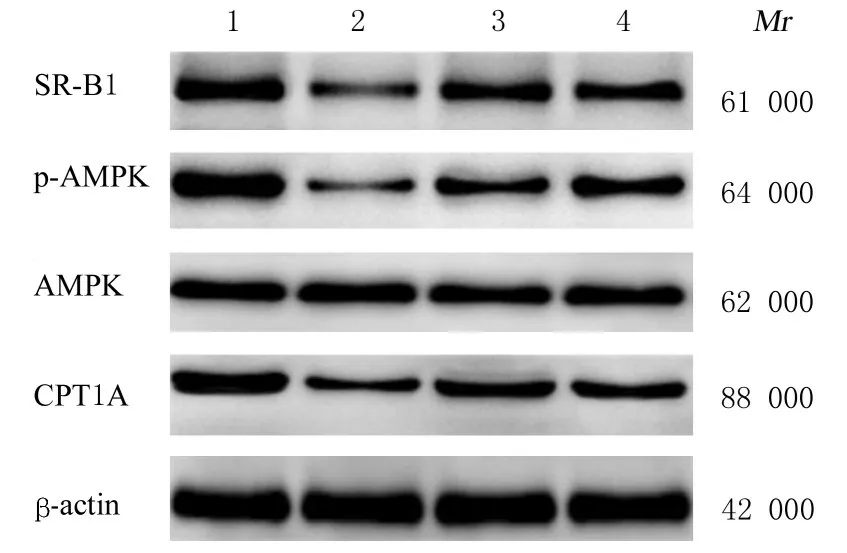
图3 各组大鼠肝组织中SR-B1、p-AMPK、AMPK 和CPT1A 蛋白表达电泳图Fig.3 Electrophoregram of expressions of SR-B1,p-AMPK, AMPK, and CPT1A proteins in liver tissue of rats in various groups
3 讨 论
血脂是指血清中TG、TC 和类脂等物质的总称, 临床发生血脂异常主要是血脂异常升高, 即高脂血症[9]。中医学将血脂异常归属于气血津液病变的范畴, 王绵之教授[10]认为本病之本为脾虚气弱, 标为痰瘀气滞, 为本虚标实。张昶《百病问对辨疑》云:“痰病根源有二……痰之动, 湿也, 主于脾, 脾土衰则湿胜, 湿为火灼, 化湿为痰”。脾主运化, 输布水谷精微。一旦出现过食肥甘厚腻、劳逸失常或先天禀赋不足等情况, 脾的输布功能出现异常, 水谷精微不化而生痰浊, 痰浊在血脉中蓄积, 痰瘀互结, 膏脂转输障碍进而造成血脂异常。本课题组前期研究[11]显示:健脾化瘀祛痰法可以有效改善膏脂输布失常。化瘀祛痰方中重用党参、黄芪, 意在健脾化瘀祛痰;茯苓、半夏、石菖蒲重在祛痰;痰浊壅塞脉道, 滞而为瘀, 加入丹参、郁金、川芎以活血;绞股蓝有降脂的功效。此九味药相辅相成, 重在健脾, 气血兼顾, 方中亦加入降血脂的药物, 中西融合。本研究结果显示:与空白对照组比较, 模型组大鼠血清TG、TC 和LDL-c 水平升高, HDL-c 水平降低, 证明高脂血症大鼠造模成功。与模型组比较, 辛伐他汀组和HYQTP 组大鼠血清TG、TC 和LDL-c 水平降低, HDL-c 水平升高, 肝组织中TG 水平降低;此外肝组织病理改变程度明显减轻, 脂肪变性程度和脂质沉积明显减少, 可见HYQTP 处理可以在一定程度上纠正高脂血症大鼠的血脂紊乱, 改善TG 代谢异常, 减少脂质沉积。
脂肪酸β 氧化发生在线粒体内, 是TG 代谢的重要途径之一。脂肪酸首先被脂酰辅酶A 合酶活化为脂酰辅酶A, 随后被肉毒碱棕榈酰转移酶1(carnitine palmitoyl transferase 1, CPT1)捕获生成脂酰肉碱, 在CPT1 的作用下进入线粒体内通过脱氢, 水合, 再脱氢, 硫化后最终生成酮体, 以酮体的 形 式 进 行 供 能[4]。CPT1 在 脂 肪 酸β 氧 化 中 扮 演重要角色, 是关键限速酶, BONNEFONT 等[12]发现:CPT1 在肝组织中一般表达为CPT1A。本研究结果显示:与空白对照组比较, 模型组大鼠肝组织中CPT1A 表达水平降低;与模型组比较, HYQTP 组大鼠肝组织中CPT1A 表达水平升高, 说明当机体发生血脂异常时, 可能是由于脂肪酸β氧化发生减少, TG 代谢异常;经HYQTP 干预后, 脂肪酸β 氧化水平明显升高, TG 水平降低, 提示HYQTP 可能通过促进CPT1A 表达水平进而调控TG 代谢。
有研究[13-14]显示:CPT1A 表达受乙酰辅酶A羧化酶(acetyl-coA carboxylase, ACC) 或过氧化物酶体增殖物激活受体-γ 共激活因子1α(PPAR coactivator-1α, PGC1α) 等 多 种 因 子 的 调 控, 研究[5]显示:ACC 可能在CPT1A 调控中扮演关键角色。ACC 表达后使乙酰辅酶A 转化为丙二酰辅酶A, 丙二酰辅酶A 是CPT1A 的抑制剂, 从而抑制脂肪酸β 氧化的发生[15]。郝梦娇等[16]研究显示:黄芪可以通过AMPK 使ACC 磷酸化, 继而失活。AMPK 是细胞代谢的主要调节者, 肝组织中AMPK 在肝激酶(liver kinase B1, LKB1)的调控下发生磷酸化而激活[17-20], Western blotting 法检测结果显示:与空白对照组比较, 模型组大鼠肝组织中p-AMPK/AMPK 比值降低;与模型组比较, HYQTP 组大鼠肝组织中p-AMPK/AMPK 比值升高。模型组大鼠肝组织中AMPK 磷酸化水平降低, 进而ACC 磷酸化减少, 机体脂肪酸β 氧化的发生受到抑制, 给予HYQTP 干预后可能通过apoA-Ⅰ使AMPK 磷酸化表达水平升高, 继而促进CPT1A表达, 增加脂肪酸β 氧化的发生, 进而改善血脂异常。
RAO 等[21]构 建apoA-Ⅰ过 表 达 小 鼠 发 现:AMPK 磷酸化水平受apoA-Ⅰ调控。apoA-Ⅰ是HDL-c 的重要脂蛋白成分, 由243 个氨基酸组成[22], 主要通过与ABCA1 结合参与胆固醇逆向转运, 有研究[5]显示: apoA-Ⅰ也可以通过AMPK通 路 调 控 脂 肪 酸β 氧 化 的 发 生。SONG 等[23]通 过基因沉默证实:SR-B1 是apoA-Ⅰ激活AMPK 通路的重要受体, 二者结合继而激活LKB1 诱导AMPK发生磷酸化。本研究结果显示:与空白对照组比较, 高脂血症大鼠肝组织中apoA-Ⅰ和SR-B1 蛋白表达水平降低;HYQTP 组大鼠肝组织中apoA-Ⅰ和SR-B1 蛋白表达水平升高, 可见由于高脂血症大鼠肝组织中apoA-Ⅰ水平降低, 无法与SR-B1 受体结合, 继而降低AMPK 磷酸化水平, 给予化瘀祛痰方干预后, apoA-Ⅰ水平升高, 促进AMPK 磷酸化, 恢复机体脂肪酸β 氧化水平, 缓解TG 的代谢异常。
综上所述, 健脾化瘀祛痰法可以通过提高apoA-Ⅰ水平进而激活AMPK, 使p-AMPK 水平升高, 继而增加CPT1A 表达水平, 促进脂肪酸β 氧化, 降低TG 水平, 改善血脂异常。为进一步验证信号通路, 本课题组下一步将从细胞水平对其具体分子机制进行深入研究。
