1,25(OH)2D3联合黄芪多糖对体外骨骼肌细胞胰岛素抵抗的改善作用及其机制
2022-12-15刘东阁闫姝琪任淑萍
李 浩, 刘东阁, 闫姝琪, 任淑萍
(吉林大学公共卫生学院劳动卫生与环境卫生学教研室, 吉林 长春 130021)
胰岛素抵抗(insulin resistance, IR)是一种机体的病理生理状态, 主要发生在骨骼肌、脂肪和肝脏组织中, 其特征为胰岛素介导的靶器官对胰岛素作用的敏感性降低, 被认为是多种疾病的致病驱动因素[1-2]。当机体发生IR 时, 胰岛素和胰高血糖素分泌发生紊乱, 并可导致多种代谢疾病的发生, 例如高血糖症、2 型糖尿病(type 2 diabetes mellitus, T2DM)、代谢综合征、非酒精性脂肪肝病和动脉粥样硬化等[3-4]。研究[5-6]显示:氧化应激和炎症反应是导致IR 的重要因素。氧化应激能够激活核因子κB (nuclear factor kappa-B, NF-κB) 信号通路, 抑制胰岛素介导的胰岛素受体(insulin receptor, InsR) 和 胰 岛 素 受 体 底 物1 (insulin receptor substrate-1, IRS-1)的酪氨酸磷酸化, 导致胰岛素信号失活;炎症反应能够激活c-Jun N-末端激酶(c-Jun N-terminal kinase, JNK) 和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路, 干扰胰岛素信号的传导, 抑制葡萄糖转运进而发生IR[7-8]。骨化三醇[1, 25-dihydroxycholecalciferol, 1, 25(OH)2D3]是维生素D 的活性形式, 可抑制体内活性氧(reactive oxygen species, ROS) 的 产 生 并 下 调NF-κB 的 表达, 通过IRS-1/葡萄糖转运蛋白4 (glucose transporter 4, GLUT4)级联反应改善糖尿病模型中 的 葡 萄 糖 代 谢, 并 改 善IR[9]; 黄 芪 多 糖(astragalus polysaccharide, APS)是从黄芪干燥根中提取的一类大分子活性物质, 能够降低糖尿病大鼠模型体内的氧化应激水平, 增加GLUT4 的表达, 使胰岛素受体底物(insulin receptor substrate, IRS)表达数明显上调, 减轻IR[10]。然而, 目前尚未见关于二者联合作用缓解IR 的报道。本文作者在体外建立骨骼肌细胞IR 模型, 通过给予细胞APS 和(或)1, 25(OH)2D3, 探讨1, 25(OH)2D3联合APS 对骨骼肌细胞IR 的缓解作用及其机制, 为防治IR 提供科学依据。
1 材料与方法
1.1 细胞、主要试剂和仪器大鼠L6 成肌细胞购自中国科学院细胞库。DMEM 高糖培养基和胎牛血清(以色列BI 公司), CCK-8 试剂(美国APEx BIO 公司), 活性氧检测试剂盒和BCA 蛋白定量试剂盒(上海碧云天生物公司), ECL 发光试剂盒(上海莫纳生物科技有限公司), APS(北京索莱宝生物科技公司), 1, 25(OH)2D3(梯希爱化成工业发展有限公司), InsR、IRS-1、磷酸化胰岛素受体底物1(phosphorylated insulin receptor substrate 1, p-IRS-1)、p38 丝裂原活化蛋白激酶(p38 mitogenactivated protein kinase, p38 MAPK) 和 磷 酸 化P65 κB (phosphorylated P65, p-P65)抗体(美国CST 公 司), GLUT4、Toll 样 受 体4 (Toll-like receptor 4, TLR4)、HRP 标记的抗兔和抗小鼠抗体(美国Abcam 公司)、P65 抗体(武汉三鹰生物技术有限公司), 单核细胞趋化蛋白1(monocyte chemoattractant protein 1, MCP-1)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin-6, IL-6) 和 白 细 胞 介 素 10(interleukin-10, IL-10) ELISA 试 剂 盒(上 海Lengton 生物科技有限公司)。凝胶电泳系统、电转系统和实时定量PCR 仪(美国Bio-Rad 公司)。
1.2 L6 成肌细胞的培养和骨骼肌细胞的诱导和分化 L6 成肌细胞采用含10%胎牛血清和1%青链霉素双抗的DMEM 高糖培养基, 置于5% CO2、37 ℃细胞培养箱中进行培养。当细胞生长至70%~80% 时传代和冻存。L6 成肌细胞贴壁后, 在含10% FBS 的高糖DMEM 培养基中生长至70%~80%时, 更换为含2% FBS 的高糖DMEM培养基进行诱导分化。诱导分化培养4~7 d, 每48 h 换1 次培养液, 直至80%的细胞长出肌管, 表明骨骼肌细胞分化成熟。
1.3 体外骨骼肌细胞IR 模型的制备将状态良好且分化成熟的骨骼肌细胞接种于96 孔细胞培养板, 待细胞密度达到70%左右, 加入不同浓度(0.2、0.4、 0.6、 0.8 和 1.0 mmol·L-1) 棕 榈 酸(palmitic acid, PA) 溶液(建立IR 模型, 作为不同浓度PA 组, 同时设置对照组, 37 ℃培养12、24 和36 h 后, 弃去旧培养基, 加入不含血清的低糖DMEM 培养基, 37 ℃继续培养, 再加入100 nmol·L-1胰 岛 素 溶 液 作 用1 h 后, 采 用Beckman 全自动生化分析仪检测培养基中剩余葡萄糖浓度。模型建立成功标准:与对照组比较, PA组葡萄糖消耗率明显降低, 提示骨骼肌细胞IR 模型建立成功。
1.4 CCK-8 法检测各组骨骼肌细胞存活率将处于对数生长期的L6 成肌细胞以每孔1×105个的密度接种至96 孔细胞培养板中, 按照“1.2”步骤进行诱导分化。实验分为空白组、对照组和不同浓度(0.2、0.4、0.6、0.8 和1.0 mmol·L-1) PA 组, 各组设置6 个平行复孔, 置于培养箱中继续培养12、24 和36 h。采用APS 处理时将细胞分为空白组、对照组、PA 组、PA+不同浓度(25、50、100 和200 mg·L-1)APS 组。1, 25(OH)2D3处理时将细胞分为空白组、对照组、PA 组、PA+不同浓度(1、10、100 和1 000 nmol·L-1)1, 25(OH)2D3组。分化成熟后, 加入0.4 mmol·L-1PA 溶液作用24 h, 再加入上述不同浓度APS 或1, 25(OH)2D3溶液, 置于培养箱中继续培养24 h。取出细胞培养板, 每孔加入10 μL CCK-8 溶液, 混匀, 培养箱中继续孵育2 h, 然后轻轻振荡混匀, 在酶标仪490 nm 处测量各孔的吸光度(A)值。细胞存活率=[(实验孔A 值-空白孔A 值)/(对照孔A 值-空白孔A 值)]×100%。
1.5 己糖激酶法检测各组细胞培养上清中葡萄糖浓度将处于对数生长期的L6 成肌细胞以1×105个/孔的密度接种至96 孔细胞培养板中, 按照“1.2”步骤诱导分化。加入APS 处理后, 实验分为空白组、对照组、PA 组、PA+不同浓度(25、50、100和200 mg·L-1)APS组。加入1, 25(OH)2D3处理后实验分为空白组、对照组、PA 组、PA+不同浓度(1、10、100和1 000 nmol·L-1)1, 25(OH)2D3组。分化成熟后, 加入0.4 mmol·L-1PA 溶液作用24 h, 再加入上述不同浓度APS 或1, 25(OH)2D3溶液, 置于培养箱中继续培养24 h。吸取细胞上清液, 采用Beckman 全自动生化分析仪测定培养基中剩余葡萄糖浓度。
1.6 细胞分组和处理实验分为对照组(不进行任何处理)、PA 组(给予0.4 mmol·L-1PA 作用24 h)、PA+APS 组(给予0.4 mmol·L-1PA 作用24 h 后 再 给 予100 mg·L-1APS 作 用24 h)、PA+1, 25(OH)2D3组[给予0.4 mmol·L-1PA 作用24 h后再给予100 nmol·L-11, 25(OH)2D3作用24 h]和PA+APS+1, 25(OH)2D3组[给 予0.4 mmol·L-1PA 作 用24 h 后 再 给 予100 mg·L-1APS 和100 nmol·L-11, 25(OH)2D3作用24 h]。
1.7 L6 成肌细胞分化的鉴定L6 成肌细胞贴壁后, 按照上述方法进行诱导分化, 诱导分化培养4~7 d, 期间倒置显微镜下拍照并记录。
1.8 流式细胞术检测骨骼肌细胞中ROS 水平细胞经PA、APS 和1, 25(OH)2D3处理后, 采用无EDTA 的胰酶对细胞进行消化, 于15 mL 离心管中离心, 弃上清, 加入1 mL PBS 缓冲液重悬管底细胞, 移入2 mL EP 管中, 按照ROS 检测试剂盒的说明书进行操作。ROS 表达水平=实验组ROS阳性细胞百分率/对照组ROS 阳性细胞百分率。
1.9 ELISA 法检测各组细胞培养上清中IL-6、IL-10、TNF-α 和MCP-1 水平按照试剂盒说明书要求加样后, 以空白孔调零, 在450 nm 波长处依序测量各孔A 值。采用ELISA 法进行计算, 拟合模型采用Logistic 曲线(四参数)。根据ELISA 试剂盒说明书检测各组细胞上清液中MCP-1、IL-10、IL-6 和TNF-α 水平。
1.10 Western blotting 法检测各组骨骼肌细胞中胰岛素抵抗相关蛋白和氧化应激相关通路蛋白表达水平收集各组细胞, 采用含蛋白酶抑制剂的RIPA 裂解液提取总蛋白, 采用BCA 蛋白定量试剂盒检测细胞浓度, 调整为统一浓度后100 ℃、5 min进行蛋白变性, 于-20 ℃保存。加入蛋白样品进行电泳后, 转移至PVDF 膜上, 5%脱脂奶粉室温封闭2 h, 加入InsR、IRS-1、p-IRS-1、p38MAPK、P65、p-P65、GLUT4和TLR4一抗(1∶1 000), 4 ℃冰箱过夜;TBST 溶液清洗3 次后加入二抗(1∶2 000), 室温孵育2 h, TBST 洗膜后, 加入ECL显影液, 全自动化学发光成像分析系统进行曝光。以GAPDH 为内参, 采用Image J 软件分析目的蛋白表达水平。
1.11 统计学分析采用Excel 录入数据, 采用SPSS 24.0 统计软件进行统计学分析。各组细胞存活率、各组细胞上清中葡萄糖浓度、细胞中ROS水平、各组细胞培养上清中IL-6、IL-10、TNF-α和MCP-1 水平和目的蛋白表达水平符合正态分布且方差齐, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 L6 成肌细胞分化为骨骼肌细胞的鉴定倒置显微镜下观察L6 细胞复苏后, 约24 h 贴壁, 镜下可见细胞排列不规则, 无肌型结构, 细胞界限不清, 多数呈椭圆形或多角形等形态;细胞生长至70%~80%时, 采用含2%胎牛血清的DMEM 培养液诱导分化, 诱导第4 天可见细胞逐渐形成肌型结构, 排列规则, 呈长梭形;诱导7 d 后细胞融合形成较多明显的肌管, 表明诱导分化成功。见图1。
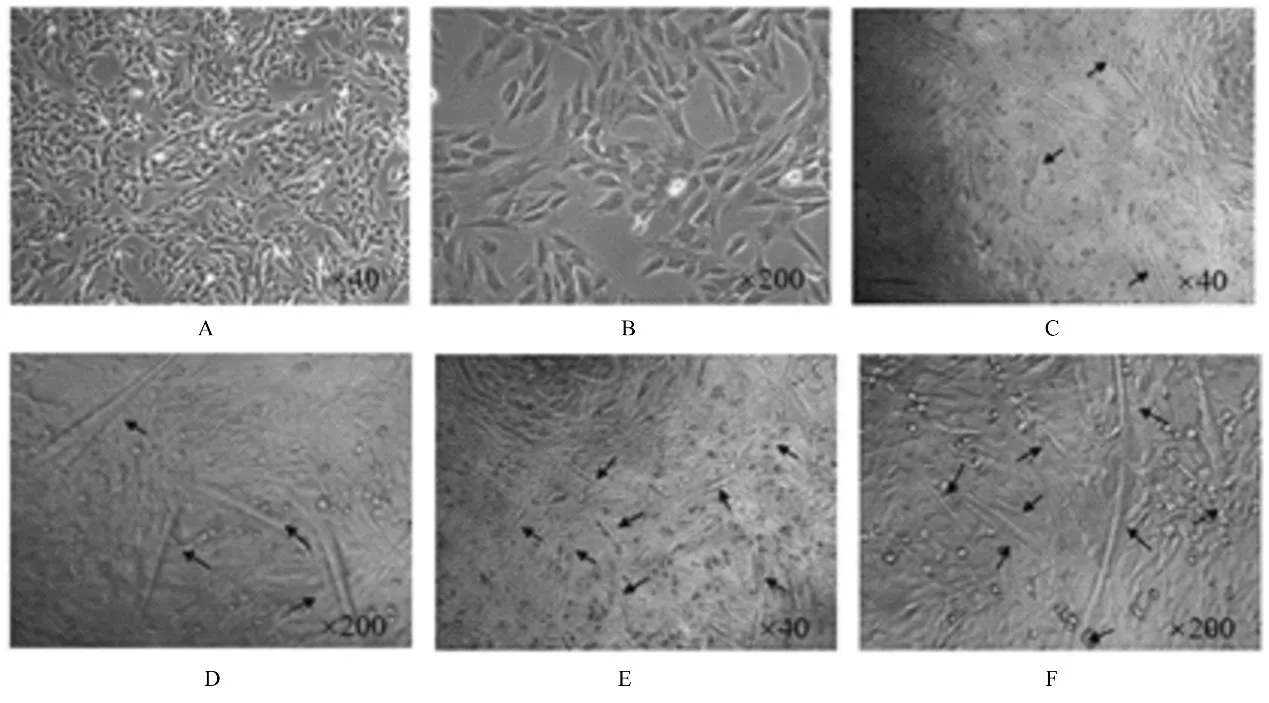
图1 诱导和分化后不同时间点各组骨骼肌细胞的形态表现Fig.1 Morphology of skeletal muscle cells in various groups at different time points after induction and differentiation
2.2 骨骼肌细胞IR 模型的评价诱导分化后的骨骼 肌 细 胞 与0.2、0.4、0.6、0.8 和1.0 mmol·L-1PA 溶液共同孵育12、24 和36 h, 随着PA 浓度的增加, 细胞存活率逐渐降低。与对照组比较, 作用12 h 时0.2 mmol·L-1PA 组细胞存活率差异有统计学意义(P<0.05)。作用24 h 时, 0.4 mmol·L-1PA 组细胞存活率达70%。随着PA 作用时间和浓度升高, 细胞上清中葡萄糖浓度升高, 说明细胞葡萄糖摄取能力降低。与对照组比较, 作用12 h 时1.0 mmol·L-1PA 组 和 作 用24 h 时0.4 mmol·L-1PA 组细胞上清中葡萄糖浓度比较差异有统计学意义(P<0.05)。细胞葡萄糖摄取能力随着PA 作用时间的增加和浓度的升高而明显降低, 说明IR 模型建立成功。因此, 本实验确定PA 造模浓度为0.4 mmol·L-1, 造模时间为24 h。各组骨骼肌细胞存活率见图2, 各组细胞上清中葡萄糖浓度见图3。
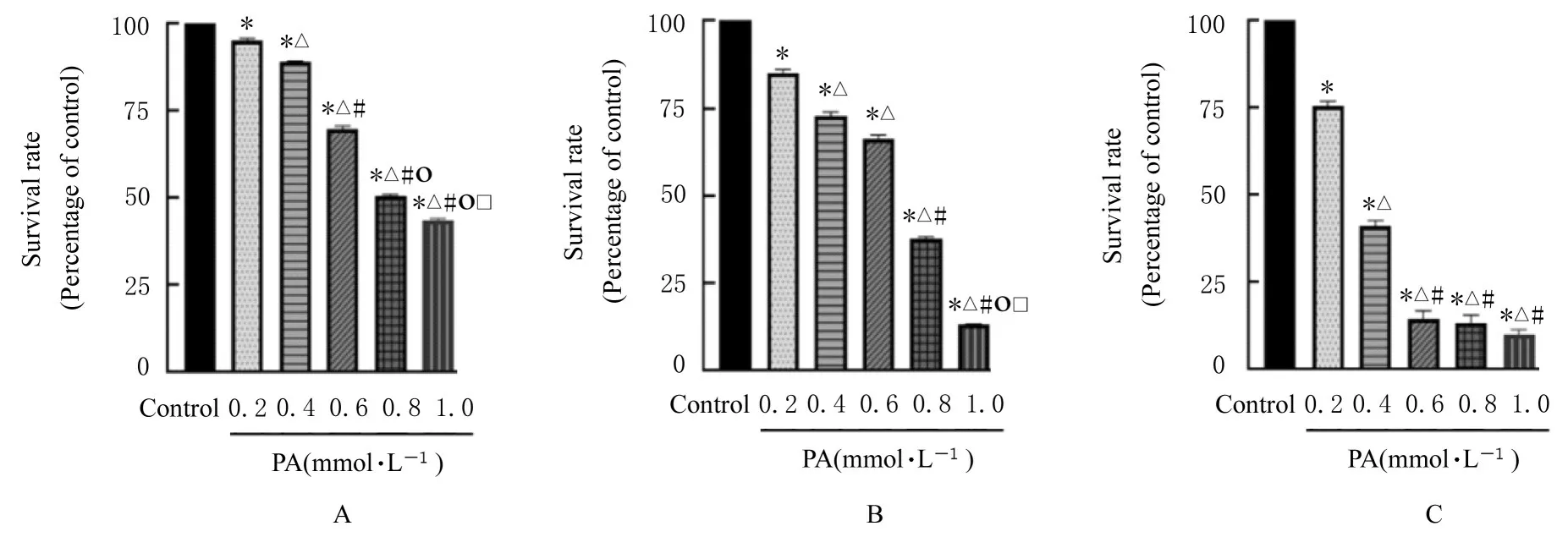
图2 各组骨骼肌细胞存活率Fig.2 Survival rates of skeletal muscle cells in various groups
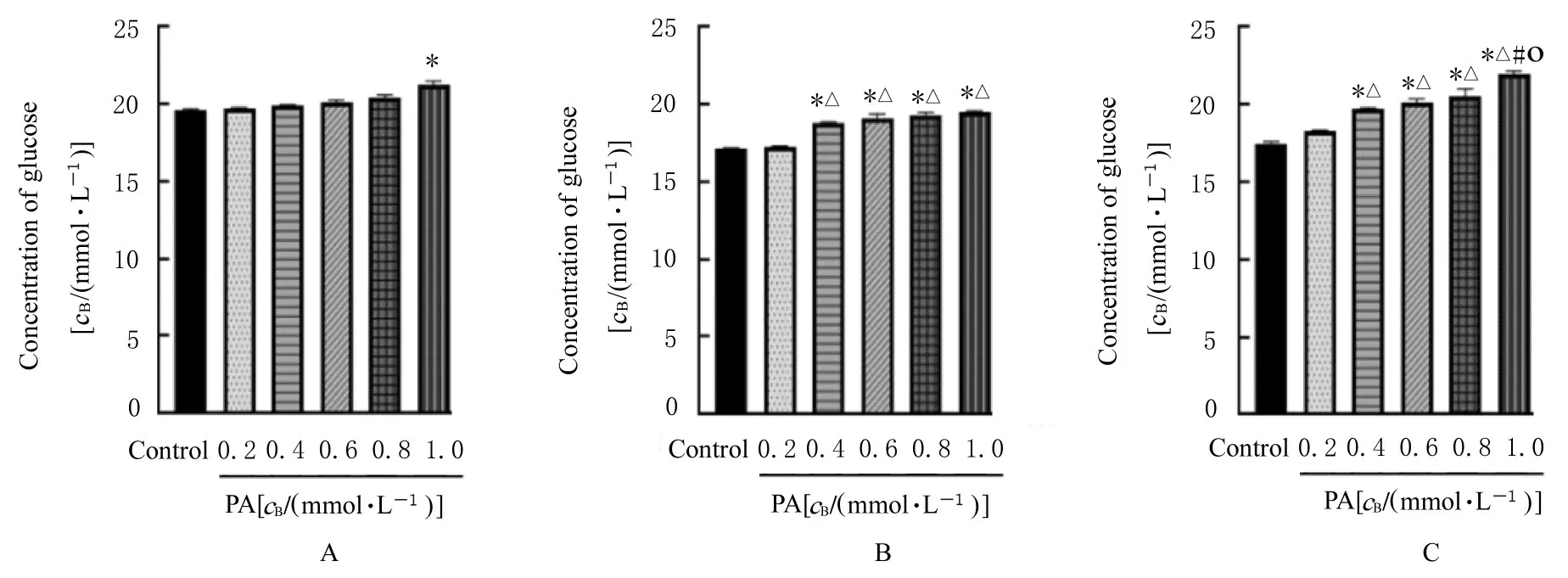
图3 各组骨骼肌细胞上清中葡萄糖浓度Fig.3 Concentrations of glucose in cell supernatant of skeletal muscle cells in various groups
2.3 APS 和1, 25(OH)2D3浓度的确定随着APS浓度的升高, 细胞存活率和葡萄糖摄取能力逐渐增强。与PA 组(20.62%±5.04%) 比较, 当APS浓度为100 mg·L-1时细胞存活率(54.62%±4.87%) 明 显 高 于PA 组, 因 此 本 实 验 选 择100 mg·L-1APS 进行后续实验。
随着1, 25(OH)2D3浓度的升高, 细胞存活率和葡 萄 糖 摄 取 能 力 逐 渐 增 强。 与 PA 组(32.24%±0.45%) 比较, 1, 25(OH)2D3浓度为100 nmol·L-1时, 细胞存活率(50.69%±2.20%)比较差异有统计学意义(P<0.05), 因此本实验选择100 nmol·L-11, 25(OH)2D3进行后续实验。
2.4 各组骨骼肌细胞中ROS 水平与对照组比较, PA 组骨骼肌细胞中ROS 水平明显升高(P<0.05);与PA 组比较, PA+APS 组、PA+1, 25(OH)2D3和PA+APS+1, 25(OH)2D3组骨骼肌细胞中ROS 水平明显降低(P<0.05);与PA+APS 组和PA+1, 25(OH)2D3组比 较, PA+APS+1, 25(OH)2D3组骨骼肌细胞中ROS 水平明显降低(P<0.05)。见图4 和表1。

表1 各组骨骼肌细胞中ROS 水平Tab. 1 Levels of ROS in skeletal muscle cells in various groups (n=3, x±s)
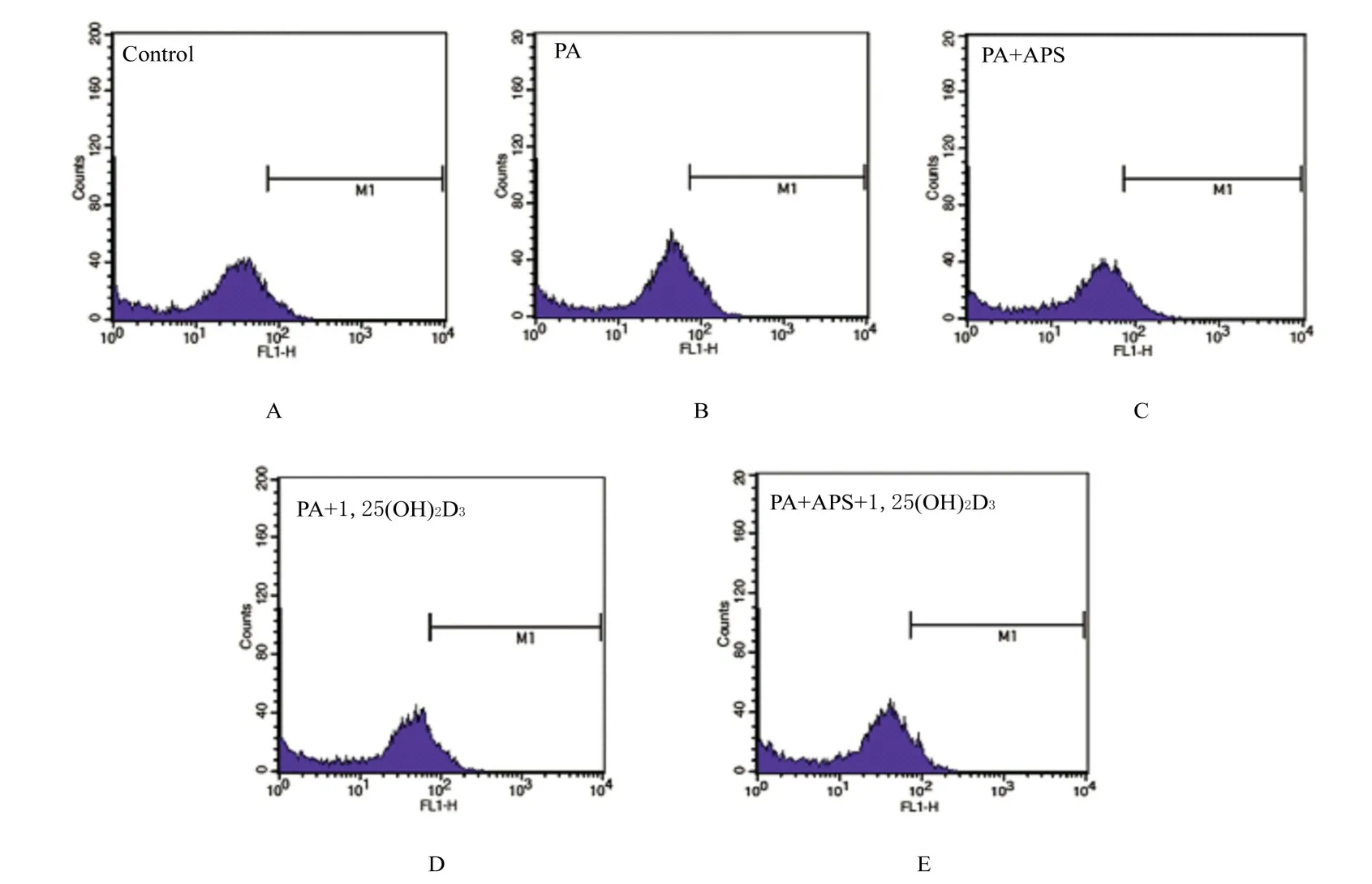
图4 各组骨骼肌细胞中ROS 水平Fig.4 Levels of ROS in skeletal muscle cells in various groups
2.5 各组细胞培养上清中IL-6、IL-10、TNF-α 和MCP-1 水平与对照组比较, PA 组细胞培养上清中促炎症因子IL-6、TNF-α 和MCP-1 水平均明显升高(P<0.05), 抗炎性因子IL-10 水平均明显降低(P<0.05);与PA 组 比 较, PA+APS 组 和PA+ 1, 25(OH)2D3组细胞培养上清中IL-6、TNF-α和MCP-1 水平均明显降低(P<0.05), IL-10 水平均明显升高(P<0.05);与PA+1, 25(OH)2D3组比较, PA+APS+1, 25(OH)2D3组细胞培养上清中IL-6 表达水平明显降低(P<0.05);与PA+APS 组和PA+1, 25(OH)2D3组 比 较, PA+APS+1, 25(OH)2D3组细胞培养上清中IL-10 水平明显升高(P<0.05)。见表2。
表2 各组细胞培养上清中炎症因子水平Tab.2 Levels of inflammatory factors in culture supernatant of cells in various groups [n=3, ±s,ρB/(ng·L-1)]
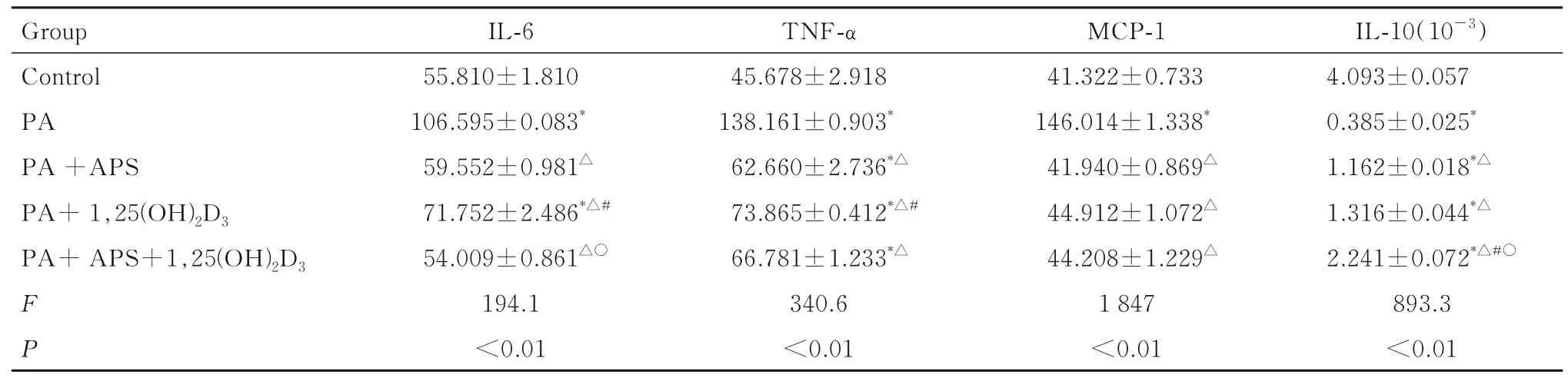
表2 各组细胞培养上清中炎症因子水平Tab.2 Levels of inflammatory factors in culture supernatant of cells in various groups [n=3, ±s,ρB/(ng·L-1)]
*P<0.05 vs control group;△P<0.05 vs PA group;#P<0.05 vs PA +APS group ;○P<0.05 vs PA+ 1, 25(OH)2D3 group.
Group Control PA PA +APS PA+ 1,25(OH)2D3 PA+ APS+1,25(OH)2D3 FP IL-10(10-3)4.093±0.057 0.385±0.025*1.162±0.018*△1.316±0.044*△2.241±0.072*△#○893.3<0.01 IL-6 55.810±1.810 106.595±0.083*59.552±0.981△71.752±2.486*△#54.009±0.861△○194.1<0.01 TNF-α 45.678±2.918 138.161±0.903*62.660±2.736*△73.865±0.412*△#66.781±1.233*△340.6<0.01 MCP-1 41.322±0.733 146.014±1.338*41.940±0.869△44.912±1.072△44.208±1.229△1 847<0.01
2.6 各组细胞中IR 相关蛋白表达水平与对照组比 较, PA 组、 PA+APS 组 和 PA+APS+1, 25(OH)2D3组细胞中InsR、IRS-1、p-IRS-1 和GLUT4 蛋白表达水平均明显降低(P<0.05)。与PA 组比较, PA+1, 25(OH)2D3和PA+APS+1, 25(OH)2D3组 细 胞 中IR 及PA+APS 组、PA+1, 25(OH)2D3和PA+APS+1, 25(OH)2D3组细胞中IRS-1、p-IRS-1 及GLUT4 蛋白表达水平均明显升高(P<0.05)。PA+APS+1, 25(OH)2D3组 细胞 中IR、IRS-1、p-IRS-1 和GLUT4 蛋白表达水平 均 明 显 高 于PA+APS 组 和PA+1, 25(OH)2D3组(P<0.05)。见图5和表3。

表3 各组骨骼肌细胞中InsR、IRS-1、p-IRS-1 和GLUT4 蛋白表达水平Tab. 3 Expression levels of InsR, IRS-1, p-IRS-1, and GLUT4 proteins in skeletal muscle cells in various groups (n=3, x±s)
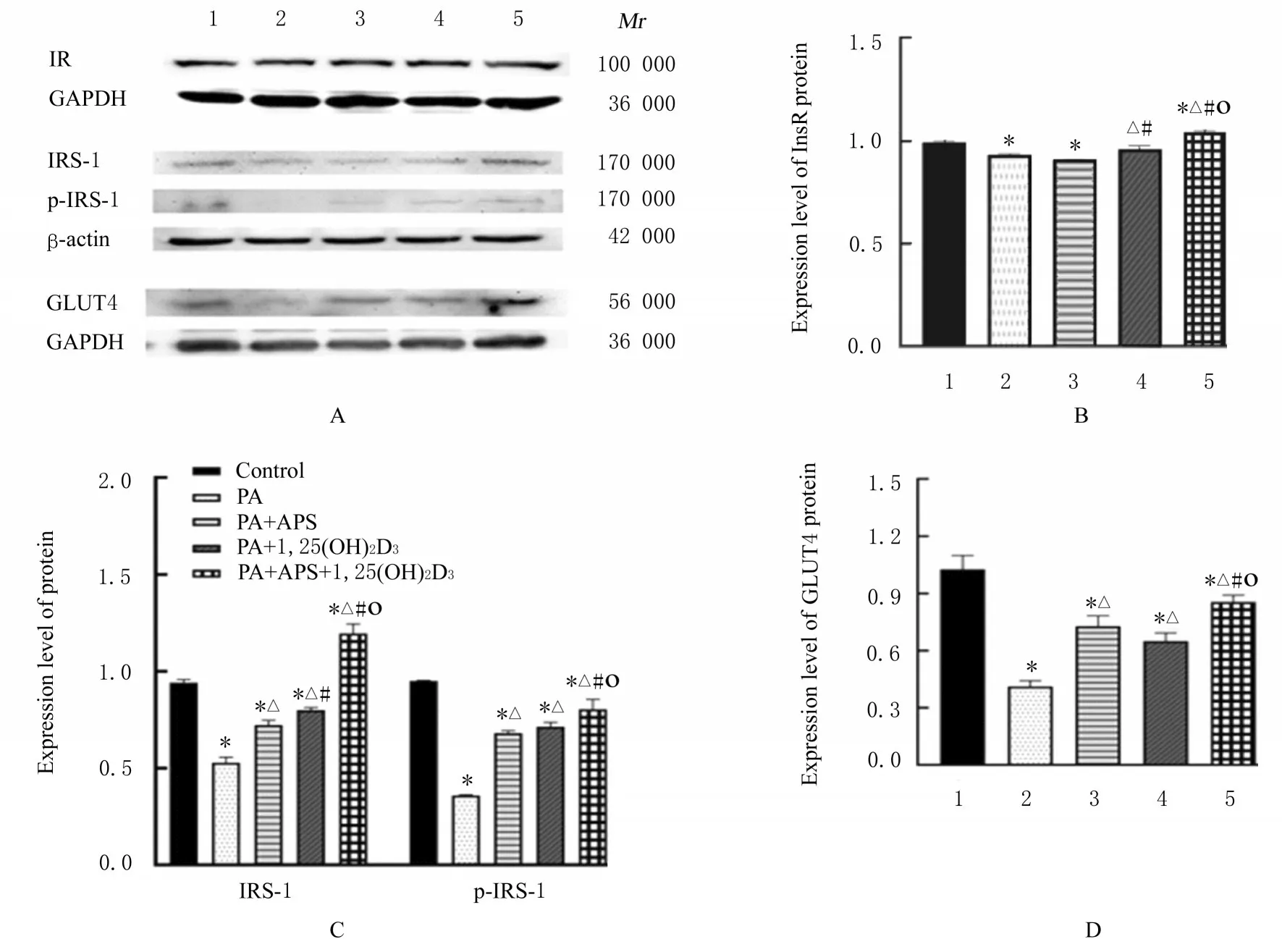
图5 各组骨骼肌细胞中InsR、IRS-1、p-IRS-1 和GLUT4 蛋白表达电泳图(A)和直条图(B-D)Fig. 5 Electrophoregram (A) and histograms (B-D) of expressions of InsR, IRS-1, p-IRS-1, and GLUT4 proteins in skeletal muscle cells in various groups
2.7 各组细胞中氧化应激相关通路蛋白表达水平与对照组比较, PA 组细胞中P65、p-P65、p38MAPK 和TLR4 蛋 白 表 达 水 平, PA+APS 组 细胞中P65、p-P65、p38MAPK 和TLR4 蛋白表达水平, PA+1, 25(OH)2D3组细胞中P65 和p38MAPK蛋白表达水平均明显升高(P<0.05)。与PA 组比较, PA+APS 组、PA+1, 25(OH)2D3组和PA+APS+1, 25(OH)2D3组 细 胞 中 P65、 p-P65、p38MAPK 和TLR4 蛋白表达水平明显降低(P<0.05)。与PA+APS 和PA+1, 25(OH)2D3组比较, PA+APS+1, 25(OH)2D3组 细 胞 中p-P65 和p38MAPK 蛋白表达水平均明显降低(P<0.05), PA+APS+1, 25(OH)2D3组 细胞中TLR4 蛋白表达水平明显低于PA+APS 组(P<0.05)。见图6和表4。
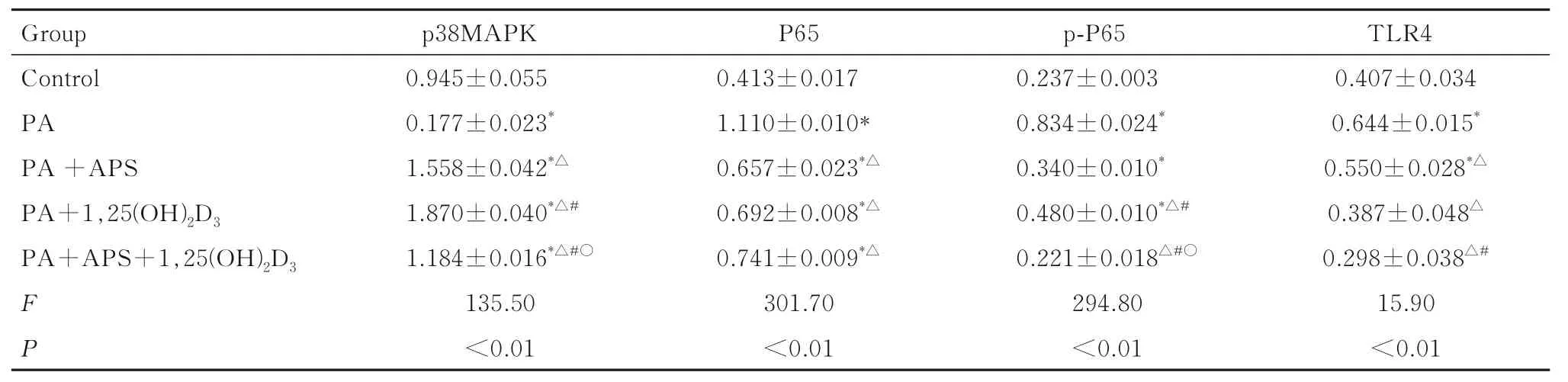
表4 各组骨骼肌细胞中p38MAPK、P65、p-P65 和TLR4 蛋白表达水平Tab. 4 Expression levels of p38MAPK,P65, p-P65, and TLR4 proteins in skeletal muscle cells in various groups (n=3, x±s)
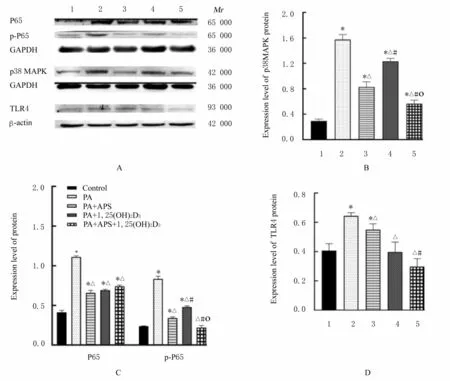
图6 各组骨骼肌细胞中p38MAPK、P65、p-P65 和TLR4 蛋白表达电泳图(A)和直条图(B-D)Fig. 6 Electrophoregram (A) and histograms(B-D) of expressions of p38MAPK,P65, p-P65, and TLR4 proteins in skeletal muscle cells in various groups
3 讨 论
不良的生活行为方式可以导致机体内氧化还原失衡, 诱发氧化应激反应, 并激活与炎症、凋亡和免疫等相关的多种细胞信号通路, 干扰胰岛素信号的传导, 最终诱导IR 的发生[11-12]。IR 不仅导致患者生活质量下降, 寿命缩短, 还会给社会带来沉重的经济负担[13]。因此研究缓解IR 的药物并探讨其作用机制将有助于防治代谢综合征、心血管疾病和相关并发症的发生发展[14-15]。骨骼肌是葡萄糖摄取
和储存的主要场所, 其内发生的葡萄糖代谢紊乱会影响全身的代谢[16]。近年来, 有研究[10]显示:APS 可通过降低IR 中细胞氧化应激水平, 增加细胞葡萄糖的摄取和利用;1, 25(OH)2D3可通过增强胰岛素敏感性, 降低机体慢性炎症反应来缓解IR。然而, 目前尚未见关于二者联合作用缓解IR 的研究报道。因此本文作者在体外建立骨骼肌细胞IR模型, 通过给予细胞APS 和(或)1, 25(OH)2D3, 探讨1, 25(OH)2D3联合APS 对骨骼肌细胞IR 的缓解作用及其机制, 为防治IR 提供科学依据。
骨骼肌是全身葡萄糖代谢的重要场所, 约80%的葡萄糖代谢发生在骨骼肌组织中, 所以本实验以骨骼肌细胞作为研究对象, 研究1, 25(OH)2D3联合APS 对骨骼肌细胞IR 的缓解作用及其机制。研究[17]显示:组织中游离脂肪酸(free fatty acid, FFA)的积聚可以导致NADPH 氧化酶和PKC 激酶依赖性激活, 进而促进ROS 的产生, 激活氧化应激通路, 降低胰岛素敏感性, 导致IR 的发生。已知血浆中FFA 由饱和脂肪酸和单不饱和脂肪酸组成, 而PA 作为常见的饱和脂肪酸, 已被证实可以诱导肝组织发生IR, 并产生大量ROS[18]。本研究以PA 诱导骨骼肌细胞产生IR 建立体外细胞模型, 结果显示:随着PA 作用时间的增加和作用浓度的升高, 骨骼肌细胞存活率和葡萄糖摄取能力降低, 说明PA 可以诱导骨骼肌细胞发生IR, 这与前人研究[19-20]结论一致。另外, 本研究结果显示:PA 作用24 h 后, 骨骼肌细胞中ROS水平升高, 说明骨骼肌细胞发生IR 会使细胞中ROS 水平升高。本研究结果显示:单独采用APS和单独采用1, 25(OH)2D3可有效减少骨骼肌细胞中ROS 的产生, 并且联合使用降低细胞氧化应激程度优于单独使用。上述结果说明1, 25(OH)2D3和APS 可以通过抑制骨骼肌细胞中ROS 的产生, 通过增强胰岛素的敏感性来发挥缓解IR 的作用。
本研究结果显示:骨骼肌细胞在PA 诱导下可明显下调InsR、IRS-1 和GLUT4 蛋白表达水平, 给予APS 和1, 25(OH)2D3后, IRS-1 和GLUT4 蛋白表达水平明显升高, 且二者联合应用时蛋白表达水 平 升 高 更 加 明 显, 说 明 采 用1, 25(OH)2D3和(或)APS 可以逆转PA 的作用, 并使骨骼肌细胞中InsR、 IRS-1 以 及GLUT4 表 达 升 高, 说 明1, 25(OH)2D3和APS 可以通过上调胰岛素信号通路蛋白的表达, 提高葡萄糖摄取的能力, 缓解骨骼肌IR。本研究结果显示:暴露于PA 的骨骼肌细胞 中NF-κB、p-NF-κB、TLR4 和p38MAPK 蛋白表达水平升高, 而加入1, 25(OH)2D3和APS 后上述蛋白的表达受到明显抑制, 这说明1, 25(OH)2D3和APS 可能通过抑制TLR4 蛋白的表达, 进而抑制下游分子NF-κB 和p38MAPK 蛋白的表达, 抑制氧化应激反应, 增强胰岛素信号的传导, 从而发挥缓解骨骼肌IR 的作用。
研究[21]显示:除了脂肪组织, 骨骼肌中也含有巨噬细胞。在高脂饮食(high-fat diet, HFD)喂养的小鼠肌肉中, 发现M1 巨噬细胞浸润增多, 并且处于促炎状态, 释放大量炎性因子到外周组织中, 干扰肌肉胰岛素敏感性, 诱导IR 的发生[22]。在本研究中, PA 可增加骨骼肌细胞中促炎性因子IL-6、TNF-α 和MCP-1 的 释 放, 抑 制 抗 炎 性 因 子IL-10 的产生。采用APS 和(或)1, 25(OH)2D3治疗均可有效改善骨骼肌细胞中促炎性因子和抗炎性因子的释放, 并且效果可达到对照组水平, 进而缓解骨骼肌IR 效应。
综上所述, PA 可以诱导骨骼肌细胞发生IR, 降低葡萄糖摄取能力, 产生氧化应激和炎性反应, 而1, 25(OH)2D3和APS 可以减弱PA 带来的上述效应, 并增强胰岛素信号的传导, 提高胰岛素刺激的葡萄糖摄取。1, 25(OH)2D3和APS 具有缓解骨骼肌IR 的潜力, 其联合应用的效果优于单独应用。
