大鼠臂旁外侧核化学毁损对脂多糖致热反应的影响
2022-12-15高文敏何田慧吴沆烘陈圳炜赖玉培胥建辉
高文敏, 何田慧, 姚 兰, 吴沆烘, 陈圳炜, 赖玉培, 胥建辉, 张 洁
(成都医学院体温与炎症四川省高校重点实验室, 四川 成都 610500)
臂 旁 外 侧 核 (lateral parabrachial nucleus, LPB)位于小脑上脚的背外侧缘, 参与心血管和呼吸等内脏活动的调节和温度觉、痛觉及痒觉等感觉信 息 的 传 递[1-8]。研 究[9-12]证 实:LPB 是 致 热 介 质前列腺素E2(prostaglandin E2, PGE2)在体温中枢视前区(preoptic area, POA) 外的致热作用部位之一。本课题前期研究[9]显示:在脂多糖(lipopolysaccharide, LPS) 致发热过程中, PGE2能在LPB 局部合成, 在清醒大鼠LPB 中微量注射PGE2 可以引起明显的发热效应, 同时伴有能量代谢率明显升高。麻醉后, 在大鼠LPB 中局部应用PGE2, 可引起直肠和棕色脂肪(brown adipose tissue, BAT) 温度升高, 支配BAT 的交感神经放电活动增强, 颈部肌电增强和尾部皮肤温度降低。上述研究结果显示:LPB 中PGE2 通过增加BAT 代谢产热, 骨骼肌战栗产热和减少尾部皮肤散热可引起体温升高和发热, 但LPB 在LPS 引起的全身性发热过程中的作用尚未见报道。本实验采用脑立体定位、化学毁损、无线遥测、免疫荧光和尼氏染色等方法观察LPB 毁损对大鼠腹腔注射LPS 致热反应的影响, 研究LPB 在LPS 致发热过程中的作用, 为发热反应的中枢机制研究提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器成年雄性SD 大鼠(体质量200~250 g)12 只, 购自成都达硕实验动物有限公司, 动物生产许可证号:SCXK(川)2020-030, 随机分为对照组(6 只)和LPS 毁损组(6 只)。鹅膏氨酸和LPS 购自美国Sigma 公司, 小鼠源性抗NeuN 购自英国Abcam 公司, 驴抗小鼠红色荧光二抗购自美国Invitrogen 公司, 硫堇、驴血清、Triton X-100、抗荧光衰减封片剂和OCT 冰冻切片包埋剂购自北京索莱宝科技有限公司, 磷酸缓冲液(phosphate buffer solution, PBS) 粉剂购自北京中杉金桥生物技术公司, 水合氯醛、多聚甲醛、氯化钠、蔗糖和无水乙醇购自成都科龙化工试剂有限公司。玻璃微电极购自美国WPI 公司, 微量注射器购自瑞士汉密尔顿公司, 无线遥测发射子(TA10TA-F40)购自美国DSI 公司, 脑立体定位仪(68018) 购自深圳RWD 公司, 无线遥测系统(RPC-1) 购 自 美 国DSI 公 司, 冰 冻 切 片 机(CM1950)购自德国Leica 公司, 自动荧光显微镜(BX63)购自日本奥林巴斯公司。
1.2 脑立体定位和化学毁损腹腔注射10%水合氯醛麻醉大鼠后, 将大鼠固定于立体定位仪上, 正中切开头皮暴露颅骨并调平。采用颅骨钻在双侧分别钻孔后采用玻璃微电极进行双侧各2 个位点注射。第1 个LPB 注射位点坐标:前囟后8.9 mm, 左右旁开2.4 mm, 深7.2 mm;第2 个LPB 注射位点坐标:前囟后9.0 mm, 左右旁开2.2 mm, 深6.8 mm。玻璃微电极尖端内径为20~30 μm, 采用热熔胶将电极密封固定于10 μL 微量注射器上, 电极和注射器内充满矿物油, 采用微量注射泵吸取药液并注射。LPB 毁损组和对照组大鼠分别在LPB注射鹅膏氨酸(10 g·L-1, 每个位点0.12 μL)和等量生理盐水, 注射速率为50 nL·min-1。注射完毕后, 留置10 min 后缓慢提出玻璃电极, 再缝合头部皮肤, 术后连续3 d 肌肉注射头孢曲松钠(50 g·L-1)预防术后感染。7 d 后腹腔植入监测体核温度(core temperature, Tcore)所用的发射子。
1.3 发射子植入和遥控测温采用碘伏溶液浸泡手术器械, 采用新洁尔灭浸泡发射子至少1 h 后, 麻醉大鼠, 剔除手术部位覆盖的鼠毛, 碘伏消毒后, 在腹中部正中切口, 其内放置监测Tcore所用的发射子。手术完成后, 持续3 d 给予大鼠头孢曲松钠预防术后感染, 恢复1 周后进行实验。
实验前1 d 下午将大鼠放置于人工气候箱(24 ℃)中的无线遥测接收板上进行适应性过夜。实验当天上午8 点开启无线遥测系统, 间隔5 min记录1 次Tcore。气候箱内昼暗光期时间分别为12 h, 即早上6:00开灯, 下午18:00关灯。上午10:00, 对照组和 LPB 毁损组大鼠腹腔注射 LPS(100 μg·kg-1)和等量生理盐水, 连续监测记录10 h 大鼠自由活动时Tcore和活动度变化, 实验结束后灌注取材, 进行腹腔注射后续实验。
1.4 对照组和LPB 毁损组大鼠LPB 中NeuN 和尼氏小体的分布腹腔注射水合氯醛麻醉大鼠后, 经升主动脉灌注预冷的生理盐水冲洗血液后, 灌注多聚甲醛溶液(4%)预固定, 然后取脑组织进行后固定;次日, 将脑组织转移至准备好的蔗糖溶液(30%)中沉降, 待脑组织沉底后, 从下丘与脑桥头端延续部位开始连续冰冻冠状切片, 片厚20 μm, 分 为2 套。1 套 采 用0.3%Triton X-100 透膜, 10%驴血清封闭, 加入一抗(小鼠抗NeuN, 1∶800), 在室温环境中(37 ℃左右)放置10 min, 接着转移至4 ℃冰箱孵育过夜。次日, 采用PBS 缓冲液对切片进行洗涤, 重复3 次, 每次5 min, 待充分清洗切片后, 加入驴抗小鼠红色荧光二抗孵育60 min;洗脱后进行封片处理, 在暗光环境中置于荧光显微镜下观察。另1 套切片加入硫堇水溶液进行尼氏染色, 进一步观察2 组大鼠LPB 中神经元损伤情况。具体步骤:采用硫堇水溶液于温箱内浸染30 min, 之后采用蒸馏水洗涤;将经过处理的切片采用90%酒精分色约20 s、95%酒精脱色1 min、最后浸泡于100%高浓度的酒精中3 min, 二甲苯透明不超过10 min, 在中性树胶封片后置于镜下观察。
1.5 统计学分析采用SPSS 21.0 统计软件进行统计学分析。大鼠Tcore和活动度以±s表示。对照组和LPB 毁损组大鼠腹腔注射LPS 或生理盐水后不同时间点Tcore及活动度组间比较采用两独立样本t检验。腹腔注射LPS 或生理盐水后不同时间点2 组大鼠Tcore组内比较采用重复测量的方差分析。以P<0.05 为差异有统计学意义。
2 结 果
2.1 腹腔注射生理盐水或LPS 后不同时间点2 组大鼠Tcore和活动度腹腔注射生理盐水或LPS 前对照组和LPB 毁损组大鼠在24 ℃环境中的基础Tcore分 别 为(37.34±0.17)℃和(37.28±0.18)℃, 组间比较差异无统计学意义(P>0.05)。腹腔注射生理盐水后, 2 组大鼠Tcore均较基础Tcore有短暂上升, 但体温变化幅度较小。腹腔注射LPS 后, 对照组诱导出典型的双相发热。注射LPS 1.5 h后, 对照组大鼠Tcore开始升高, 2.5 h 时Tcore达峰值[(38.78±0.16)℃](1 相), 1.0 h 后Tcore再次升高, 约5.5 h 时Tcore达第2 次峰值[(38.97±0.21) ℃](2 相), 然后逐渐下降恢复, 2.5 和5.5 h 时大鼠Tcore均高于基础Tcore(P<0.05)。LPB毁损组大鼠腹腔注射LPS 后也出现发热反应, 5.5 h 时Tcore较基础Tcore明显升高(P<0.05);腹腔注射LPS 后2.5 h, 对照组和LPS 毁损组大鼠Tcore分 别 增 加 (1.43±0.19)℃ 和 (0.47±0.14)℃, 在腹腔注射LPB 后5.5 h, 对照组和LPB 毁损组大鼠Tcore分别增加(1.62±0.20)℃和(0.95±0.26)℃, 见图1 和表1。对照组和LPB 毁损组大鼠腹腔注射生理盐水或LPS 后, 活动度均出现短暂增加, 但2 组大鼠活动度比较差异无统计学意义(P>0.05)。见图2 和表2。
表2 腹腔注射生理盐水和LPS 后不同时间点对照组和LPB 毁损模型组大鼠活动度Tab. 2 Activities of rats in control group and LPB-lesion group at different time points after intraperitoneal injection of saline andLPS (n=6,±s)

表2 腹腔注射生理盐水和LPS 后不同时间点对照组和LPB 毁损模型组大鼠活动度Tab. 2 Activities of rats in control group and LPB-lesion group at different time points after intraperitoneal injection of saline andLPS (n=6,±s)
Activity Activity Group Baseline 5.5 h after treated with saline 2.80±1.23 0.80±0.55 Baseline Control LPB-lesion 0.67±0.52 0.10±0.07 2.5 h after treated with saline 0.00±0.00 1.17±0.52 0.93±0.72 1.37±1.06 2.5 h after treated with LPS 1.73±0.91 1.47±0.66 5.5 h after treated with LPS 1.70±1.13 1.30±0.71
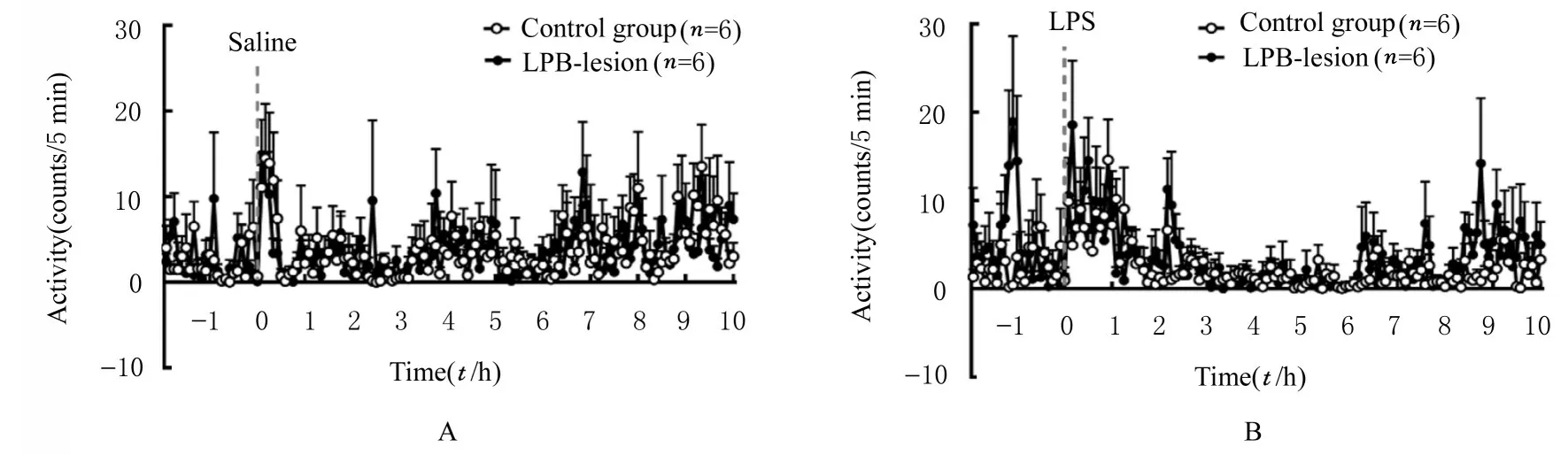
图2 腹腔注射生理盐水(A)和LPS(B)后不同时间点对照组和LPB 毁损组大鼠活动度Fig. 2 Activities of rats in control group and LPB-lesion group at different time points after intraperitoneal injection of saline (A)and LPS (B)
表1 腹腔注射生理盐水和LPS 后不同时间点对照组和LPB 毁损组大鼠TcoreTab.1 Tcore of rats in and control group and LPB-lesion group at different time points after intraperitoneal injection of saline andLPS (n=6,±s,T/°C)
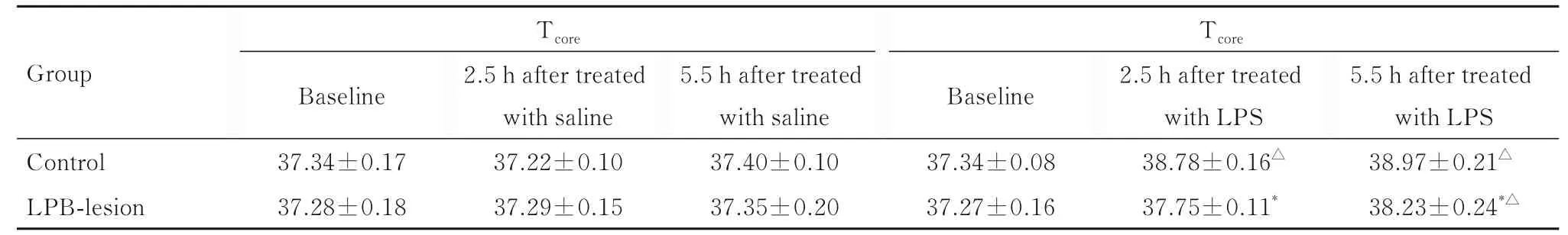
表1 腹腔注射生理盐水和LPS 后不同时间点对照组和LPB 毁损组大鼠TcoreTab.1 Tcore of rats in and control group and LPB-lesion group at different time points after intraperitoneal injection of saline andLPS (n=6,±s,T/°C)
*P<0.05 vs control group;△P<0.05 vs baseline Tcore.
Tcore Tcore Group 5.5 h after treated with LPS 38.97±0.21△38.23±0.24*△Baseline 5.5 h after treated with saline 37.40±0.10 37.35±0.20 Baseline 2.5 h after treated with LPS 38.78±0.16△37.75±0.11*2.5 h after treated with saline 37.22±0.10 37.29±0.15 Control LPB-lesion 37.34±0.17 37.28±0.18 37.34±0.08 37.27±0.16

图1 腹腔注射生理盐水(A)和LPS(B)后不同时间点对照组和LPB 毁损组大鼠TcoreFig. 1 Tcore of rats in control group and LPB-lesion group at different time points after intraperitoneal injection of saline(A)and LPS (B)
2.2 2 组大鼠LPB 中神经元标志物NeuN 和尼氏小体的分布采用NeuN 免疫荧光染色和尼氏染色确定LPB 毁损的效果和范围。在注射生理盐水的对照组大鼠LPB 中分布着大量红色荧光标记的NeuN 免疫阳性神经元, 细胞结构完整, 细胞形态规则, 呈纺锤形、卵圆形、锥体形和多极形, 尼氏小体大而数量多;LPB 毁损组大鼠LPB 毁损区域中头尾方向前、中和后3 个水平几乎未见NeuN 免疫阳性神经元, 神经元胞体缺失, 尼氏小体大量消失, 并可见神经胶质细胞数量明显增多。尽管有部分大鼠毁损范围扩展到邻近的结构, 但均包括了LPB 的大部分区域。见图3。
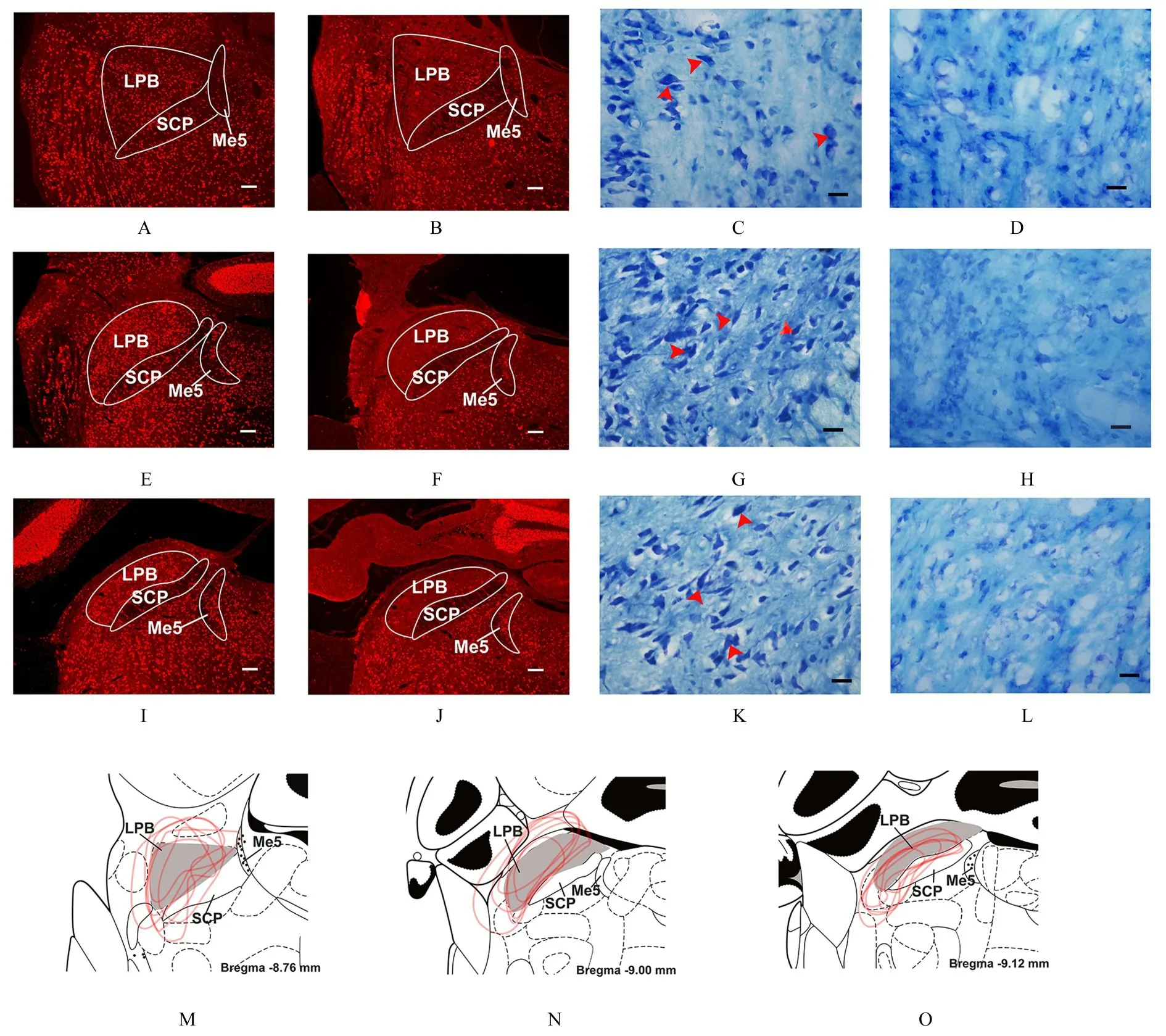
图3 对照组和LPB 毁损组大鼠LPB 中NeuN 和尼氏小体的分布Fig.3 Distributions of NeuN and Nissl body in LPB area of rats in control group and LPB-lesion group
3 讨 论
鹅膏氨酸是一种谷氨酸类似物, 可作用于N-甲基- D-天门冬氨酸受体, 引起兴奋毒性级联反应和神经细胞内钙超载, 破坏胞体, 而细胞中的神经末梢和轴突通路却不受影响, 常用于脑区非特异化学毁损[13]。本研究在大鼠LPB 局部注射鹅膏氨酸进行化学毁损, 观察毁损LPB 对腹腔注射LPS致热反应的影响, 探讨LPB 在全身性发热中的作用, 并采用免疫荧光染色和尼氏染色检测LPB 毁损的效果和范围, 本研究结果显示:LPB 毁损组大鼠LPB 毁损区域几乎未见神经元标志物NeuN 阳性染色, 神经元胞体缺失, 尼氏小体大量消失, 这些结果与国内外学者[13]采用鹅膏氨酸进行有效化学毁损的结果一致, 本研究结果显示:毁损范围包括了LPB 大部分区域, 说明LPB 毁损是有效的。腹腔注射生理盐水后, 2 组大鼠Tcore均较基础Tcore有短暂升高, 这是腹腔注射引起的应激性体温升高, 但2 组大鼠Tcore变化幅度不大, 说明LPB 毁损对腹腔注射引起的应激性体温升高并无影响。对照组大鼠腹腔注射LPS 诱导出典型的双相发热。在注射LPS 1.5 h 后, 对照组大鼠Tcore开始升高, 2.5 h 达峰值, 1.0 h 以后Tcore再次升高, 5.5 h 达第2 次峰值, 然后逐渐下降, 这与国内外学者[14-15]报道的LPS 致热反应的趋势一致, 说明成功建立了发热模型。而在LPB 毁损组大鼠腹腔注射LPS 后的第1 和第2 发热时相的升温反应均减弱, 注射后2.5 和5.5 h 大鼠体温升高幅度均低于对照组, 提示LPB部分参与了LPS 致热反应。这与本课题组前期实验[9]中采用NS-398 抑制LPB 局部PGE2 合成, 部分消除了LPS 致热效应的结果一致, 也表明LPB除了参与前馈体温调节[1-5], 也部分参与了LPS 致热反应过程。对照组和LPB 毁损组大鼠腹腔注射生理盐水或LPS 后, 活动度虽出现了短暂的增加, 但2 组大鼠活动度比较差异均无统计学意义, 表明LPS引起的Tcore升高与活动度的变化无关。PGE2受体广泛分布于整个脑组织中, 但以往研究主要集中于下丘脑POA 区, 证实POA 区是PGE2 诱导发热的重要中枢部位[16-19], 但研究[9-12]显示:LPB也是PGE2的致热作用部位之一。本研究结果显示:LPB 化学毁损模型部分消除了LPS 的致热效应, 表明LPB不但参与了PGE2 的局部致热反应, 还在LPS 引起的全身性发热中起一定作用。ALMEIDA 等[20]报道:化学毁损下丘脑室旁核, 也部分消除了LPS的致热效应, 提示发热反应并不是由单一中枢引起, 可能是多中枢共同作用的结果。
研究[1-5]表明:LPB 中神经元在体温调节中发挥关键作用[1-5]。来自皮肤的冷、热前馈信号分别激 活LPB 外 亚 核 (external lateral parabrachial nucleus, LPBel)-POA 和LPB背亚核(dorsal lateral parabrachial nucleus, LPBd) -POA 通 路, 启 动 产热和(或)散热机制, 维持体温稳定。这些传入信号经体温中枢视前区下传至下丘脑背内侧或中缝苍白核, 进而调节产热和散热, 启动冷、热防御反应。皮肤冷信号通过这一下传通路引起产热增加、散热减少的冷防御反应。相反, 皮肤热信号引起产热减少和散热增加的热防御反应[1-3]。本课题组前期研究[21-23]显示:LPBel 和LPBd 中存在对局部脑温变化敏感的热敏和冷敏神经元;PGE2 增加了LPB 中大部分热敏、冷敏和温度不敏感神经元的自发放电活动, 但PGE2 对这3 类神经元的兴奋程度和比例都无差异, 但却差异性调节LPB 不同亚核神经元的放电活动, 分别兴奋LPBel 神经元, 抑制LPBd 神 经 元[9]。PGE2 是 否 通 过 激 活 介 导 冷 防 御反应的LPBel-POA 通路, 抑制介导热防御反应的LPBd-POA 通路, 引起产热增加, 散热减少, 进而诱导发热, 值得深入研究。
综上所述, LPB 化学毁损模型部分消除了LPS的致热反应, 表明LPB 在LPS 致热反应过程中起一定作用。该发现有助于更深入地认识LPB 在全身性发热中的作用, 提示发热反应可能并不是单一中枢引起, 这为发热反应的中枢机制研究提供了新思路。
