基于电子鼻、HS-GC-IMS、HS-SPME-GC-MS技术联用分析不同发酵年份老香黄挥发性成分差异
2022-12-14阳丹陈小爱杨玉洁蔡舒陈树喜周爱梅
阳丹,陈小爱,杨玉洁,蔡舒,陈树喜,周爱梅,,3*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)(2.广东展翠食品股份有限公司,广东潮州 515634)(3.华农(潮州)食品研究院有限公司,广东潮州 521021)
老香黄(也称佛手香黄、老香橼)是以新鲜佛手柑为原料经过盐制、干燥、蒸熟、浸糖液、浸中药粉液等步骤,最后再封坛发酵制成的,具有止咳化痰、去积祛风、理气开胃等功效,作为岭南特有的保健制品,它久藏不坏,且愈久药效愈佳[1,2]。但目前,老香黄并无统一的、标准的制作工艺以及行业规范,主要依靠家庭或小作坊等生产形式进行生产,导致各家老香黄品质有差异[3]。老香黄发酵年份不同,其品质和功能上都具有很大差别[4]。
目前,国内外关于不同发酵年份老香黄的研究较少,且主要集中在腌制过程、不同厂家老香黄的成分变化以及食用安全性研究。严赞开等[5]运用气相色谱-质谱联用(Gas Chromatography-Mass Spectrometry,GC-MS)技术分析发现,腌制期间老香黄的(Z)-2,3-丁二醇、(E)-2,3-丁二醇的含量明显增加;林良静等[6]运用气相离子迁移谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)技术通过相对香气活度值(ROAV)计算分析得出,不同厂家老香黄的风味贡献最大的挥发性物质是甲硫基丙醛;有研究者[7-9]从微生物、添加剂含量检测方面验证了老香黄的食用安全性。而对于不同发酵年份老香黄的成分变化的研究,目前主要集中在非挥发性成分方面。如郭舒臣等[3]对不同年份老香黄非挥发性化学物质分析得出,贡献最大的差异化学标志物是5,7-二甲氧基香豆素。老香黄发酵年份越长,功能越好,价格越贵,且在发酵期间表现出独特的风味,但是对于不同发酵年份老香黄风味的研究鲜见报道,尤其是对挥发性风味成分研究更少。食品香气成分与食品的挥发性物质有关,作为食品风味的重要组成部分,对食品的整体评估有重要意义[10]。此外,挥发性化合物具有芳香、抗真菌、杀虫、生物信号和治疗特性。因此,检测挥发性有机化合物对于评估食品质量、真实性、纯度和来源非常重要[11,12]。
本课题组前期对发酵不同月份老香黄的挥发性成分进行了检测,发现6~12 个月老香黄挥发性成分差异较大[13],本研究是在前期研究的基础上,进一步研究不同发酵年份老香黄挥发性成分的变化。研究采用电子鼻、顶空-气相色谱-离子迁移谱(Headspace-Gas Chromatography-Ion Mobility Spectrometry,HS-GC-IMS)和顶空固相微萃取-气相色谱-质谱联用(Headspace Solid Phase Microextraction-Gas Chromatography-Mass Spectrometry,HS-SPME-GC-MS)三项技术联用,发挥它们在便捷性、高效性以及灵敏性等方面的互补优势[14],更加全面分析不同发酵年份挥发性成分变化。同时利用主成分分析(Principal Component Analysis,PCA)、正交偏最小二乘判别分析(Orthogonal Partial Least Squares Regression Discriminant Analysis,OPLS-DA)法筛选出发酵不同年份期间老香黄差异性化学标志物,为判别不同年份老香黄提供依据,为建立一套不同年份老香黄质量评价体系提供一定理论支撑。
1 材料与方法
1.1 材料与仪器
老香黄由广州展翠食品股份有限公司提供,为相同工艺下常温密封发酵0、1、2、3、4、5年的样品,将其分别命名为0Y、1Y、2Y、3Y、4Y、5Y。
PEN3 型便携式电子鼻系统,德国Airsense 公司;Flavour Spec 1H1-00053 型气相离子迁移谱联用仪,德国G.A.S 公司;HP6890-5973 气相色谱-质谱联用仪,美国Aglient 公司;固相微萃取SPME 进样手柄,美国SUPELCO 公司;75 μm CAR/PDMS 固相微萃取纤维,美国SUPELCO 公司;四氟乙烯橡胶盖顶空瓶,广州市丛源仪器有限公司;AL104 万分之一电子天平,梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 电子鼻分析
(1)样品处理
精确称量3.0 g 老香黄,充分研磨后,立即装入50 mL 密封进样瓶中,室温平衡30 min 后检测,每个样品做3 个平行。
(2)检测条件
电子鼻运行参数:分析采样时间120 s,采样时间间隔1 s,清洗时间为120 s,归零时间10 s,准备进样时间5 s,传感器和样品流速均为400 mL/min,载气为空气,清洗传感器后进样[13]。本研究选取数据较平稳的111 s 为信采集时间。PEN3 型电子鼻由10 个金属氧化物传感器(MOS)组成,传感器所代表的物质种类及性能描述如表1所示。

表1 PEN3 传感器性能描述Table 1 PEN3 sensor performance description
1.2.2 HS-GC-IMS 分析
顶空进样条件:称取2 g 细磨样品放入20 mL 玻璃瓶中;孵化温度:60 ℃;孵化时间:15 min;孵化转速:500 r/min;进样针温度:65 ℃;进样体积:500 µL。
GC 条件:色谱柱(FS-SE-54-CB-1,15 m×0.53 mm,1 µm);色谱柱温:60 ℃;运行时间:30 min;载气为高纯度N2(纯度≥99.999%);载气流量:2.00 mL/min,保持2 min,在2~20 min 线性增至100.00 mL/min,然后保持10 min。
IMS 条件:离子源为氚源(6.5 keV),正离子模式,漂移管长度9.8 cm,管内线性电压500 V/cm,漂移气流量:150 mL/min;漂移气:高纯氮气(纯度≥99.999%);IMS 温度:45 ℃。外标为n-酮C4-C9,计算各化合物的保留指数(RI)。
1.2.3 HS-SPME-GC-MS 分析条件
顶空固相微萃取(HS-SPME)条件:老香黄研碎后密封,取6.0 g 样品到30 mL 萃取瓶中,使用微量注射器向萃取瓶内加入1 μL 2-辛醇(500 μg/mL)标品溶液,然后在70 ℃的恒温磁力搅拌器上平衡15 min,用活化的固相微萃取针萃取30 min,然后插入GC 进样口,解析3 min。
GC 条件:DB-WAX 毛细管色谱柱(60 m×0.25 mm×0.25 μm);升温程序:70 ℃保持2 min,以3℃/min 升到120 ℃,最后以4 ℃/min 升高至230 ℃,保持5 min;进样口温度260 ℃;不分流进样;载气(He)流速1 mL/min。
MS 条件:电子轰击离子源;电子能量70 eV;离子源温度230 ℃;传输线温度280 ℃;四极杆温度150℃;质量扫描范围为m/z35~600 u。
1.3 数据处理
GC-MS内置NIST08.L化学工作站标准谱库鉴定挥发性成分,辅以内标法确定各种成分的含量。使用GC-IMS 设备自带的仪器分析软件,包括LAV 和插件(Gallery Plot、Reporter)对样品挥发性成分进行采集和分析,通过保留指数(RI)和漂移时间与GC-IMS 文库以及峰面积归一化处理进行化合物定性定量分析。使用正交偏最小二乘法判别分析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA)筛选化学差异物;SPSS 23.0 软件做主成分分析(PCA),采用t检验进行组间的差异显著性分析,p<0.05 表示差异显著。
2 结果与讨论
2.1 基于电子鼻分析不同发酵年份老香黄的挥发性成分
电子鼻是一种气味检测技术,它模仿人类的嗅觉系统,为食品的新鲜度评价、过程监测和质量控制提供低成本、快速的感官信息[15]。PCA 是一种生成主成分(PC)变量的方法,以消除原始特征变量之间的相关性[16]。由PCA(图1)得知,总贡献率为82.35%(PC1 63.45%和PC2 18.90%),说明这两个主成分可以解释不同样本的主要特征信息。从对主成分1 的贡献度来看,PC1 值按5Y<3Y<2Y<4Y<1Y<0Y 的顺序增加,而PC2值则按0Y<2Y<1Y<3Y<4Y<5Y 的顺序递增。Wang等[17]将黄酒陈酿年份与其风味物质的变化结合,用以区分黄酒年龄,不同发酵年份老香黄的PCA 空间分布区域显示,除了3年和4年样品的置信区间有所重合之外,其余年份的样品分布较为独立,可以大致区分不同发酵年份老香黄。其中,发酵3年和4年的老香黄风味成分最为相似,其余发酵年份风味存在较大差异,未发酵的老香黄与其他样品相比,分布距离最远,差异较大,说明发酵工艺对风味的影响较大[18-20]。
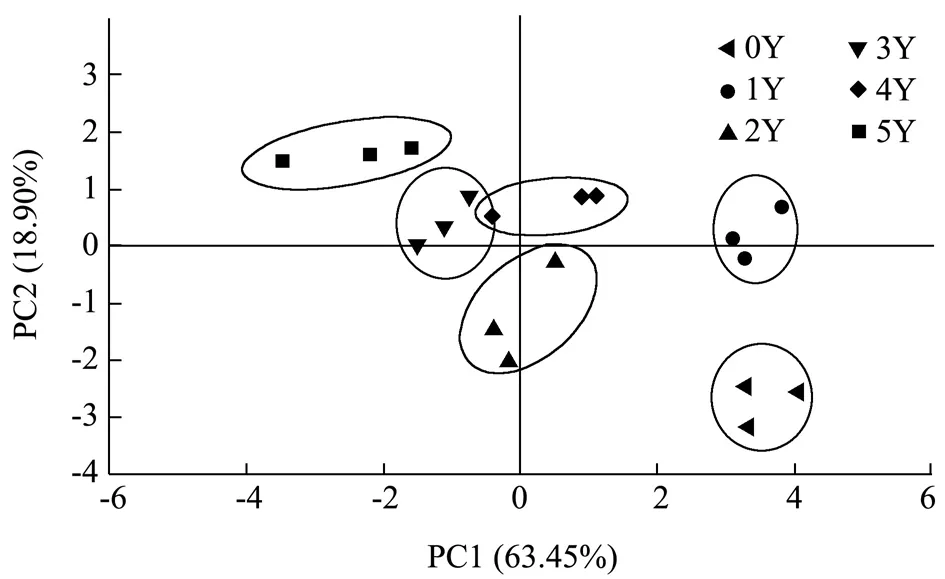
图1 电子鼻不同发酵年份老香黄挥发性成分的PCA 图Fig.1 PCA diagram of volatile components of Lao Xianghuang in different fermentation years of electron nose
2.2 基于HS-GC-IMS 分析不同发酵年份老香黄的挥发性风味成分变化
顶空-气相色谱-离子迁移谱(HS-GC-IMS)是一种相对较新的技术,利用不同离子漂移时间的差异进行物质分析,对于一些挥发性有机化合物的痕量检测非常适用[21]。采用GC-IMS 对其进行风味捕捉,仪器自带的软件生成离子迁移指纹图谱(图2)。横轴为检测出挥发性成分,纵轴为发酵0、1、2、3、4、5年的老香黄,图中颜色的深浅代表浓度高低,由于单体离子和中性分子可能在漂移区形成附属物,因此一种化合物可能会产生多个信号或点(单体和二聚体,在文中分别以M 和D 表示)。结合图2和表2来看,GC-IMS共检测出39 种挥发性成分,包括萜烯类8 种、醇类5种、醛类9 种、酯类4 种、酮类4 种、酚类1 种、酸类2 种、杂环化合物5 种以及其它1 种。
从指纹图谱(图2)可以看出,0Y 样品中反式-β-罗勒烯、戊酸乙酯、糠醛、乙酸丁酯、丙酮、2-呋喃甲醇等物质的含量较高;1Y 样品中α-松油烯、壬醛、戊醛、丙酸、4-甲基愈创木酚、乙酸乙酯等物质的含量较高;2Y 样品中3-蒈烯、月桂烯、β-蒎烯、α-蒎烯、芳樟醇、庚醛、2-乙酰基呋喃、3-甲基丁酸、反式-橙花叔醇、2-丁酮、2-乙基呋喃等物质的含量较高;3Y 样品中异松油烯、莰烯、异戊醛、二乙酰等物质的含量较高;4Y 样品中柠檬烯、己醛等物质的含量较高;5Y样品中香茅醛、桉叶油醇、丁醛、2-乙酰基噻唑等物质的含量较高。结合图2和表2看,α-蒎烯、反式-β-罗勒烯、芳樟醇、香茅醛、糠醛的含量在发酵期间较为稳定。异戊酸在未发酵样品中的含量为0.32%,显著高于其余阶段,其在发酵5年后含量达到最低值,为0.02%。2-乙基呋喃、2-丁酮、反式-橙花叔醇、2-乙酰基呋喃等物质在发酵3年时含量明显增加,达到整个发酵阶段的最大值,分别为1.33%、10.33%、22.17%、1.82%,在3年以后含量均呈现下降趋势。
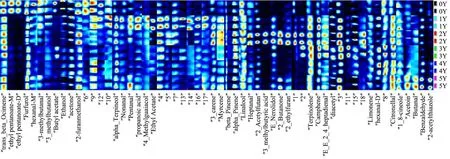
图2 不同发酵年份老香黄挥发性组分GC-IMS 指纹图谱Fig.2 GC-IMS fingerprint of volatile components in Lao Xianghuang in different fermentation years
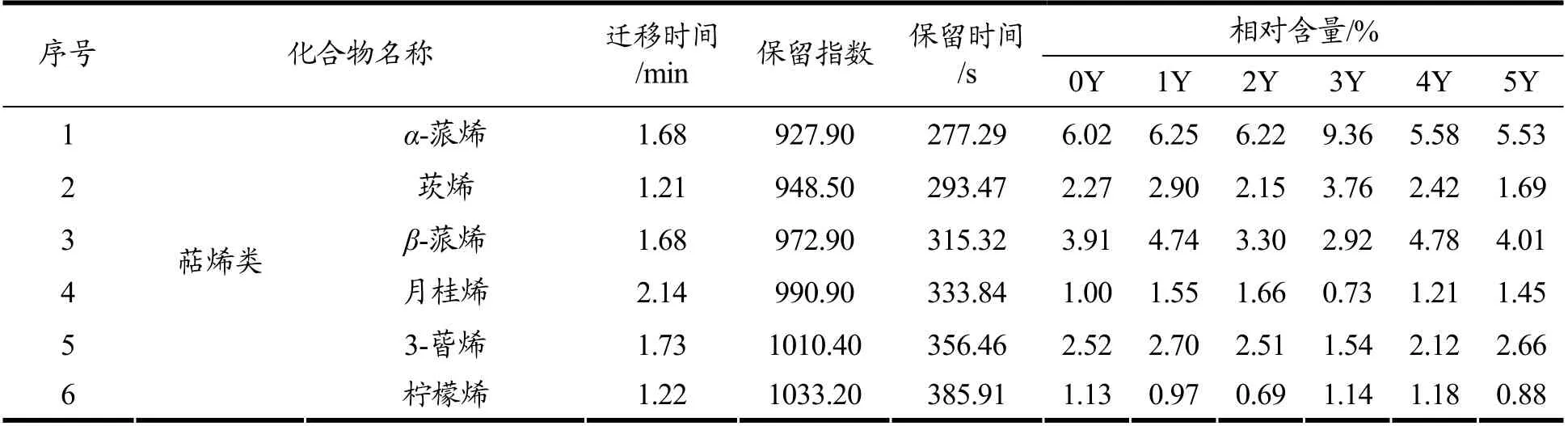
表2 GC-IMS 检测不同发酵年份老香黄挥发性成分含量Table 2 GC-IMS detects the volatile component content of Lao Xianghuang in different fermentation years
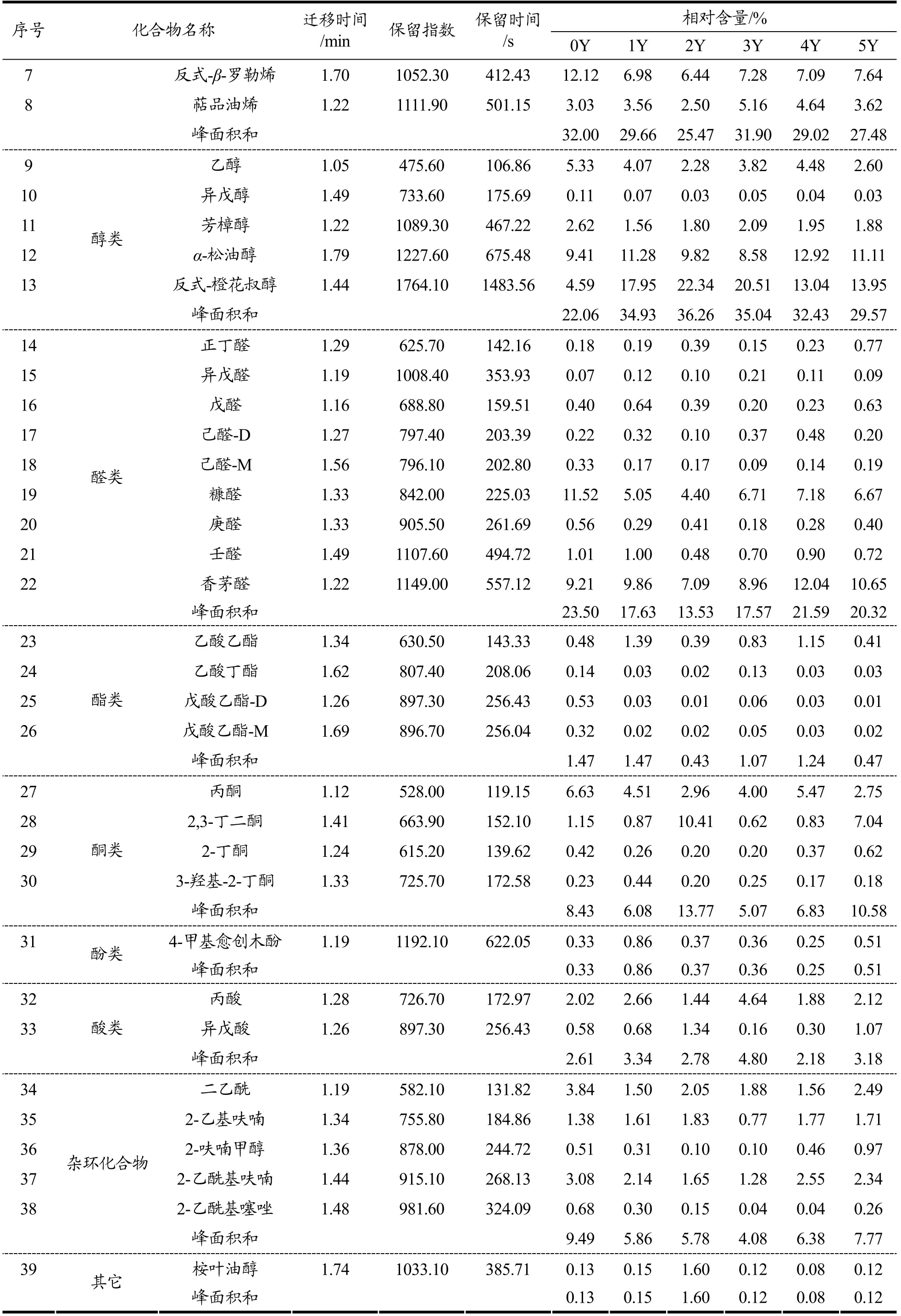
续表2
在老香黄发酵期间,萜烯类物质逐渐减少。醇类物质呈现先上升后下降趋势。醛类物质呈现先下降后上升趋势。酯类、酮类和杂环化合物呈现整体上升趋势。总体而言,随着发酵时间的延长,老香黄中的一部分挥发性物质不断减少,而又有一部分物质不断增多,甚至从无到有,说明挥发性物质成分种类越来越丰富,这可能与老香黄发酵过程中氨基酸和蛋白质、脂质的相互作用以及有机酸与醇类物质发生酯化反应[22,23]有关,且从种类和含量来看,发酵3年的老香黄挥发性成分种类较为丰富且含量偏高。
2.3 基于HS-SPME-GC-MS 分析不同发酵年份老香黄的挥发性成分
顶空固相微萃取- 气相色谱- 质谱联用(HS-SPME-GC-MS)是一种常用于检测食品风味的萃取分离检测技术,它综合了气相色谱和顶空固相微萃取的安全性、准确性和高分离能力,以及质谱在物质鉴定方面的优越性[24]。采用HS-SPME-GC-MS 对发酵0年、1年、2年、3年、4年、5年的老香黄挥发性成分进行定性定量分析,结果如表3、图3所示。在不同发酵年份的老香黄样品中,一共鉴定出50 种挥发性物质,包括萜烯类、醇类、醛类、酚类、酯类、醚类、杂环化合物和其它种类与HS-GC-IMS 检测出来的大类物质大致相同。其中,不同发酵年份样品中发现共有化合物14 种,分别为α-蒎烯、β-蒎烯、月桂烯、萜品油烯、柠檬烯、异松油烯、1-石竹烯、巴伦西亚橘烯、芳樟醇、α-松油醇、糠醛、麦芽酚、茴香脑、2,4-二甲基苯乙烯,与陈小爱等[13]不同月份老香黄结果相似。

图3 不同年份老香黄挥发性成分种类含量图Fig.3 Type content diagram of Lao Xianghuang volatile components in different years
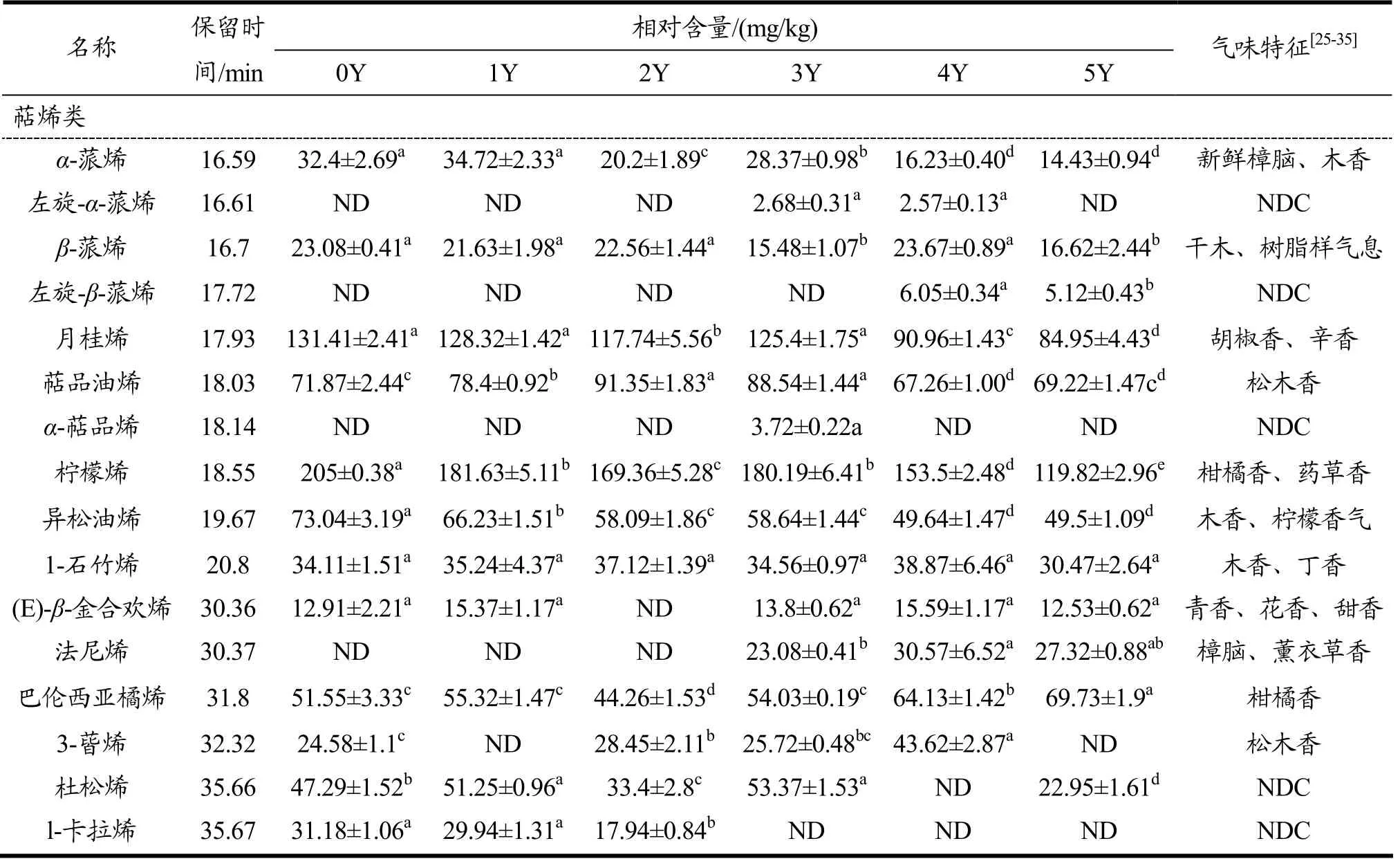
表3 HS-SPME-GC-MS 分析发酵不同年份的挥发性成分含量变化Table 3 HS-SPME-GC-MS analyzed changes in volatile component content in different years of fermentation
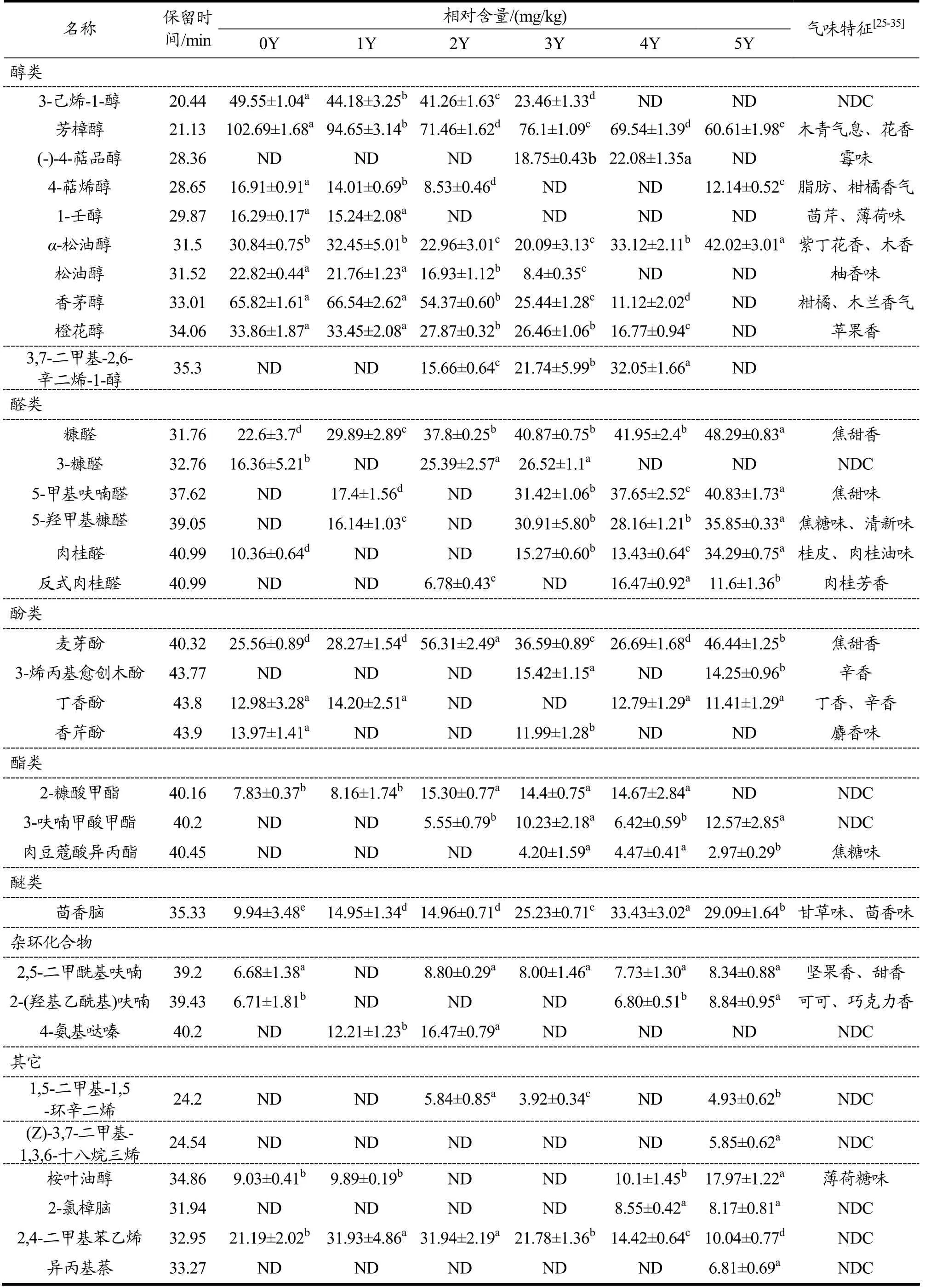
续表3
2.3.1 不同发酵年份老香黄挥发性香气组分分析
由图3、表3可知,老香黄挥发性成分含量最为丰富的是萜烯类物质,6 个发酵年份总体含量先逐年下降,到第三年略有上升,然后又持续下降。萜烯类物质具有柑橘香、药草香、柠檬香、胡椒香、辛香、木香等香气[25,26]。醇类化合物主要由氨基酸脱羧、脱氨产生,在老香黄不同发酵年份中含量逐渐下降,其具有柑橘、木兰香气、苹果香等香气,其中(-)-4-萜品醇是发酵期间产生的不良气味,但含量较低[27,28]。醛类物质在不同发酵年份中相对含量分别为49.33、63.44、69.97、145、137.68、170.88 mg/kg,大体上呈现逐年上升的趋势,其具有焦糖味、清新味、桂皮、肉桂油味、肉桂芳香等香味[29-31]。酚类物质在不同发酵年份中相对含量分别为52.52、42.48、56.32、64.01、39.49、72.11 mg/kg,其中具有焦甜香的麦芽酚为主要物质,除此之外酚类物质还有丁香、辛香、麝香味[32,33]。酯类物质和醚类物质在不同年份老香黄中含量均不高,但总体含量呈现上升趋势,其中3-呋喃甲酸甲酯具有焦糖香,茴香脑具有甘草、茴香等令人愉悦的气味[34,35]。杂环化合物主要有2,5-二甲酰基呋喃的甜香、坚果香,以及2-(羟基乙酰基)呋喃的巧克力香、可可,但含量都不高。还有少量具有薄荷糖香的桉叶油醇。
综上,可以得出萜烯类、醇类、醛类和酚类是老香黄中含量较丰富的物质,发酵不同年份老香黄中萜烯类、醇类、醛类含量变化最为显著(p<0.05),萜烯类以及醇类含量总体呈现下降趋势,醛类化合物含量总体呈现上升趋势,与梅明鑫[36]研究沃尔卡姆柠檬果酒发酵过程中挥发性成分的变化趋势相似。醇类物质的减少与醛类、酯类物质的增加可能与发酵过程中的氧化、醇类和醛类转化以及微生物合成有机酸发生酯化等反应有关[37-39]。
2.3.2 不同发酵年份老香黄共有挥发性成分变化分析
选取6 个发酵阶段都存在的共有化合物,对其不同阶段含量变化进行分析。结合图4和表3分析,α-蒎烯和β-蒎烯的含量随着发酵时间的推移呈现降-升-降趋势,在发酵5年后α-蒎烯相对含量达到最低值14.04 mg/kg,β-蒎烯发酵3年后相对含量达到最低值14.74 mg/kg,而α-松油醇在发酵期间呈现先下降后上升趋势,在发酵5年后达到最大值,相对含量为45.51 mg/kg。α-松油醇是一种由α-蒎烯和β-蒎烯转化而来的氧化产物[40],所以α-蒎烯和β-蒎烯含量降低与α-松油醇含量上升存在一定联系,并且有研究发α-蒎烯在微生物作用下可转化为(-)-4-萜品醇[41],因此发酵3年、4年突然出现的(-)-4-萜品醇可能是由α-蒎烯的微生物转化而来。月桂烯呈稳定下降趋势,在发酵5年后相对含量显著降低达到最低值86.54 mg/kg(p<0.05)。萜品油烯呈现先上升后下降的趋势,在发酵3年后相对含量达到峰值90.6 mg/kg。柠檬烯在未发酵样品中含量最大,相对含量为204.89 mg/kg,随着发酵时间的推移呈现稳定下降趋势,在发酵5年后相对含量显著降低(p<0.05),达到最低值116.63 mg/kg。已有研究发现,柠檬烯在微生物作用下,其6 位烯丙基可羟基化、氧化得到香芹酚,8 位可氧化得到α-松油醇。由此可以说明,老香黄在发酵阶段,大量柠檬烯被微生物催化转换,导致含量逐年下降[42-44]。异松油烯、芳樟醇和1-石竹烯在发酵期间均呈现稳定下降趋势。巴伦西亚橘烯呈现先下降后上升趋势,在发酵5年时达到峰值,相对含量为69.15 mg/kg。糠醛为多糖的次级代谢产物[45],在发酵过程中呈现稳定上升趋势。茴香脑相对含量在发酵期间均呈现稳定上升趋势,在发酵5年后显著上升(p<0.05),达到最大值30.96 mg/kg。麦芽酚相对含量在发酵期间呈现升-降-升趋势,在发酵3年后达到峰值56.53 mg/kg。2,4-二甲基苯乙烯相对含量呈现先上升后稳定下降趋势,在发酵5年后达到最低值,为10.46 mg/kg。
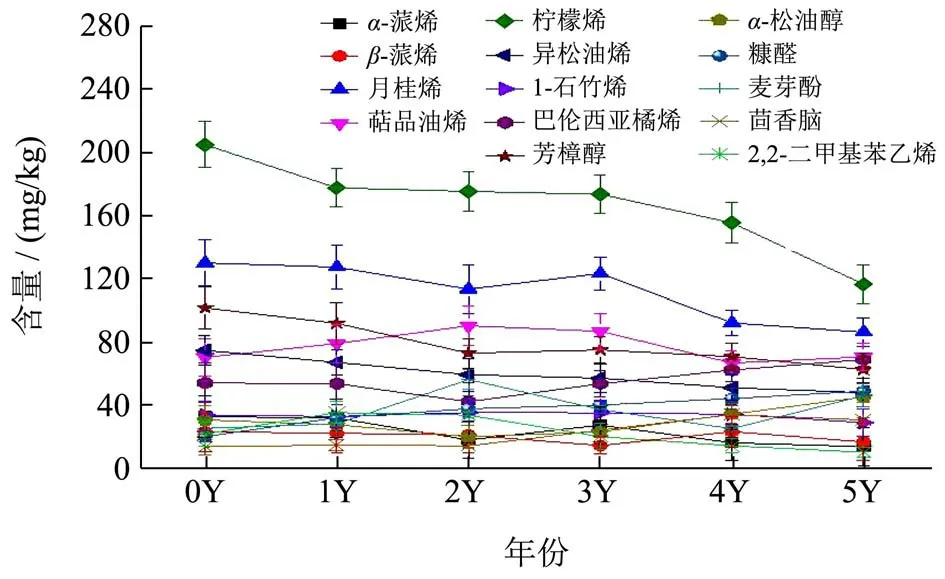
图4 不同发酵年份老香黄挥发性共有成分变化趋势图Fig.4 Trend of volatile components of Lao Xianghuang in different fermentation years
总体而言,在老香黄中月桂烯与柠檬烯相对含量最高,但是随着发酵时间延长而降低;糠醛和茴香脑在发酵期间相对含量逐渐上升;芳樟醇、异松油烯和1-石竹烯在发酵期间总体呈现下降趋势;α-蒎烯和β-蒎烯在发酵期间呈现降-升-降的趋势;α-松油醇和巴伦西亚橘烯发酵前期相对含量逐渐降低,但是在发酵2年后相对含量呈现升高趋势;萜品油烯和2,4-二甲基苯乙烯在发酵0-2年相对含量升高,但是2年后相对含量发生下降;麦芽酚发酵期间呈现升-降-升趋势。
2.3.3 正交偏最小二乘判别分析(OPLS-DA)不同年份共有挥发性成分
OPLS-DA 是在偏最小二乘判别(Partial Least Squares Regression Discriminant Analysis,PLS-DA)的基础上进一步发展起来的,通过正交化,排除与分类无关的自变量,减少误差,从而达到筛选不同样本的特征变量的目的[46]。一般认为,变量投影重要性(VIP)大于1 时,则表明该变量对于模型中各个类别的区分有重要意义。
将不同发酵年份14 个共有挥发性成分进行正交偏最小二乘判别分析,经OPLS-DA 分析R2 为0.593,Q2 为0.679,R2 和Q2 均大于0.500,说明此模型构建成功,具有很好的拟合度和预测能力。对化学标志物含量的VIP 值大小进行排序。Var1~Var14 分别代表α-蒎烯、β-蒎烯、月桂烯、萜品油烯、柠檬烯、异松油烯、1-石竹烯、巴伦西亚橘烯、芳樟醇、α-松油醇、糠醛、麦芽酚、茴香脑、2,4-二甲基苯乙烯。由图5可知,老香黄VIP 值大于1 的差异化学标志物有8 种,其中有6种萜烯类差异物质分别为,Var5(柠檬烯)、Var3(月桂烯)、Var6(异松油烯)、Var13(1-石竹烯)、Var1(α-蒎烯)以及Var8(巴伦西亚橘烯),萜烯类物质是芸香科植物中含量较高的物质,具有香甜花草香,有研究报道佛手在腌制放置过程中萜烯类物质持续下降[5];另外两种分别为Var11(糠醛)、Var9(芳樟醇),糠醛是在发酵过程中含量持续上升的焦甜香物质,主要是多糖降解产生的[45],芳樟醇随着发酵时间越长含量逐渐降低,一般在生佛手中含量较高[47]。以上8 种化学成分对6 个发酵阶段的老香黄的分类有显著影响,这些成分是引起不同发酵年份老香黄挥发性物质变化的主要差异性化学标志物,可为区分不同发酵年份老香黄提供一定依据。

图5 OPLS-DA 分析不同发酵年份老香黄共有成分差异贡献度图Fig.5 OPLS-DA Analysis of the difference contribution of common components in different fermentation years Lao Xianghuang
3 结论
本文主要利用电子鼻、HS-GC-IMS、HS-SPMEGC-MS 三种不同的技术联用对不同发酵年份老香黄挥发性成分变化进行分析,并结合OPLS-DA 分析不同发酵年份老香黄特征性成分。电子鼻分析结果得知,PCA 能明显区分发酵与未发酵老香黄,未发酵的老香黄风味与发酵的差异较大,其中发酵3、4年老香黄风味成分相似,而发酵1年、2年、5年老香黄风味差异较大,说明发酵工艺对老香黄风味的影响较大。HS-GC-IMS 和HS-SPME-GC-MS 所测出的基础风味物质种类基本一致,且鉴定出物质变化趋势也大致相同,萜烯类以及醇类含量总体呈现下降趋势,醛类化合物含量总体呈现上升趋势,但是,酸类物质是HS-GC-IMS 技术优于HS-SPME-GC-MS 技术检测到的小分子(C2~C10)、低含量的物质。HS-GC-IMS 定性检测出39 中挥发性成分,包括萜烯类8 种、醇类5种、醛类9 种、酯类4 种、酮类4 种、酚类1 种、酸类2 种、杂环化合物5 种以及其他1 种。离子迁移指纹图可以直观的看出老香黄在不同发酵年份期间各种挥发性成分的变化情况,且伴有部分物质的消失和新物质的形成。HS-SPME-GC-MS 的结果中一共鉴别出50 种挥发性成分,包括萜烯类16 种、醇类10 种、醛类6 种、酚类4 种、酯类3 种、醚类1 种、杂环化合物3 种和其它类7 种。不同发酵年份样品中发现共有化合物14 种,然后结合OPLS-DA 分析挥发性化合物的变化,共筛选出8 种差异性化学标志物,分别为柠檬烯、月桂烯、异松油烯、1-石竹烯、糠醛、芳樟醇、α-蒎烯、巴伦西亚橘烯,可为鉴别不同年份老香黄提供一定理论依据。
