基于Nisin对琼脂/卡拉胶基复合膜的改性及应用评价
2022-12-14宋雪健王欣卉王春圻李志江李娟王洪江孟令伟张东杰张爱武魏甜甜于金池
宋雪健,王欣卉,王春圻,李志江,3,李娟,王洪江,孟令伟,张东杰,3*,张爱武,魏甜甜,于金池
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)(2.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319)(3.国家杂粮工程技术研究中心,黑龙江大庆 163319)
多糖(Polysaccharide)是由十个以上的单糖通过糖苷键结合的高分子碳水化合物,包括淀粉(Amylum)、纤维素(Cellulose)、阿拉伯胶(Gum Arabic)、琼脂(Agar)等。多糖分子可以通过氢键相互作用,形成一个连续复杂的网络结构[1,2],具有一定的成膜性,是传统石油基包装材料的可替代品。琼脂是由琼脂糖(Agarose)和琼脂胶(Agaropectin)构成的多聚半乳糖,琼脂糖是由1→3-β-D-半乳糖和1→4-3,6 内醚-ɑ-L-半乳糖结合成的链状结构[3];琼脂胶与琼脂糖的分子结构较为相似,但由于甲氧基(CH3O-)、硫酸基等基团的存在导致琼脂胶没有凝胶功能,但会在琼脂的制作过程中随着工艺流程渐渐被除去[4,5]。琼脂的稳定性强,无毒无害,美国食品和药物管理局(FDA)自1972年就开始认定琼脂胶为安全的(GRAS)成分。我国也出台了相应的国家标准《食品安全国家标准 食品添加剂琼脂》(GB/T 1886.239-2016)[6]。琼脂具有较强的凝胶特性,即使浓度低至0.004%仍然能形成凝胶,但离子、pH 值等因素会影响凝胶强度。琼脂单独成份制备的膜性能指标较差,组织粗糙、易脆及较硬。但上述缺点可通过与其他材料复合进行改进。琼脂与其他材料一起制备膜的研究也已有报道,如Sousa 等[7]在95 ℃的条件下,将1%(m/m)的琼脂和干基重的15%甘油,共混10 min,制备的琼脂膜其厚度为(7±1)µm。Jang等[8]研究发现琼脂和质量分数为1.5 wt%(基于琼脂重)的甘油制备的薄膜其断裂伸长率为47.17%,明显高于琼脂与山梨醇、果糖等增塑剂制备的薄膜。上述研究结果表明,甘油是提高琼脂膜弹性的最有效的增塑剂。将琼脂与其他生物聚合物共混,可以有效地改变其单独成膜的功能特性。此外,Mahuwala 等[9]利用质量比为2:2 的琼脂/木薯淀粉共混,1.2 g 甘油作为增塑剂制备的复合膜理化性能较好,其水蒸气透过率为2.02×10−1± 0.22×10−1g/(m·s·Pa)。Rhim 等[10]研究发现卡拉胶和琼脂进行复配,可以提升琼脂膜的抗拉强度和透明度。
Nisin 是一种天然生物抗菌剂,是由乳酸链球菌通过菌株的代谢过程得到的由34 个氨基酸组成的多肽化合物,化学式为C143H230N42O37S7[11,12]。Nisin 对大多数革兰氏阳性菌表达出较强的抑制作用,可以通过阻碍细胞膜上的磷脂化合物的合成,影响硫氢基团的活性进而使造成细胞膜受损,导致具体失活[13]。Nisin 于1988年被FDA 列入一般公认安全名单[14],1990年,我国国标中正式批准Nisin 可使用于作为食品防腐剂[15]。
果蔬的腐败变质首先是受到细菌的侵害后,才进一步感染真菌、霉菌,在果蔬保鲜中对细菌的控制极为重要。近些年来,Nisin 作为细菌抗菌剂也被应用于包装领域。如Lopes 等[16]研究发现,在壳聚糖/果胶复合凝聚物中加入Nisin,可以赋予其抑菌功能,并且可以延缓Nisin 的释放,提高其在食品保鲜中的稳定性。Sivarooban 等[17]在大豆分离蛋白膜中加入10 000 IU/g 的 Nisin、1wt%的葡萄籽提取物及0.16wt%的EDTA 制备的薄膜具有较好的理化性能,能抑制李斯特菌、大肠杆菌及沙门氏菌的滋生。Wang等[18]制备的含有Nisin的N-琥珀酰壳聚糖抗菌膜能够起到延长草莓货架期的效果。综上所述,Nisin 在作为抗菌剂被应用于抗菌保鲜材料的研究具有一定的可行性,并且将Nisin 与琼脂进行复合的研究较为少见,因此,本研究采用琼脂作为成膜基材,Nisin 作为抗菌剂,卡拉胶作为增强剂来制备复合抗菌膜,并将其应用于果蔬的保鲜研究。
1 材料与方法
1.1 试验材料
琼脂,北京索莱宝科技有限公司;Nisin(效价≥1 000 000 IU/g),南京森贝伽生物科技有限公司;卡拉胶,滕州市香凝生物工程有限责任公司;丙三醇,辽宁泉瑞试剂有限公;脑心浸液琼脂(BHI),青岛高科园海博生物技术有限公司;2,6-二氯靛酚,上海研生实业有限公司;抗坏血酸,天津富宇化工厂;氢氧化钠,天津市大茂化学试剂厂;邻苯二甲酸氢钾,穗冠化工;蓝莓,购置于北京华联超市;妙洁密实袋(PE),烟台白马包装有限公司。
1.2 试验设备
XLW 型智能电子拉力试验机,济南兰光机电技术有限公司;DGG-9140B 型电热恒温鼓风干燥箱,上海森信实验仪器厂;BYT-B1 型透气性测试仪,济南兰光机电技术有限公司;TSY-T1H 透湿性测试仪,济南兰光机电技术有限公司;FMJ-450 双面加热塑料封口机,济南兰光机电技术有限公司;DMN 型光泽度仪,天津市其立科技有限公司;WGT-S 透光率/雾度测定仪,上海仪电物理光学仪器有限公司;JSM-6390LV 扫描电子显微镜,日本JEOL 公司;NicoletiS5 傅里叶变换红外光谱仪,美国Dynamica Velocity 公司;HGA-02 顶空气体分析仪,济南兰光机电技术有限公司。
1.3 试验方法
1.3.1 复合抗菌膜的制备
试验参照Wang 等[19]的研究方法,确定了琼脂的质量分数为1.6%(m/V,占水比,下同),0.2% (m/V)的卡拉胶,0.6% (m/V)的甘油于220 mL 的蒸馏水中,用保鲜膜覆盖烧杯口,防止液体蒸发,在100 ℃的水浴条件下,中速共混,待其充分溶解后,分别将质量分数为0.00%、0.20%、0.24%、0.28%、0.32%、0.36%的Nisin 分散于30 mL 的蒸馏水中,并加入成膜液中,混匀,将250 mL 成膜液流延于20×29 cm 的玻璃板上,待其凝固成型,在35 ℃的条件下干燥8 h,即可得到复合膜,并将其置于温度为25 ℃、相对湿度为50%的条件下保存24 h 后对其性能指标进行分析。
1.3.2 复合抗菌膜的性能表征
1.3.2.1 厚度的测定
试验参考Óscar 等[20]的研究方法但有所修改,在复合膜的上中下位置处各去3 个点利用电子数显螺旋测微器进行测量,并取平均值,即为复合膜的厚度。
1.3.2.2 抑菌性能
试验选取金黄色葡萄球菌(Staphylococcus aureus,SA)和单增李斯特菌(Listeria monocytogenes,LM)作为目标菌,将菌种在(37±1)℃的条件下进行活化3代,采用0.9%的生理盐水进行梯度稀释,使其浓度达到108CFU/mL。吸取100 μL 菌液于BHI 培养基中涂布均匀待用。将含有不同浓度Nisin 的抗菌膜裁剪成直径为6 mm 的小圆圈,至于上述培养皿中央,于(37±1)℃条件下培养48 h,用游标卡尺对抑菌圈宽度进行测量。用公式1 对抑菌圈宽度进行计算[21]。

式中:
D——抑菌圈宽度,mm;
D1——抑菌圈外径,mm;
D2——抗菌膜直径,单位为mm。
1.3.2.3 水溶性(Water-solubility,WS)及溶胀度(Swelling Degree,SD)的测定
参照Ghanbarzadeh 等[22]的方法经改进后进行水溶性测量。将膜裁剪成20×20 mm 的正方形样品,置于培养皿中于80 ℃下恒温干燥至恒重。将膜称重后放入盛有20 mL 蒸馏水的培养皿中。室温下溶胀1 h 后将膜取出,再次干燥至恒重,然后称重。计算膜的水溶性。

式中:
m1——第一次称重的质量,g;
m2——第二次称重的质量,g。
将膜裁剪成20×20 mm 的正方形样品,于65 ℃条件下恒温干燥至恒重,称重后放入蒸馏水中,室温下浸泡2 h,将膜取出后放于滤纸上,用滤纸将膜表面的水吸干后称重。计算膜的溶胀度。

式中:
m3——第一次称重的质量,g;
m4——第二次称重的质量,g。
1.3.2.4 光学性能的测定
将复合膜裁剪成 5×5 cm 的正方形,参考GB/T 2410-80-2008 及美国材料试验协会标准ASTM D1 003-61-2007,对复合膜的透光率(Transmittance,T)及雾度(Haze,H)进行测定[23]。
选取入射角度为75°的光泽度测试仪,根据 GB/T 8941-2007 进行光泽度(Glossiness,G)的测试,其中标准板进行标定处理差值在1.2 Gs 之内即可[24]。
1.3.2.5 阻隔性能的测定
参照国标GB/T 12704-1997 的标准方法,对复合膜的透氧系数(Oxygen Permeability,OP)进行测试,高纯氧气浓度为99.99%。参考Zhang 等[25]研究方法对对包装膜的透湿量(Water Vapor Permeability,WVP)进行测定。测试的环境温度为25 ℃、相对湿度为50%。
1.3.2.6 机械性能的测定
将抗菌膜裁剪成2×15 cm 的尺寸,设置仪器上移速度为25 mm/min,初始夹距为50 mm,对抗菌膜的抗拉强度(Tensile strength,TS)及断裂伸长率(Elongation at Break,EB)进行测试。
将膜裁剪成宽为15 mm,长为150 mm 的长条,将其中的一端用封口机封合。设置拉力试验机的初始夹距为50 mm,拉引速率为50 mm/min。以热封部位为中心,将抗菌膜打开呈180°,对热封强度(Heat Sealing Strength,HS)进行测试。试验结果单位以N/15 mm 表示。
1.3.2.7 微观结构的测定
(1)扫描电镜测定(SEM)
将抗菌膜剪裁成样条,平铺于粘有导电胶的载体上进行表面喷金处理,采用合适的放大倍数观察膜的表面结构[26]。
(2)红外光谱测定(FT-IR)
采用FT-IR 结合溴化钾压片前处理,对复合膜的内部结构及其官能团信息,在波数为400~4 000 cm-1范围内进行信息采集分析[27]。
1.3.3 复合抗菌膜的保鲜研究
1.3.3.1 蓝莓的包装设计理论基础
采用抗菌膜对蓝莓进行最优的包装方式进行保鲜研究。蓝莓的最优O2体积分数为5%,CO2体积分数为20%[28]。在4 ℃的条件下O2的扩散系数为0.063 m2·h-1,在20 ℃的条件下O2的扩散系数为0.069 m2·h-1。
采用顶空气体分析仪在相对湿度为90%,温度分别为4、20 ℃的条件下用取样针刺透硅胶密封垫测定果蔬的消耗氧气速率,设置采样时间间隔为5 s,分析时间为15 s,多次测量取平均值。试验根据气调包装气体传质模型公式4 对抗菌膜的气调包装方式进行设计。

式中:
N——抗菌膜的打孔数量;
D——气体的扩散系数,m2/h;
Ap——所打孔的孔面积,m2;
P——分压,atm;
Pa——大气压,atm;
L——抗菌膜的厚度,μm;
Ld——在穿孔深度为穿孔直径的1.1 倍时气体扩散阻力的校正穿孔长度,m;
R——气体常数,m3·atm·k-1·mol-1;
——抗菌膜的透气性,mol·μm·m-2·h-1·atm-1;
S——抗菌膜的表面积,m2;
W——被包装物的质量,kg;
RO2——O2的消耗速率,mol·kg-1·h-1。
1.3.3.2 果蔬的处理方法
试验选取200 g 蓝莓作为研究对象,分别用抗菌膜(含有Nisin 的复合膜)、琼脂膜(不含有Nisin 的复合膜)、PE 膜进行包装处理,其中PE 膜作为对照组,分别在温度为4 ℃、20 ℃,相对湿度为90%条件下进行储藏,研究随着储藏时间的延长抗菌膜对果蔬的保鲜效果。蓝莓在4 ℃的条件下取样时间间隔为6 d;在20℃条件下取样时间间隔为1 d。
1.3.3.3 失水率的测定
将蓝莓从包装袋中取出,根据公式5 对果蔬的失水率进行测定[29]。

式中:
A——失水率,%;
m0——贮前质量,g;
mt——贮间测定质量,g。
1.3.3.4 菌落总数
根据GB/T 4789.2-2016(食品安全国家标准 食品微生物学检验 菌落总数测定)标准对菌落总数进行测定。
1.3.3.5 可溶性固形物含量的测定(SSC)
试验选取果实中部的果肉,吸取汁液均匀涂在阿贝折射仪上进行测定[30]。
1.3.3.6 硬度的测定
用GY-4 型水果硬度计进行硬度值测试。
1.3.3.7 Vc 含量的测定
采用2,6-二氯靛酚法进行测定。
1.4 数据处理
利用SPSS 20.0 软件结合Duncan 计算方法进行数据分析,p<0.05 表示差异显著。所有指标均测量3 次取平均值。
2 结果与分析
2.1 复合抗菌膜的性能表征
2.1.1 Nisin 质量分数对复合膜厚度的影响
研究发现随着Nisin的质量分数增加抗菌膜的厚度也随之变大,从0.065 mm 增加到0.103 mm,并且添加Nisin 的抗菌膜与未添加的相比较具有显著性的差异(p<0.05),可能是Nisin 分子会与琼脂分子形成交联反应,提升成膜基材凝胶化,导致膜厚度增加。试验制备的琼脂膜抗菌膜与Wang 等[19]制备的琼脂膜抗菌膜(厚度为0.201 mm)相比较具有厚度薄,节省材料的优点,导致这一结果的原因,可能是成膜组分的相容性较好。
2.1.2 Nisin 浓度对复合膜抗菌效果的影响
金黄色葡萄球菌和单增李斯特菌是导致果蔬变质的微生物之一,因此对其进行抑制是延长果蔬货架期的重要保障。由图2可知,对于金黄色葡萄球菌来说,随着Nisin 浓度的增加,复合膜的抑菌圈宽度由1.533 mm增加到4.133 mm,并呈现出显著的差异性(p<0.05),证明Nisin 与其他组分进行了较好的融合,且保持了良好的抑菌活性。本文的研究与Lan 等[31]得到的研究结果相一致,并且于张乐等[32]研究的乳链菌肽对明胶-酪蛋白钙复合抗菌膜相比较,本试验制备的复合抗菌膜中Nisin 浓度较低,但对于金黄色葡萄球菌有着相似的抑菌圈宽度,证明了本试验中抗菌膜有较好的抑菌效果。试验结果表明复合抗菌膜对于李斯特菌也有一定的抑菌效果。整体抑菌圈宽度呈上升趋势,由1.131 mm增加到2.197 mm,但差异不够明显,特别是相邻两浓度梯度之间差异不显著。该结果与Abdollahzadeh 等[33]将乳酸链球菌素(100 AU)、肉桂精油(0.6wt%)和氧化锌纳米颗粒(10 mg/15 mL)加入到琼脂基膜中,制备的共混膜具有显著抑制单核增生李斯特菌生长的作用,并对食品品质无影响,取得的研究结果相一致,说明不同的成膜材料可能不影响Nisin 的抑菌效果。在Nisin 质量分数为0.28%时,相比较0.24%以下,试验制备的复合抗菌膜对两种细菌有较强的抑制效果。因此,试验制备的复合抗菌膜表现出较强的抑菌效果,复合试验预期,可以进行下一步试验。

图1 Nisin 浓度对复合膜厚度的影响Fig.1 Effect of Nisin concentration on the thickness of film

图2 Nisin 浓度对复合膜的抑菌圈宽度影响Fig.2 Effect of Nisin concentration on the bacteriosphere width of the composite film
2.1.3 复合膜的综合性能指标评价
由表1可知,复合膜的水溶性和溶胀度均随着Nisin 质量分数的增加而增大(p<0.05),在质量分数为0.28%时,水溶性为45.01%,溶胀度为197.01%,说明试验制备的复合膜具有可降解特性、复合环保基包材材料研究目的。试验制备的复合膜水溶性与Bi等[34]等采用壳聚糖/花青素/甘油制备的复合膜(水溶性为16.97% ~19.30%)相比较,具有较大的水溶效果。

表1 Nisin 浓度对复合膜的综合性能指标影响Table 1 Effect of Nisin concentration on the comprehensive performance index of the composite film
透光率是指光线透过抗菌膜的光通量和射到抗菌膜上的光通量的比值。雾度是指光线透过薄膜而偏离入射光线方向的散射光通量与透射光通量的比值。透光率和雾度是食品包装材料中的关键参数,直接影响消费者对产品的接受程度。对于复合膜而言,透光率和雾度成反比。Nisin的颜色为淡黄色,复合膜的透光率随着Nisin质量分数的增加而降低(p<0.05),但当Nisin 的质量分数为0.28%时,透光率为79.78%,雾度为70.01%。较低的透光率和较高雾度可以更好的减少光照对被包装物的影响,与普通包装材料相比试验制备的复合膜一定程度上对果蔬能予以较好的保护作用[35]。
光泽度与复合膜表面的粗糙程度有直接关系。虽然Nisin 镶嵌于琼脂/卡拉胶膜表面或贯穿其分子层时,会造成表面光滑度降低,因Nisin 的浓度较低,所以对于复合膜的光泽度无显著差异(p>0.05)。
透氧系数是衡量抗菌膜透气性能的参数之一,数值越大,表明透气性越高。研究发现Nisin 的浓度与复合膜的透氧系数存在正相关。Nisin 的浓度与复合膜的透湿量成正比,随着浓度的增加,透湿量由298.40 g·m-2·d-1增加到440.91 g·m-2·d-1,由此验证了水溶性增大的原因,并推断Nisin 的浓度可能会影响到复合膜的机械性能。
机械性能是评价包装材料应用能力的体现。如图3可知,Nisin 的质量分数与复合膜的抗拉强度成反比,当Nisin 质量分数从0.00%增加到0.36%时,复合膜的抗拉强度从24.23 MPa 下降到12.88 MPa。说明Nisin分子的存在确实降低了成膜基材分子间的相互作用力。当Nisin 质量分数为0.28%时,复合膜的热封强度为3.21 N/15 mm,抗拉强度为16.09 MPa,与张金丽等[36]利用12 g/L 的琼脂和40 g/L 的明胶(1:1)、0.4 g 甘油及不同体积的银纳米颗粒制备的复合膜(抗拉强度为13.92~14.89 MPa)相比较具有较强的机械性能。
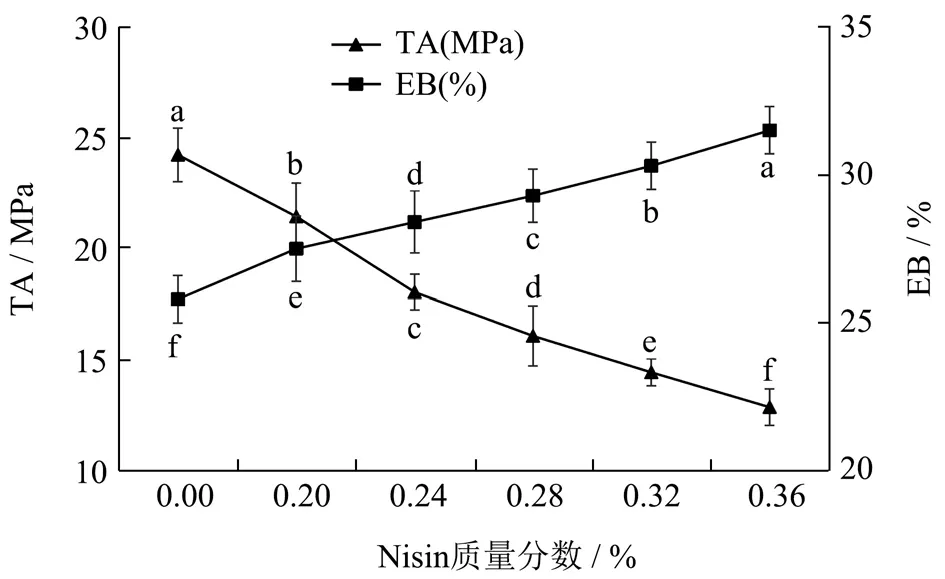
图3 Nisin 浓度对复合膜的机械性能影响Fig.3 Effect of the Nisin concentration on the mechanical properties of the composite films
2.1.4 复合膜微观结构分析
2.1.4.1 扫描电镜结果与分析
由图4可知当复合膜中不添加Nisin 时,复合膜的相容性较好,表面均匀、平整,但随着Nisin 质量分数的增加,复合膜开始出现了明显的团聚现象,并且浓度越大,复合膜的团聚现象越多越大,进而验证了复合膜的各项性能指标测试结果。试验与李迪等[37]研究结果相吻合。通过综合对复合膜的抑菌性、机械性能等指标的综合评价,以及考虑实际应用中成本的问题,故试验选取Nisin 质量分数为0.28%的复合膜进行进一步研究及保鲜效果评价。

图4 不同Nisin 含量复合膜的扫描电镜图Fig.4 SEM micrograph of composite films with different Nisin concentration
2.1.4.2 红外光谱分析
由图5可知,A、B 两条图谱大体呈相似趋势,琼脂在3 400 cm-1处有一个宽峰,属于羟基O-H 和N-H 的伸缩振动峰的叠加;2 923 cm-1和2 927 cm-1为残糖基上的甲基或次甲基的C-H 的伸缩振动吸收峰;1 151 cm-1处出现了C-O-C 振动吸收峰,1 091 cm-1处出现了C-O振动吸收峰。Nisin-琼脂基抗菌膜与琼脂膜进行对比,二者最大不同在于1 652 cm-1有明显的C=O 伸缩振动吸收峰,1 598 cm-1处出现的伯胺基的N-H 弯曲振动峰[38],说明Nisin 中酰胺基成功与琼脂中氨基进行键合,形成了Nisin-琼脂的共聚物。
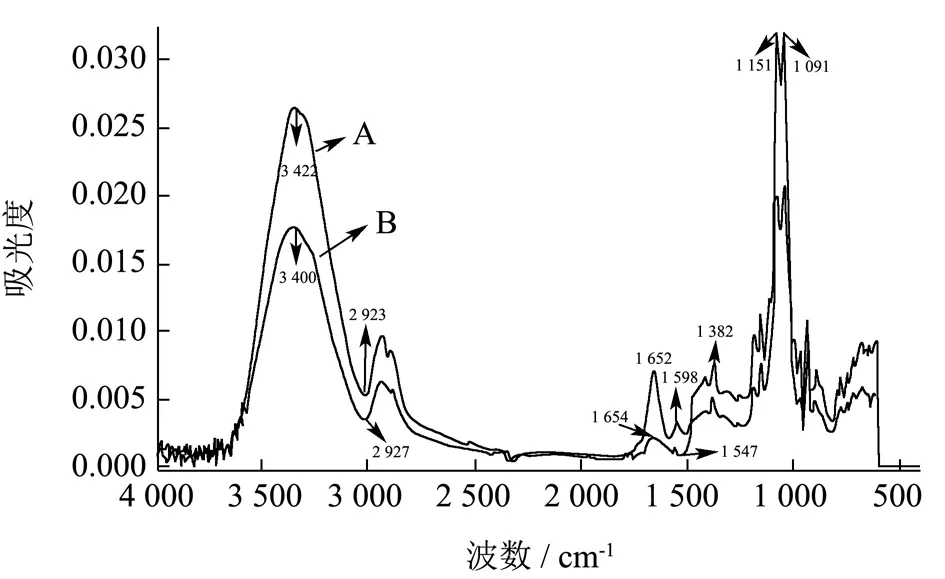
图5 复合膜的红外光谱图Fig.5 Infrared spectrogram of the composite film
2.2 复合膜的保鲜效果研究
2.2.1 果蔬的包装设计分析
综合上述的研究成果,从抑菌能力、性能指标、成本分析及应用价值角度出发,研究采用Nisin 质量分数为0.28%的抗菌膜对果蔬进行保鲜研究。因果蔬中水分的含量较大,且储藏环境较为湿润,故选取高湿条件下进行包装设计。包装设计的依据源自果蔬的呼吸强度与抗菌膜的透气能力处于相平衡的状态,避免造成无氧损伤或者氧气浓度过高对果蔬造成的伤害,从而达到延长货架期的目的。由于包装材料的透气系数较低,无法满足水果的适宜储藏条件,因此需要进行打孔处理,孔径为0.302 mm,且各组的打孔位置相一致,其他处理组也需要做相应的操作。
2.2.2 蓝莓的保鲜效果

表2 蓝莓的包装方式Table 2 Packaging method of blueberry
2.2.2.1 蓝莓的失水率
水果在储藏期内其呼吸作用会造成水分流失。由图6可知,蓝莓的失水率随贮藏时间的延长而逐渐增大,在4 ℃条件下贮藏15 d,PE 保鲜袋组的最大失水率为0.98%,抗菌膜组1.88%,琼脂膜组2.03%。在20℃条件下储藏5 d,PE 组最大失水率为1.98%,抗菌膜组5.76%,琼脂膜组5.25%。试验与Chiabrando 等[39]利用壳聚糖对蓝莓进行涂膜保鲜减缓蓝莓水分的流失的作用相一致。蓝莓在20 ℃条件下的失水率远高于4℃,主要由于温度越高蓝莓果实的呼吸作用越强。PE保鲜袋组要优于其他处理组,虽然PE 膜也打孔了,但由于空隙较小,且PE 膜的透水性较差,故水蒸气难以散发,一定程度上增大了保鲜膜内部空气环境湿度,减少了水分的蒸发,更加有利于微生物的滋生。抗菌膜透水性优于琼脂膜,但随着抗菌剂的释放迁移与溶解,使得抗菌膜和琼脂膜对于保水性的差异逐渐减小(p>0.05)。

图6 不同温度条件对蓝莓失水率的影响Fig.6 Effect of temperature on the rate of water loss blueberries
2.2.2.2 蓝莓的菌落总数
由图7所示,在不同条件下蓝莓中菌落总数呈“J”型增长趋势,在低温条件下菌落增长速率较为缓慢。抗菌膜组菌落数明显少于其他对照组,证明随时间的延长,抗菌膜中抗菌剂的释放与迁移,抑制了蓝莓表面细菌的滋生及外部环境细菌的侵害,延缓了蓝莓的腐烂变质。在储藏期满时,在4 ℃和20 ℃的条件下,抗菌膜组的菌落总数为4.20 lg cfu/g、6.37 lg cfu/g 明显低于其他处理组(p<0.05)。试验取得的结果与许琳琳[40]利用枯草芽孢杆菌环脂肽/海藻酸钠复合膜对蓝莓进行保鲜研究得到的结果相似。PE 组内的蓝莓因呼吸作用释放的水蒸气,无法全部排出保鲜袋外,造成了内部空气湿度环境过大,水分的回流加速了蓝莓的腐败与溃烂,验证了失水率分析中给出的猜想。

图7 不同贮藏温度对菌落总数的影响Fig.7 Effects of different storage temperature on the total number of colonies
2.2.2.3 蓝莓的可溶性固形物
SSC 是衡量水果的成熟度、果品品质的重要参考指标之一。图8表示蓝莓中SSC 的随贮藏时间的变化过程,开始阶段由于蓝莓的水分流失及成熟度进一步提高,使SSC 小幅度上升,后因微生物的影响及呼吸作用使蓝莓中营养物质开始流失,导致其开始下降。在4 ℃和20 ℃条件下,储藏期满时,对照组蓝莓的SSC 降低到10.08%和10.37%,明显低于抗菌膜组且具有显著性差异(p<0.05),因此,抗菌膜组能有效地减缓SSC 的流失。杨清菁等[41]在4 ℃和20 ℃的储藏条件下,采用0.5wt%壳聚糖对蓝莓果实进行涂膜处理,结果表明该方法对SSC 含量影响较小,试验与其得到的结果相似。
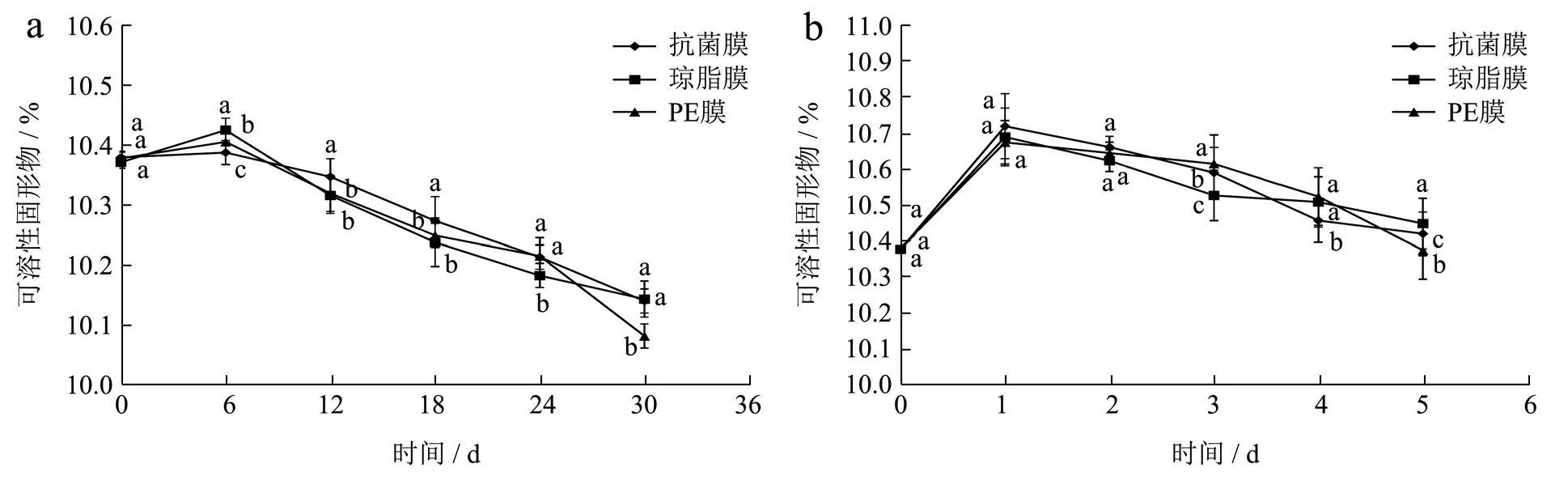
图8 不同贮藏温度对可溶性固形物的影响Fig.8 Effects of different storage temperatures of soluble solids
2.2.2.4 蓝莓的硬度
硬度是反应果蔬成熟度、耐贮存性、果品品质的重要指标之一,通过硬度的检测对下一步的运输和贮藏提供依据。由图9可知,蓝莓的硬度随着储藏时间的延长而逐渐降低。在不同温度条件下抗菌膜组蓝莓硬度的分别从5.89×105Pa 降低到4.58×105Pa,5.87×105Pa降低到4.69×105Pa,与其他处理组相比较具有显著性差异(p<0.05)。主要是因为抗菌膜可以有效的抑制蓝莓中微生物的增长与繁殖,减缓蓝莓营养成分的损失,故硬度下降趋势较为缓慢。抗菌剂Nisin 对细菌的抑制能有效地减缓蓝莓果肉中胶层和纤维素等物质的分解,抑制了蓝莓硬度的降低[42]。

图9 不同贮藏温度对蓝莓硬度的影响Fig.9 Effects of different storage temperature on the hardness of blueberries
2.2.2.5 蓝莓的Vc 含量
新鲜的蓝莓中含有大量的Vc,采后随着储藏时间的延长Vc 极易被氧化而造成流失。蓝莓的Vc 含量的变化如图10所示。蓝莓中的Vc 含量随着贮藏时间延长而逐渐降低,但降低程度存在差异。在4 ℃条件下抗菌膜组与其他处理组相比较具有显著性差异(p<0.05)。Vc 含量从51.99 mg/100 g 下降到44.25 mg/100 g,琼脂膜组从51.99 mg/100 g 下降到42.78 mg/100 g,PE 组从52.03 mg/100 g 下降到41.91 mg/100 g,在高温条件下,也是抗菌膜组优于其他处理组(p<0.05)。这是因为抗菌膜组能有效地抑制微生物的滋生,降低蓝莓的腐烂速率,并且抗菌膜阻隔性好,将蓝莓与外界隔绝,降低了Vc 的氧化作用,达到了延长货架期的目的。汪东风等[43]研究发现与对照组相比较,壳聚糖膜对蓝莓保鲜时能有效地减低Vc 的流失,试验与其得到结果相类似。
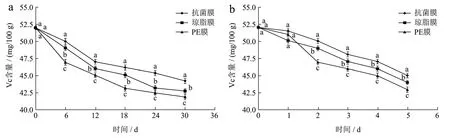
图10 不同贮藏温度对Vc 含量的影响Fig.10 Effects of different storage temperature conditions on the content of Vc
3 结论
研究采用1.6wt%的琼脂、0.2wt%的卡拉胶作为主要的成膜基材,体积分数0.6%的甘油作为增塑剂、不同质量分数的Nisin 作为抗菌剂制备环保抗菌膜,并对其性能指标及对蓝莓的保鲜效果进行研究,结果表明,随着Nisin 质量分数(0.00%、0.20%、0.24%、0.28%、0.32%、0.36%)增加,复合抗菌膜的水溶性、雾度、透光率、透氧系数、热风强度及抗拉强度存在显著性差异。
复合抗菌膜能有效地抑制导致蓝莓腐败变质特征菌,金黄色葡萄球菌和李斯特菌的滋生,并且当Nisin浓度为0.28%时对两者的抑菌圈宽度分别为3.326 mm和1.812 mm,说明了该抗菌膜可以应用于蓝莓的保鲜研究。
采用Nisin 浓度为0.28%的抗菌膜对蓝莓进行合理的包装设计,研究其保鲜效果,结果表明,抗菌膜与对照组相比较能有效地抑制蓝莓中菌落数的增加,减缓可溶性固形物、硬度、Vc 的流失,可以起到延长其货架期的目的。
