不同等级普洱熟茶的代谢物差异分析
2022-12-14王娟肖巧梅张晓宇罗涵潇李雪丹魏子涛吕才有
王娟,肖巧梅,张晓宇,罗涵潇,李雪丹,魏子涛,吕才有*
(1.云南农业大学茶学院,云南昆明 650201)(2.勐海县茶叶与绿色食品产业发展中心,云南勐海 666200)
普洱茶是使用独特的加工工艺而制成的具有独特品质特征的茶叶,按加工工艺的不同分为普洱生茶和普洱熟茶[1]。因其具有降脂减肥、抗氧化、降血糖、预防心血管疾病等的药理作用[2-4],市场需求量逐渐增大。市场扩大的同时,云南省茶叶种植面积也在逐年上升,但我国平均茶园单产830 kg/hm2远低于土耳其的3 314 kg/hm2,致使很多茶叶的生物产量没有被充分利用,茶鲜叶存在利用率低[5],并且省内对茶树鲜叶的采摘还主要依靠传统手工采摘方式来完成[6],采摘环节出现了严重的用工荒。如何提高单位面积的产出效益和降低采摘成本成为云南省茶产业发展亟待解决的问题,机械化采摘成为解决此难题的最可能途径[7-9]。茶树鲜叶机械化采摘的研究推广,促使提升机采机制茶品质成了首要任务。分级处理是提高品质的一个重要手段,经过分级处理后的机采茶,在应用及品质上都有所提升。目前已有大量的分级设备投入使用,可以对机采鲜叶进行分级,一定程度上提高鲜叶的匀度和质量[10]。经分级后的机采鲜叶,也能初步区分鲜叶的老嫩程度,有利于之后加工原料的分离[11]。依据原料的等级来加工不同种类红茶和绿茶[12,13],使得机采鲜叶原料的资源利用率提升到最大化。利用机采机制晒青茶,经分级处理后加工成普洱熟茶,是提高利用率和产出效益的方法,也是普洱茶提质增效的关键手段。
茶叶品质评定的方法包括感官审评和理化检验,感官审评是利用人们的感觉器官对茶叶的外形、内质进行审评,并用专业术语来描述茶叶的各种品质属性。而理化检验则是通过一定的仪器、设备或方法来探测茶叶的理化性状,组学是动态的揭示系统结构、功能相互作用和运行规律的技术,目前植物代谢组学被广泛用在茶学研究中,主要集中在茶叶加工[14]、茶叶功效[15]、品质研究[16]等方面。本试验采用秋季机采鲜叶制作的机采晒青茶为原料,经筛分后得到的三个不同等级机采机制晒青茶,通过小框发酵的方式加工成不同等级普洱熟茶。用代谢组学技术来揭示氨基酸、生物碱、黄酮及类黄酮和儿茶素及其衍生物这几类物质在不同等级普洱熟茶中的变化规律,以期找到影响不同等级普洱熟茶品质的主要化学成分;并根据感官审评结果来筛选出提高机采晒青茶加工普洱熟茶品质的加工工序,增加机采机制晒青茶的经济效益。
1 材料与方法
1.1 实验材料
晒青茶取样:本实验于2020年秋季,课题组成员前往云南省德宏现代农业产业茶园使用机械采摘大叶种云抗十号鲜叶,后经机械化加工制成机采机制晒青茶,并以此为原料。通过型号6CSY 茶叶平筛机(筛子为4 目和7 目)把机采机制晒青茶原料分为三个等级,三个不同等级机采机制晒青茶在相同条件下使用竹筐发酵的加工方式,得到A、B 和C 三个不同等级普洱熟茶试样。
1.2 试验方法
1.2.1 感官审评
引用感官审评国标[17]中普洱熟茶的感官审评方法分别从香气、汤色、滋味、叶底四个方面评审并得出评语。
1.2.2 差异代谢物测定
委托上海百趣生物科技有限公司,A、B 和C 三个不同等级普洱熟茶为实验材料,应用EXION LC System(SCIEX)超高效液相色谱仪,使用超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)和串联质谱(Tandem Mass Spectrometry,MS/MS)的代谢组学技术,通过Waters UPLC 液相色谱柱对目标化合物进行色谱分离,主要方法如下:
(1)代谢物提取
将样本进行冷冻干燥处理后再进行研磨(60 Hz,30 s);称取50 mg 的样本到离心管中,加入700 µL 甲醇水提取液(体积比3:1,含内标);涡旋30 s,35 Hz匀浆4 min,冰水浴超声5 min;重复匀浆超声3 次;在混匀仪上4 ℃过夜;将样本4 ℃,12 000 r/min 离心15 min;取上清经0.22 µm 微孔滤膜过滤;用提取液稀释上清液20 倍,涡旋30 s,每个样本各取20 µL 混合成质量控制(Quality Control,QC)样本;-80 ℃储存直到上机检测。
(2)液相条件
本试验使用EXION LC System(SCIEX)超高效液相色谱仪,通过Waters UPLC 液相色谱柱对目标化合物进行色谱分离。液相色谱A 相为含体积分数0.1%甲酸水溶液,B 相为乙腈。柱温箱温度为40 ℃,自动进样器温度为4 ℃,进样体积为2 µL,体积流量为400 µL/min,具体流动相梯度见表1。
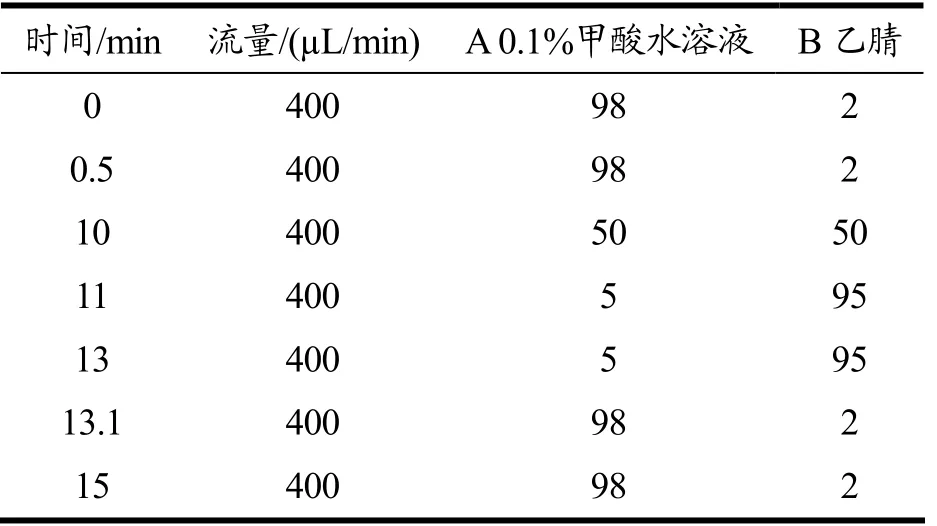
表1 液相色谱流动相条件Table 1 Mobile phase conditions of liquid chromatography
(3)质谱条件
本试验使用装备IonDrive Turbo VESI 离子源的SCIEX 6500 QTRAP+三重四极杆质谱仪,以多反应监测(MRM)模式进行质谱分析。离子源参数如下:IonSpray Voltage:+5500 V/-4500 V,Curtain Gas:35 psi,Temperature:400 ℃,Ion Source Gas 1:60 psi,Ion Source Gas 2:60 psi,DP:±100 V。
1.3 数据分析
每个样品提取4 次,实验中所有质谱数据采集及目标化合物定量分析工作。均通过SCIEX Analyst Work Station Software(Version 1.6.3)来完成。使用MSconventer 软件将质谱原始转成TXT 格式。再使用自撰写R 程序包结合自建数据库完成提峰、注释等工作。
采用多元统计分析,基于正交偏最小二乘法-判别分析(Orthogonal Projections to Latent Structures-Discriminant Analysis,OPLS-DA)结果,从多变量分析 OPLS-DA 模型的变量重要性投影(Variable Importance in Project,VIP)中初步筛选出不同样品间差异代谢物,再通过组合单变量分析的P(P-Value)值或差异倍数值(Fold Change)来进一步筛选差异代谢物。本试验中存在生物学重复,通过Fold Change 和OPLS-DA 模型的VIP 值相结合的方法来筛选差异代谢物。筛选标准:选取Fold Change≥2(上调)和Fold Change≤0.5(下调)的代谢物。
2 结果与讨论
2.1 感官审评
参照普洱茶国家标准GB/T 22111-2008 对三个试样进行感官审评,得出感官审评结果表2和图1,认为这三个普洱熟茶试样为合格茶样,具有普洱熟茶的品质特征。外形评定中A 最好,条索较紧结和紧细,只是略带老梗;B 较好,带少量黄片与老梗;C 较差,存在大量黄片与老梗。内质评定中七个试样的汤色除A为红褐之外,其余试样的汤色都为褐红,差异较小;香气结果中为B 较好,表现为陈香浓郁且持久,其余试样都为陈香较浓郁;滋味结果中为B 和C 最好,口感达到醇厚,A 的滋味较淡;叶底结果中,A 的叶底明显区别于其余试样,A 的叶底中明显存在泛青的现象,说明发酵程度不足,其余试样差异较小。

表2 感官审评结果Table 2 Sensory evaluation results

图1 感官审评Fig.1 Sensory evaluation
A、B 和C 三个不同等级普洱熟茶中B 的感官审评结果最优;A 等级嫩度最高,但感官审评结果并不是最优的,叶底中出现泛青现象,发酵程度明显低于其余试样,说明不一定嫩度最高,加工的普洱熟茶品质就最好。
2.2 代谢产物种类及主成分分析
三个试样经广泛靶向代谢组学技术鉴定,共检测到1 073 种物质,已确定1 048 种代谢物,包括178 个黄酮及类黄酮、141 个生物碱、139 个萜类、86 个酚类及其衍生物、67 个苯丙素和香豆素、55 个脂类、50 个醇类、44 个氨基酸及其衍生物、42 个酸类、36 个杂环化合物、32 个有机化合物、31 个核苷酸及其衍生物、28 个木脂素、24 个酮类、18 个醌类、14 个植物激素、9 个糖类、6 个维生素、3 个酯类和45 个其他类,共20 个类别。
主成分分析(Principal Component Analysis,PCA)图中横坐标PC[1]和纵坐标PC[2]分别表示排名第一和第二的主成分的得分,每个散点代表一个样本,散点的颜色和形状表示不同的分组。样本基本处于95%置信区间内。图2PCA 得分图中,A、B 和C 三个不同等级存在明显区分。A 明显区别于其余试样,本实验设计的不同等级试样之间均得到清晰的区分,存在具有显著性差异的相关化合物,说明它们可作为鉴别不同等级普洱熟茶之间的代谢标志物。

图2 PCA 得分图Fig.2 PCA score chart
2.3 不同等级普洱熟茶代谢物对比分析
为了进一步区分不同组别差异,确定不同等级普洱熟茶的差异成分,采用有监督的OPLS-DA 进行数据分析,图3分别显示了OPLS-DA 方法对原料分级和精制分级后得到不同等级普洱熟茶的分析结果。图中横坐标t[1]P 表示第一主成分的预测主成分得分,展示样本组间差异,纵坐标t[1]O 表示正交主成分得分,展示样本组内差异,每个散点代表一个样本,散点形状和颜色表示不同的实验分组。从OPLS-DA 得分图的结果可以看出,两组样本两两之间区分非常显著,且样本全部处于95%置信区间(Hotelling's T-squaredellipse)内,说明不同等级普洱熟茶组分间的代谢产物都产生较大的差异。

图3 不同等级普洱熟茶对比的OPLS-DA 得分散点图Fig.3 OPLS-DA score scatter diagram of comparison of different grades of Pu'erh ripe tea
置换检验通过随机改变分类变量Y的排列顺序,多次(次数n=200)建立OPLS-DA 模型以获取随机模型的R2和Q2值。图4中横坐标表示置换检验的置换保留度(与原模型Y变量顺序一致的比例,置换保留度等于1 处的点即为原模型的R2Y和Q2值),纵坐标表示R2Y和Q2取值,绿色圆点表示置换检验得到的R2Y值,蓝色方点表示置换检验得到的Q2值,两条虚线分别表示R2Y和Q2的回归线[18]。原模型R2Y非常接近1,说明建立的模型符合样本数据的真实情况;原模型Q2比较接近1,说明如果有新样本加入模型,会得到比较近似的分布情况,总的来说原模型可以很好地解释两组样本之间的差异。置换检验随机模型的Q2值均小于原模型的Q2值;Q2的回归线与纵轴的截距小于零;同时随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降。由此说明本试验模型具有良好的稳健性,不存在过拟合现象。
2.4 不同等级普洱熟茶差异代谢物的筛选
VIP 值表示对应代谢物的组间差异在模型中各组样本分类判别中的影响强度,一般认为VIP≥1 的代谢物则为差异显著。本研究以VIP≥1 且p<0.05 为卡值标准,用OPLS-DA 模型(图4)来比较不同等级普洱熟茶间的代谢差异。A、B 和C 三个不同等级普洱熟茶差异代谢物中,A 组相对于B 组有269 个差异代谢物,237 个成分显著上调,32 个成分显著下调;A 组相对于C 组有296 个差异代谢物,255 个成分显著上调,41个成分显著下调;B 组相对于C 组有127 个差异代谢物,83 个成分显著上调,44 个成分显著下调。
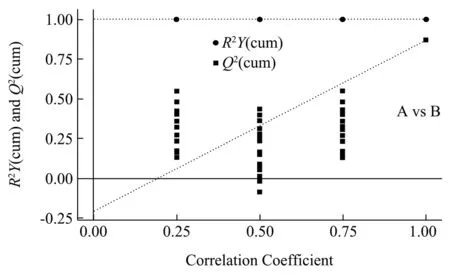
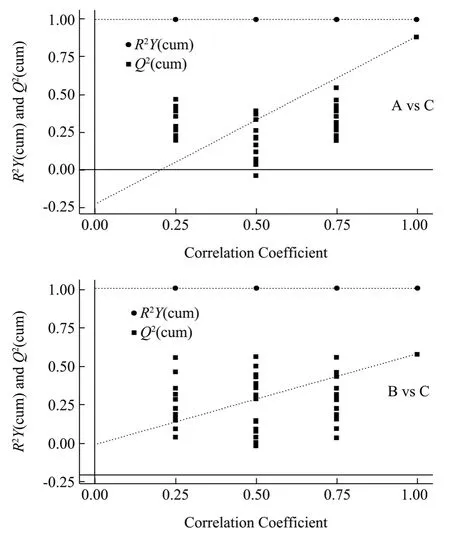
图4 不同等级普洱熟茶对比的模型置换检验图Fig.4 Model replacement test chart for comparison of different grades of Pu'erh ripe tea
根据上述得到的差异代谢物,将筛选差异代谢物的结果以火山图(Volcano Plot)的形式进行可视化,来寻找潜在的差异物质[19]。如图5所示,火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化(取以2 为底的对数),纵坐标表示学生t检验的P-value(取以10 为底对数的负数),散点大小代表OPLS-DA 模型的VIP 值,散点越大VIP 值越大。散点颜色代表最终的筛选结果,显著上调的代谢物以红色表示,显著下调的代谢物以蓝色表示,非显著差异的代谢物为灰色。可以直观的看出不同组间差异代谢物的分布情况,每组对比样本都有明确的高表达或者低表达的区域,都能够很好的区别,不同等级普洱熟茶在代谢产物的表达上有呈现出明显差异性。
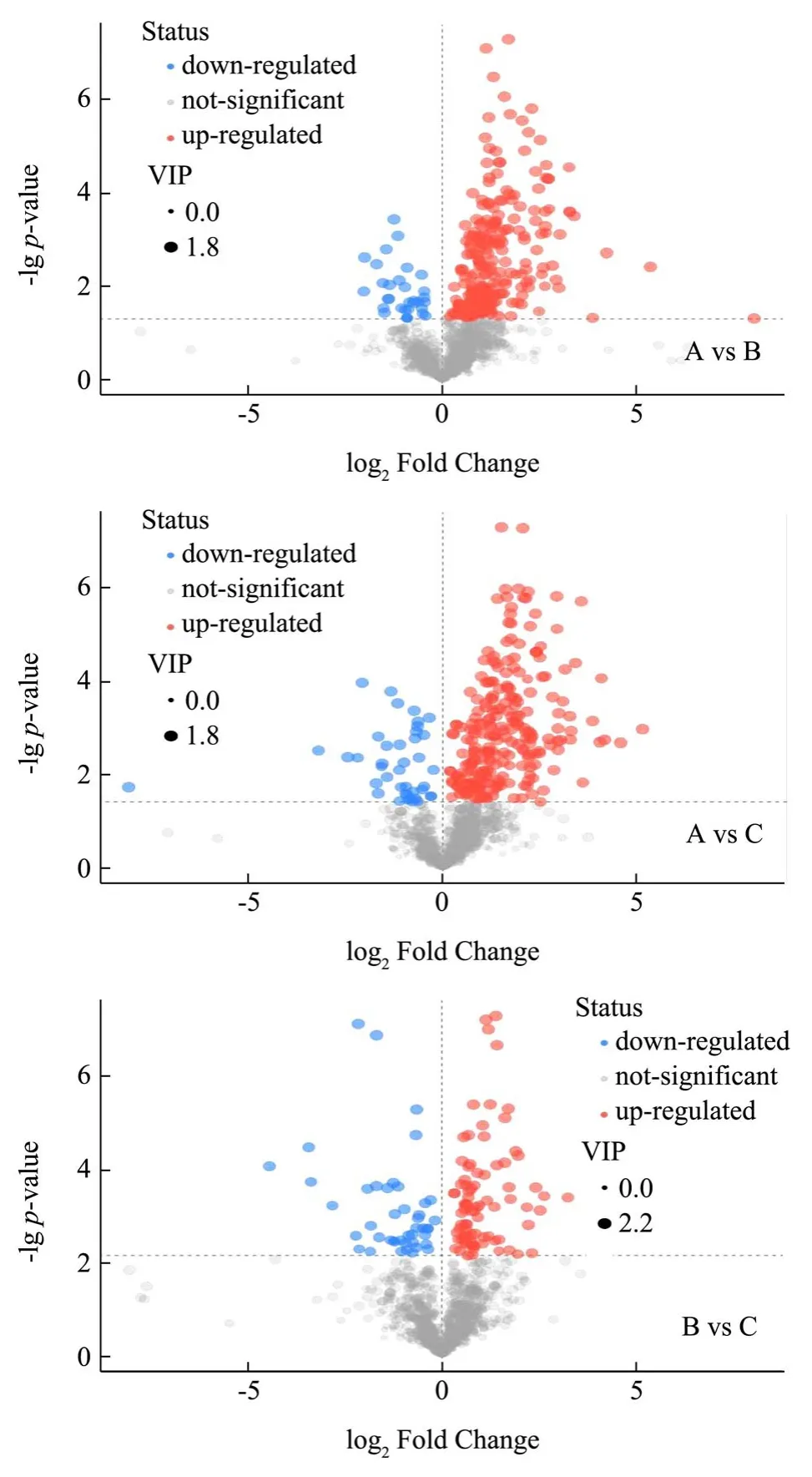
图5 A vs B、A vs C、B vs C 差异代谢物Fig.5 The difference metabolites of A vs B、A vs C、B vs C
2.5 不同等级普洱熟茶主要差异代谢物分析
为了进一步找出不同等级普洱熟茶中两组间对结果分析起贡献作用的变量,采用VIP≥1、p<0.05 且Fold Change≥2 或≤0.5 作为最终差异物筛选的条件,结果筛选鉴定出A、B 和C 三个不同等级中差异代谢物共238 个,具体结果见表附录;其中A 组相对于B组有163 个差异代谢物,150 个成分显著上调,13 个成分显著下调;A 组相对于C 组有185 个差异代谢物,167 个成分显著上调,18 个成分显著下调;B 组相对于C 组有37 个差异代谢物,23 个成分显著上调,14 个成分显著下调。上调代表相对定量增加,下调代表相对定量降低。
238 个差异代谢物中有12 个在三组对比中均为差异代谢物,即为标志性代谢物,包括1 个核苷酸及其衍生物、1 个嘌呤核苷类、3 个萜类、2 个酚类、4 个黄酮及类黄酮和1 个糖类。表3为标志性差异代谢物的详细信息,红色代表差异为2 倍以上,蓝色代表差异在0.5 以下。对这些标志性差异代谢物的相对定量作出柱形图(图6)。结果可得:A、B 和C 三个不同等级普洱熟茶随着等级的降低,鸟苷3',5'-环一磷酸、去氧苦地胆苦素、黄独素B、黄独素D、表没食子儿茶素没食子酸酯、没食子酸甲酯、3-没食子酰基奎宁酸、儿茶素、(-)-没食子酸儿茶素酯、表儿茶素没食子酸酯等这些标志性差异代谢物的相对定量是显著减少的,而D-麦芽糖的相对定量却是随着等级的降低而显著增加。儿茶素类物质有很强的抗氧化活性,是茶叶中重要的活性成分之一,根据有关文献,儿茶素组分含量在武夷肉桂茶[20]、湖南黑毛茶[21]等不同茶类中都与等级呈正相关。本实验的12 个标志性代谢物中,儿茶素类物质占比较多,表没食子儿茶素没食子酸酯、儿茶素、(-)-没食子酸儿茶素酯和表儿茶素没食子酸酯这几个儿茶素类物质的相对定量都是极显著的A 高于B 高于C,说明普洱熟茶儿茶素组分的相对定量与等级也呈正相关,等级越高儿茶素组分相对定量越高。
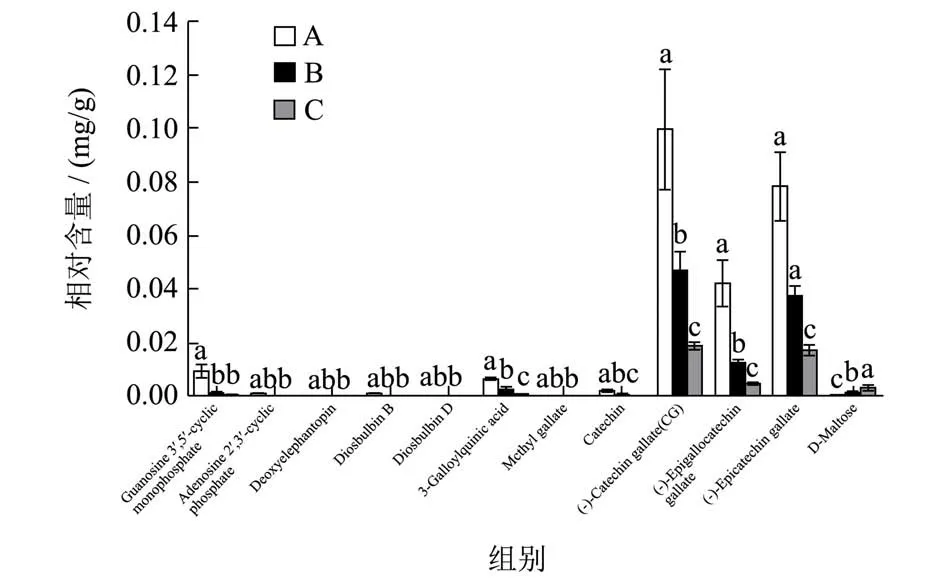
图6 标志性差异代谢物Fig.6 Marker differential metabolites

表3 标志性差异代谢物Table 3 Marker differential metabolites
茶叶品质研究中,氨基酸、生物碱、黄酮及类黄酮和儿茶素及其衍生物这几类物质对茶叶品质的影响至关重要[22],所以本次研究也重点关注到这几类物质在不同等级普洱熟茶中变化差异。238 个差异代谢物中共筛选出18 个氨基酸及其衍生物、18 个生物碱、19个黄酮及类黄酮和12 个儿茶素及其衍生物。表4为重点类物质信息表,由表可知:18 个氨基酸及其衍生物的相对总量为A(0.053 mg/g)>B(0.007 mg/g)>C(0.006 mg/g);18 个生物碱的相对总量为A(0.072 mg/g)>B(0.042 mg/g)>C(0.028 mg/g);19 个黄酮及类黄酮的相对总量为A(0.516 mg/g)>C(0.221 mg/g)>B(0.245 mg/g);12 个儿茶素及其衍生物的相对总量为A(1.808 mg/g)>B(0.668 mg/g)>C(0.482 mg/g)。这几类物质的相对总量变化趋势都随等级降低而减少,除了儿茶素及其衍生物类物质中A、B 和C 之间具有显著性差异(p<0.05),其余类物质都为A 与B和C 之间具有显著性差异(p<0.05),B 和C 之间无显著性差异(p>0.05)。

表4 重点类物质信息Table 4 Information of key substances

续表4
采用绘制热图的方式对这些重点物质的单一相对定量进行代谢产物层次聚类分析,图7中不同位置的色块代表代谢物的相对表达量,高低表达组分交互在一起,红色表示代谢物相对定量上调,蓝色表示代谢物相对定量下调;Group 1 代表氨基酸、Group 2 代表生物碱、Group 3 代表黄酮及类黄酮和Group 4 代表儿茶素及其衍生物。热图分析可得:A 中氨基酸、生物碱、黄酮及类黄酮和儿茶素及其衍生物这几类物质大部分都呈高表达,说明A 在三个等级中这几类重点物质的相对定量较高,在B 中呈较低表达,在C 中呈低表达;B 中有生物碱Lumichrome(光色素)和黄酮及类黄酮(-)-Maackiain(高丽槐素)呈高表达,其中Lumichrome(光色素)在A 中呈较低表达,C 中呈低表达,(-)-Maackiain(高丽槐素)在C 中呈高低表达,A 中呈低表达;C 中氨基酸Levodopa(左旋多巴)、生物碱Tombozine(妥包嗪)和黄酮及类黄酮Isorhamnetin(异鼠李素)呈高表达,这三个物质在B 中都呈较低表达,A 中呈低表达。

图7 不同等级普洱熟茶重点物质热图Fig.7 Heatmap of key substances of different drades of Pu'erh ripe tea
综上所述:这几类物质相对总量的变化趋势都随等级降低而减少,在所有物质的相对定量分析中除了氨基酸Levodopa(左旋多巴)、生物碱Tombozine(妥包嗪)和黄酮及类黄酮Isorhamnetin(异鼠李素)这三个物质是随着等级的降低而显著增加,其余大部分物质是随着等级的降低而显著减少。氨基酸类物质在发酵过程中,微生物的大量繁殖需要消耗大量的氨基酸作为氮源[23],陈保等[24]曾在不同等级原料加工普洱熟茶的化学成分变化研究中,得出三级晒青茶和叶片粗老的老黄片在游离氨基酸总量的变化上随等级的降低呈下降趋势的结论;薛晨[25]得出不同等级普洱茶中各氨基酸组分随级别的降低总体呈下降趋势,本实验中氨基酸的相对总量变化趋势也随等级降低而减少,以上结论与本实验结果一致,意味着不同等级晒青茶的发酵影响着氨基酸总量的消耗。吕海鹏等[26]研究得出高等级普洱茶中的黄酮总量(1.39%)明显低于中、低等级普洱茶(分别为1.54%和1.58%),中、低级别普洱茶差异不明显(p>0.05);而赵熙[27]等在研究不同等级茯砖茶化学成分变化中,却得到一级料茯砖茶(2.72%)的黄酮类物质含量高于三级料茯砖茶(2.15%),本实验结果中黄酮及类黄酮的相对总量变化趋势为A(0.516 mg/g)>C(0.245 mg/g)>B(0.221 mg/g),A明显高于B 和C,但B 和C 之间差异较小,与以上结论存在异同点。
2.6 差异代谢物相关通路分析
通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库[28]对所有差异显著的代谢物质进行通路富集分析,结果如图8显示,气泡图中每一个气泡代表一个代谢通路,气泡所在横坐标和气泡大小表示该通路在拓扑分析中的影响因子大小,气泡越大影响因子越大;气泡所在纵坐标和气泡颜色表示富集分析的P 值(取负自然对数,即-ln P-value),颜色越深P 值越小,富集程度越显著。代谢产物主要分布在15 条代谢途径中,基于富集分析得到的P 小于0.05 对关键代谢途径进行筛选,得到1 条差异代谢物数量富集相关性较强的通路,该差异代谢物富集通路为苯丙氨酸代谢,包括L-苯丙氨酸、2-苯乙胺、2-苯乙酰胺和4-羟基肉桂酸等4种代谢物质。
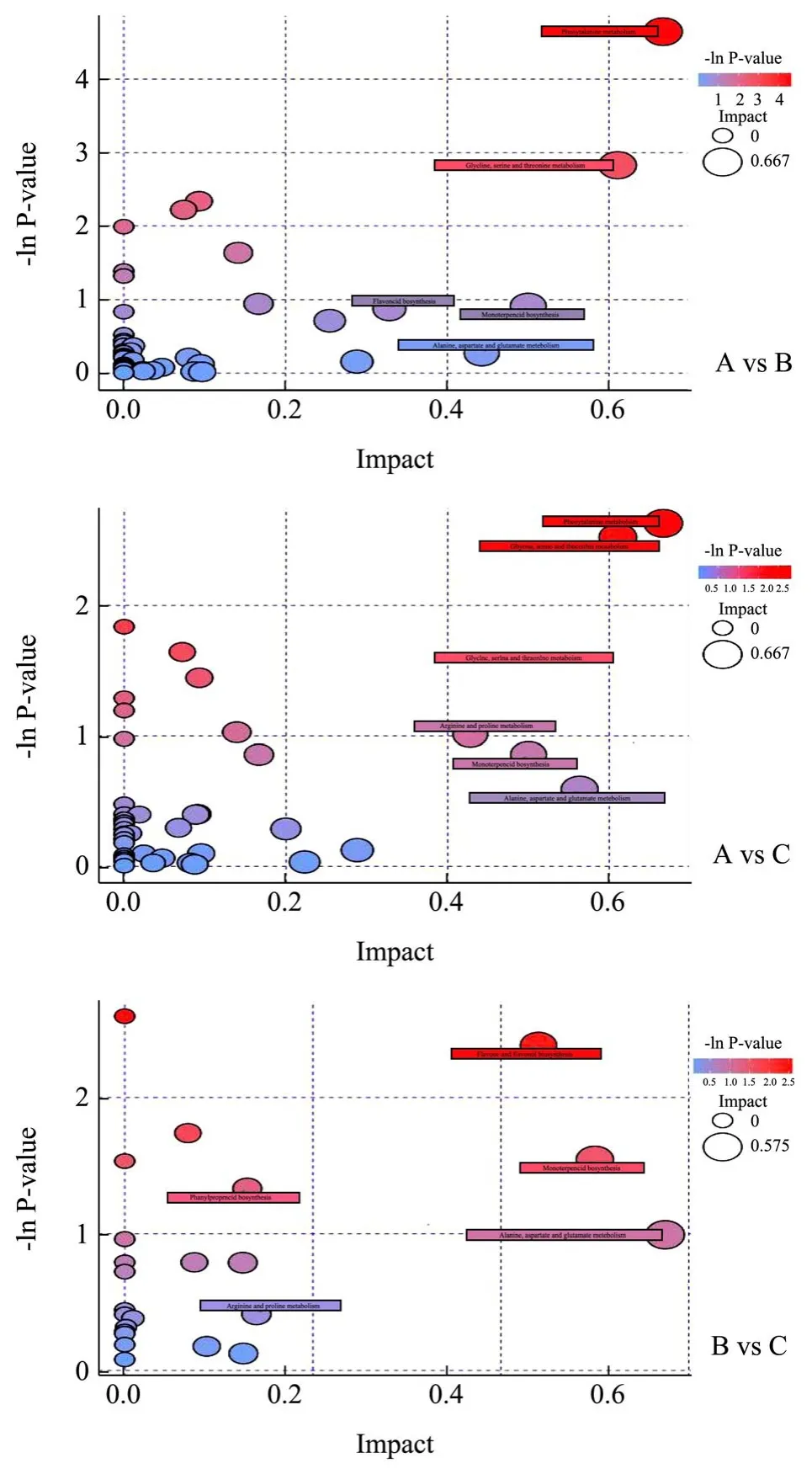
图8 差异代谢物KEGG 富集通路气泡图Fig.8 Bubble diagram of differential metabolite KEGG enrichment pathway
3 结论
A、B 和C 三个不同等级普洱熟茶的感官审评结果可得B 的品质在三个等级中最优;A 的原料等级最高,导致发酵程度较低,品质受影响。代谢物差异分析可得:三个试样经广泛靶向代谢组学技术鉴定,共检测到1 073 种物质,已确定1 048 种代谢物,采用VIP≥1、p<0.05 且Fold Change≥2 或≤0.5 作为最终差异物筛选的条件,结果筛选鉴定出A 相对于B、A 相对于C和B 相对于C 三个组间差异代谢物共238 个;共含有12 个标志性代谢物,其中鸟苷3',5'-环一磷酸、去氧苦地胆苦素、黄独素B、黄独素D、表没食子儿茶素没食子酸酯、没食子酸甲酯、3-没食子酰基奎宁酸、儿茶素、(-)-没食子酸儿茶素酯、表儿茶素没食子酸酯等这些标志性差异代谢物的相对定量与等级之间呈正相关,随等级的降低是显著减少的,而D-麦芽糖的相对定量却是与等级之间呈负相关,随等级的降低而显著增加;238个差异代谢物中共筛选出18个氨基酸及其衍生物、18 个生物碱、19 个黄酮及类黄酮和12 个儿茶素及其衍生物,这几类物质相对总量的变化趋势都随等级降低而减少;在所有物质的相对定量分析中除了氨基酸Levodopa(左旋多巴)、生物碱Tombozine(妥包嗪)和黄酮及类黄酮Isorhamnetin(异鼠李素)这三个物质是随着等级的降低而显著增加,其余大部分物质是随着等级的降低而显著减少;代谢产物主要分布在15 条代谢途径中,其中苯丙氨酸代谢是相关性较强的通路,包括L-苯丙氨酸、2-苯乙胺、2-苯乙酰胺和4-羟基肉桂酸等4 种代谢物质。总之,同种原料的不同等级普洱熟茶之间代谢物在组成上有所不同,并且随着茶叶等级的降低,各类代谢物所占的相对定量也存在着差异,说明机采机制晒青茶的不同分级处理对后续普洱茶代谢物形成具有重要影响。
