Box-Behnken设计-效应面法优化白屈菜红碱mPEG-PLGA纳米粒处方制备工艺及其药动学研究
2022-12-08刘万路
刘万路
Box-Behnken设计-效应面法优化白屈菜红碱mPEG-PLGA纳米粒处方制备工艺及其药动学研究
刘万路
威海海洋职业学院,山东 威海 264300
Box-Behnken设计-效应面法优化白屈菜红碱单甲氧基聚乙二醇-聚乳酸羟基乙酸共聚物(methoxy poly(ethylene glycol)-poly(lactic-co-glycolic acid,mPEG-PLGA)纳米粒[chelerythrine mPEG-PLGA nanoparticles,Che@mPEG-PLGA/NPs]处方,并对最佳处方进行体外评价及体内药动学研究。纳米沉淀法制备Che@mPEG-PLGA/NPs,以包封率、载药量和粒径为指标,采用单因素试验结合Box-Behnken设计-效应面法筛选Che@mPEG-PLGA/NPs的最佳处方。将Che@mPEG-PLGA/NPs混悬液进一步制备成冻干粉,并考察冻干粉的稳定性和体外释药行为。SD大鼠分为Che原料药组、物理混合物组和Che@mPEG-PLGA/NPs组,分别按20 mg/kg剂量ig后采血,HPLC法测定血药浓度,计算主要药动学参数及相对生物利用度。Che@mPEG-PLGA/NPs最佳处方为mPEG-PLGA用量572 mg、水相与有机相的体积比为2.3∶1、泊洛沙姆188用量为1.2%。Che@mPEG-PLGA/NPs的包封率为(83.49±1.59)%,载药量为(4.61±0.14)%,粒径为(163.93±8.02)nm。Che@mPEG-PLGA/NPs在不同pH值释药介质中的体外释药具有明显的缓释特征。药动学结果显示,Che@mPEG-PLGA/NPs的达峰时间(max)延后至(2.12±0.46)h,半衰期(1/2)延长至(5.66±0.93)h,达峰浓度(max)增加至4.49倍,相对口服吸收生物利用度提高至4.66倍。Che@mPEG-PLGA/NPs可显著提高Che的口服吸收生物利用度,值得进一步研究。
白屈菜红碱;mPEG-PLGA;纳米粒;Box-Behnken设计-效应面法;缓释;药动学;口服生物利用度;纳米沉淀法
白屈菜红碱(chelerythrine,Che)属于异喹啉类苯并菲啶型生物碱,主要存在于白屈菜、博落回等中药植物根茎中[1],具有抗肿瘤、镇痛、改善肝功能、消炎、抑菌等活性[1-3],且毒性极低[1]。另据研究结果显示[4],Che可以通过调节SARS-CoV-2感染的关键信号通路,来防止过度炎症性免疫反应,且本身独特的抗病毒机制,使其非常有潜力成为治疗新型冠状病毒的候选药物之一,开发价值较高。经测定,Che在25 ℃下水中溶解度为(91.28±0.31)µg/mL,半衰期为(2.49±0.49)h[5],存在一定的首关效应[6],导致口服吸收生物利用度较低(仅为13.29%)[7],临床应用受到较大限制。目前,Che制剂新技术研究有固体分散体[5]、脂质体[6]、固体脂质纳米粒[8]等报道。
将难溶性药物制备成纳米粒,可提高生物利用度及药效等,因而在药物制剂新技术研究中占据重要的地位。与脂质纳米粒相比,聚合物纳米粒具有更高的包封率及结构稳定性,且可通过结构修饰赋予纳米粒更多功能,因而具有更高的生物利用度及药效[9],颇受医药研究者的重视。甲氧基聚乙二醇-聚乳酸-羟基乙酸共聚物[methoxy poly(ethylene glycol)-poly(lactic-co-glycolic acid),mPEG-PLGA]是一种两亲性嵌段共聚物,具有良好的生物相容性,作为一种优良的药物载体被广泛用于医药研发领域。已有国内外文献报道将其应用于制备mPEG-PLGA纳米粒[10-11],可供口服或注射给药,有效解决了难溶性药物溶解度和溶出度低的问题,提高生物利用度及疗效等。本研究采用Box-Behnken设计-响应面法对白屈菜红碱-甲氧基聚乙二醇-聚乳酸-羟基乙酸纳米粒(chelerythrine mPEG-PLGA nanoparticles,Che@mPEG-PLGA/NPs)进行处方研究[12],比较体外释药行为和口服药动学行为,期望为Che纳米制剂研究提供新策略。
1 仪器与材料
1260型高效液相色谱仪,DAD检测器,美国Agilent公司;BSA224S型电子天平,赛多利斯仪器公司;KH-501型超声仪,昆山禾创超声仪器有限公司;08-2G型恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;RC-6D型溶出仪,天津创兴电子设备制造股份有限公司;超滤离心管,截留相对分子质量为8000,美国Millipore公司;Talos F200S G2型透射电子显微镜(TEM),赛默飞仪器公司;Empyrean型X射线衍射仪,马尔文帕纳科公司;透析袋,截留相对分子质量为8000~10 000,美国Viskae公司;Master-sizer型粒度分析仪,英国马尔文仪器公司;FD-1D-80型真空冻干机,江苏天翔仪器有限公司。
Che对照品,批号110807-201009,质量分数98.9%,中国食品药品检定研究院;Che原料药,批号191125,质量分数98.0%,南京邦诺生物科技有限公司;盐酸小檗碱对照品,批号20201028,质量分数98.2%,成都德思特生物技术有限公司;mPEG-PLGA,相对分子质量2000~18 000,广州市碳水科技有限公司;海藻糖,批号190210,南京松冠生物科技有限公司;泊洛沙姆188,批号WPEE587E,德国巴斯夫有限公司;甘露醇,批号20191105,上海康朗生物科技有限公司;聚山梨酯-80,批号20191105,湖南尔康制药有限公司;其他试剂均为分析纯。
SD大鼠,雌雄兼用,购自吉林大学动物实验中心,许可证号:SCXK(吉)2016-007,购时周龄为6周,体质量为(200±20)g,实验室继续饲养1周至体质量为(240±20)g,药动学实验前禁食12 h。所有动物实验遵循威海海洋职业学院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 Che@mPEG-PLGA/NPs的制备[11]
取60 mg的Che和处方量的mPEG-PLGA溶于15 mL丙酮,超声溶解,得有机相。配制一定浓度含有乳化剂的水溶液作为水相,在磁力搅拌速率为850 r/min条件下将有机相逐滴滴加至水相中,滴毕后继续磁力搅拌15 min。将混悬液置于45 ℃水浴中减压旋蒸25 min,以除尽有机溶剂,在一定功率下超声一定时间,过0.45 μm水相微孔滤膜,补加蒸馏水至初始水相体积,即得Che@mPEG-PLGA/ NPs混悬液。空白mPEG-PLGA/NPs同法制备(不加Che)。
2.2 Che@mPEG-PLGA/NPs含量测定
2.2.1 色谱条件 色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 µm);流动相为1%三乙胺水溶液(稀磷酸调pH至3.2)-甲醇(70∶30);柱温为30 ℃;体积流量为1.0 mL/min;检测波长为264 nm;进样体积为10 µL。理论塔板数以Che峰计不低于6500。
2.2.2 对照品储备液的配制 精密称取Che对照品10 mg,置于25 mL量瓶中,甲醇溶解稀释至刻度,即得400 μg/mL Che对照品储备液。
2.2.3 供试品溶液的配制 取Che@mPEG-PLGA/NPs混悬液1 mL至100 mL量瓶中,加入丙酮30 mL超声6 min,放置30 min,甲醇稀释至刻度线。精密量取2 mL置于10 mL量瓶中,流动相稀释至刻度线,取适量过0.45 μm微孔滤膜,即得供试品溶液。
2.2.4 空白对照溶液 取空白mPEG-PLGA/NPs,按“2.2.3”项下方法制备,即得空白对照溶液。
2.2.5 专属性考察 分别取空白对照溶液、Che对照品溶液和Che@mPEG-PLGA/NPs供试品溶液进样,结果见图1。可知辅料不干扰Che含量测定,专属性高。
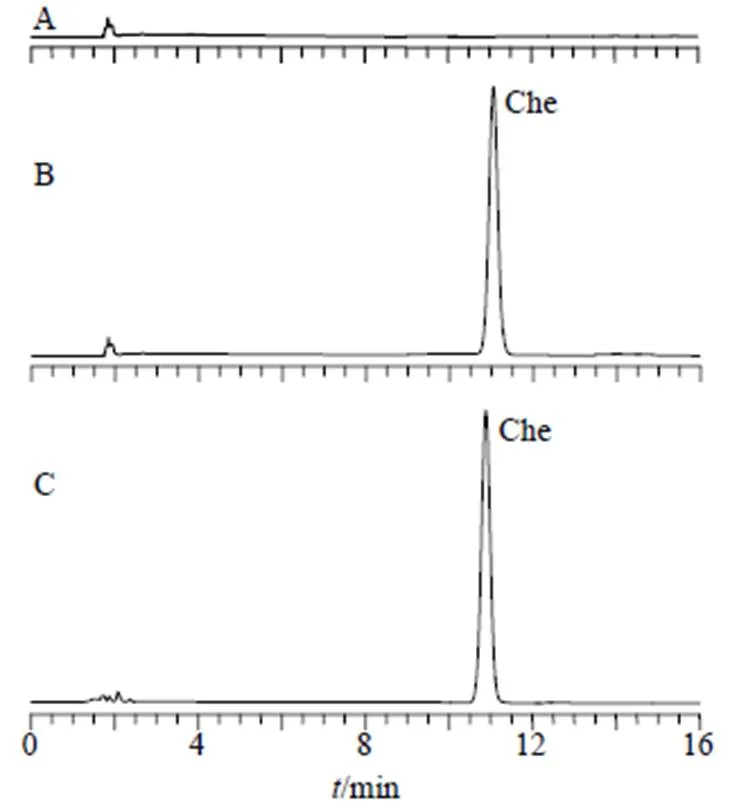
图1 空白对照溶液(A)、Che对照品溶液(B)和Che@mPEG-PLGA/NPs供试品溶液(C)的HPLC图
2.2.6 线性关系考察 取“2.2.2”项对照品储备液,采用流动相分别配制成质量浓度为10、5、1、0.5、0.1、0.05 μg/mL的系列对照品溶液,按照“2.2.1”项色谱条件进样测定,记录Che的峰面积。以Che质量浓度为横坐标(),Che各质量浓度对应的峰面积为纵坐标(),进行线性回归,得回归方程为=21.049 6-0.715 8,=0.999 6,结果表明Che线性范围为0.05~10 μg/mL。
2.2.7 精密度考察 取质量浓度分别为10、1、0.05 μg/mL的Che对照品溶液,各质量浓度连续进样6次,计算得Che峰面积RSD值分别为0.31%、0.26%、0.58%,结果表明仪器精密度良好。
2.2.8 稳定性考察 取Che@mPEG-PLGA/NPs供试品溶液,于制备后0、2、4、6、8、12 h进样测定,计算得Che峰面积的RSD为1.04%,表明供试品溶液稳定性良好。
2.2.9 重复性考察 取Che@mPEG-PLGA/NPs混悬液,平行制备6份供试品溶液,进样测定,计算得Che质量浓度的RSD为1.71%,表明该实验重复性良好。
2.2.10 加样回收率考察 取9份0.5 mL的Che@ mPEG-PLGA/NPs混悬液,分为低、中、高3组,每组均3份,分别加入400 μg/mL的对照品储备液1、2、3 mL。按照“2.2.3”项下方法制备供试品溶液,进样测定,并计算Che质量浓度及其加样回收率。结果显示,Che平均加样回收率为99.26%,RSD为1.70%,结果表明该实验加样回收率较高。
2.3 包封率、载药量、粒径及ζ电位的测定
2.3.1 游离药物回收率的测定[13]采用1.2%泊洛沙姆188配制Che质量浓度为0.15 mg/mL,作为游离药物溶液。取9份0.5 mL的Che@mPEG-PLGA/NPs混悬液,分为低、中、高3组,每组3份,分别加入游离药物溶液0.25、0.50、0.75 mL,于低温(4 ℃)条件下10 000 r/min离心(离心半径4 cm)30 min,取外管超滤液进HPLC测定游离Che质量浓度,计算Che的回收率。结果显示低、中、高3组的平均加样回收率为101.73%,RSD为1.48%,因此方法回收率良好。
2.3.2 包封率和载药量的测定 取Che@mPEG-PLGA/NPs混悬液1 mL至超滤管中,于低温(4 ℃)条件下10 000 r/min离心(离心半径4 cm)30 min,取外管中的续滤液进行HPLC测定游离Che质量浓度,计算含量(游离)。按“2.2.2”项下方法处理,进HPLC测定Che总质量浓度,并计算总量(总)。精密量取5 mL纳米粒混悬液置于干燥恒定质量的称量瓶中,预冻后冷冻干燥,称定质量(0),计算包封率和载药量。
包封率=(总-游离)/总
载药量=(总-游离)/0
2.3.3 粒径及ζ电位的测定 取Che@mPEG-PLGA/ NPs混悬液0.1 mL置于离心管中,加入4 mL蒸馏水摇匀。取适量,于粒度分析仪上测定粒径、多分散性指数(polydispersity index,PDI)及ζ电位。
2.4 Che@mPEG-PLGA/NPs处方单因素考察
2.4.1 mPEG-PLGA型号的选择 Che为60 mg,mPEG-PLGA用量为500 mg,泊洛沙姆188用量为0.8%,水相与有机相体积比为2∶1,超声功率为300 W,超声时间为10 min的条件下,分别考察不同mPEG-PLGA型号对包封率等考察指标的影响,结果见表1。包封率和载药量均随着PLGA相对分子质量的增加而增加,可能是由于PLGA相对分子质量越大,载体的亲水性降低,遇到水相形成的纳米粒愈牢固、稳定,故后续均选择mPEG-PLGA(2000~18 000)来制备Che@mPEG-PLGA/NPs。
表1 mPEG-PLGA型号的影响(,n = 3)
2.4.2 mPEG-PLGA用量的考察 固定Che为60 mg,泊洛沙姆188用量为0.8%,水相与有机相体积比为2∶1,超声功率为300 W,超声时间为10 min条件下,分别考察不同mPEG-PLGA用量对包封率等考察指标的影响,结果见表2。随着mPEG-PLGA用量的增加,包封率先增加后减小,可能是由于体系中mPEG-PLGA用量增加可有效包载药物,但用量过多时mPEG-PLGA之间可能会发生聚集,反而不利于包载药物[10],导致包封率及载药量下降,且粒径也有增大趋势,因此有必要进一步优化其用量。
2.4.3 水相与有机相体积比的考察 Che用量为60 mg,泊洛沙姆188用量为0.8%,mPEG-PLGA用量为500 mg,超声功率300 W,超声时间为10 min条件下,分别考察不同水相与有机相体积比对包封率等考察指标的影响,结果见表3。水相较少时体系黏度较大,不利于mPEG-PLGA包裹药物形成纳米粒。随着水相的增加,纳米粒包封率先增加后减小,可能是由于随着水相的增加,处方中表面活性剂的用量也随之增加,进而在表面活性剂的作用下使药物进入水相中,导致包封率及载药量出现下降。但水相的增加有利于形成较小粒径的Che@mPEG-PLGA/NPs。水相与有机相体积比为2∶1时纳米粒各项指标相对较好,但有必要进一步优化。
表2 mPEG-PLGA用量的影响(,n = 3)
表3 水相与有机相体积比的影响(,n = 3)
2.4.4 表面活性剂种类的考察 Che用量为60 mg,表面活性剂用量均为0.8%,mPEG-PLGA用量为500 mg,水相与有机相体积比为2∶1,超声功率300 W,超声时间为10 min条件下,分别考察不同表面活性剂种类对对包封率等考察指标的影响,结果见表4。聚山梨酯-80或聚乙烯醇作为表面活性剂时各项指标均较泊洛沙姆188差,聚乙烯醇具有一定的毒性[10],故选择泊洛沙姆188作为制备Che@ mPEG-PLGA/NPs的表面活性剂。
2.4.5 泊洛沙姆188用量的影响 Che用量为60 mg,mPEG-PLGA用量为500 mg,水相与有机相体积比为2∶1,超声功率300 W,超声时间为10 min条件下,分别考察不同泊洛沙姆188用量对纳米粒包封率等考察指标的影响,结果见表5。未加泊洛沙姆188时包封率、载药量均较低,粒径较大。随着泊洛沙姆188用量的增加,包封率及载药量均增加后减小,可能是由于泊洛沙姆188用量越大,体系的黏度越大,药物与水相反应变慢,影响了载体对药物的包裹,也增加了制剂中辅料用量,使载药量下降。另外,表面活性剂的增溶作用使药物进入水相,最终影响了包封率及载药量。当泊洛沙姆188用量较低时油水之间的界面张力较大,导致粒径较大,随着用量的增加,油水界面张力下降,有利于形成粒径较小的纳米粒,但浓度过高时体系的黏度也随之上升,反而导致粒径有所变大。因此需要对泊洛沙姆188用量进行优化。
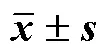
表4 表面活性剂种类的影响(,n = 3)
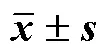
表5 表面活性剂泊洛沙姆188用量的影响(,n = 3)
2.4.6 超声功率的影响 超声的主要目的是为了降低mPEG-PLGA纳米粒粒径[13],而且适当的超声有利于mPEG-PLGA材料包载药物,但过大的超声功率或过长的超声时间会对材料造成破坏[14],从而影响包封率及载药量,因此有必要进行考察。Che用量为60 mg,mPEG-PLGA用量为500 mg,水相与有机相体积比为2∶1,泊洛沙姆188用量为1.0%,超声时间为10 min条件下,分别考察超声功率对包封率等考察指标的影响,结果见表6。当超声功率达到400 W时,纳米粒的包封率和载药量均下降,超声功率达到500 W时粒径明显开始变大,可能是较高的超声功率对纳米粒有破坏作用所致。由于功率为300 W时纳米粒各项指标相对理想,故确定超声功率为300 W。
2.4.7 超声时间的影响 Che用量为60 mg,mPEG-PLGA用量为500 mg,水相与有机相体积比为2∶1,泊洛沙姆188用量为1%,超声功率为300 W条件下,分别考察不同超声时间对包封率等考察指标的影响,结果见表7。合适的超声时间有利于mPEG-PLGA包裹药物,但超声时间过长反而对纳米粒有破坏作用,超声增溶作用也使药物进入水相,最终影响包封率及载药量等。较长的超声时间也会使纳米粒重新融合、聚集,导致粒径变大。综合考虑纳米粒的各项指标,最终确定超声时间为12 min。
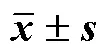
表6 超声功率的影响(,n = 3)
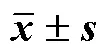
表7 超声时间的影响(,n = 3)
2.5 Box-Behnken响应面法优化处方
2.5.1 试验设计 单因素试验结果显示,mPEG-PLGA用量、水相与有机相体积比和泊洛沙姆188用量对Che@mPEG-PLGA/NPs各项指标影响较大,分别作为自变量1、2、3。对纳米制剂来讲,包封率和载药量是重要参数,故作为考察指标;纳米粒粒径大小可能影响制剂的生物利用度[15],因而也选为考察指标,Box-Behnken设计-响应面法试验设计见表8。为更直观地评价,将包封率、载药量和粒径转化为总评归一值(overall desirability,OD),计算过程:①包封率(1)和载药量(2)计算公式为1或2=(M-min)/(max-min);粒径(3)计算公式为3=(max-i)/(max-min)。②OD=(12…d)1/k,为指标数。结果见表8,其中各试验组的包封率RSD均在0.57%~1.94%,载药量RSD在0.13%~1.84%,粒径RSD在0.48%~1.92%。
2.5.2 模型的拟合、效应面优化与预测 对数据拟合后得OD的2次多元回归方程为OD=0.82+0.151+0.122+0.133-0.1112+0.2813+0.1323-0.1312-0.2322-0.2732,方差分析结果见表9,该模型的=0.019 0<0.05,说明该模型具有显著性意义。另外,2=0.932 9,adj2=0.900 8,失拟项=0.215 1>0.05,证明该数学模型干扰小,可信度较高。因此,可采用此模型对Che@mPEG-PLGA/NPs的处方进行研究。1、3、13、22和32均具统计学意义(<0.05、0.01)。
三维曲面图见图2,Che@mPEG-PLGA/NPs最佳处方为mPEG-PLGA用量572.41 mg、水相与有机相的体积比为2.28∶1、泊洛沙姆188用量为1.17%。预测的包封率、载药量和粒径分别为83.67%、4.69%和160.94 nm。
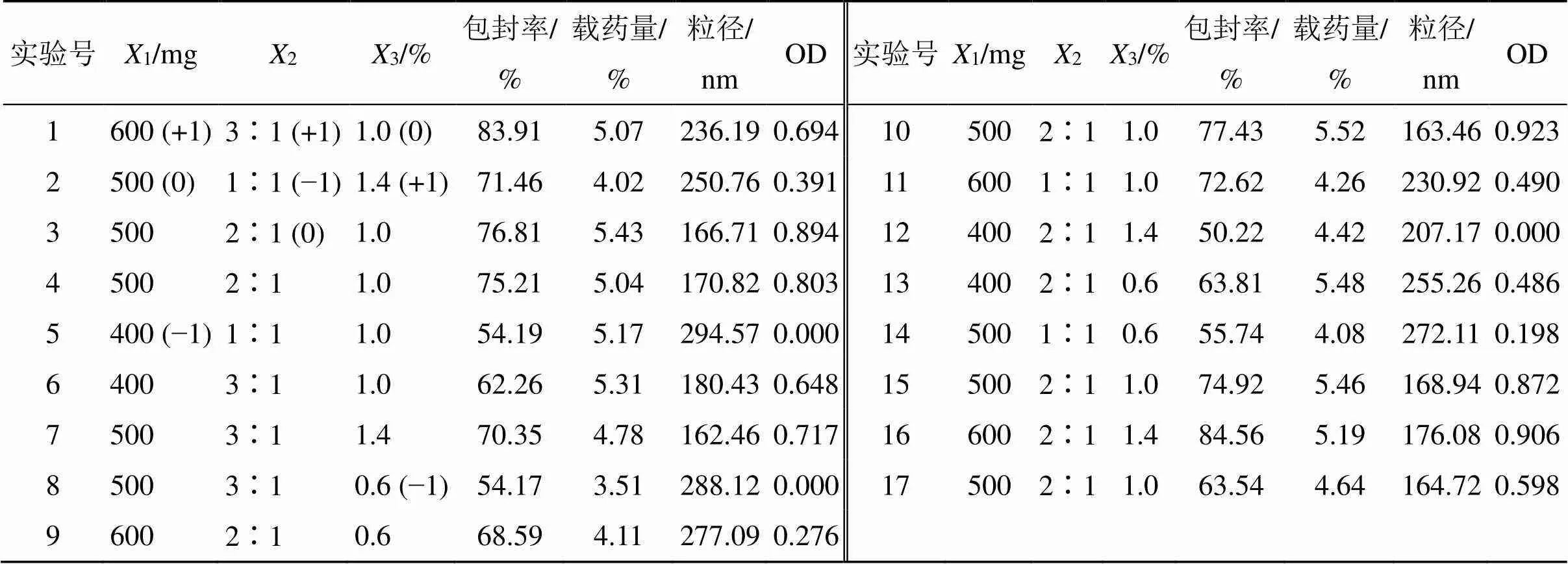
表8 Box-Behnken试验设计结果(n = 3)
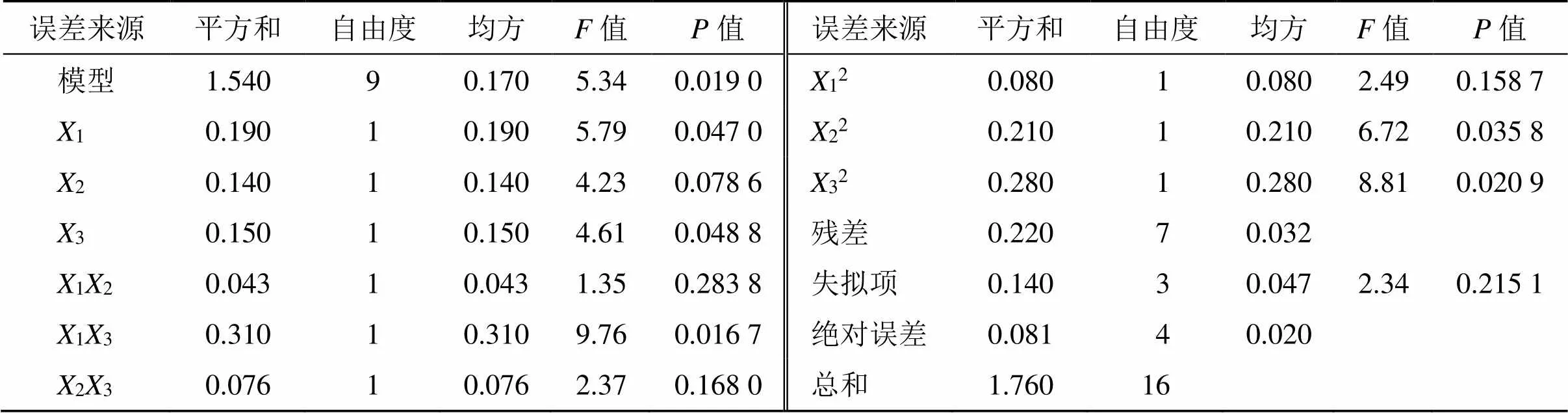
表9 方差分析
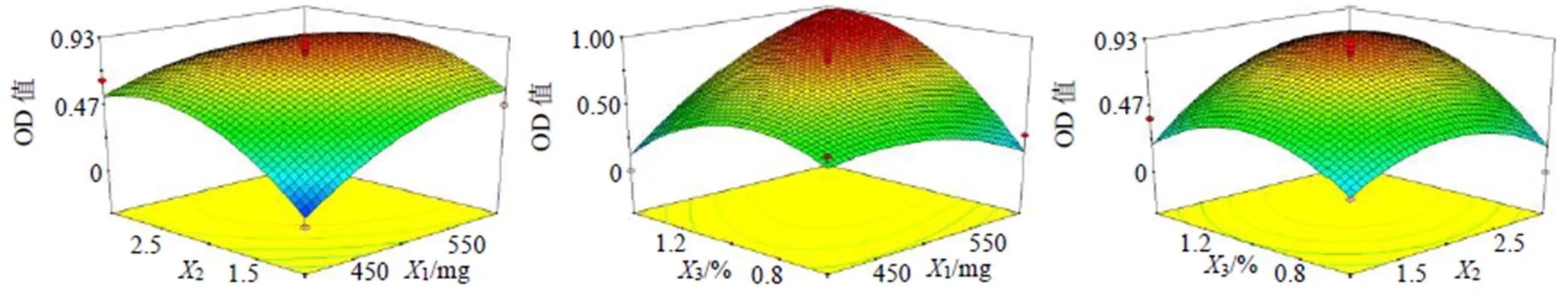
图2 各自变量与响应值的三维图
2.6 最佳处方工艺的确定及微观形态观察
考虑到实际可操作性,调整mPEG-PLGA用量为572 mg、水相与有机相的体积比为2.3∶1、泊洛沙姆188用量为1.2%。平行制备3批Che@mPEG-PLGA/NPs,分别测定包封率、载药量和粒径,计算偏差[偏差=(预测值-实际值)/预测值],结果见表10。Che@mPEG-PLGA/NPs包封率、载药量和粒径相对偏差均小于±5%,证明采用Box-Behnken响应面法优化Che@mPEG-PLGA/NPs处方具有预测性较好,可靠性高的特点。粒径分布图见图3,粒径分布范围在60~400 nm,PDI为0.093±0.014;ζ电位为(−23.91±1.84)mV,见图4。
表10 预测值和实际值的比较(,n = 3)
取Che@mPEG-PLGA/NPs混悬液,蒸馏水稀释50倍,滴加于带支持膜的铜网上,铺展后静置6 min,滴加2%磷钨酸染色,晾干,于TEM下观察Che@mPEG-PLGA/NPs形态,拍照,结果见图5。外貌呈球形或类球形,纳米粒子之间无黏连。TEM观察到粒径与粒度分析仪测得的粒径存在一定的差别,这可能由于粒度分析仪测得的是水化粒子的粒径,而TEM观察的是干燥粒子的粒径[16]。
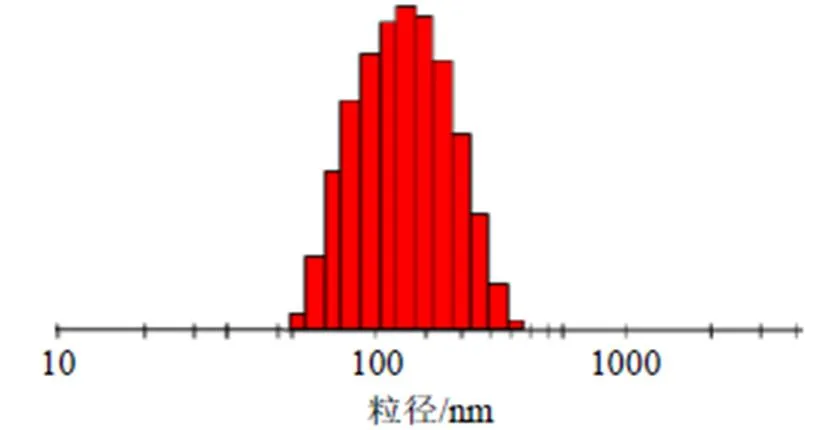
图3 Che@mPEG-PLGA/NPs的粒径分布
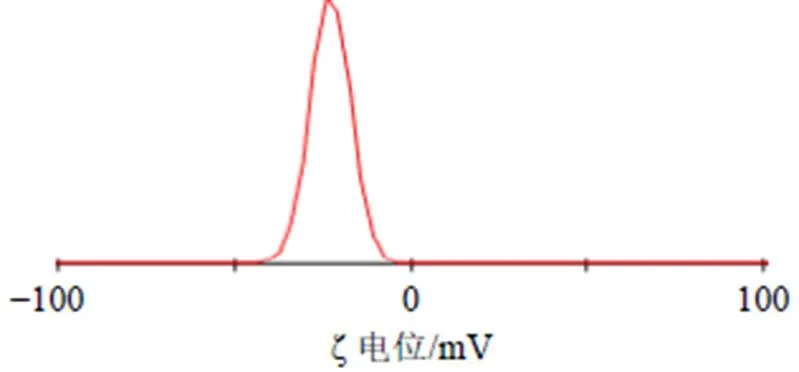
图4 Che@mPEG-PLGA/NPs的ζ电位
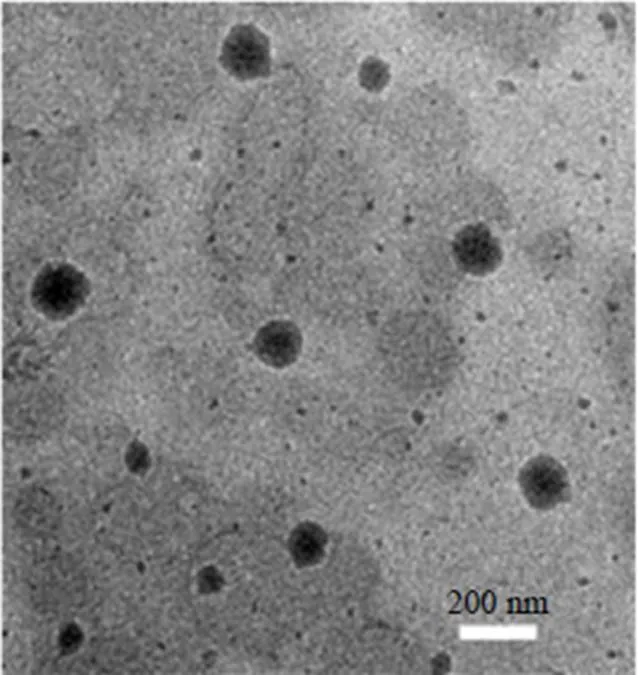
图5 Che@mPEG-PLGA/NPsTEM图
2.7 冻干粉的制备
取Che@mPEG-PLGA/NPs混悬液加入6%的冻干保护剂(海藻糖-甘露醇1∶1),摇匀至溶解澄清,置于温度为−30 ℃的超低温冰箱中预冻2 d。迅速置于初始温度为−30 ℃冷冻干燥机中,抽真空,进行低温冻干1 d,然后缓慢回复常压,取出冻干粉,立即密封,置于干燥器中保存。所得冻干粉外观饱满,色泽均一。冻干前后外观见图6。
取适量冻干粉蒸馏水复溶,测得包封率略下降至(82.64±1.41)%,粒径增长至(172.64±9.13)nm,ζ电位为(−22.86±1.72)mV。

图6 Che@mPEG-PLGA/NPs(A)及冻干粉外观(B)
2.8 体外释药行为研究及模型拟合
取Che@mPEG-PLGA/NPs冻干粉,使Che含量均为30 mg,加入空白释药介质5 mL,制备混悬液并置于透析袋中,两端扎紧。释放介质为900 mL的pH 6.8缓冲盐水溶液,介质温度(37±1)℃,转速为75 r/min,分别于0、0.25、0.5、1、1.5、2、2.5、3、4、6、8、12、24、36 h取样3 mL,并补加3 mL空白释放介质。各样品经0.45 μm微孔滤膜滤过,按照“2.2.1”项色谱条件,进样测定Che质量浓度。同法考察Che@mPEG-PLGA/NPs冻干粉在pH 1.2盐酸水溶液和pH 7.4缓冲盐水溶液的释药情况,结果见图7。Che@mPEG-PLGA/NPs在3种不同pH值介质中均呈现两相特征,0~4 h时间段释药相对较快,而在4~36 h呈现缓释特征。Che@ mPEG-PLGA/NPs冻干粉在pH 1.2盐酸水溶液、pH 6.8缓冲盐水溶液和pH 7.4缓冲盐水溶液中36 h的累积释放率分别为75.25%、70.09%、68.93%。Che@ mPEG-PLGA/NPs在pH 1.2盐酸水溶液中的释药速率快于pH 6.8缓冲盐水溶液和pH 7.4缓冲盐水溶液[10]。分别采用零级、一级、Higuchi和Weibull模型对Che@mPEG-PLGA/NPs在3种不同pH值介质体外释药进行拟合,并采用拟合相关系数(2)作为判断依据。结果发现在3种不同pH值介质体外释药过程均与Weibull模型拟合度最高。其中在pH 1.2盐酸水溶液中Weibull拟合方程为lnln[1/(1-M/¥)]=0.384 2 ln-1.014 3,2=0.975 2,在pH 6.8磷酸水溶液中Weibull拟合方程为lnln[1/(1-M/¥)]=0.398 4 ln-1.206 1,2=0.988 6,在pH 7.4磷酸水溶液中Weibull拟合方程为lnln[1/(1-M/¥)]=0.429 0 ln-1.347 4,2=0.991 2。代表时间,M为时间累积释放度,¥为¥时间累积释放度,M/¥为时间累积释放率。
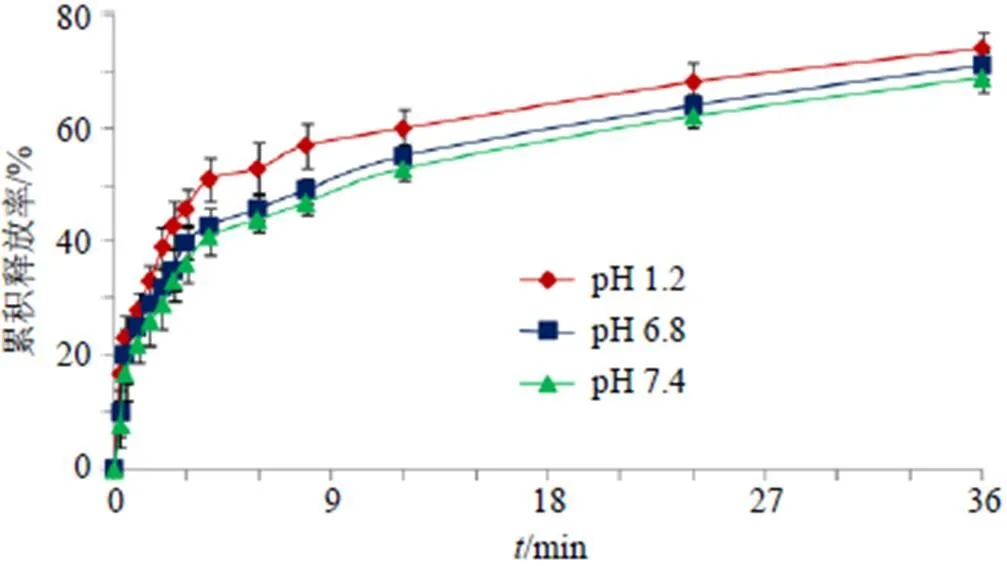
图7 Che@mPEG-PLGA/NPs体外释放曲线(,n = 6)
2.9 晶型研究
X射线粉末衍射法(X-ray powder diffraction,XRPD)对Che@mPEG-PLGA/NPs冻干粉作晶型分析,取Che原料药、空白辅料、物理混合物(Che和辅料比例与Che@mPEG-PLGA/NPs冻干粉一致)和Che@mPEG-PLGA/NPs冻干粉适量进行扫描。条件为Cu-Kα靶,扫描角度(2)为3°~45°,速度为5°/min,见图8。Che原料药在7.8°、9.6°、10.0°、14.6°、16.1°、25.8°、26.7°等处出现明显的晶型峰。由于辅料的掩蔽作用,Che在物理混合物中仅可观察到在7.8°、9.6°、16.1°、25.8°、26.7°的晶型峰,说明Che在物理混合物中仍是晶型物质。但Che@mPEG-PLGA/NPs冻干粉的XRPD图谱中,未见Che原料药的任何晶型峰,说明Che在冻干粉转变为无定型物质。
2.10 冻干粉稳定性考察 前期考察发现,未冻干的Che@mPEG-PLGA/NPs混悬液在第10天即可观察到沉淀,说明未冻干时稳定性较差,故将其制备成冻干粉来改善稳定性。取制备的Che@mPEG- PLGA/NPs冻干粉,密封,置于恒温恒湿箱中(温度30 ℃,湿度55%),分别于0、10、20、30、40、60、90 d取样,测定包封率、粒径和ζ电位,结果见表11。结果显示,Che@mPEG-PLGA/NPs冻干粉各个指标波动较小,稳定性得到明显改善。
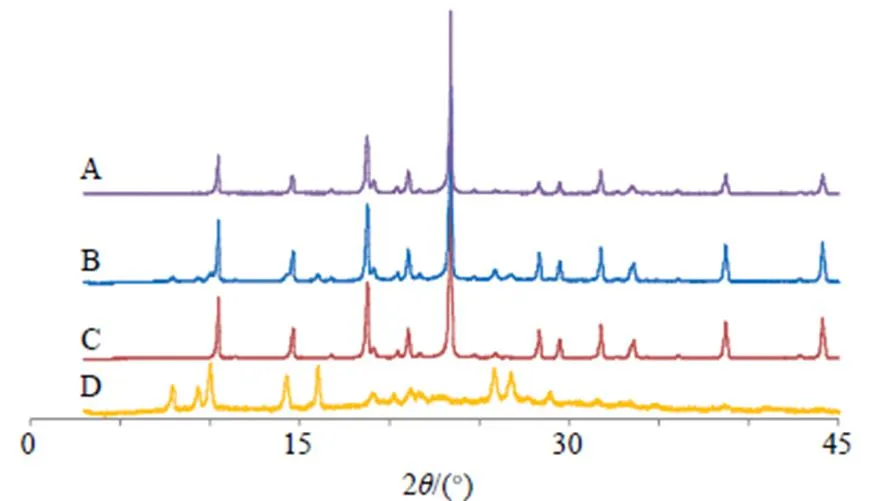
图8 Che@mPEG-PLGA/NPs冻干粉(A)、物理混合物(B)、空白辅料(C)和Che原料药(D)的XRPD结果
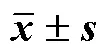
表11 稳定性试验结果(,n = 3)
2.11 口服药动学研究
2.11.1 实验方案 取Che、物理混合物(Che和辅料比例同Che@mPEG-PLGA/NPs)和Che@mPEG-PLGA/NPs冻干粉适量,加入0.5%的CMC-Na水溶液配制灌胃液,临用现配。取禁食12 h的健康SD大鼠18只,抛币法随机分成3组,每组6只,对每只大鼠进行称定质量,ig剂量均为20 mg/kg,计时,于0.167、0.5、1、1.5、2、3、4、6、8、10、12 h,Che@mPEG-PLGA/NPs取血点延长至18 h,各点均取血约0.2 mL,引流至肝素化EP管中,4000 r/min离心3 min,取血浆于−20 ℃保存。
2.11.2 血浆样品的制备[6]取解冻后的血浆样品100 μL至5 mL的EP管中,加入20 μL盐酸小檗碱内标溶液(质量浓度为1200 ng/mL)和甲醇0.5 mL(沉淀蛋白),涡旋混匀得混悬液,继续加入2 mL氯仿进行提取,涡旋2 min。10 000 r/min离心5 min(温度为−4 ℃,离心半径4 cm),取上清液于40 ℃水浴中氮气吹干后得残渣,加入甲醇100 μL复溶,继续10 000 r/min离心5 min(温度为−4 ℃),即得血浆样品溶液。
2.11.3 血浆对照品的配制及标准曲线 取盐酸小檗碱对照品,甲醇配制成1200 ng/mL作为药动学研究用内标溶液。取Che对照品,用甲醇配成2500、2000、1000、500、100、50 ng/mL,各质量浓度分别量取100 μL于40 ℃水浴中氮气吹干后得残渣,加入100 μL空白血浆,涡旋混匀,后续按“2.11.2”项方法处理后进HPLC。以Che与内标峰面积比为纵坐标(),Che质量浓度为横坐标(),得血浆对照品回归方程为=0.033 8-0.379 2,相关系数()=0.996 2,线性范围为50~2500 ng/mL。
2.11.4 方法学验证 取空白血浆、血浆对照品溶液和血浆样品,进样测定,考察该色谱条件的专一性,结果见图9。可见,血浆内源性物质未对内标及Che色谱峰产生干扰,专属性高。
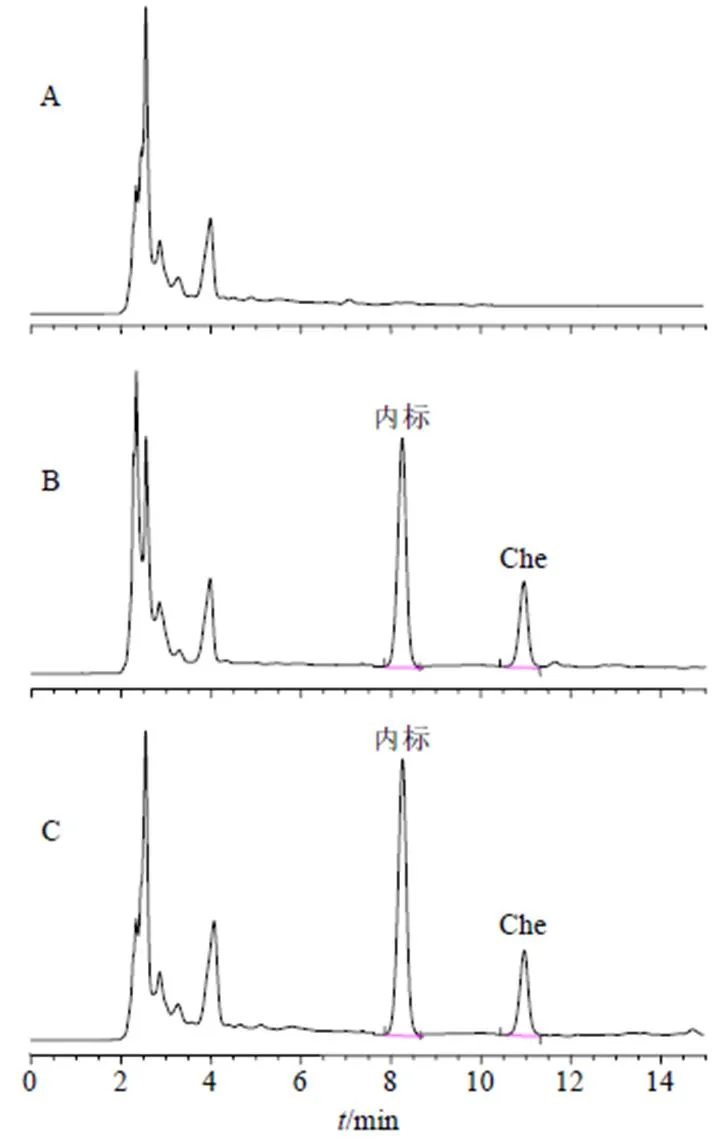
图9 空白血浆(A)、血浆对照品溶液(B)、血浆样品(C)的HPLC图
取Che质量浓度为50(低)、1000(中)、2500 ng/mL(高)的血浆对照品溶液,各质量浓度连续进样6次,计算得Che和内标峰面积比值RSD分别为7.05%、4.11%、6.30%,因此日内精密度良好。
低、中、高质量浓度每天进样1次,连续测定6 d,测定Che和内标峰面积,计算得两者比值的RSD分别为8.04%、4.79%、6.28%,因此日间精密度良好。
取血浆样品分别于0、2、4、8、12、24 h进样,测定Che和盐酸小檗碱的峰面积,计算得两者比值的RSD为9.27%,因此血浆样品稳定性良好。
取50(低)、1000(中)、2500 ng/mL(高)Che的对照品溶液各100 μL,共3组,于40 ℃水浴中氮气吹干后得残渣,加入空白血浆100 μL,涡旋混匀,按“2.11.2”项方法操作,进样,测定Che和内标峰面积,两者比值带入方程=0.033 8-0.379 2计算测得Che质量浓度,与实际质量浓度比较得出回收率。结果显示,平均回收率为94.07%(=9),RSD为6.91%,说明回收率较高。
取质量浓度为50 ng/mL血浆对照品溶液(不含内标)逐步稀释后进样测定,以信噪比为10作为定量限,信噪比为3作为检测限,结果显示Che的定量限和检测限分别为5.0、2.5 ng/mL。
2.11.5 药动学结果 采用3P97软件对各组数据进行处理,采用非参数法秩和对达峰时间(max)及半衰期(1/2)检验,峰浓度(max)和曲线下面积(AUC)经对数转换后进行独立样本检验。Che、物理混合物和Che@mPEG-PLGA/NPs药动学曲线见图10,主要药动学参数见表12。
Che和辅料的物理混合物主要药动学参数与Che原料药相比无统计学意义(>0.05),说明辅料在一定程度上影响了Che的口服吸收,但影响并不显著。Che@mPEG-PLGA/NPs的max延后至(2.12±0.46)h,1/2延长至(5.66±0.93)h,max增加至4.49倍,均具有极显著性差异(<0.01),相对口服吸收生物利用度提高至4.66倍(与Che相比)。可见,处方中的辅料具有一定的促吸收作用(>0.05),但Che@mPEG-PLGA/NPs对Che药动学行为影响更大,促吸收作用显著。
3 讨论
本研究采用mPEG-PLGA作为纳米载体,保留了PLGA载体的相容性好、安全性高等优势[17-18],经mPEG修饰后弥补了PLGA疏水性强的缺陷。杨锦等[2]采用mPEG-PLGA(2000~15 000)制备了mPEG-PLGA纳米粒,其包封率(80.18±1.11)%低于采用mPEG-PLGA(2000~18 000)制得的纳米粒,且表面活性剂用量(1.8%)较大,可能存在一定的安全隐患,可见mPEG-PLGA型号的选择较为重要,可能会影响处方中其他辅料的用量。mPEG-PLGA纳米粒的粒径一般较PLGA纳米粒低,可能是由于mPEG修饰后增加了聚合物载体的亲水性,在形成纳米粒时与水相之间的表面张力下降所致[17]。但mPEG-PLGA纳米粒的ζ电位绝对值往往不高,可能是由于纳米粒表面的mPEG接枝具有屏蔽作用所致[11],故本研究将其制备成冻干粉来增加Che@ mPEG-PLGA/NPs的稳定性。
图10 药-时曲线(,n = 6)
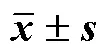
表12 药动学参数(,n = 6)
与Che比较:**<0.01;与物理混合物比较:##<0.01
**< 0.01Che bulk drug;##< 0.01physical mixture
在一定范围内的mPEG-PLGA载体用量及水相与有机相体积比会影响体系黏度,进而对包封率产生影响,分析原因可能是由于体系黏度较高时不利于mPEG-PLGA材料在溶剂中充分舒展[19],从而影响载体mPEG-PLGA和Che的聚合几率及速度。较大的水相体积导致包封率较低,可能是由于水相体积较大时增加了表面活性剂用量,在其增溶作用下促使Che进入水相[13],从而影响了包封率。但较大的水相比例制得的纳米粒粒径较小,可能是由于水相体积较大时可降低体系黏度,纳米粒更易分散,减少融合或聚合几率,从而有助于降低粒径。结合单因素考察结果,选择mPEG-PLGA用量优化区间为400~600 mg,水相与有机相体积比优化区间为1∶1~3∶1。泊洛沙姆188用量也会影响Che@ mPEG-PLGA/NPs的各项指标,可能是由于当其浓度较低时乳化能力有限,影响制剂的粒径;浓度过大时不仅影响制剂的安全性,也会因增溶作用最终对包封率及载药量造成影响,故也选为主要因素之一,结合单因素考察结果选择优化区间为0.6%~1.4%。
Che@mPEG-PLGA/NPs体外释药过程分为2个阶段,即快速释药期和缓慢释药期。纳米制剂中的游离药物与纳米药物存在交换平衡,如将游离药物除去不仅可能会打破两者之间的平衡,进而影响制剂的稳定性,也可能破坏mPEG-PLGA纳米粒的结构,故未将游离药物除去。由于未除去的游离药物快速释放,另一方面分散于纳米粒浅表层药物释放相对容易,因而产生了快速释药期。包裹于mPEG-PLGA纳米粒内部药物释放出去需经历载体材料的溶蚀后才能缓慢扩散出去,释药相对困难,故出现了缓慢释药期,这种释药方式很可能会改变Che原料药的药动学行为[9,19-20]。
药动学结果显示,Che@mPEG-PLGA/NPs的max发生极显著性延后,可能与Che@mPEG-PLGA/NPs本身具有缓释特征有关[21];其1/2延长至(5.66±0.93)h,极显著性增加了药物的消除半衰期,增加了体内循环时间,从而利于增加生物利用度及提高药效;max增加至4.49倍,可能是由于mPEG增加了纳米粒子的亲水性,减弱了黏液中黏蛋白对药物的静电吸引[22-23],利于Che@mPEG-PLGA/NPs能够透过黏液层达到上皮细胞,进而进入体循环。Che在胃肠道中容易被代谢[7],制备成Che@mPEG-PLGA/NPs后降低了胃肠道对Che的破坏几率,提高了药物的稳定性;Che@mPEG-PLGA/NPs粒径较小,更易于通过派伊尔氏结,实现高效吸收[10, 24],最终使max及相对口服吸收生物利用度得到明显提高。本研究完成了Che@mPEG-PLGA/NPs处方工艺研究,重复性良好。冻干粉在90 d内稳定性较好,体外释药具有明显的缓释特征。Che以无定形状态存在于Che@mPEG-PLGA/NPs冻干粉中,且口服吸收生物利用度得到显著提高。今后继续对Che@mPEG-PLGA/NPs的注射药动学、组织分布、药效学等展开研究[25-26],进一步丰富研究资料,为Che新型纳米制剂研发提供借鉴。
志谢 本研究由山东省职业教育栾会妮名师工作室资助(2019)
利益冲突 所有作者均声明不存在利益冲突
[1] 王培卿, 尹震花, 康文艺. 白屈菜红碱药理活性研究进展 [J]. 中国中药杂志, 2013, 38(17): 2745-2749.
[2] 杨锦, 韩伟, 张永萍, 等. 白屈菜红碱纳米粒的制备及体外抗黑色素瘤活性评价 [J]. 中国药房, 2021, 32(24): 2980-2986.
[3] 李磊, 杨学亮, 张云, 等. 白屈菜红碱对腺样囊性癌细胞生长的抑制作用及机制研究 [J]. 药物评价研究, 2021, 44(7): 1361-1367.
[4] Valipour M, Zarghi A, Ebrahimzadeh M A,. Therapeutic potential of chelerythrine as a multi-purpose adjuvant for the treatment of COVID-19 [J]., 2021, 20(22): 2321-2336.
[5] Li W F, Qing S, Zhi W B,. The pharmacokinetics and anti-inflammatory effects of chelerythrine solid dispersions[J]., 2017, 40: 51-58.
[6] Li W F, Xing W, Niu X F,. The pharmacokinetics of chelerythrine solution and chelerythrine liposomes after oral administration to rats [J]., 2013, 79(8): 654-660.
[7] Zhao N J, Wang L L, Liu Z Y,. Pharmacokinetics of chelerythrine and its metabolite after oral and intramuscular administrations in pigs [J]., 2021, 51(11): 1264-1270.
[8] 赵义军, 叶晓楠, 林春盛, 等. 白屈菜红碱固体脂质纳米粒的制备及其体外释放研究 [J]. 中南药学, 2021, 19(11): 2348-2353.
[9] 赵广阔, 苏为科, 帅棋. 新型多功能可生物降解PEG-PLA/PLGA/PCL聚合物纳米抗肿瘤药物载体的研究进展 [J]. 中国现代应用药学, 2020, 37(18): 2291-2298.
[10] Li D, Ding J X, Tang Z H,.evaluation of anticancer nanomedicines based on doxorubicin and amphiphilic Y-shaped copolymers [J]., 2012, 7: 2687-2697.
[11] Wang Q, Wei N, Liu X F,. Enhancement of the bioavailability of a novel anticancer compound (acetyltanshinone IIA) by encapsulation within mPEG-PLGA nanoparticles: A study of formulation optimization, toxicity, and pharmacokinetics [J]., 2017, 8(7): 12013-12030.
[12] 魏永鸽, 黄贺梅, 齐园圃, 等. Box-Behnken设计-效应面法优化吴茱萸碱-羟基乙酸共聚物纳米粒处方及体外释药研究 [J]. 中国医院药学杂志, 2021, 41(23): 2416-2422.
[13] 隋小宇, 李娟, 翟伟宇, 等. 超滤法测定甘草次酸脂质体包封率 [J]. 中成药, 2018, 40(2): 478-480.
[14] 张海荣, 刘琴, 艾照全. 超声波在聚合物合成中的研究 [J]. 胶体与聚合物, 2007, 25(4): 41-42, 44.
[15] 杭凌宇, 申宝德, 沈成英, 等. 不同粒径波棱甲素纳米混悬剂的制备及药动学研究 [J]. 中草药, 2021, 52(7): 1898-1905.
[16] 邓向涛, 张文周, 张智强. 钩藤碱纳米混悬剂缓释片制备、优化与体外释放评价 [J]. 中草药, 2020, 51(20): 5128-5136.
[17] 益慧慧. mPEG-PLGA-芒果苷纳米粒的制备及药代动力学研究 [D]. 西安: 西北大学, 2018.
[18] 陈洋洋, 李梦媛, 李雪莹, 等. 染料木素MePEG-PLGA共聚物胶束体内外抗肿瘤作用 [J]. 中国现代应用药学, 2020, 37(12): 1442-1447.
[19] 陈泳霖, 张文君, 张国锋, 等. 尼莫地平PEG-PLGA纳米粒的制备及其处方优化 [J]. 中国医院药学杂志, 2021, 41(19): 1979-1986.
[20] 赵广阔, 苏为科, 帅棋. 新型多功能可生物降解PEG-PLA/PLGA/PCL聚合物纳米抗肿瘤药物载体的研究进展 [J]. 中国现代应用药学, 2020, 37(18): 2291-2298.
[21] 管庆霞, 夏昭睿, 王艳宏, 等. 包载马钱子碱聚乳酸-羟基乙酸共聚物纳米粒处方工艺优化及其特性研究 [J]. 中草药, 2021, 52(4): 951-961.
[22] 侯文书, 张丹参, 张力, 等. PEG修饰姜黄素固体脂质纳米粒的制备、表征及溶出特征 [J]. 中草药, 2019, 50(8): 1927-1934.
[23] 李金明, 林东海, 田景振. 呋喃二烯mPEG-PLGA纳米粒的制备及大鼠口服生物利用度 [J]. 中国新药杂志, 2015, 24(14): 1670-1674.
[24] Liu X J, Li L, Liu X J,. Mithramycin-loaded mPEG-PLGA nanoparticles exert potent antitumor efficacy against pancreatic carcinoma [J]., 2017, 12: 5255-5269.
[25] Cheraga N, Sun N C, Huang X X,. Optimized rapamycin-loaded PEGylated PLGA nanoparticles: Preparation, characterization and pharmacokinetics study [J]., 2021, 61: 102144.
[26] 赵炎军, 王建平, 吴凡, 等. 黄芩苷PEG-PLGA纳米胶束的制备、表征及在急性心肌缺血模型大鼠体内的组织分布 [J]. 中草药, 2018, 49(18): 4269-4276.
[27] 马舒伟, 刘兴艳, 辛杨, 等. 银杏内酯K的PLGA-PEG纳米粒制备、表征和神经保护活性评价[J]. 中草药, 2019, 50(7): 1562-1568.
Formulation optimization of chelerythrine-mPEG-PLGA by Box-Behnken design-response surface method and oral pharmacokinetics study
LIU Wan-lu
Weihai Ocean Vocational College, Weihai 264300, China
Box-Behnken design-response surface method was employed to optimize the formulation of chelerythrine methoxy poly(ethylene glycol)-poly(lactic-co-glycolic acid (mPEG-PLGA) nanoparticles (Che@mPEG-PLGA/NPs), and carry outevaluation and oral pharmacokinetics study of optimal prescriptions.Nano-precipitation method was employed to prepare Che@mPEG-PLGA/NPs. Encapsulation rate, drug loading and particle size were used as evaluation indexes, single factor investigation method combined with Box-Behnken response surface design method was combined to investigate the optimal prescriptions of Che@mPEG-PLGA/NPs, and then its lyophilized powder was prepared. Stability and release behaviorof lyophilized powder was investigated. SD rats were divided into Che suspension, physical mixture and Che@mPEG-PLGA/NPs groups, blood samples were collected after gastric administration at a dose of 20 mg/kg. The plasma concentrations were determined by HPLC, main pharmacokinetic parameters and relative bioavailability were calculated.The optimal formulation of Che@ mPEG-PLGA/NPs: mPEG-PLGA dosage was 572 mg, water phase to organic phase volume ratio was 2.3∶1 and concentration of poloxamer 188 was 1.2%. Envelopment efficiency, drug loading and particle size of Che@mPEG-PLGA/NPs were (83.49 ± 1.59)%, (4.61 ± 0.14)% and (163.93 ± 8.02) nm. Drug releasehad obvious sustained-release characteristics in different pH dissolution media. Pharmacokinetic results showed thatmaxof Che@mPEG-PLGA/NPs was delayed to (2.12 ± 0.46) h,1/2was prolonged to (5.66 ± 0.93) h,maxwas increased to 4.49 times and relative oral bioavailability was enhanced to 4.66 times.Che@mPEG-PLGA/NPs can significantly improve the oral bioavailability of Che, which was worthy of further study.
chelerythrine; mPEG-PLGA; nanoparticles; Box-Behnken design-response surface method; sustained release; pharmacokinetic; oral bioavailability; nano-precipitation method
R283.6
A
0253 - 2670(2022)23 - 7361 - 11
10.7501/j.issn.0253-2670.2022.23.006
2022-08-29
国家自然科学青年基金资助项目(51804021)
刘万路(1981—),男,硕士,讲师,研究方向为现代给药系统。Tel: (0631)7697687 E-mail: liuwanlu2010@126.com
[责任编辑 郑礼胜]
