艾叶及其腺毛显微鉴定研究
2022-12-08刘孟奇回成程陈随清王海波辛海量
刘孟奇,回成程,陈随清,郭 涛, 2*,王海波,辛海量
艾叶及其腺毛显微鉴定研究
刘孟奇1,回成程1,陈随清1,郭 涛1, 2*,王海波3,辛海量2, 4*
1. 河南中医药大学药学院,河南 郑州 450046 2. 仲景中医药产业研究院,河南 南阳 473001 3. 河南省食品药品检验所国家药品监督管理局中药材及饮片质量控制重点实验室,河南 郑州 450018 4. 海军军医大学药学院,上海 200433
为艾叶及腺毛的显微鉴定和品质评价提供可靠的实验数据。利用荧光显微镜和扫描电子显微镜对艾叶进行显微和组织化学研究。艾叶上、下表面均分布有腺毛和非腺毛。腺毛由2列细胞构成,其头部由4或6个细胞对叠而成,柄部和基部各由2个细胞构成;非腺毛均为T形,柄由2~5个细胞构成,按照顶细胞特点将T形非腺毛分为2种:一种顶细胞呈长梭形而弯曲(I型);另一种顶细胞呈细丝状,极长、扁平且扭曲(II型)。草酸钙簇晶直径3~40 μm,多存在于叶肉细胞中;上表面气孔稀少,下表面气孔多,气孔为不定式;上、下表皮细胞的垂周壁均为波状弯曲。常见螺纹导管,偶见环纹、梯纹、网纹和孔纹导管。组织化学研究显示,腺毛有挥发油、萜类、黄酮类等成分。为下一版《中国药典》艾叶显微鉴定相关内容的修订和完善提供了重要参考依据。
艾;显微鉴定;腺毛;非腺毛;组织化学
艾Lévi. et Vant.为菊科蒿属植物,中药艾叶为其干燥叶,具温经止血、散寒止痛、祛湿止痒之功效[1]。我国大部分地区都有分布,多地有栽培,资源丰富。艾叶具有特殊气味,上表面有稀疏柔毛和腺点,下表面密被灰白色蛛丝状绒毛。艾叶在我国民间有悠久的使用历史,其大多经晒干捣碎得“艾绒”,制成艾条供灸用。我国历代本草记载的艾叶原植物包括艾的野生种及同属多种近缘种[2],同属多种植物(代用品或易混品)在不同地区被用作艾叶或混于艾叶中。由于艾及同属多种植物叶形变化都非常大,仅从性状方面鉴定艾叶仍然存在一定困难。
艾叶含有挥发油、黄酮类、萜类和多糖等成分[3]。挥发油含量的高低被认为可反映艾叶品质的优劣[4-6],而腺毛是挥发油合成和贮存的场所[7-8],因此,挥发油的含量可能与腺毛密切相关。研究者对艾、臭蒿Ostenf. et Pauls.和黄花蒿L. 3种蒿属植物进行了研究,结果表明挥发油含量与其叶表面腺毛密度正相关[9]。杨珂等[10]报道艾叶表面腺毛大小、饱满程度等形态特点也与挥发油含量正相关;另外,也有文献报道非腺毛为高纯度艾绒的主要成分[11]。可见,对艾叶腺毛和非腺毛的显微特征进行深入研究,对于艾叶及艾绒的质量评价都有重要价值。
《中国药典》1977~2020年版中艾叶显微鉴定项内容未发生任何改变,其所载艾叶显微特征都包括腺毛、非腺毛和草酸钙簇晶3项,并指出非腺毛有2种:一种为T形毛,另一种为单列性非腺毛,由3~5细胞构成,顶端细胞特长而扭曲,常断落[12-19, 1]。尽管之前不乏有艾叶相关的显微研究[20-29];然而,由于艾叶下表面密被灰白色蛛丝状绒毛,给其显微观察带来了巨大挑战;同时,由于过去很长一段时间显微制片技术和观察手段不够全面,一定程度上也影响了艾叶显微研究的进展。值得指出的是,对于艾叶非腺毛研究,在大多文献报道中并未提及单列性非腺毛[25, 27-32],或虽提及单列性非腺毛而无可信的图片[26, 33]。此外,当前对于艾叶草酸钙晶体类型、导管类型、叶表皮细胞特点、气孔类型及其分布特点等显微特征仍缺少较为全面的研究。
进入21世纪以来,显微仪器和制片技术的不断进步,给中草药深入的显微鉴定创造了新的条件。本研究以艾叶为研究材料,在采用多种制片技术的基础上,结合光学显微和扫描电子显微技术对艾叶进行显微及组织化学研究,旨在为艾叶和艾绒的显微鉴定和质量评价提供可靠的参考资料。
1 仪器和材料
1.1 材料
2021年5月,分别于湖北蕲春县、河南南阳、河南汤阴县、浙江宁波和河南中医药大学中药植物园等地采集新鲜艾叶,共计100多个批次,经河南中医药大学药学院苏秀红教授鉴定均为蒿属植物艾Lévi. et Vant.的叶,其中来源于河南中医药大学中药植物园艾的原植物及不同发育时期的叶如图1所示。
1.2 仪器与试剂
Canon EOS R6xin型数码相机(日本佳能株式会社);Leica RM 2016型石蜡切片机(德国徕卡公司),Leica CM1860型冰冻切片机(德国徕卡公司),Olympus SZX16型荧光体视显微镜(日本奥林巴斯公司);Olympus BX53型正置荧光显微镜(日本奥林巴斯公司);Quorum K850型二氧化碳临界点干燥仪(英国Quorum公司);Quorum SC7620型离子溅射镀膜仪(英国Quorum公司);Zeiss EVO10钨灯丝扫描电子显微镜(德国蔡司公司)。

A-原植物 B-不同发育时期叶的上、下表面
盐酸、酒精、二甲苯、甲苯胺蓝O、水合氯醛、氢氧化钠、次氯酸钠、稀甘油、FAA(70%酒精∶冰乙酸∶甲醛=90∶5∶5)、石蜡、4-对亚硝基苯酚、浓硫酸、NADI(1%二甲基对苯二胺磷酸盐缓冲剂溶液+1%的α-萘酚酒精溶液1∶1等量混合),苏丹III、苏丹IV、二苯基硼酸-2-氨基乙酯(DPBA)购自美国Sigma公司。
2 方法
2.1 艾叶外观性状及显微观察
2.1.1 数码相机拍照 使用数码相机对艾原植物拍照,取发育程度不同的艾叶,对其上、下表面分别拍照。
2.1.2 体式显微镜观察 取新鲜艾叶,用刀片将其切成8~10 mm小块,制成水封片后,用荧光体视显微镜对上、下表面分别观察并拍照。
2.1.3 荧光显微镜观察 取新鲜艾叶,用清水漂洗后,切成8~10 mm小块,制成水封片后,用荧光显微镜对上、下表面分别观察并拍照。另取新鲜艾叶,用刀片轻刮下表面以除去非腺毛,然后用刀片将叶片切成8~10 mm小块,一部分材料制成水封片后,直接用荧光显微镜观察并拍照,一部分材料先用浓盐酸浸泡5~15 min,再制成水封片后,用荧光显微镜观察并拍照。
2.1.4 透明叶制片观察 取新鲜艾叶在95%酒精中浸泡过夜以除去叶绿素,再转入10%的氢氧化钠中,浸泡至其变褐色后,转入20%的次氯酸钠中漂白至无色,然后用水合氯醛溶液透明,用稀甘油封片后,再用荧光显微镜在明视野下对上、下表面分别观察并拍照。
2.1.5 石蜡切片观察 取新鲜艾叶,在中脉中段切取8~10 mm小块,用FAA固定24 h,采用梯度酒精(70%、80%、90%、100%)脱水,二甲苯透明,石蜡包埋,石蜡切片机切片,切片厚度10~15 μm,经0.5%的甲苯胺蓝O染色,用中性树胶封片后,用荧光显微镜观察并拍照。
2.1.6 冰冻切片观察 取新鲜艾叶,在叶柄端部取一段材料,然后在叶片中脉中段处切取8~10 mm小块,分别用冰冻切片机切片,用荧光显微镜观察并拍照。
2.1.7 扫描电子显微镜观察 选取不同发育时期的艾叶,切成小块,用FAA固定,采用梯度酒精(70%、85%、95%、100%)脱水,转入乙酸异戊酯,使用二氧化碳临界点干燥仪干燥后,用导电胶带将材料粘贴于样品台上,用离子溅射镀膜仪镀金后,用扫描电子显微镜观察叶表面特征并拍照。
计算腺毛的长度和宽度、非腺毛密度和气孔密度等数值,随机测20个数值,取其平均值。
2.2 组织化学分析
取新鲜艾叶,一部分材料用刀片切成8~10 mm小块,一部分材料用冰冻切片机切片,切片厚度30~50 μm;用不同的化学试剂染色:(1)检测单萜用4-对亚硝基苯酚[34];(2)检测倍半萜用浓硫酸[35-36];(3)检测萜类(挥发油)用NADI[37];(4)检测脂类用苏丹III[38]、苏丹IV[39];(5)检测黄酮类用香草醛-浓盐酸[40]、二苯基硼酸-2-氨基乙酯(DPBA)[41];染色后分别用荧光显微镜观察并拍照。
2.3 粉末显微观察
艾叶制成粉末,取少量艾叶粉末,经水合氯醛透化后,稀甘油封片,用荧光显微镜观察并采用蓝色或绿色滤光片以获取清晰图像并拍照,观察草酸钙晶体时在明视野或偏振光下观察拍照。
3 结果与分析
3.1 艾叶的外观性状及显微观察
艾为多年生草本或略成半灌木状(图1-A),幼嫩期艾叶上表面为黄绿色(图1-B,1的上表面),被白色绒毛,随着叶的发育,上表面颜色逐渐变深,成熟期为深绿色(图1-B,2-4的上表面);从幼嫩期到成熟期,艾叶下表面始终覆盖灰白色蛛丝状绒毛(图1-B,1-4的下表面)。
使用荧光体视显微镜观察成熟艾叶,在蓝光激发下可见上表面分布有黄色的腺点(即腺毛)和非腺毛(图2-A);在明视野下可见下表面密被灰白色蛛丝状绒毛(图2-B)。用荧光显微镜观察成熟艾叶,在蓝光激发下可见上表面有许多腺毛发出明亮的黄色或白色光;腺毛顶面观呈椭圆形,腺毛的密度约(40±5)个/mm2;同时可观察到上表面有许多 T形非腺毛发出黄绿色光,其柄较短,顶细胞长梭形而弯曲,两臂不等长,臂长多在300~500 μm(图2-C)。在蓝光激发下,下表面的腺毛和非腺毛也分别发出明亮的黄色(或白色)和黄绿色光,其中在叶脉处的T形非腺毛最为清晰,其柄较短,而顶细胞比上表面的长,臂长多在500~800 μm,这种顶细胞较长的T形非腺毛在叶脉间也有稀疏分布(图2-D)。上述上、下表面的这种T形非腺毛,其顶细胞都为长梭形弯曲,两臂不等长,本文将其称为I型T形非腺毛。
艾叶下表面叶脉间密集分布有蛛丝状的非腺毛,下表面的腺毛通常为其覆盖,因此用体视显微镜在明视野下观察难以被发现(图2-B),而在荧光显微镜蓝光激发下由于这些腺毛能发出明亮的黄色或白色光,因而可清晰观察到(图2-D),下表面的腺毛密度显著低于上表面(图2-C)。用荧光显微镜在紫外光激发下,可观察到上表面的T形非腺毛(I型)柄由2~5个细胞构成,柄或柄脱落后留下的脱落痕都均可发出明亮的蓝色光(图2-E)。上、下表面腺毛大小并无明显区别,长度都约为(56±4)μm,宽度约(45±3)μm,顶面观都呈椭圆形(图2-F)。
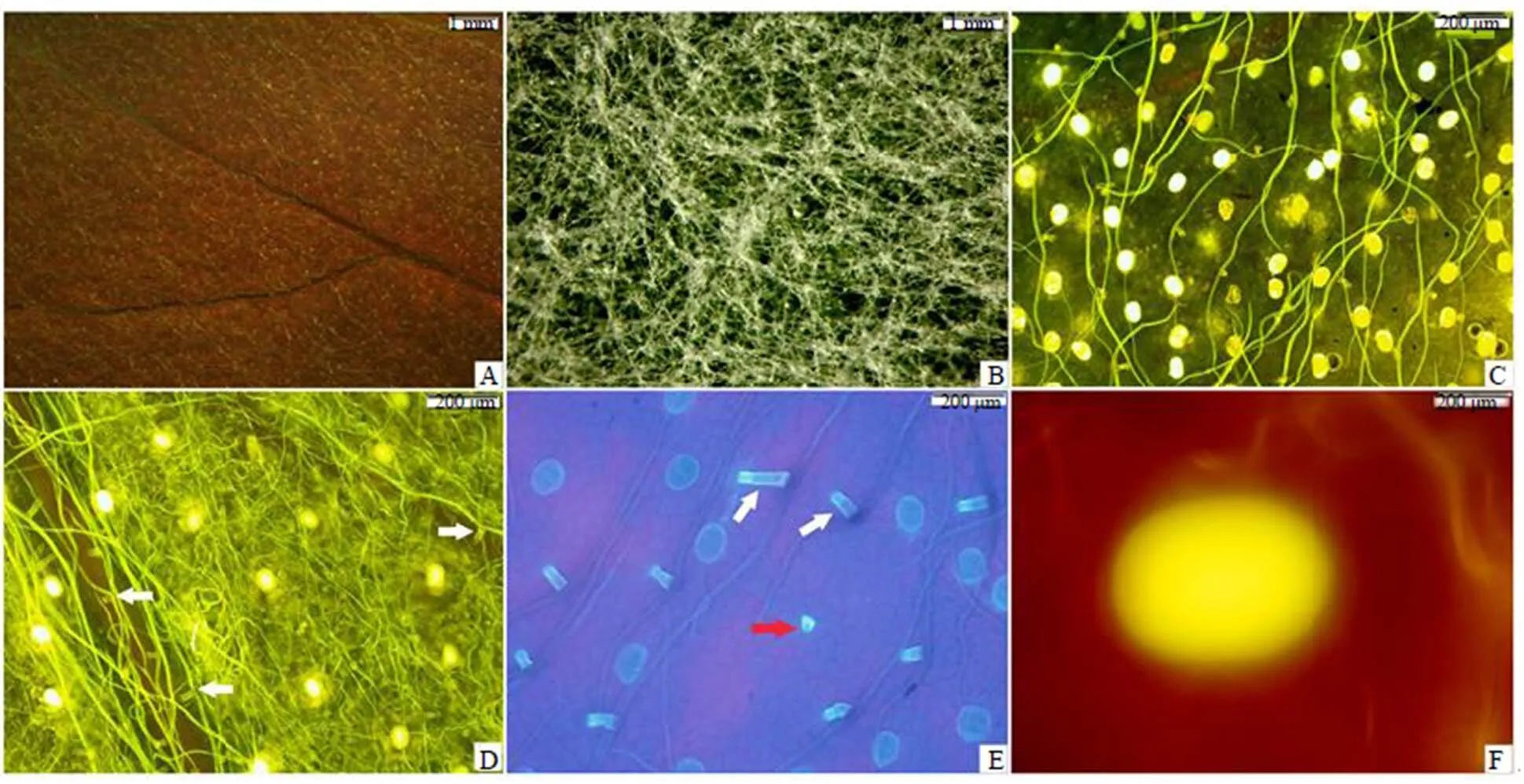
A, B-荧光体视显微镜下叶表面观察:A为上表面(蓝光激发),B为下表面(明视野) C, D-荧光显微镜下叶表面观察(蓝光激发):C为上表面 D为下表面(白箭头示I型T形非腺毛) E-上表面(白箭头示I型T形非腺毛的柄,红箭头示其柄脱落留下的脱落痕,椭圆形蓝斑为腺毛) F-腺毛(蓝光激发)
用荧光显微镜在20倍物镜下,用蓝光激发,可观察到艾叶下表面叶脉间的T形非腺毛发出黄色光,柄尤为显著,其顶细胞由此向两侧逐渐变细(图3-A);而在紫外光激发下,T形非腺毛发出蓝色光,柄最为显著,其顶细胞极为细长、扁平而扭曲,细胞壁薄,为另一种T形非腺毛(图3-B),本研究称其为II型T形非腺毛。用刀片刮去艾叶下表面的非腺毛,紫外光激发并在10倍物镜下观察,下表面的I型和II型T形非腺毛柄的脱落痕或残余柄都呈现为蓝色“斑点”,而腺毛呈现为椭圆形“黑斑”,因此可以清晰观察到腺毛和非腺毛的分布并方便计数,成熟艾叶下表面腺毛的密度约(21±3)个/mm2,T形非腺毛(含I型和II型)密度达到(146±10)个/mm2(图3-C),透明叶制片在紫外光激发下观察,发现柄一般由2~5个细胞构成(图3-D)。
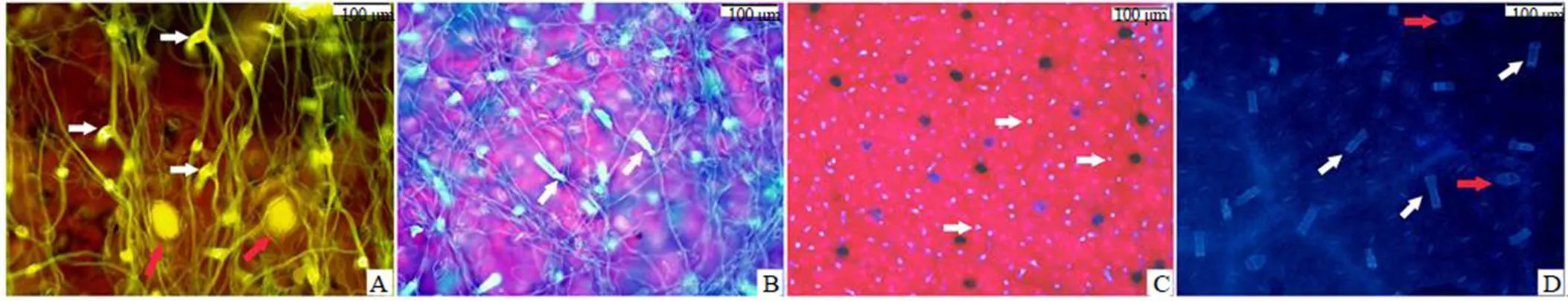
A-蓝光激发下观察到的II型T形非腺毛(白箭头示柄)和腺毛(红箭头) B-紫外光激发下观察到的II型T形非腺毛(白箭头示柄) C-下表面去除T形非腺毛后紫外光激发观察(白箭头示T形非腺毛柄的脱落痕或残余柄,黑斑处为腺毛) D-下表面紫外光激发下观察(红箭头示T形非腺毛的柄,白箭头示腺毛)
观察成熟艾叶横切面,可见上表面T形非腺毛(I型)柄由2~5个细胞构成,顶细胞长梭形而弯曲,两臂不等长;下表面 T形非腺毛(II型)顶细胞极为细长而扭曲,在横切制片中易被切断,因而难以观察到完整的顶细胞,其柄也多由2~5个细胞构成(图4-A)。艾叶上、表皮都由单层细胞构成,上表皮细胞明显比下表皮细胞厚,腺毛位于上、下表面的凹陷处;艾叶为异面叶,栅栏组织由一层细胞构成,海绵组织细胞排列疏松(图4-B),其中分布有大小不等的草酸钙簇晶(图4-C)。
艾叶在幼嫩期(图1-B的1),即可观察到其腺毛已由2列细胞构成,其中腺毛基部由2个较小的细胞构成,柄部(由2细胞构成)和头部(3层6细胞或2层4细胞构成)细胞的细胞质浓,染色重,此时腺毛体积较小,尚未产生分泌物(图4-D)。腺毛发育成熟时,头部的细胞(4或6个)被共同的角质层包围,分泌物储存在角质层和细胞壁之间的间隙(即角质层下间隙)中,成熟腺毛柄部较短,由两个较小细胞构成,基部由两个更小的细胞构成(图4-E)。艾叶上表面气孔稀少,分布不均匀,下表面气孔较多,气孔密度高达(300±25)个/mm2,气孔都呈椭圆形,为不定式,气孔周围有3~5个副卫细胞,气孔长轴长(26±4)μm,短轴长(20±2)μm,成熟艾叶上、下表面的表皮细胞形状均为无规则形,垂周壁式样均为波状弯曲(图4-F,G)。上、下表面T形非腺毛(含I型和II型)自柄完全脱落后均留下圆形的脱落痕,脱落痕一般位于表皮细胞的近中央位置,也有少数位于两个表皮细胞的交界处,脱落痕直径(10±1)μm(图4-H)。腺毛的顶面观呈椭圆形(图4-G),其基部呈近圆形,直径(15±2)μm,由2个细胞构成(图4-H、I)。
扫描电镜观察到艾叶在幼嫩期(图1-B的1)上表面密被I型T形非腺毛(图5-A),下表面叶脉密集,叶脉上密被I型T形非腺毛,叶脉间I型T形非腺毛也较多,覆盖其下方未发育成熟的II型T形非腺毛(图5-B)。叶片成熟时,上表面的I型T非腺毛随着叶片发育成熟而变得稀疏,腺毛顶面观为椭圆形(图5-C)。成熟艾叶下表面的叶脉间密被II型T形非腺毛,I型T形非腺毛则变得稀疏,但是仍位于II型T形非腺毛上方,由于II型T形非腺毛非常密集,顶细胞极长又相互交错盘结,覆盖了绝大多数腺毛,只在少数地方可以观察到露出的腺毛(图5-D)。
在艾叶的幼嫩期(图1-B的1),可以观察到腺毛已形成头部的各层细胞(图6-A)。随着叶的生长,腺毛体积有所增大,最顶端两细胞界限明显,中间有明显缢缩(图6-B),后来腺毛明显膨大,开始具分泌作用,分泌物贮存在角质层下间隙中,位于顶部两细胞界限处角质层上有时可见小裂孔,但未见分泌物溢出(图6-C),当腺毛完全发育成熟时,在角质层下间隙中充满分泌物,腺毛体积达到最大,顶面观呈现椭圆形(图6-D),角质层破裂后可以看到腺毛最顶端的两个细胞(图6-E)。

A-横切观察(黑箭头和红箭头分别示I型和II型T形非腺毛) B-横切制片高倍物镜下观察 C-横切制片观察到叶肉细胞中的草酸钙簇晶(白箭头) D-未具分泌功能的腺毛(白箭头示基部) E-成熟具分泌功能的腺毛(白箭头和红箭头分别示基部和柄部) F-上表面的气孔和表皮细胞(白箭头示I型T形非腺毛的柄) G-下表面的气孔(白箭头和红箭头分别示腺毛和T形非腺毛的脱落痕) H-上表面(白箭头和红箭头分别示腺毛的基部和T形非腺毛的脱落痕) I-上表面腺毛的基部放大观察(白箭头)
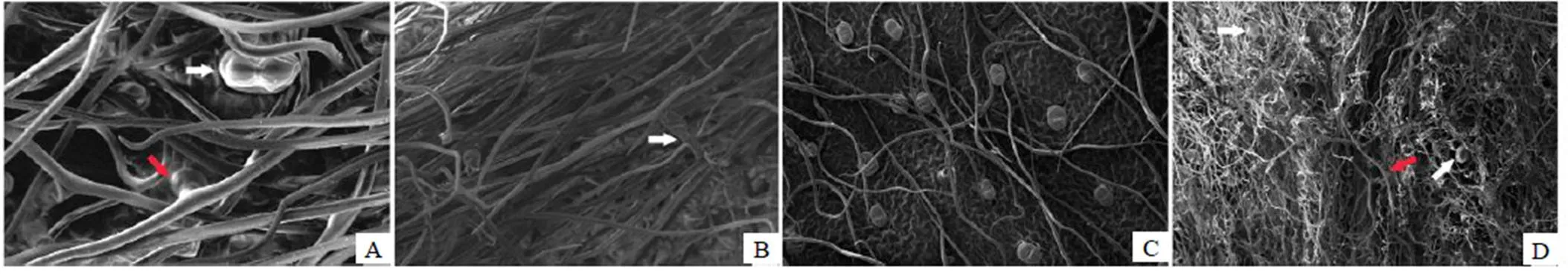
A-幼嫩叶上表面(白箭示头腺毛,红箭头示I型T形非腺毛) B-幼嫩叶下表面(白箭头示I型T形非腺毛) C-成熟叶上表面 D-成熟叶下表面(白箭头腺毛,红箭头示I型T形非腺毛)

A-幼嫩叶上表面的腺毛(白箭头) B-未具分泌功能的腺毛(白箭头示T形非腺毛的柄) C-具有分泌功能的腺毛(白箭头示裂孔) D-充满分泌物的成熟腺毛(白箭头示裂孔) E-角质层破裂后的腺毛(白箭头示顶部两细胞间的界限) F-上表面的I型T形非腺毛 G-下表面(白箭头示II型T形非腺毛的柄,红箭头示腺毛) H-下表面上的II型T形非腺毛(白箭头示柄) I-下表面上T形非腺毛的脱落痕(白箭头) J-下表面上的气孔(白箭头)
艾叶样品前期处理良好时,可以观察到I型T形非腺毛的柄和顶细胞都形态饱满、表面光滑(图6-F)。下表面的II型T形非腺毛顶细胞细长、扁平且扭曲、两臂向两侧延伸并逐渐变细(图6-G),柄由2~5个细胞构成,少数柄的下端细胞膨大(图6-H),艾叶的两种T形非腺毛的柄脱落后在表皮细胞上都会留下圆形的脱落痕(图6-I)。艾叶上表面气孔稀少,下表面气孔密集,这些气孔的2个保卫细胞都略高出表面,外拱盖光滑,气孔周围有3~5个表皮细胞,为不定式气孔(图6-J)。
叶柄横切制片可观察到5~7个大小不等的外韧维管束,中间的最大;韧皮纤维和木纤维被甲苯胺蓝O染成深蓝色(图7-A)。叶柄上分布I型T形非腺毛和少量的腺毛,I型T形非腺毛顶细胞长度较短,臂长小于300 μm。叶柄表皮由一层细胞构成,表皮细胞下有一些厚角组织细胞(图7-B),而叶的中脉只有一个外韧维管束(图7-C)。叶柄中的一些薄壁细胞中分布有草酸钙簇晶,最大可达40 μm,还有少量的草酸钙方晶(图7-D),在中脉横切片中也发现有较大的草酸钙簇晶,偏振光下观察非常显著(图7-E)。对叶柄和中脉纵切制片观察发现韧皮纤维的细胞壁较厚,有明显的单纹孔(图7-F),叶柄和中脉中有梯纹(图7-G)、网纹(图7-H)、孔纹和螺纹导管(图7-I)。
3.2 组织化学分析
组织化学研究显示:4-对亚硝基苯酚处理艾叶后,腺毛显示棕红色(图8-A),表明存在单萜类物质;浓硫酸染色处理后,腺毛显示黄色(图8-B),表明存在倍半萜类物质;NADI处理腺毛后,显示蓝色(图8-C),表明有萜类物质存在;苏丹IV处理后,腺毛显示红色(图8-D),表明有脂类物质存在;香草醛-浓盐酸处理后,腺毛显示红色(图8-E),经过DPBA处理后蓝光激发后腺毛发出黄色荧光(图8-F),表明有黄酮类物质存在。
3.3 粉末显微观察
艾叶粉末颜色为绿褐色。腺毛顶面观为椭圆形,可见头部最顶端细胞的2细胞相对而生(图9-A),腺毛侧面观也呈椭圆形,由4或6细胞(更常见)相对叠合而成,腺毛柄部常脱落(图9-B)。非腺毛均为T形,柄由2~5细胞构成,常部分或全部脱落,顶细胞有两种类型:一种顶细胞长梭形弯曲,细胞腔狭小,表面较光滑,两臂不等长(I型T形非腺毛,图9-C);另一种顶细胞两臂呈细丝状极长、扁平且扭曲(II型T形非腺毛),柄易脱落,常见长而扁平、扭曲的顶细胞部分(图9-D)。成熟艾叶上、下表皮细胞垂周壁均为波状弯曲(图9-E,F)。上表面气孔稀少,下表面气孔多,气孔类型为不定式(图9-F)。螺纹导管最为常见(图9-G),偶见环纹、梯纹、网纹和孔纹导管。常见草酸钙簇晶,直径在3~40 μm(图9-H),偶见方晶(图9-I)。
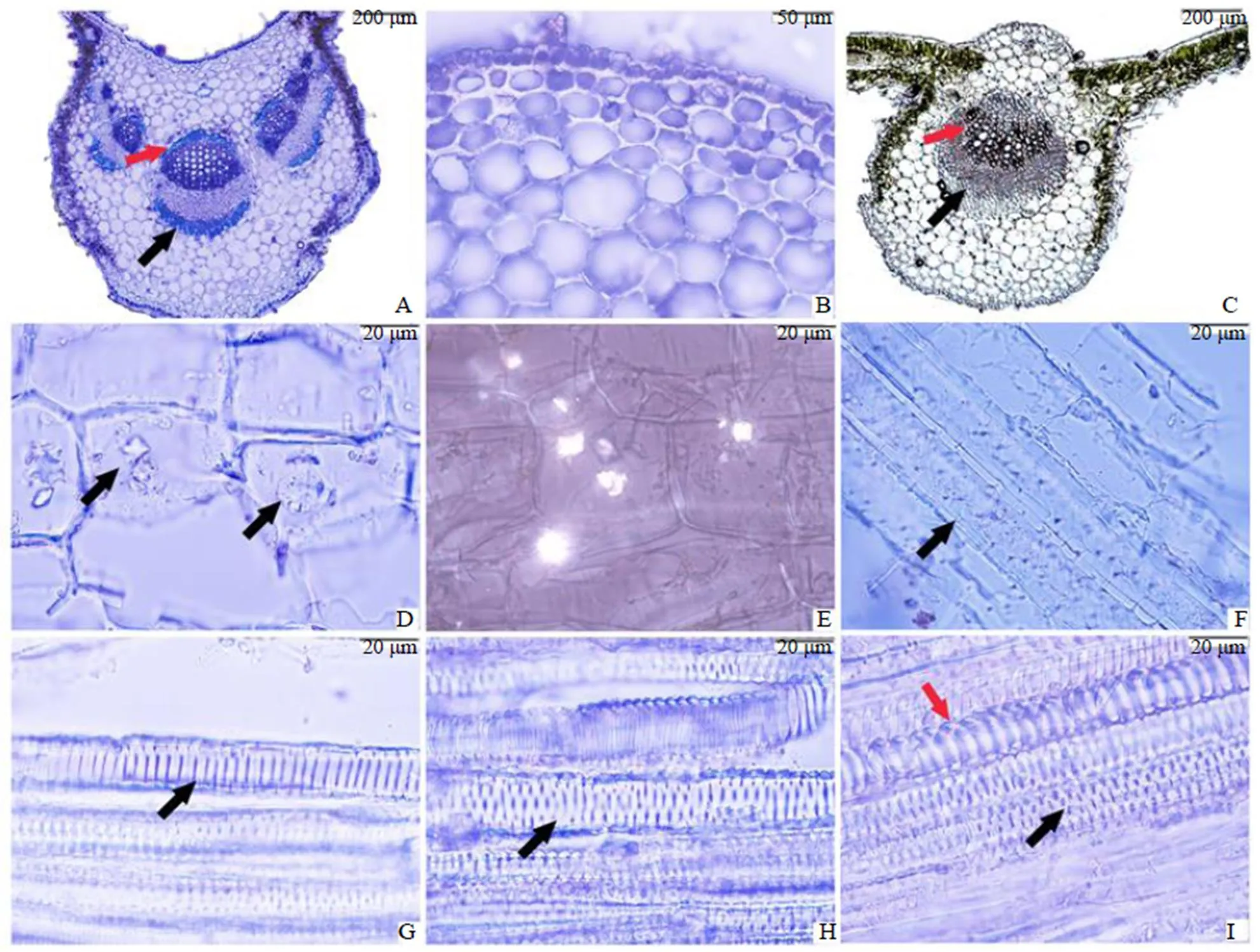
A-叶柄的横切(黑箭头示韧皮纤维,红箭头示木纤维) B-叶柄中的厚角组织 C-中脉横切(黑箭头示韧皮部,红箭头示木质部) D-叶柄薄壁细胞中的草酸钙方晶(黑箭头) E-中脉薄壁细胞中的草酸钙簇晶(偏振光下) F-叶柄中的韧皮纤维(黑箭头) G-叶柄中的梯纹导管(黑箭头) H-叶柄中的网纹导管(黑箭头) I-中脉中的螺纹导管(红箭头)和孔纹导管(黑箭头)
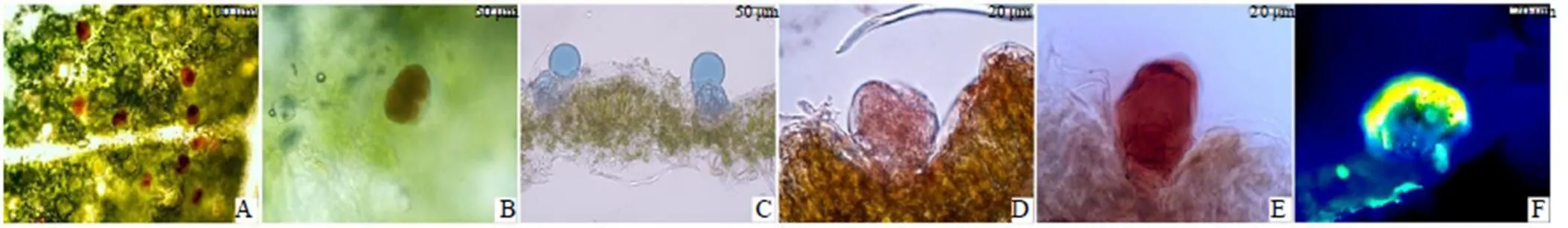
A-4-对亚硝基苯酚染色 B-浓硫酸处理 C-NADI染色 D-苏丹Ⅳ染色 E-香草醛-浓盐酸处理 F-DPBA处理
4 讨论
荧光显微镜下可观察到艾叶的上、下表面都分布有大小、形态及结构相同的腺毛,上表面的腺毛密度显著高于下表面。艾叶腺毛的柄部和基部都由2个细胞构成,其头部由2层4个或3层6个细胞构成,被共同的角质层包围,角质层下的间隙可以积累大量的分泌物。艾叶腺毛顶面观呈椭圆形,腺毛柄部较短,为短柄的头状腺毛。由于艾叶短柄的头状腺毛生长于叶表面凹陷处,扫描电镜下观察到腺毛的顶面观往往只看到其最顶端的细胞。在艾叶粉末中,腺毛的柄部常脱落,只留下头部,顶面观呈椭圆形,侧面观可看到头部的6(更常见)或4个细胞,并可观察到角质层下间隙充满分泌物。艾叶的腺毛类型和黄花蒿[42]的腺毛特点相同,都为2列性。最近Cui等[27-28]研究指出艾叶腺毛除了2列性(10细胞,其中头部6细胞,柄部和基部各2个细胞)腺毛外,还存在单列性(5细胞)腺毛,而其他关于包括艾Lévi. et Vant.、野艾蒿Candolle、五月艾Willd.等蒿属植物的研究均未发现单列性腺毛[20-26]。本研究采用多种显微手段观察证实艾叶不存在单列性腺毛,并认为CUI等所述单列性(5细胞)腺毛是由于2列性(10细胞)腺毛在与其顶面观长轴垂直方向进行切片所致,由于制片原因造成的假象在显微研究中是较为常见的。1977至2020年,各版《中国药典》中艾叶腺毛的顶面观均被描述成“鞋底状”[1,12-19],是对头部最顶端对叠而生的2个细胞的细胞壁轮廓而言,笔者认为腺毛头部角质层下间隙中的分泌物也是腺毛不可分割的重要组成部分,在粉末观察中,腺毛的柄部较短,又常脱落,顶面观和侧面观均呈椭圆形,因此,腺毛的顶面观和侧面观都描述为椭圆形比较合适。

A-腺毛的顶面观 B-腺毛的侧面观 C-I型T形非腺毛 D-II型T形非腺毛(白箭头和红箭头分别示柄和顶细胞上柄的脱落痕) E-上表皮 F-下表皮 G-螺纹导管 H-草酸钙簇晶 I-偏振光下的草酸钙方晶
A-top view of glandular trichome B-side view of glandular trichome C-Type I T-shaped non- glandular trichome D-Type II T-shaped non- glandular trichome( (white arrow head and red arrow head show the handle and handle's abscission mark on the apical cell respectively ) E-upper epidermis
F-lower epidermis G-spiral vessel H-calcium oxalate cluster crystal I-calcium oxalate square crystal under polarized light
图9 艾叶粉末显微特征图(均放大400×)
Fig. 9 Microscopic features ofpowder(400× for all)
艾叶叶柄,以及上、下表面叶脉处的非腺毛都为I型T形非腺毛(下表面的叶脉间也分布有少量),顶细胞呈长梭形而弯曲、表面光滑、两臂不等长。这些发现与1977年以来各版《中国药典》描述的T形非腺毛形态学特征基本相同。然而,艾叶下表面叶脉间除了少量的I型T形非腺毛外,更多的是大量密集分布的II型T形非腺毛。II型T形非腺毛最显著的特点在于:顶细胞极长、扁平且扭曲,且这些II型T形非腺毛的顶细胞相互缠绕。和上表面的I型T形非腺毛的密度(32±5)个/mm2相比,下表面II型T形非腺毛的密度高达(146±10)个/mm2,加上其顶细胞臂极细长,因此就有“上表面有稀疏柔毛”、“下表面密被灰白色绒毛”[1]的性状。
《中国药典》2020年版载艾叶:“另一种为单列性非腺毛,3~5细胞,顶端细胞特长而扭曲,常断落”[1]。然而,徐国钧院士等编撰的《中药材粉末显微鉴定》描述艾叶:“T形毛,常缠结。顶细胞横生,大多极细长而扭曲……,胞腔线形或不明显”[43]。其并未发现有“单列性非腺毛”,与历版《中国药典》不一致。1988年,刘训红等[27]研究认为艾叶的非腺毛都为T形,其并根据顶细胞特点将T形非腺毛分为2种,一种顶端细胞长而弯曲,两臂不等长;另一种顶端细胞特长而扭曲(密布于下表皮)。同样也并未提及“单列性非腺毛”。宋平顺等[44]对艾、野艾蒿等12种蒿属植物进行了研究,发现这些植物的叶表面均分布有腺毛和T形非腺毛,而未发现存在“单列性非腺毛”,并明确指出艾叶T形非腺毛顶细胞存在两种情况:“细胞壁厚、略弯曲、或细胞壁薄而成缠绕状”,这一结论也与本研究结果十分相近。显然,徐国钧院士提到的“大多极细长而扭曲”的非腺毛就是本研究中的II型T形非腺毛,而“胞腔线形或不明显”则为I型T形非腺毛顶细胞的特点;其与本研究描述的区别在于:前者将T形非腺毛的特征作了简化而一并描述之;而本研究依据T形非腺毛顶细胞特点直接将其分为2类,更加清晰、不易引起误读。需要特别指出的是:前期对1000多个批次的艾叶样品进行研究,从未发现顶端细胞特长而扭曲的“单列性非腺毛”。同时,发现粉末中II型T形非腺毛的柄易脱落,留下长而扁平、扭曲的顶细胞。仔细分析,不难发现:粉末中柄脱落的II型T形非腺毛就是现版《中国药典》所载具有“3~5细胞,顶端细胞特长而扭曲,常断落”特点的所谓“单列性非腺毛”。
显微鉴定是中药基原鉴定的重要依据,对其质量评价也有重要意义。艾叶显微特征的深入研究对于艾叶和艾绒的真伪鉴别及质量评价都具有重要参考价值,也为下一版《中国药典》艾叶显微鉴定相关内容的修订和完善提供了参考资料。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 23.
[2] 林有润. 中国古本草书艾蒿类植物的初步考订 [J]. 植物研究, 1991, 11(1): 1-24.
[3] 兰晓燕, 朱龙波, 黄显章, 等. 艾叶中主要化学成分的鉴定及其含量测定研究[J]. 中草药, 2021, 52(24): 7630-7637.
[4] 赵志鸿, 王丽阳, 郑立运, 等. 艾叶挥发油对HBV的抑制作用 [J]. 郑州大学学报: 医学版, 2015, 50(2): 301-304.
[5] 赵桂芝, 王绪平, 俞忠明, 等. 艾叶挥发油对耳肿胀急性炎症模型小鼠的抗炎作用研究 [J]. 浙江中医杂志, 2016, 51(4): 288-289.
[6] 许俊洁, 卢金清, 郭胜男. 蕲艾挥发油的化学成分及其体外抗氧化活性研究 [J]. 中国医院药学杂志, 2017, 37(1): 76-79, 83.
[7] Nishizawa A, Honda G, Kobayashi Y,. Genetic control of peltate glandular trichome formation in[J]., 1992, 58(2): 188-191.
[8] Turner G W, Gershenzon J, Croteau R B. Distribution of peltate glandular trichomes on developing leaves of peppermint [J]., 2000, 124(2): 655-664.
[9] 唐巧玉, 付伟, 周毅峰, 等. 三种蒿属植物叶面腺体观察及其挥发性物质的SPME-GC-MS分析 [J]. 湖北民族学院学报: 自然科学版, 2014, 32(4): 371-374.
[10] 杨珂, 黄显章, 王利丽, 等. 基于扫描电镜技术观察不同产地艾叶表面特征 [J]. 电子显微学报, 2020, 39(2): 173-180.
[11] 彭政, 杨雅雯, 徐扬, 等. 不同叶绒比艾绒氮含量比较及其在艾绒等级鉴定上的应用研究 [J]. 中国中药杂志, 2020, 45(17): 4051-4056.
[12] 中国药典 [S]. 一部. 1977: 158.
[13] 中国药典 [S]. 一部. 1985: 64.
[14] 中国药典 [S]. 一部. 1990: 68.
[15] 中国药典 [S]. 一部. 1995: 68.
[16] 中国药典 [S]. 一部. 2000: 67.
[17] 中国药典 [S]. 一部. 2005: 61.
[18] 中国药典 [S]. 一部. 2010: 82.
[19] 中国药典 [S]. 一部. 2015: 89.
[20] 刘训红, 宋采成. 艾叶及野艾叶的比较鉴别 [J]. 中草药, 1988, 19(2): 35-36.
[21] 蒋林, 林有润. 中国蒿属植物比较形态和解剖学研究: (I)叶表皮结构 [J]. 植物研究, 1993, 13(4): 353-369, 415.
[22] 陈宗良, 张慧芳. 艾叶、野艾及细叶艾的比较鉴别 [J]. 中药材, 1999, 22(5): 235-237.
[23] 黄红兵, 刘心纯. 艾与五月艾的生药鉴定 [J]. 中药材, 1999, 22(6): 283-287.
[24] 孙稚颖. 山东产艾及几种近缘种的形态解剖学研究 [J]. 山东中医药大学学报, 2014, 38(1): 72-75.
[25] 赵中振, 陈虎彪. 中药显微鉴定图典 [M]. 福州: 福建科学技术出版社, 2016.
[26] 李曦凝, 吕佳美, 林贺, 等. 艾叶与艾炭显微特征对比研究 [J]. 世界最新医学信息文摘, 2018, 18(11): 1-3.
[27] Cui ZH, Huang X Z, Li C,. Morphology, distribution, density and chemical composition of glandular trichomes in(Asteraceae) [J]., 2020, 24(2): 359-365.
[28] Cui Z H, Li M Z, Han X J,. Morphogenesis, ultrastructure, and chemical profiling of trichomes inH. lév. & vaniot (Asteraceae) [J]., 2022, 255(5): 102.
[29] 罗丹丹, 彭华胜, 康利平, 等. 宽叶山蒿与艾不同部位叶片腺毛和非腺毛形态特征比较研究 [J]. 中国中药杂志, 2021, 46(13): 3319-3329.
[30] 武娟, 毛梦然, 蒲锐, 等. 艾灸疗法与艾绒 [J]. 亚太传统医药, 2018, 14(11): 102-104.
[31] 武娟, 万定荣, 蒲锐, 等. 艾灸疗法原材料艾叶和艾绒的鉴别 [J]. 中国药业, 2019, 28(11): 1-3.
[32] 武娟, 万定荣, 赵百孝, 等. 艾绒的质量评价标准及其商品分级研究 [J]. 中国药业, 2019, 28(24): 4-7.
[33] 万定荣, 武娟, 蒲锐, 等. 艾叶的鉴定、品质与国际标准研究概况 [J]. 中南民族大学学报: 自然科学版, 2020, 39(4): 362-369.
[34] Gersbach P V, Wyllie S G, Sarafis V. A new histochemical method for localization of the site of monoterpene phenol accumulation in plant secretory structures [J].2001, 88(4): 521-525.
[35] Geissman T A, Griffin T S. Sesquiterpene lactones: Acid-catalysed color reactions as an aid in structure determination [J]., 1971, 10(10): 2475-2485.
[36] Cappelletti E M, Caniato R, Appendino G. Localization of the cytotoxic hydroperoxyeudesmanolides in[J]., 1986, 14(2): 183-190.
[37] David R, Carde J P. Coloration différentielle des pseudophylles de Pin maritime au moyen du réactif de Nadi[J].1964, 258: 1338-1340.
[38] Schmid R, O'Brien T P, McCully M E. The study of plant structure: Principles and selected methods [J].1982, 31(4): 789.
[39] JohansenD A.[M]. 1st ed. London McGraw Hill, London, 1940.
[40] Guerin H P, Delaveau P G, Paris R R. Localisations histochimiques.: II: Procédés simples de localisation de pigments flavoniques. application à quelques phanérogames [J].1971, 118(1/2): 29-36.
[41] Heinrich G, Pfeifhofer H W, Stabentheiner E,. Glandular hairs ofKunth (Asteraceae): Morphology, histochemistry and composition of essential oil [J]., 2002, 89(4): 459-469.
[42] Janick J. Floral morphology ofwith special reference to trichomes [J].1995, 156(6): 807-815.
[43] 徐国钧. 中药材粉末显微鉴定 [M]. 北京: 人民卫生出版社, 1986: 236.
[44] 宋平顺, 卫玉玲, 张伯崇. 甘肃产艾叶的原植物调查及生药鉴定 [J]. 中草药, 1994, 25(7): 372-376.
Microscopic identification and histochemical study of glandular trichomes inleaves
Liu Meng-qi1, Hui Cheng-cheng1, Chen Sui-qing1, Guo Tao1,2, Wang Hai-bo3, XIN Hai-liang2,4
1. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Zhongjing Chinese Medicine Industry Research Institute,Nanyang 473001, China 3. NMPA Key Laboratory for Quality Control of Traditional Chinese Medicine, Henan Institute for Food and Drug Control, Zhengzhou 450018, China 4. School of Pharmacy, Naval Medical University, Shanghai 200433, China
To provide reliable reference for microscopic identification and quality evaluation ofleaves and moxa floss.The microstructure and histochemistry ofwere studied by fluorescence microscope and scanning electron microscope.Glandular trichomes and non- glandular trichomes were distributed on the upper and lower surfaces of. The glandular trichome was composed of two rows of cells, with four or six cells overlapping each other at the head, two cells at the stalk and two cells at the base. Non- glandular trichomes are characteristic of T shape, and their stalk was composed of 2-5 cells. According to the characteristics of apical cells, the T- shaped non- glandular trichomes can be divided into two types: One was apical cells with long spindle and curved shape (type I), and the other was filamentous, extremely long, flat, and twisted (type II). Calcium oxalate cluster crystals with diameters ranging from 3 to 40 μm were found mostly in mesophyll cells. There were few stomata on the upper surface and many stomata on the lower surface, and the stomata were amorphous. The vertical walls of upper and lower epidermal cells were wavy and curved. The spiral vessel was often found. While the scalariform, reticulate and pitted vessel are occasionally found. The results of histochemical study showed that glandular trichomes contained volatile oil, terpenoids, flavonoids and other components.The results of this study provide an important reference for the revision and improvement of the microscopic identification ofin the next edition of.
Lévi. et Vant.; microscopic identification; glandular trichomes; non-glandular trichomes; histochemistry
R286
A
0253 - 2670(2022)23 - 7532 - 11
10.7501/j.issn.0253-2670.2022.23.025
2022-06-06
教育部产学研合作协同育人项目(202102294010);河南省科技厅科技攻关项目(222102310110);科技基础资源调查专项子课题(2018FY100802-03)
刘孟奇(1971—),男,副教授,研究方向为中药资源与鉴定。E-mail: 2009liumq@163.com
通信作者:郭 涛(1976—),男,教授,研究方向为中药鉴定与质量控制。E-mail: gt010010@163.com
辛海量(1976—),男,教授,研究方向为中药鉴定、质量评价及中药药理。E-mail: hailiangxin@163.com
[责任编辑 时圣明]
