超临界CO2萃取热带睡莲鲜样两种产物形态的挥发性组分与抗氧化活性比较
2021-08-23黄秋伟毛立彦唐毓玮黄欣欣石兰蓉龙凌云
黄秋伟 毛立彦 唐毓玮 黄欣欣 石兰蓉 龙凌云


摘 要:以超临界CO2萃取热带睡莲鲜样所得的精油与水相为材料,采用气相色谱-质谱联用法分析两者的挥发性组分,采用四种体外抗氧化法测定和比较两者的抗氧化活性。结果表明,精油的挥发性组分种类要明显多余水相的,且精油中主要组分为萜烯类化合物,含量最高组分为6,9-十七碳二烯(含量为25.41 %),水相中主要组分为芳香醇类化合物,含量最高组分为苯甲醇(含量为72.86%)。四种体外抗氧化法比较结果均表现为精油>水相,水相具备原花的部分花香和一定的抗氧化活性,可以进一步的开发利用。
关键词:热带睡莲 精油 水相 超临界CO2萃取 抗氧化活性
中图分类号: 文献标志码:A
睡莲是睡莲科(Nymphaeaceae)睡莲属(Nymphaea Linn.)多年生宿根浮叶植物的统称,依据分布区域和生态适应性可分为耐寒睡莲和热带睡莲两大类,其中,大多数的热带睡莲品种及栽培种的鲜花均具有清雅宜人的芳香气味,而芳香气味的产生一般与植物精油密切相关。用于植物精油提取的技术较多,除了常用的蒸馏法外[1],超临界流体萃取是目前主要技术手段之一,其中常见报道的流体介质又以二氧化碳居多[2-4]。超临界流体萃取技术原料可以是固体干样、固体鲜样、液体样,当用来萃取鲜样时,其分离产物为互不相溶的两种形态,可以称之为油相和水相,油相为精油等非极性成分,水相为随萃取流体介质而流出的含水副产物。当前,关于睡莲的研究报道热点主要是基于不同技术手段探究睡莲系统发育[5-8]、睡莲基因组及花色组成因子研究[9-10]、睡莲代谢物组成[11]、睡莲生理特性及其对水体修复机制[12-15]等,而关于睡莲精油提取及其活性研究的报道较为罕见。本文采用超临界CO2萃取法来萃取热带睡莲 “保罗兰”鲜花样品,利用GC-MS检测手段检测分析萃取得到的精油和水相挥发性组分,通过四种体外抗氧化法来对比两者的抗氧化活性,为两者后期在食品及日用化妆品领域的开发提供理论数据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
供试植物:采摘于广西亚热带作物研究所睡莲资源种质圃,采摘品种为热带睡莲“保罗兰”;CO2气体(食品级,纯度≥99.99 %):广西国信气体研究院有限公司;无水乙醇(2.5 L装分析纯):成都市科隆化学品有限公司;1,1-二苯基-2苦基肼自由基:东京化成工业株式会社;2,2-联氨-双(3-乙基苯并噻唑啉-6磺酸)二胺盐:上海源叶生物科技有限公司;其余化学试剂(分析纯):采购于广西南宁茵兴科技有限公司。
1.1.2 仪器与设备
HA221-40型超临界流体萃取装置:江苏南通华安超临界萃取有限公司;气相色谱-质谱联用仪(7980A/5975C):美国Agilent公司;50/30μm CAR/PDMS/DVB萃取纤维头:美国SUPELCO公司;GR200型电子分析天平:日本A&D公司;T6新世纪紫外可见分光光度计:上海普析通用仪器公司;其余为实验室常规设备。
1.2 方法
1.2.1 热带睡莲花鲜样的超临界萃取
参照黄秋伟[16]等的研究方法,利用超临界CO2萃取法来提取睡莲鲜样。称取开花一天的热带睡莲“保罗兰”鲜花雄蕊50 g,超临界萃取压力为27.5 MPa,萃取温度为45 ℃,循环萃取时间设置为120 min。萃取结束后,收集分离釜中萃取物的上层精油并转移至离心管中于4 ℃冷藏,同时收集萃取得到的下层水相,也转移至离心管中于4 ℃冷藏。
1.2.2 萃取物挥发性组分的GC-MS测定
1.2.2.1 样品预处理
油相:取0.5 g精油样品置于20 ml顶空瓶中,拧紧瓶盖。于60 ℃下平衡5 min后,用固相微萃取针60 ℃下萃取20 min,然后于进样口解吸5 min。
水相:取6 ml水相样品置于20 ml顶空瓶中,拧紧瓶盖。于60 ℃下平衡5 min后,用固相微萃取针60 ℃下萃取20 min,然后于进样口解吸5 min。
1.2.2.2 分析条件
色谱条件:色谱柱为HP-INNOWAX毛细管柱子(30m×0.25mm×0.25μm);载气为He,流速1 mL/min,分离比5:1;进样温度为250 ℃;升温程序为起始温度为40 ℃,保持5 min,以8 ℃/min,升至250 ℃,保持5 min。质谱条件:EI电离子源,能量70eV;离子源温度230℃,四极杆温度150℃,接口温度250℃,扫描范围30~400 m/z。
1.2.3 萃取物对DPPH自由基的清除作用
将精油与水相分别用无水乙醇配制成0.01、0.10、1.00、10.00 mg/mL浓度液,以这4个浓度液进行预试验,试验反应时间暂定20 min,来确定试验对象的起始浓度。预实验发现精油在1.00 mg/mL的浓度時表现出清除效果,而水相要达到10.00 mg/mL时才表现出清除效果。因此睡莲精油、水相分别以1.00 mg/mL、10.00 mg/mL作为起始浓度,并设置两个浓度递增梯度范围,以这两个浓度梯度作为清除DPPH自由基能力测定的浓度梯度,其它的抗氧化测定指标也采用这两个浓度梯度。
1.2.3.1 清除DPPH自由基反应时间的确定
参考刘帅涛[17]等的研究方法,分别量取精油与水相的一低一高两个浓度1 mL,将这两个浓度液分别与1 mL的0.04 mg/mL DPPH溶液于比色皿中混合作为处理组,另取浓度液溶剂即无水乙醇1 mL与1 mL的0.04 mg/mL DPPH溶液与比色皿中混合作为空白组。处理组和空白组加样混合完毕后,马上在波长为517 nm的光波下测定吸光值,并开始计时,以空气作为空白调零,同时以吸光值为纵坐标,时间梯度为横坐标,绘制动力学曲线,取反应平衡的时间点作为自由基清除体系的反应时间。
1.2.3.2 清除DPPH自由基能力测定
量取对照组与试验组中的各个浓度液和无水乙醇各2 mL,分别与2 mL的0.04 mg/mL DPPH溶液混合,另取各个浓度液2 mL与2 mL DPPH溶液的溶剂混合。三个混合液混合均匀后静置于黑暗条件下常温反应,反应时间则依据1.2.3.1步骤的结果中反应平衡点来设定。反应时间到达后,置于517 nm的光波下测量,以空气作为空白调零,记录对应的吸光值。样品浓度液与DPPH溶液混合液的吸光值记为Ai;样品浓度液与DPPH溶液溶剂混合液的吸光值记为Aj;无水乙醇与DPPH溶液混合液记为A0。并按照下式计算清除率,并以样品浓度对数为X,自由基清除率为Y,作线性回归求方程,算出清除率为50%的样品浓度(IC50):
DPPH清除率(%)=[1-(Ai-Aj)/A0]×100
1.2.4 萃取物清除ABTS+自由基能力测定
参考白海娜[18]等的方法,并调整用量。吸取等体积的2.6 mmol/L 过硫酸钾溶液与7.4 mmol/L ABTS+自由基溶液均匀混合后,置于暗室且室温条件下反应12~16 h。用无水乙醇将混合液稀释40~50倍,调整其在波长734 nm处的吸光值在0.70±0.05的范围内。量取对照组与试验组中的各个浓度液0.2 mL与2 mL稀释液于比色皿中混合,同时量取0.2 mL无水乙醇与2 mL稀释液于比色皿中混合,加样完毕后静置6 min反应,之后快速测量734 nm处的吸光值。样品浓度混合液的吸光值记为Ai;无水乙醇混合液的吸光值记为A0。并按照下式计算清除率,并以样品浓度对数为X,清除率为Y,作线性回归求方程,算出清除率为50%的样品浓度(IC50):
ABTS+自由基清除率(%)=[(A0-Ai)/A0]×100
1.2.5 萃提物总还原力测定
参考张俊霞[19]等和邢玉娟[20]等的测定方法。量取精油与水相的稀释浓度液各1 mL,并置于玻璃试管中,然后依次与同体积的0.2 mol/mL磷酸盐缓冲液(pH=6.6)、1%铁氰化钾溶液均匀混合。混合液于在50 ℃处水浴反应20 min,反应完毕后快速置于冰水中冷却。加入10%三氯乙酸溶液1 mL终止反应,冷却液于12000 r/min转速下,低温高速离心10 min,吸取上清液2.0 mL,加入2.0 mL蒸馏水,0.4 mL0.1%三氯化铁溶液,混匀后静置10 min,并测定混合液在波长为700 nm处的吸光度。
1.2.6 萃提物铁还原总抗氧化能力(FRAP)测定
参考杨少辉[21]等的方法,先配制FRAP工作液,然后配制10 mmol/L的硫酸亚铁标准母液,并将其稀释成0.2、0.4、0.6、0.8、1.0、1.2、1.4 mmol/L的硫酸亚铁测定标液,吸取各浓度标液0.1 ml于试管中,分別加入FRAP 工作液2.9 mL,设定水浴温度为37 ℃,反应30 min,同时以水为空白对照,于光波长 593 nm 处测定吸光度,以标液浓度为横坐标,吸光值为纵坐标,绘制硫酸亚铁标准曲线,求出线性方程。按照测标准曲线的方法进行测定样品抗氧化能力,分别吸取 0.1 mL的不同试验浓度精油和水相稀释液。样品的总抗氧化能力 FRAP值以亚铁离子的摩尔浓度来表示。
2 结果与分析
2.1 挥发性组分分析结果
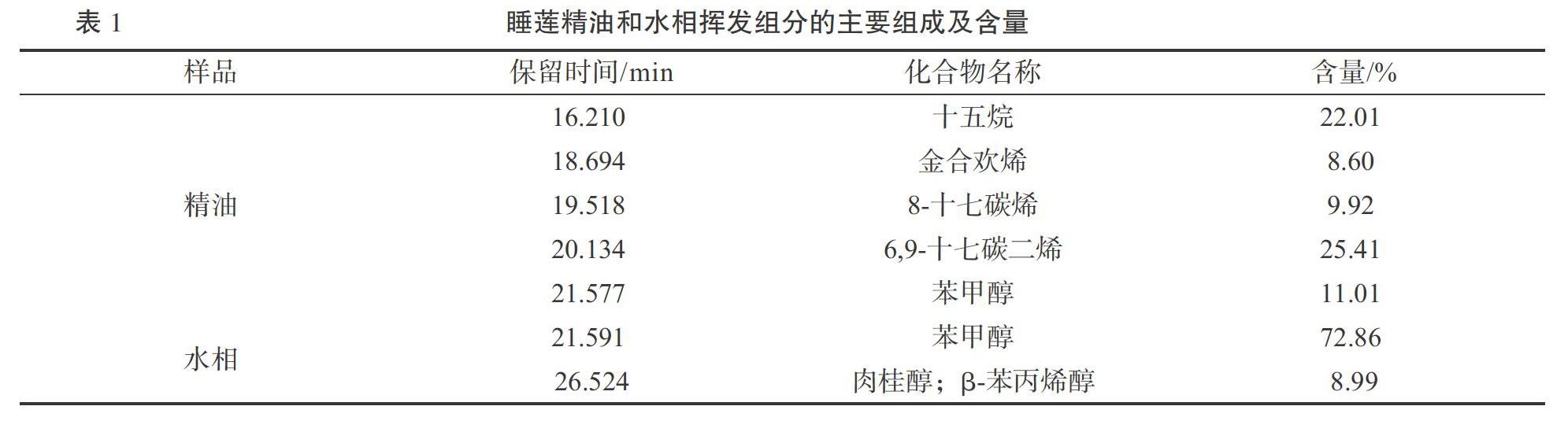
睡莲精油和水相经顶空固相微萃取,通过气相-质谱联用检测技术对其内含组分进行分析,其挥发性成分种类总离子流图如图1和图2所示。其中含量超过5%的主成分见表1。
由图1和图2可以明显看出,精油谱图的出峰数目要明显高于水相的,每一个峰就相当于检测到一个化合物,这表明精油挥发性化合物种类多于水相。结合谱图的保留指数,通过NIST08谱图库进行解谱分析,精油共检出54种已知成分,水相共检出14种已知成分[16]。此外,由表1数据可见,依据峰面积归一化法进行定量分析,精油中含量超过5%的化合物有5种,且这些挥发性化合物主要是萜烯类,有3种组分,其中含量最高的组分为6,9-十七碳二烯,含量为25.41%;水相中含量超过5%的化合物只有2种,且都是芳香醇类化合物,其中含量最高的组分为苯甲醇,含量可达到72.86%,且苯甲醇为精油和水相两者挥发性组分主要组成的共有成分。
2.2 DPPH自由基的清除作用
2.2.1 DPPH自由基清除体系反应时间的确定
精油与水相的自由基混合液和无水乙醇自由基混合液在波长517 nm下的吸光值随着时间延长的动力学曲线结果见图3和图4。
由图3和图4可以看出,随着时间的延长,精油与水相的自由基混合液的吸光值表现出规律性的下降趋势。
此外,两组作为对照的无水乙醇混合液在不加样品的情况下,吸光值随着时间延长,变化曲线接近水平线,说明了本试验所选用的DPPH自由基体系较为稳定。添加高低浓度睡莲精油的自由基混合液,当反应时间超过30 min后,两者的吸光值均无变化,说明睡莲精油清除自由基反应平衡点为30 min;水相对自由基的降色效果较弱,且反应较慢,当时间为90 min时,高低两个浓度的水相才使得自由基混合溶液吸光值从0.572分别降至0.411、0.448,超过这一时间点后吸光值无变化,由此说明水相清除自由基的反应平衡点为90 min。
2.2.2 DPPH自由基清除能力测定结果
精油与水相对DPPH自由基的清除率随浓度梯度的变化结果见图5和图6。
图中不同小写字母表示差异显著(P<0.05),下同。
由图5和图6可以看出,在所选取的浓度梯度范围内,睡莲精油和水相对DPPH自由基的清除率随着浓度的提高而升高,且各个梯度值的清除率均表现出显著性差异,通过清除曲线所得的回归方程计算,超临界花油清除自由基的IC50为3.848 mg/mL(R2=0.956),而水相在试验浓度范围内所产生的自由基清除率均低于50%,因而无法计算IC50。
2.3 ABTS+自由基清除能力的测定结果
精油与水相对ABTS+自由基的清除率随浓度梯度的变化结果见图7和图8。
从图7和图8中可以看出,试验浓度范围内的精油对自由基的清除率随浓度提高而表现出显著性地升高,而水相在所设定的10.00~80.00 mg/mL浓度范围内,清除率随着浓度提高而升高,且彼此间差异显著,当浓度提升至100.00 mg/mL,清除率虽有升高,但相对于80.00 mg/mL的清除率无显著性变化;经回归方程计算,精油清除自由基的IC50为2.107 mg/mL(R2=0.963),而水相在浓度范围内的自由基清除率均低于50%,因而无法计算IC50。
2.4 总还原力的测定结果
精油与水相的总还原力大小随浓度梯度的变化结果见图9和图10。
从图9和图10可看出,在试验浓度范围内,随着浓度梯度的不断提高,精油和水相的所表现出来的总还原力,即吸光值均呈现逐渐增大的态势。此外,精油的吸光值总体上高于水相,随着浓度的提高,前者与后者的差值就越大,而试验中样品吸光值越大,表明其相对应总还原力就越强。
2.5 总抗氧化力的测定结果
本次试验所测得的硫酸亚铁标准曲线见图11。精油与水相的总抗氧化力测定结果见图12和图13。
由图11的标准曲线方程,将所测得到的吸光值换算成FRAP值。由图12和图13可以看出,精油与水相的稀释液浓度越高,所还原得到的FRAP值越高,相对应的总抗氧化力就越强。在试验的浓度范围内,精油和水相各个处理浓度间彼此相应的总抗氧化力差异显著。此外,低浓度下精油得到的FRAP值要高于水相,但差值相差不大,随浓度的提高,两者的差值逐步增大,当浓度均达到最大时,精油与水相对应的FRAP差值已由起始浓度时的0.003 mmol/L增大到了的0.250 mmol/L。试验中样品测试结果换算的FRAP值越高,表明其相对应的总抗氧化力越强。
3 讨论与结论
利用超临界萃取睡莲花鲜样,除了可以得到睡莲花精油,还可以得到与精油不相溶的水相,所谓水相实质上是利用超临界流体亲和溶解及易分离的特性,在萃取鲜样材料时,因材料带有水,部分水会跟着流体流出分离后所出现的一种副产物,是一种混合有天然产物的混合相[22]。目前关于植物精油超临界流体萃取研究[23],基本上均以CO2为主,且萃取材料均为干样,而用鲜样作为萃取材料的研究极为罕见,这是由于大多数研究都是以提高超临界精油产率为目的,而鲜样含水量高,会增加超临界流体传质阻力,降低精油的萃取率[24],所以目前关于超临界精油活性研究报道较多,而超临界水相活性的相关研究基本没有。
本研究主要采用GC-MS測定分析超临界萃取睡莲花鲜样所得到睡莲花精油和水相两者的挥发性组分,结果发现精油挥发组分种类要多于水相的,且精油主要挥发组分为萜烯类,水相主要挥发组分为芳香醇类;同时采用DPPH自由基清除、ABTS+自由基清除、总还原力、总抗氧化力这四种体外抗氧化测定模型,来测定及对比睡莲花精油和水相的抗氧化活性。抗氧化活性对比试验结果表明,在试验设置的浓度范围内,对于DPPH和ABTS+这两种自由基的清除能力,睡莲花精油>水相;对于总还原力的强弱,睡莲花精油>水相。因此,从整体的抗氧化测定结果来看,睡莲花精油的抗氧化活性要明显强于水相,但水相与精油挥发性主要组成成分均具有苯甲醇,因而相当于具有鲜花部分的挥发性香气成分,且从试验结果中也可以看出,当水相用乙醇稀释至10 mg/mL的浓度时,稀释液才对本次试验采用的自由基模型表现出清除效果,因而看出在这一稀释浓度时就具备一定的抗氧化活性,因而有一定的开发价值。
参考文献
[1] 何新萍,高新慧,敬思群,等. 响应面法优化茴香花精油提取工艺条件及精油组成分析[J].食品工业,2011,32(10):4-7.
[2] 赵令江,莘海亮,杨梅花,等. 超临界CO2萃取柑橘皮精油工艺研究[J]. 凯里学院学报,2019,37(3):32-35.
[3] 刘丽娜.响应面法优化超临界CO2萃取红树莓籽精油的工艺[J]. 粮食与油脂,2019,32(8):40-42.
[4] 丁仡,李源栋,刘秀明,等. 超临界CO2萃取印蒿精油工艺优化及成分分析[J]. 食品研究与开发,2019,40(24):167-172.
[5] 刘艳玲,徐立铭,倪学明,等. 基于ITS 序列探讨睡莲属植物的系统发育[J]. 武汉大学学报(理学版),2005(2):258-262.
[6] 张海平,房伟民,陈发棣,等. 部分睡莲属植物形态性状的多样性分析[J]. 南京农业大学学报,2009,32(4):47-52.
[7] Péter P, Kinga K M, István S, et al. Genetic Variability of Thermal Nymphaea(Nympha- eaceae) Populations Based on ISSR Markers: Implications on Relationships, Hybridization, and Conservation[J]. Plant Molecular Biology Reporter, 2011, 29(4): 906-918.
[8] 苏群,杨亚涵,田 敏,等. 睡莲种质资源遗传多样性分析及DNA 指纹图谱构建[J]. 热带作物学报,2020,41(2):258-266.
[9] 朱满兰,王亮生,张会金,等. 耐寒睡莲花瓣中花青素苷组成及其与花色的关系[J]. 植物学报,2012,47(5):437-453.
[10] Zhang L S, Chen F, Zhang X T, et al. The water lily genome and the early evolution of flowering plants[J]. Nature, 2020, 577(7788): 79-84.
[11] 袁茹玉.不同品种睡莲花挥发物组成及其茶汤功能成分和抗氧化活性评价[D]. 南京:南京农业大学,2014.
[12] 古琴.低温胁迫对不同热带睡莲品种抗寒生理的影响[J]. 上海农业学报,2016,32(5):114- 118.
[13] 张雅君,吴含玉,张会金,等. 夏季小花睡莲挺水叶光抑制加剧的机制[J]. 植物生理学报,2018,54(1):54-62.
[14] 柯美玉,陈栩. 光对睡莲开花生物钟的调控作用研究[J]. 中国园艺文摘,2018,(5):21-25.
[15] 宋力,黄勤超,黄民生. 利用荷花与睡莲对沉积物中重金属的修复研究[J]. 光谱学与光谱分析,2016,36(9):2884-2888.
[16] 黄秋伟,毛立彦,龙凌云,等. 热带睡莲精油的超临界CO2萃取优化及其成分GC-MS分析[J]. 食品研究与开发,2020,41(7):188-195.
[17] 刘帅涛,陶慧林,李锦艳. 4种黄酮小分子对DPPH自由基的清除作用及构效关系研究[J].分析测试学报,2012,31(1):71-75.
[18] 白海娜,王振宇,刘瑞海,等. 白藜芦醇与黑木耳多糖协同清除ABTS+自由基活性的研究[J]. 現代食品科技,2014,30(3):64-68.
[19] 张俊霞,王应玲,姜 宁,等. 白花蛇舌草总黄酮提取工艺及其抗氧化活性研究[J]. 湖北农业科学,2017,56(18):3523-3527.
[20] 邢玉娟,陈 新,刘 梁,等. 水蒸气蒸馏和超临界萃取来凤凤菊精油抗氧化研究[J]. 食品研究与开发,2018,39(9):1-5.
[21] 杨少辉,宋英今,王洁华,等. 雪莲果体外抗氧化和自由基清除能力[J]. 食品科学,2010,31(11):166-169.
[22] 徐怀德. 天然产物提取工艺学[M]. 北京:中国轻工业出版社,2008: 135-137.
[23] 吴嘉碧,陈丹玲,陈侣平. 植物精油提取方法研究进展综述[J]. 化工设计通讯,2016,42(02):33-34.
[24] 许克勇,吴彩娥,李元瑞. 物料水分含量对油脂超临界C02萃取的影晌[C]. 第五届超临界流体技术及应用研讨会论文集,2005:146-149.
