梓醇对糖尿病小鼠肝肾并发症与肝脏胆汁酸作用的研究
2022-12-08陈小芳李先恩
曾 卿 陈小芳 刘 畅 李先恩
(中国医学科学院药用植物研究所,北京,100193)
随着我国经济的发展和生活方式的改变,糖尿病患者数量迅速增长,给人类健康构成了巨大威胁。其中,2型糖尿病作为以高血糖为主要特征的渐进性代谢疾病,可以通过调整饮食结构、口服降糖药物或皮下注射胰岛素等常规疗法进行干预。目前,除噻唑烷二酮类和二甲双胍这些临床上应用广泛的降糖药物以外,有研究发现中药中多种有效成分具有温和的胰岛素增敏作用和降血糖作用,对改善糖尿病并发症和维持血糖稳态具有一定效果。
梓醇(Catalpol,CAT)是我国传统中药中用于治疗消渴症的常用药地黄[Rehmanniaglutinosa(Gaetn.) Libosch.ex Fisch.et Mey.]的主要成分之一,具有多种药理活性,如抗炎、调节神经系统和脂质代谢紊乱等[1-2]。有研究发现,梓醇通过上调磷酸化AMP活化蛋白激酶(AMP-activated Protein Kinase,AMPK)α1/2的表达,调节脂质、葡萄糖代谢紊乱、胰岛素抵抗和降低血糖,治疗实验用糖尿病纯合子(db/db)小鼠[3]。此外,梓醇也被证明能通过抑制活性氧产生和核因子κB活性来降低由晚期糖基化终末产物(Advanced Glycation End Products,AGEs)介导的炎症反应[4-5],说明梓醇不仅可以明显降低血糖水平,还能够有效改善糖尿病并发症[6],而梓醇对于糖尿病性肝病、肾损伤、视网膜损伤与周围神经病变的干预作用却少见报道。因此,有关梓醇对db/db小鼠中糖尿病性肝肾损伤与胆汁酸水平作用的探究具有重要的研究价值。
1 材料与方法
1.1 材料
1.1.1 动物 选取48只无特定病原体(Specific Pathogen Free,SPF)级雄性糖尿病鼠(Diabetic Mouse),简称db小鼠,购于北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2019-0008],饲养地点为中国医学科学院药用植物研究所实验动物中心[许可证:SYXK(京2017-0020],饲养环境湿度50%~65%,温度22~24 ℃,光照和黑暗时间各12 h。其中选取8只4周龄体质量(22±1)g的糖尿病导入m基因杂合子(db/m)雄性小鼠作正常组,以普通维持饲料喂养,其余4周龄体质量(19±2)g的实验用糖尿病纯合子(db/db)雄性小鼠喂养高糖高脂饲料。本研究经动物伦理委员会批准通过。
1.1.2 药物 梓醇(成都瑞芬思生物科技有限公司,货号:Z-005);二甲双胍素片(上海施贵宝制药有限公司,批号:02000913)。
1.1.3 试剂与仪器 血清白蛋白(中生北控生物科技有限公司,货号:100020070)、谷草转氨酶(中生北控生物科技有限公司,货号:100020010)、谷丙转氨酶(中生北控生物科技有限公司,货号:100020000)、直接胆红素酶联免疫吸附测定试剂盒(Dogesce公司,货号:DG94561Q-96)、总胆红素测定试剂盒(Dogesce公司,货号:DG91296Q-96)、维生素B12酶联免疫吸附测定试剂盒(上海必优生物科技有限公司,货号:P1002)、叶酸酶联免疫吸附测定试剂盒(Calbiotech公司,美国,货号:IME00026)、谷胱甘肽和同型半胱氨酸酶联免疫吸附测定试剂盒(江西艾博因生物科技有限公司,货号:IB-E22250);色谱级乙腈(Fisher公司,美国,货号:T001014000)、色谱级甲醇(Fisher公司,美国,货号:LS004524)、色谱级甲酸(天津市光复精细化工研究所,货号:20190517);胆酸(CA,上海源叶生物有限公司,货号:B20274)、脱氧胆酸-2,2,4,4-d4(DCA,上海源叶生物有限公司,货号:B21032)、甘氨胆酸(GCA,上海源叶生物有限公司,货号:B27078)、甘氨石胆酸(GLCA,上海源叶生物有限公司,货号:S27511)、石胆酸(LCA,上海源叶生物有限公司,货号:B28100)、鹅去氧胆酸2,2,3,4,4-d4(CDCA,上海源叶生物有限公司,货号:B20347)、猪去氧胆酸(HDCA,上海源叶生物有限公司,货号:B21672)、熊去氧胆酸(UDCA,上海源叶生物有限公司,货号:B24105)、牛磺胆酸(TCA,上海麦克林有限公司,货号:T877269)、牛磺猪去氧胆酸(THDCA,上海源叶生物有限公司,货号:B26449)、牛磺鹅去氧胆酸(TCDCA,上海源叶生物有限公司,货号:B20919)、牛磺熊去氧胆酸(TUDCA,上海源叶生物有限公司,货号:B20921);高糖高脂饲料(北京华阜康生物科技股份有限公司,饲料编号:1K65)。1-14冷冻离心机(Sigma公司,德国,型号:3K15);旋涡混合器(海门其林贝尔仪器制造有限公司,型号:QL-901);血糖试纸及血糖仪(罗氏公司,德国,型号:ACTIVE);全自动生化仪(贝克曼公司,日本,型号:AU480);液相色谱-质谱联用仪(AB SCIEX公司,美国,型号:Q-Trap 5500)。
1.2 方法
1.2.1 分组与模型制备 适应性喂养1周后测定小鼠空腹血糖2次,若2次空腹血糖值均大于7.9 mmol/L,则开始给药。db/m小鼠作正常组,40只造模成功的小鼠随机均分为模型组、阳性药组(二甲双胍,200 mg/kg)、梓醇低剂量组(150 mg/kg)、梓醇中剂量组(200 mg/kg)和梓醇高剂量组(250 mg/kg)。
1.2.2 给药方法 正常组和模型组每日灌胃等体积的生理盐水,各观察组按给药剂量每天灌胃1次。给药8周后,所有小鼠隔夜禁食,摘眼球取血,分离血清,取部分肝脏和眼球固定于甲醛溶液中,其余置于-80 ℃环境中保存。
1.2.3 检测指标与方法
1.2.3.1 体质量、血糖及口服葡萄糖耐量试验(Oral Glucose Tolerance Tests,OGTT)测定 每周记录1次小鼠空腹血糖值和体质量数据。第8周进行OGTT,禁食10 h后,每只小鼠灌胃葡萄糖溶液(2 g/kg),于0 min、30 min、60 min、120 min测定小鼠的血糖值,并计算糖耐量曲线下面积(Area Under the Curve,AUC)。
1.2.3.2 器官指数测定 解剖时分别称取各小鼠完整肝脏和肾脏并称重,分别计算肝体比和肾体比。器官指数=器官质量/体质量。
1.2.3.3 生化指标测定 在第8周,收集并记录小鼠24 h尿量。按试剂盒说明书测定血清中血尿素氮(Blood Urea Nitrogen,BUN)、谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)、谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)、血清白蛋白(Albumin,ALB)、总胆红素(Total Bilirubin,T-Bil)和直接胆红素(Direct Bilirubin,D-Bil)、间接胆红素(Indirect Bilirubin,I-Bil)的水平并计算白蛋白-胆红素(Albumin-Bilirubin,ALBI)值。
ALBI=0.66×log10(T-Bil-0.085×ALB)。
1.2.3.4 血液与肝脏中维生素B12、叶酸和同型半胱氨酸水平测定 于冰水浴条件下,精确称取小鼠肝脏组织0.5 g,加入9倍量的生理盐水,制备成10%的匀浆液,3 000 r/min条件下离心10 min(离心半径5 cm),取上清液待测,室温平衡30 min后,依据试剂盒说明书测定肝脏和血液中维生素B12、叶酸和同型半胱氨酸水平。
1.2.3.5 肝脏和视网膜病理学检查 利用苏木精-伊红(Hematoxylin Eosin,HE)染色法观察小鼠肝脏和视网膜损伤情况。取适量肝组织,先在4%多聚甲醛中固定48 h,用从低浓度到高浓度的乙醇将其脱水,二甲苯透明后进行浸蜡包埋切片。得到的切片再进行二甲苯脱蜡脱苯、HE染色、乙醇洗脱、二甲苯透明、中性树胶封片等流程,使用200倍光学显微镜观察小鼠视网膜和肝组织病理学变化。采用半定量分级评分方法对小鼠组织受损情况进行评估,评分标准如下:0分,无脂肪变性及炎症坏死;1分,轻度性脂肪变性及炎症坏死;2分,中度性脂肪变性及炎症坏死;3分,重度性脂肪变性及炎症坏死。
1.2.3.6 测定糖尿病小鼠肝脏中胆汁酸水平 肝脏样本的采集和前处理:精密称取肝脏样品0.5 g,粉碎后加入低温乙腈,涡旋振荡1 min后,转速离心10 min(4 ℃,3 000 r/min,离心半径5 cm),取上清液,氮气吹干,残渣用100 μL 60%甲醇水复溶,涡旋振荡1 min后,同条件离心10 min,取上清液待测。1)色谱分析条件:色谱柱为UPLC BEH C18(2.1 mm×50 mm,1.7 μm),流动相水相为0.1%甲酸水,有机相为甲醇,梯度洗脱(0~6 min,80%~60%B;6~10 min,60%~50%B;10~15 min,50%~40%B;15~18 min,40%~30%B;18~20 min,30%~80%B),流速0.2 mL/min,柱温28 ℃,样品室温度4 ℃。进样量为5 μL。2)质谱分析条件:配制混标溶液[含牛磺鹅去氧胆酸(Taurochenodeoxycholic Acid,TCDCA)、牛磺胆酸(Taurocholic Acid,TCA)、熊去氧胆酸(Ursodeoxycholic Acid,UDCA)、胆酸(Cholic Acid,CA)、牛磺猪去氧胆酸(Tauroursodeoxycholic Acid,THDCA)、牛磺熊去氧胆酸(Tauroursodesoxycholic Acid,TUDCA)、猪去氧胆酸(Hyodesoxycholic Acid,HDCA)、鹅去氧胆酸(Chenodeoxycholic Acid,CDCA)、石胆酸(Lithocholic Acid,LCA)、去氧胆酸(Deoxycholic Acid,DCA)、甘氨石胆酸(Glycolithocholic Acid,GLCA)和甘氨胆酸(Glycocholic Acid,GCA)各0.78 mg/L、1.21 mg/L、0.165 mg/L、0.06 mg/L、0.086 mg/L、0.02 mg/L、0.06 mg/L、0.056 mg/L、0.019 mg/L、0.028 mg/L、0.014 mg/L、0.048 mg/L]采用针泵进样,用负离子模式对胆汁酸标准品进行扫描,确定标准品的母离子、子离子,定量离子及定性离子、去簇电压(Declustering Potential,DP)、碰撞电压(Collision Potential,CE)、入口电压(Exit Potential,EP)及出口电压(Cell Exit Potential,CXP)参数。优化离子源参数,使各标准品的离子化效率和样品丰度达到最佳。
1.3 统计学方法 生化指标采用Graphpad Prism 6.0软件进行作图,并采用SPSS 24.0统计软件进行ANOVA分析,以P<0.05为差异有统计学意义;超高效液相色谱法-三重四极杆-线性离子阱质谱(Ultra-performance Liquid chromatography-quadrupole Linear Ion Trap Mass Spectrometry,UPLC-QTRAP-MS/MS)所采集到的原始数据通过Analyst 1.6.2软件进行积分和定量分析,随后使用SIMCA-P软件对各组液质实验数据采取偏最小二乘法判别分析法进行统计分析。为了探究梓醇对糖尿病小鼠肝脏代谢谱中各胆汁酸的影响,对12种胆汁酸的水平进行测定,并对其进行主成分分析和模型的排列阵列分析。
2 结果
2.1 梓醇对db/db糖尿病小鼠体质量、血糖及糖耐量的调节作用 在高糖高脂饲料的诱导下,db/db小鼠出现体质量增加和血糖升高的变化,同时伴随着多食、多饮、多尿、嗜睡。见图1A。各组实验小鼠的体质量均有显著增加。其中,正常组小鼠体质量显著低于db/db小鼠,差异有统计学意义(P<0.05),梓醇高剂量组小鼠体质量明显低于模型组(P<0.05),梓醇在一定程度上控制db/db小鼠的体质量。同时也观察到,高脂高糖饲喂1周后,观察组db/db小鼠空腹血糖均值升至10 mmol/L以上,造模成功。见图1B。给药2周内,模型组血糖增加迅速,升至25 mmol/L以上,而从给药第3周开始,各组小鼠血糖水平进入平台期,且与模型组比较,各给药组的血糖水平均显著低于模型组(均P<0.05),其中梓醇高剂量组小鼠的血糖水平低于阳性药组小鼠。正常组的糖耐量值显著低于模型组(P<0.01);其余各组血糖值在葡萄糖负荷30 min内达到峰值,其中梓醇高剂量组的血糖峰值略低于阳性药组,为(10.04±1.93)mmol/L;梓醇中剂量组、梓醇低剂量组的AUC分别减少了41.25%和25.90%,梓醇在一定程度上能够提高糖尿病小鼠的葡萄糖耐受能力。见表1。

图1 梓醇对db/db糖尿病小鼠体质量(A) 及血糖(B)的影响
2.2 梓醇对db/db 2型糖尿病小鼠肝肾损伤的调节作用 模型组肝体比显著高于正常组且肾体比显著小于正常组(P<0.05);梓醇各剂量组能降低糖尿病小鼠肝体比且更接近正常组水平,但对肾体比的干预作用不明显,梓醇能有效改善由糖尿病导致的肝脏肥大(P<0.05)。见图2。

图2 梓醇对db/db糖尿病小鼠肾体比(A)和肝体比(B)的调节作用
正常组小鼠的肝细胞紧密,细胞以中央静脉为中心呈放射状排列且大小均一,细胞无坏死及浸润,肝窦清晰可见。而模型组小鼠的肝细胞形态不规则,细胞肿胀变性,炎症细胞浸润,有严重坏死,细胞核形态不规则,大小不一,肝窦消失,肝小叶结构轮廓消失,肝索结构破坏。见图3。梓醇各剂量组的小鼠肝细胞相比于模型组有改善,细胞内脂肪空泡化有明显减轻。梓醇能改善糖尿病小鼠的肝脏受损情况(P<0.05)。

图3 梓醇对db/db糖尿病小鼠肝病理的影响(HE染色,×200)
模型组血清中GOT、GPT、血清白蛋白、I-Bil、T-Bil和D-Bil的水平与正常组比较偏高,差异有统计学意义(P<0.05)。而与模型组比较,各梓醇各剂量组均能降低糖尿病小鼠血清中GOT、GPT、I-Bil、T-Bil、D-Bil和GSH的水平,其中梓醇高剂量组表现最佳,差异有统计学意义(P<0.05)。而阳性药组二甲双胍对肝酶及胆红素调节作用不明显,差异无统计学意义(P>0.05)。见图4。
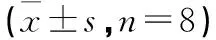
表1 梓醇对db/db小鼠葡萄糖耐受能力的调节作用

图4 梓醇对db/db糖尿病小鼠肝功能的调节作用
2.3 梓醇对2型糖尿病小鼠周围神经病变的影响 模型组血清中和肝脏内维生素B12、叶酸与同型半胱氨酸水平与正常组比较明显偏低。梓醇高剂量组和梓醇中剂量组能显著提高血清和肝脏内的维生素B12水平,差异有统计学意义(P<0.01,P<0.05);梓醇各剂量组小鼠均能提高肝脏和血清中叶酸水平,其中梓醇中剂量组表现良好;而梓醇各剂量组小鼠对血清与肝脏中的同型半胱氨酸水平影响较小。见图5。

图5 梓醇对db/db糖尿病小鼠周围神经病变的调节作用
2.4 视网膜病理学检查 正常组小鼠的视网膜组织结构清晰,各层细胞排列整齐,毛细管无扩张充血;模型组小鼠视网膜组织排列紊乱,细胞肿胀,数目减少,毛细管扩张充血;而经梓醇干预后的小鼠视网膜损伤得到不同程度的改善,特别是梓醇低剂量组的视网膜组织结构清晰,较少细胞肿胀,毛细管扩张充血现象较少。梓醇能改善db/db糖尿病小鼠的视网膜损伤。见图6。

图6 梓醇对db/db糖尿病小鼠视网膜病理的影响(HE染色,×200)
2.5 梓醇对db/db 2型糖尿病小鼠肝脏胆汁酸水平的影响
2.5.1 质谱母离子、子离子及其条件 在负离子模式下,对12种胆汁酸的定量离子对、去簇电压、入口电压、碰撞电压和出口电压等质谱参数进行测定。见表2。根据表2数据对小鼠肝脏的12种胆汁酸进行定量分析。

表2 12种胆汁酸的MS分析参数
2.5.2 方法学考察结果 1)线性关系及回归方程:分别精密称取牛磺胆酸、熊去氧胆酸和牛磺鹅去氧胆酸2.42 mg、0.33 mg和1.56 mg,溶解于2 mL色谱甲醇中;精密称取牛磺猪去氧胆酸、牛磺熊去氧胆酸、胆酸、猪去氧胆酸和鹅去氧胆酸各0.43 mg、0.10 mg、0.30 mg、0.30 mg和0.28 mg,溶解于5 mL色谱甲醇中;精密称取石胆酸、脱氧胆酸、甘氨胆酸和甘氨石胆酸各0.19 mg、0.28 mg、0.48 mg和0.14 mg,溶解于10 mL甲醇中。采用二倍稀释法配置成不同浓度的混标母液,以峰面积(Y)相对于浓度(X)制作标准溶液工作曲线。绘制并计算得到该方法的标准曲线、线性范围及相关系数,可以发现该方法的线性良好,相关系数较高,方法可行性良好。见表3。

表3 12种胆汁酸标准品的线性范围、相关系数、线性方程考察结果
2)加标回收率:将已经前处理的肝脏样品,加入混标溶液5 mL,测定加标回收率,生物样品的加标回收率一般要求在80%~120%。所测定的各胆汁酸标准品的平均加标回收率在90.44%~116.02%,符合要求。见表4。

表4 12种胆汁酸的平均加标回收率及相对标准偏差(%)
3)48 h稳定性及精密度:取配置好的各胆汁酸混标溶液于室温中放置1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h和48 h,按照1.2.3.6项的方法测定各胆汁酸水平并计算相对标准偏差值,一般生物样品精密度要求在80%~120%,所测得的各标品精密度的相对标准偏差在2.27%~17.42%,符合要求。见表5。

表5 12种胆汁酸的精密度与48 h稳定性及48 h稳定性相对标准偏差(%)
2.5.3 梓醇对db/db小鼠肝脏中胆汁酸水平的影响 R2和Q2的数值较为接近,说明模型解释能力尚可。见图7。主成分分析结果可知,各组小鼠肝脏胆汁酸谱界限分明,其中梓醇中剂量组的胆汁酸谱相较于阳性药组更接近于正常组,梓醇中剂量组能改善db/db糖尿病小鼠肝脏中的胆汁酸代谢,有益于糖尿病的调节及其并发症的改善。见图8。

图7 肝脏提取物代谢成分的排列阵列

图8 肝脏提取物代谢成分的主成分分析
db/db小鼠肝脏的各胆汁酸水平相较于正常小鼠发生了显著变化。与正常小鼠不同的是,模型小鼠肝脏中游离型胆汁酸如胆酸和熊去氧胆酸的水平显著上升(P<0.05)。结合型胆汁酸如甘氨石胆酸和甘氨胆酸的水平上升显著(P<0.05);牛磺结合型胆汁酸如牛磺熊去氧胆酸、牛磺猪去氧胆酸和牛磺胆酸的水平几乎无变化,高血糖状态会影响小鼠肝脏胆汁酸代谢且显著改变其肝脏胆汁酸组成,二者关系密切。各给药组药物干预8周后,肝脏胆汁酸也发生变化。首先,梓醇与二甲双胍均能降低糖尿病小鼠肝脏中游离胆汁酸(胆酸、熊去氧胆酸)和结合型胆汁酸的水平(甘氨石胆酸、甘氨胆酸),提高鹅去氧胆酸与去氧胆酸的水平。中剂量梓醇表现更佳,不仅升高了小鼠肝脏中的去氧胆酸(P<0.05)和石胆酸水平(P<0.01),还能显著降低糖尿病小鼠肝脏中胆酸(P<0.001)、甘氨胆酸和甘氨石胆酸水平(P<0.05),使得糖尿病小鼠中的肝脏各胆汁酸含水平趋向正常小鼠。梓醇可能通过调节糖尿病小鼠肝脏中的各胆汁酸水平,从而起到一定改善糖尿病的作用。见图9~10。

图9 各组db/db糖尿病小鼠肝脏游离型胆汁酸水平比较

图10 各组db/db糖尿病小鼠肝脏中结合型胆汁酸水平比较
3 讨论
由于缺乏瘦素受体基因,db/db小鼠易在高糖高脂的饲养条件下诱导2型糖尿病且与人罹患糖尿病的进程较为相似,现已成为国际上认可的探究人2型糖尿病及其并发症的动物模型。在评估机体肝损伤情况时,临床上常通过检测机体血清中的GPT、GOT、血清白蛋白、T-Bil、D-Bil、I-Bil和ALBI值来表征[7-10],其中ALBI值常用来评估早期肝脏损伤程度。本研究建立的模型小鼠可自发发生2型糖尿病,为探究梓醇治疗糖尿病及其并发症提供了研究基础。结合上述测定的各项生化指标和组织病理切片结果可以得知,梓醇不仅有效控制db/db小鼠的体质量和血糖,还能改善其糖耐受能力,有效调节糖尿病小鼠的糖代谢紊乱。除了显著降血糖作用,梓醇在改善糖尿病并发症方面发挥了良好的药效:不仅可以显著降低血清中GPT、GOT、T-Bil、I-Bil、D-Bil和GSH水平,还能降低小鼠肝体比、肾体比指数,减少脂肪在肝脏的堆积,从而改善肝损伤,在一定程度上保证了肝脏的正常功能。除此之外,梓醇能显著提高2型糖尿病小鼠肝脏中维生素B12和叶酸水平,降低由糖尿病导致的周围神经病变。
胆汁酸作为一种在肝脏中合成的重要代谢产物,通过肝肠循环参与机体的胆固醇代谢,从而保证机体脂质代谢的正常运行。进食时,胆汁酸随着胆汁进入肠道,经肠道及其微生物作用有95%的胆盐可被重吸收经门静脉入肝,小部分进入外围循环,以此来维持胆盐池的稳定[11]。现在越来越多的研究证实胆汁酸能通过激活多种细胞核受体和膜受体介导的信号通路,参与调节多种代谢过程,是一种代谢稳态的关键调节剂。胆汁酸除了在脂质代谢发挥的不可忽视的作用,如促进食物中脂类成分的消化吸收,还能参与葡萄糖代谢[3,12]。胆汁酸能影响肠道激素的合成与分泌,从而调节糖代谢。胆汁酸激活胰腺B细胞中的法尼醇X受体,上调成纤维细胞生长因子19,活化G蛋白偶联胆汁酸受体5,以及促进肠道L细胞中胰高血糖素样肽-1的分泌,改善db/db小鼠胰岛素抵抗,从而维持葡萄糖代谢平衡[13-14]。研究发现糖尿病患者体内胆汁酸代谢紊乱,可能是由于胆汁酸能够促进胆汁形成和膳食脂质吸收,而糖脂代谢的紊乱超出了胆汁酸调节能力导致[15]。另有研究表明,法尼酯X受体在维持葡萄糖稳态具有一定作用,可能是由于胆汁酸激活了法尼酯X受体,从而实现对胆汁酸和脂质代谢的调节,起到改善糖尿病及其肝脏并发症的作用[16-18]。同样,在大量的实验动物及人体实验中也发现,使用胆汁酸结合剂后胆汁酸的肠肝循环受到干扰,血浆中胆固醇水平降低,胆汁酸调节作用受到一定抑制,法尼酯X受体激活也受到了抑制,证实法尼酯X受体在胆汁酸和糖代谢之间的桥梁作用[14,19-20]。除此之外,在一些降脂研究中也发现,胆汁酸结合剂,如考来烯胺散(消胆胺)、考来替兰和盐酸考来维仑[21],不仅能降低血浆胆固醇水平,还能降低血糖和糖化血红蛋白的水平,说明一些胆汁酸结合剂具有治疗2型糖尿病及其肝脏并发症的潜力[17]。为了进一步探究梓醇降糖和改善糖尿病发症的机制,对db/db小鼠肝脏提取物中12种胆汁酸进行定量分析,并对其变化情况进行分析。梓醇干预后的糖尿病小鼠肝脏胆汁酸谱发生显著变化,下调甘氨结合型胆汁酸(甘氨胆酸、甘氨石胆酸)和游离型胆汁酸石胆酸、去氧胆酸与鹅去氧胆酸水平,上调游离型胆汁酸中胆酸与熊去氧胆酸水平。梓醇干预后糖尿病小鼠的胆汁酸谱情况趋向正常组而与模型小鼠相反,说明梓醇不仅能降低血糖水平,能通过调节肝脏中胆汁酸水平,调节糖尿病小鼠的糖脂代谢紊乱,从而起到降低血糖、提高糖耐受能力和改善其肝损伤等并发症的作用。
地黄是一个具有重要药用价值和经济效益的药用植物[22]。本研究探究了地黄中有效成分梓醇的降糖机制,并观察了梓醇在改善2型糖尿病肝脏及视网膜损伤方面和调节肝脏胆汁酸方面的作用,发现梓醇能够通过调节肝脏胆汁酸代谢发挥降糖和改善糖尿病并发症的药效活性,为地黄治疗糖尿病及其并发症提供了理论依据。
