卵巢生殖细胞肿瘤诊治的中国专家共识(2022年版)△
2022-12-06中国优生科学协会肿瘤生殖学分会中国医师协会微无创医学专业委员会妇科肿瘤学组中国医院协会妇产医院分会妇科肿瘤专业学组广西医学会妇产科学分会
中国优生科学协会肿瘤生殖学分会,中国医师协会微无创医学专业委员会妇科肿瘤学组,中国医院协会妇产医院分会妇科肿瘤专业学组,广西医学会妇产科学分会
卵巢生殖细胞肿瘤(ovarian germ cell tumor,OGCT)是一组起源于卵巢生殖细胞的肿瘤,占卵巢肿瘤的15%~20%,其中5%为恶性OGCT(malignancy OGCT,MOGCT)[1-3],主要发生于青少年与年轻女性(adolescent and young adult,AYA)[1-3]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)将AYA定义为初次诊断时15~39岁的群体[4],OGCT最常见的发病年龄为16~20岁,因此,OGCT可视为青少年妇科肿瘤。国外的数据显示,69.7%的MOGCT患者在初次诊断时为Ⅰ期,Ⅱ、Ⅲ、Ⅳ期分别占7.5%、18.2%和4.6%[5]。中国的临床数据显示,Ⅰ期MOGCT患者占31.4%~52.1%,其中52.1%的卵黄囊瘤患者在初次诊断时为Ⅰ期,5.3%、35.1%和7.4%的卵黄囊瘤患者初次诊断时分别为Ⅱ、Ⅲ、Ⅳ期[6]。MOGCT患者的生存结局与年龄、疾病分期、手术是否能够完整切除肿瘤、组织学类型、肿瘤标志物[甲胎蛋白(α-fetoprotein,AFP)和β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)等]下降程度、有无性腺发育不良等有关[7-11]。初潮前及45岁以上的患者预后较差,国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期与无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)显著相关[12]。以铂类为基础的联合化疗可使MOGCT患者的生存率得以明显提高[13-14]。鉴于OGCT亚型复杂,临床诊治差异较大,目前缺乏针对性的临床诊治指南或共识,中国优生科学协会肿瘤生殖学分会、中国医师协会微无创医学专业委员会妇科肿瘤学组、中国医院协会妇产医院分会妇科肿瘤专业学组、广西医学会妇产科学分会联合制定本共识,以期为OGCT的规范化诊疗提供有益借鉴。本共识推荐级别及其代表意义,见表1。

表1 本共识推荐级别及其代表意义
1 病理组织学分类
2020年第五版《WHO女性生殖器官肿瘤分类》中,良性OGCT包括成熟畸胎瘤、单胚层囊性畸胎瘤及良性卵巢甲状腺肿,MOGCT包括未成熟畸胎瘤、无性细胞瘤、卵黄囊瘤、胚胎性癌、非妊娠性绒毛膜癌和混合性生殖细胞肿瘤等[15],以成熟畸胎瘤最为常见,无性细胞瘤、未成熟畸胎瘤、卵黄囊瘤和混合性生殖细胞肿瘤次之,其他类型罕见[16]。OGCT的组织学分型及相应的特异性免疫组化指标,详见表2。

表2 OGCT的组织学分型及相应的特异性免疫组化指标
1.1 畸胎瘤
1.1.1 成熟畸胎瘤 成熟畸胎瘤是最常见的OGCT,占所有卵巢肿瘤的10%~20%、青春期前卵巢肿瘤的90%、20岁以下卵巢肿瘤的60%[17]。肿瘤成分较为复杂,至少有两个胚层的成熟组织(外胚层、中胚层和/或内胚层),内含毛发、骨骼、牙齿、头皮等结构。外胚层衍生物包括鳞状上皮和皮肤附件结构以及神经外胚层(胶质细胞、室管膜和小脑);中胚层衍生物包括脂肪、骨骼、软骨和平滑肌;常见的内胚层衍生物包括胃肠道及支气管上皮、甲状腺和唾液腺,罕见垂体、肾上腺、甲状旁腺组织和前列腺等衍生物。任一胚层成分都可能恶变,恶变率为2%~4%,以鳞状细胞癌最为多见,其次为腺癌和类癌,常发生在增厚囊壁的头节附近[18]。
1.1.2 未成熟畸胎瘤 未成熟畸胎瘤占卵巢畸胎瘤的1%~3%,由2~3个胚层(中外胚层为主)组成,包含不成熟组织。未成熟组织主要是神经上皮组织,镜下见原始神经管,也可能存在有丝分裂活跃的神经胶质细胞,与成熟的外胚层或内胚层组织共存。根据未成熟神经上皮组织占比,组织学分级分为G1~G3级,组织学分级能够指导治疗决策和预后判定[19]。未成熟畸胎瘤的复发和转移与所含神经上皮的数量和未成熟程度直接相关[20]。未成熟畸胎瘤不含卵黄囊瘤成分,否则归类为混合性生殖细胞肿瘤。早期卵巢未成熟畸胎瘤患者的5年生存率可达100%,晚期患者可达75%[21]。
1.2 无性细胞瘤
无性细胞瘤是原始生殖细胞异常增生形成的中低度恶性肿瘤,占所有卵巢恶性肿瘤的1%~3%[22],占MOGCT的33%~45%,是MOGCT最常见的亚型[23-24]。镜下见均匀圆形的原始生殖细胞,细胞质透明,核大,呈巢状或索状排列,八聚体结合转录因 子 4(octamer-binding transcription factor 4,OCT4)或婆罗双树样基因4(spalt like transcription factor 4,SALL4)、细胞表面分化抗原 117(cluster of differentiation 117,CD117)和/或平足蛋白(podoplanin,D2-40)免疫组化染色可协助确诊。无性细胞瘤患者对化疗敏感,预后好,总生存率>90%[25]。80%的无性细胞瘤可见12号染色体异常(等臂12p),30%~50%的无性细胞瘤存在KIT突变(外显子17,密码子816)[26]。
1.3 卵黄囊瘤
卵黄囊瘤又称内胚窦瘤,是一种原始生殖细胞肿瘤,恶性程度高,约占卵巢恶性肿瘤的1%和MOGCT的20%,发病率仅次于无性细胞瘤[27],常见于儿童及年轻女性,80%的患者年龄<30岁,是2岁以下婴幼儿最常见的MOGCT[6],容易早期转移,对化疗高度敏感。病理表现为多种内胚层(如原肠、间充质和次级卵黄囊)及其衍生物(肠、肝、肺)的分化,镜下最常见的是网状/微囊型,其他病理形态包括内胚层窦型(Schiller-Duval小体)和腺型(子宫内膜样型)等。其发生可能与基因突变、染色体变异、表观遗传学及环境因素有关,约75%的患者存在12号染色体异常,多为等臂12p[24,28-30]。
1.4 混合性MOGCT
混合性MOGCT由两种或两种以上恶性生殖细胞组成,占MOGCT的10%~20%,约93.8%的混合性MOGCT中含有卵黄囊成分,9.4%含有胚胎性癌,6.3%含有非妊娠性绒毛膜癌,混合组织类型以卵黄囊瘤和未成熟畸胎瘤、卵黄囊瘤和无性细胞瘤最常见[6,31-33]。临床特点及治疗参考主要成分,预后较单纯MOGCT差。
1.5 其他罕见MOGCT
胚胎性癌为原始生殖细胞肿瘤,单纯胚胎性癌少见,主要与其他恶性生殖细胞成分(卵黄囊瘤和畸胎瘤等)混合存在,归为混合性生殖细胞肿瘤。镜下表现为单形性到多形性的肿瘤细胞以实性、巢状、腺状和乳头状结构混合,排列多样。具有多种分化潜能,恶性程度高,预后差,但对化疗敏感。
非妊娠性绒毛膜癌是生殖细胞源性恶性肿瘤,单纯性非妊娠性绒毛膜癌的病理形态与妊娠性绒毛膜癌相同,由细胞滋养细胞和合体滋养细胞组成,大部分非妊娠性绒毛膜癌是混合性生殖细胞肿瘤的组成部分。淋巴结转移和腹腔内扩散概率高于妊娠性绒毛膜癌,易早期血行转移,恶性程度极高,预后极差。
推荐意见:OGCT亚型分类复杂,各种成分常有不同程度的混合。畸胎瘤中恶变的胚层成分和混合性MOGCT中的主要成分与临床预后密切相关,推荐在诊断报告中具体列出肿瘤成分及比例,协助制订治疗方案。(推荐级别:1类)
2 OGCT的诊断
2.1 临床表现
60%以上的成熟畸胎瘤可无任何临床症状,仅在体检时发现[34-35],也可表现为与盆腔包块相关的一系列症状,如腹痛、腹胀等,多为单侧,10%~20%为双侧[36],部分畸胎瘤与抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)有关的自身免疫性脑炎有关,其中约63%为成熟畸胎瘤,23%为未成熟畸胎瘤[38]。部分畸胎瘤可能与视神经阵挛-肌阵挛综合征、少年皮肌炎样综合征以及血清阴性关节炎有关[37-38]。
MOGCT的生长较为迅速,大多数患者在疾病早期即有相应临床症状。约70%的MGOCT患者以腹痛和腹部肿块为主要症状,腹胀(15%)、发热(10%)以及阴道异常出血(5%~10%)次之,部分患者表现为月经不调。少部分患者可因肿瘤破裂、出血或蒂扭转等急腹症就诊[39-40]。绝大多数为单侧病变,双侧仅占5.5%,多见于无性细胞瘤[41]。
2.2 影像学检查
2.2.1 超声 成熟畸胎瘤超声表现为囊性或以囊性为主的囊实性包块,内含比例不等的液性和实体成分,液性无回声区内有明显强光点或光团,有时可见脂液分层。
MOGCT的超声表现异质性大,未成熟畸胎瘤常为实性包块,一般体积较大,呈实质性或混合性回声,内含丰富的血流信号,常伴有腹腔积液。有时卵黄囊瘤的超声血流信号不明显,易误判为良性[42]。胚胎性癌、非妊娠性绒毛膜癌以及混合性生殖细胞肿瘤超声表现为单侧巨大实性或囊实性肿瘤,回声不均匀,常有弥散性不规则囊性区,大部分具有丰富的血流信号,部分伴囊壁的乳头状突起[1]。
2.2.2 CT 大部分成熟畸胎瘤的CT成像为混杂密度肿块,内有脂肪性密度或信号。钙化灶、牙齿或骨组织可以协助CT诊断,伴有成熟畸胎瘤成分的混合性生殖细胞肿瘤的CT成像可见脂肪和钙化[43]。瘤内出现直径>5 cm的实性结节,明显强化,囊壁呈钝角相交,囊外生长,周围器官间的脂肪层消失等,均为成熟畸胎瘤恶变的征象。
未成熟畸胎瘤在CT上表现为单发、体积较大、不规则或分叶状实性肿块,几乎均可见多发散在钙化和脂质,盘曲的带状略低密度影是其特征性CT征象;无性细胞瘤多为包膜完整的实质性肿块,边缘光滑,少数有囊性变,增强CT提示瘤内有明显强化;卵黄囊瘤一般边界清晰,囊性成分随肿瘤体积的增大而增多,可与周围组织粘连,亦可侵犯邻近器官,实质成分中可见较多高低密度相间的片状模糊影,增强CT显示瘤体内有迂曲的血管影;卵黄囊瘤或以卵黄囊瘤为主的混合性生殖细胞肿瘤在增强CT上显示亮点征。
2.2.3 MRI大部分MOGCT表现为实质性或以实质性为主,实质成分增强后明显强化。MRI较CT更能明确肿瘤浸润范围及与重要血管神经的毗邻关系。当实质成分伴有不同程度的坏死囊变,增强MRI表现为明显的纤维间隔,间隔可见迂曲血管,动脉期可表现为细线样强化。无性细胞瘤的增强MRI多表现为多发瘤巢和存在中央血管[44],肿块内多发纤维血管间隔将肿块分隔为多发结节状,增强MRI上可见纤维血管间隔明显强化。对于血管丰富的卵黄囊瘤,肿瘤内部在MRI的T2加权成像(T2 weighted image,T2WI)序列上可见明显的信号流空征象[45]。
2.2.4 其他影像学检查方法 正电子发射体层成像(positron emission tomography,PET)/CT 鉴 别OGCT良恶性的准确度和阴性预测值均较低[46]。目前尚无使用PET/CT辅助OGCT初步诊断的证据,更多用于监测治疗反应。
对于疑似MOGCT的患者,术前影像学检查除腹部和盆腔超声外,还应完善胸部CT以及腹部和盆腔MRI或CT。对于未行MRI或CT且已接受手术的患者,应在手术后尽快补充影像学检查以免遗漏其他部位的病变。
2.3 实验室检查
2.3.1 糖类抗原19-9(carbohydrate antigen19-9,CA19-9) 成熟畸胎瘤的构成成分较为复杂,目前尚缺乏特异性血清学肿瘤标志物。但以往研究提示卵巢成熟畸胎瘤患者中CA19-9有着较高的阳性率,且肿瘤大小、有无合并症也与CA19-9水平有着一定程度的关联[47]。
2.3.2 AFP AFP是一种糖蛋白,主要由胎儿肝细胞及卵黄囊合成,成人血清中含量极低,正常参考值<25 μg/L,急慢性肝炎、肝硬化等良性肝病患者或妊娠期女性的血清AFP水平有不同程度的升高,但大多低于1000 μg/L。而在MOGCT(如卵黄囊瘤、胚胎性癌和混合性肿瘤)中,AFP水平明显升高,通常大于1000 μg/L,尤其是单纯卵黄囊瘤患者,AFP水平可达10 000 μg/L及以上[48-50]。AFP对未成熟畸胎瘤、混合性无性细胞瘤及部分胚胎性癌混有卵黄囊成分的患者也具有诊断意义,约1/3的未成熟畸胎瘤可产生AFP,多数无性细胞瘤患者的AFP正常[51]。
2.3.3 β-HCG β-HCG由滋养细胞产生,是卵巢绒癌和含绒癌成分的生殖细胞肿瘤的标志物,所有绒毛膜癌、胚胎性癌以及某些无性细胞瘤可产生β-HCG,非妊娠性绒毛膜癌与异常升高的β-HCG有关[52]。无性细胞瘤患者的β-HCG轻度升高,提示内含多核滋养细胞巨细胞。成熟畸胎瘤、未成熟畸胎瘤及胚胎性癌极少见β-HCG轻度升高。
2.3.4 乳酸脱氢酶(lactic acid dehydrogenase,LDH) LDH可能在MOGCT患者中升高,特别是无性细胞瘤患者,无性细胞瘤可以分泌LDH,瘤体越大,LDH水平越高,可达健康人的10~15倍[53]。高水平的血清LDH与更广泛的疾病和较差的预后相关[54-56]。早期无性细胞瘤患者的血清LDH水平与晚期和复发患者之间无统计学差异,提示LDH水平升高与无性细胞瘤具有一定的相关性,但不代表疾病的严重程度,可作为辅助诊断的肿瘤标志物,但不能作为疾病预后的预测指标[57]。LDH在部分胚胎性癌和卵黄囊瘤患者中也有可能升高。
2.3.5 染色体核型分析 无性细胞瘤罕见于青春期前,大多发生在46,XY单纯性腺发育不良的患者(如Swyer综合征)中。性腺发育不全者的性腺多有性母细胞瘤,性母细胞瘤约有50%发展为卵巢恶性肿瘤的风险[6,58]。若病史和体格检查提示可能存在性腺发育不良,或实验室检查提示抗米勒管激素低,则应在术前进行染色体核型检查,此类患者可能伴有12号同位染色体畸变(等臂12p)[52]。
推荐意见:OGCT的临床表现多无特异性,辅助诊断包括影像学及血清学检查等。对于疑似MOGCT的患者,术前影像学检查包括腹部和盆腔超声、胸部CT及上腹部和盆腔MRI或CT,未接受全面分期手术者,推荐术后补充影像学检查以免遗漏其他部位的病变或转移。MOCGT的血清学标志物包括AFP、LDH和β-HCG等,可协助疾病的诊断及监测。(推荐级别:2A类)
3 分期
迄今MOGCT尚无独立的分期系统,鉴于组织的同源性,本共识建议依据2014年FIGO修订的卵巢癌手术病理学分期,对MOGCT进行分期(表3)。儿童MOGCT分期借鉴儿童肿瘤学组(Children’s Oncology Group,COG)的分期标准[5(9]表4)。

表3 卵巢癌—输卵管癌—原发性腹膜癌的FIGO分期标准(2014年)

表4 儿童MOGCT分期借鉴COG分期标准
4 良性OGCT的手术治疗
良性OGCT中最常见的亚型为成熟畸胎瘤,最主要的治疗方法是手术治疗,多数患者可采取肿瘤剥除术或患侧输卵管卵巢切除术达到治愈。腹腔镜手术创伤小、术后恢复快、并发症少,为育龄期卵巢成熟性畸胎瘤的首选治疗方法[60]。手术过程中要严格遵守无瘤防御原则,避免肿瘤内容物溢出,降低病灶种植和复发风险[61-62]。
手术治疗决策按年龄分层管理。对于青少年及育龄期女性,主张保留卵巢功能。若术前影像学提示包膜完整,与周围组织界限清,无恶变倾向,首选肿瘤剥除术,根据快速冰冻病理结果决定是否保留患侧附件。若有强烈的意愿切除患侧卵巢,则行患侧卵巢输卵管切除术[63]。绝经期或卵巢内有多发囊肿、肿瘤体积较大的围绝经期患者,推荐患侧附件切除术及对侧输卵管切除术;有保留卵巢的强烈意愿者,需有明确的快速冰冻病理排除恶性可能。强调临床决策个体化,对于围绝经期或绝经后患者,若具有切除子宫的指征及需求,也可行全子宫加双侧输卵管卵巢切除术[64]。
推荐意见:良性OGCT的手术治疗根据年龄及快速冰冻病理结果分层决策,推荐青少年及育龄期年轻女性行肿瘤剥除术(推荐级别:1类)。绝经期及卵巢内有多个囊肿或肿瘤体积较大的围绝经期患者,推荐患侧附件切除术及对侧输卵管切除术,若具有切除子宫的指征及需求,也可行全子宫及双侧输卵管卵巢切除术。推荐尽可能行双侧卵巢切除术(推荐级别:2A类)。
5 MOGCT的手术治疗
5.1 初次手术
5.1.1 保留生育功能手术(fertility-sparing surgery,FSS ) 参见本团队制定的《卵巢恶性肿瘤保留生育功能的中国专家共识(2022年版)》[65]。
5.1.2 早期患者全面分期手术 早期MOGCT全面分期手术包括:腹腔冲洗液或腹腔积液细胞学检查、可疑病变多点活检、盆腔淋巴结清扫术、大网膜切除术、双侧卵巢输卵管切除术以及子宫切除术。但MOGCT全面分期手术的必要性和范围仍有争议[22]。Billmire等[66]对儿童MOGCT的一项研究发现,未施行全面分期手术对患儿的生存率无不良影响。该研究显示,全面分期手术中最常省略的是双侧淋巴结活检(97%)、对侧卵巢活检(59%)和网膜切除术(36%)。本共识推荐全面分期手术原则:①收集腹腔冲洗液或腹腔积液进行细胞学检查;②全面探查腹膜并切除可疑病变,若全面探查腹膜未见异常可行腹膜随机活检;③大网膜切除术,特别推荐切除粘连或异常网膜;④患侧附件切除术。
MOGCT患者首次手术时系统性盆腔和腹主动脉旁淋巴结清扫存有争议。Kumar等[67]研究报道,28%的无性细胞瘤和24%的非无性细胞瘤合并淋巴结转移,淋巴结转移是预后不良的独立预测因子,因此主张淋巴结切除术。但监测、流行病学和最终结果(surveillance,epidemiology,and end results,SEER)数据库的多因素分析显示,淋巴结清扫术和淋巴结转移均不影响MOGCT患者的总体生存率[68]。早期患者行系统性淋巴结清扫只能明确分期,但不改善预后[66]。大多数未经全面分期手术术后复发的患者,不考虑初始手术分期的程度,都有较好的肿瘤结局[69]。因此,本共识推荐早期MOGCT全面分期手术,可不行系统性淋巴结切除术;术前探查或术前评估发现淋巴结异常时,可考虑淋巴结切除[70-71]。术后无化疗指征的患者如Ⅰ期无性细胞瘤或ⅠA期G1级未成熟畸胎瘤,仍考虑行系统性淋巴结清扫[4]。
5.1.3 晚期患者的初始肿瘤细胞减灭术(primary debulking surgery,PDS) 20%~30%的MOGCT患者诊断时已发展至晚期,PDS后残余病灶大小是MOGCT患者复发和生存的独立预后因素[32,72]。MOGCT患者PDS的原则是尽可能切除肉眼所见肿瘤,手术步骤如下:①术前充分进行肠道准备;②做一个足够长的腹部纵行切口;③抽取腹腔积液或盆、腹腔冲洗液进行脱落细胞学检查;④术中快速冰冻病理检查;⑤全面探查盆、腹腔,特别注意横膈、双侧结肠旁沟,切除所有受累的网膜,切除盆、腹腔转移灶,切除全子宫和双附件(卵巢动静脉高位断扎),必要时游离输尿管;⑥根据术中探查情况,切除受累的肠管、阑尾、部分膀胱或输尿管、脾脏和/或远端胰体尾、部分膈肌、胆囊、部分肝脏、部分胃等脏器;⑦尽可能剥离切除受累的腹膜,包括膈肌表面的肿瘤;⑧以下情况应考虑行腹膜后(腹主动脉旁和盆腔)淋巴结切除,a.临床拟诊Ⅱ期及以下的病例,以准确分期,b.腹膜后淋巴结明显增大者,以缩减肿瘤;⑨尽最大努力切除所有病灶,使残留病灶最大径不超过1 cm,争取达到无肉眼可见残留病灶;⑩术后详细记录病灶形态和范围、手术方式和名称、残留病灶部位及大小等。
对于接受减瘤手术后辅助化疗的MOGCT患者,不完全减瘤和完全减瘤患者二次探查术时分别有9.4%和4.4%存在病变[72]。Karalok等[73]研究中,58%的患者达到R0切除,16%的患者达到R1切除,22%的患者肿瘤残留>1 cm,3组患者的5年无病生存率(disease-free survival,DFS)分别为93%、75%和29%,提示晚期MOGCT的手术目标为R0切除。
晚期MOCGT患者理想减瘤手术时不推荐切除临床阴性淋巴结。一项有关卵巢肿瘤淋巴结清扫术(lymphadenectomy in ovarian neoplasm,LION)的前瞻性临床试验证实,切除术前影像学和术中探查评估阴性的淋巴结无助于改善PFS或OS[74]。
合并卵巢外播散,术前评估无法达到R0切除且不适合PDS的部分Ⅱ期患者、Ⅲ~Ⅳ期患者,可先行新辅助化疗(neoadjuvant chemotherapy,NACT)[71]。化疗前应进行细针抽吸穿刺活检、腹腔积液细胞学检查或腹腔镜探查取活组织进行病理学检查,肿瘤囊性部分不宜作为穿刺位点[4]。
推荐意见:Ⅰ期无性细胞瘤或ⅠA期G1级未成熟畸胎瘤,建议全面分期手术(推荐系统性淋巴结清扫术)后密切随访。其余早期MOGCT,术前评估和术中探查未见淋巴结转移的患者,不推荐淋巴结切除术(推荐级别:2B类)。晚期患者的初始手术目标为R0切除,不推荐常规切除术前影像学和术中探查阴性的淋巴结(推荐级别:2A类)。
5.2 二次手术
5.2.1 未全面分期MOGCT 的再分期手术 对于卵巢肿瘤剔除术后意外发现或诊断的MOGCT,可进行再分期手术以明确分期,指导后续治疗或有助于改善预后。Williams等[72]收集了117例MOGCT患者的临床资料,结果发现,患者可以从再分期手术中获益。对于Ⅰ期无性细胞瘤或ⅠA期G1级未成熟畸胎瘤患者,若影像学和肿瘤标志物均提示有残余病灶,且患者有生育要求,建议行FSS;若无生育要求,则行全面再分期手术。对于ⅠA期无性细胞瘤和ⅠA期G1级未成熟畸胎瘤患者,若影像学检查和肿瘤标志物(如β-HCG和AFP等)阴性,推荐切除残余卵巢,降低复发风险[71]。
其他病理类型的MOGCT,若术后影像学提示病灶残留,且患者有生育要求,推荐行FSS;若无生育要求,则行再分期手术或化疗。若术后影像学未见病灶残留,也可直接进行化疗。处理流程,详见图1。
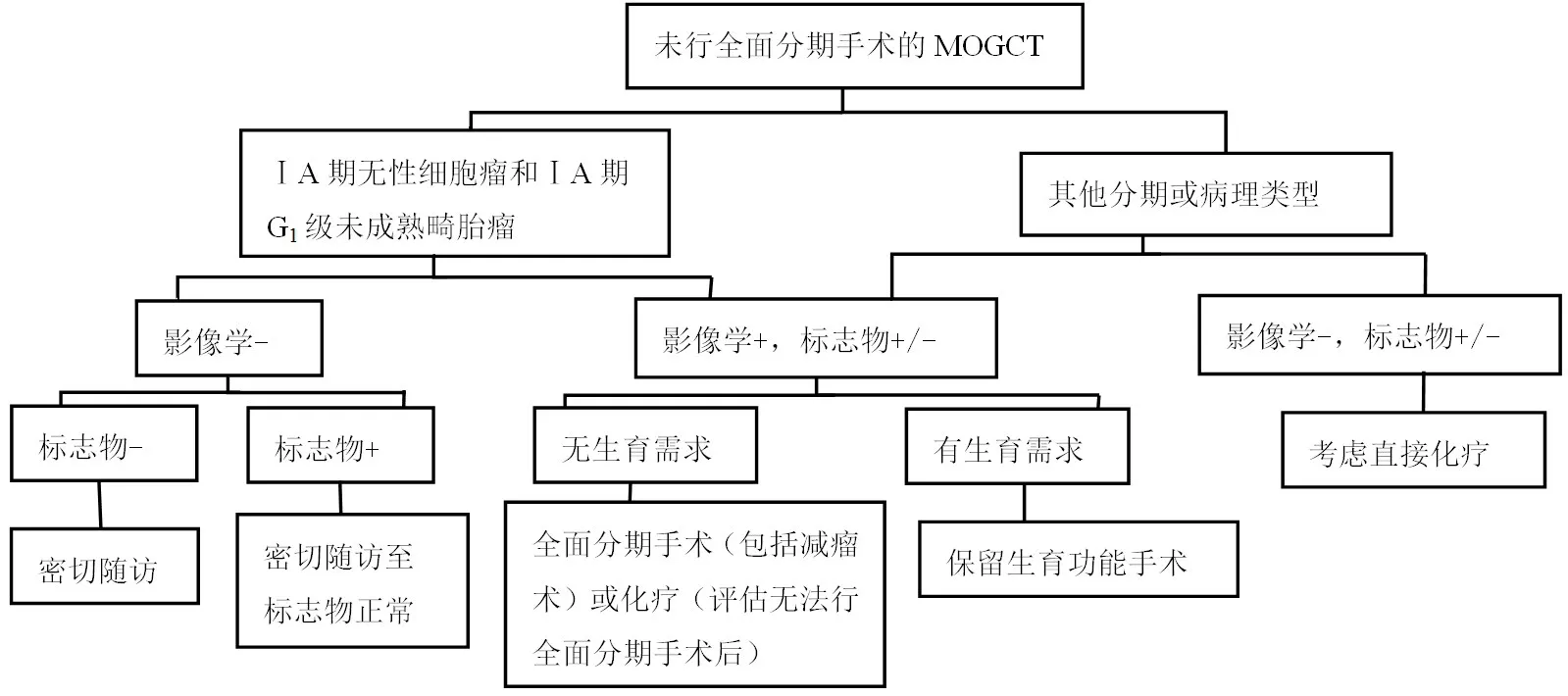
图1 未全面分期手术的MOGCT 患者的治疗选择
推荐意见:对于未全面分期手术的ⅠA期无性细胞瘤和ⅠA期G1级未成熟畸胎瘤,影像学阴性但标志物阳性,可考虑观察,密切随访;影像学和标志物双阴性则密切随访;若影像学和标志物均提示肿瘤残余,渴望保留生育功能者推荐行FSS,无生育需求者则行全面分期手术(推荐级别:2B类)。对于未全面分期手术的其他分期及病理类型的患者,影像学提示肿瘤残余,渴望保留生育功能者行FSS,无生育需求者则行全面分期手术或化疗(推荐级别:2A类)。
5.2.2 二次减瘤术 部分复发MOGCT患者可以通过二次减瘤术获益[75]。Li等[76-77]对晚期MOGCT患者接受二次减瘤手术的研究发现,二次减瘤达到R0切除的患者5年生存率为61%,未达R0切除的患者5年生存率为14%。复发性未成熟畸胎瘤患者行二次减瘤手术,手术达到R0切除的患者预后良好。充分的二次减瘤手术可切除复发的未成熟畸胎瘤,提高辅助化疗疗效和治愈的可能性大[78-79]。
首次手术及辅助化疗后仍有残留肿物(腹膜、剩余卵巢和/或淋巴结等)的患者是二次手术治疗的目标人群,原因包括:①排除残留肿瘤可能;②预防卵巢持续生长性畸胎瘤综合征(growing teratoma syndrome,GTS);③未成熟畸胎瘤逆转为成熟畸胎瘤后仍有恶变潜能。对于影像学微小残留病变的无性细胞瘤患者,可以在辅助化疗的同时密切监测[71]。
推荐意见:复发性MOGCT患者可能通过二次减瘤术获益,手术达到R0切除的患者预后良好,化疗后仍有残余肿瘤病灶(腹膜、剩余卵巢和/或淋巴结等)是二次减瘤术的适应证。(推荐级别:2B类)
6 化疗
除Ⅰ期无性细胞瘤和Ⅰ期G1级未成熟畸胎瘤外,其他MOGCT均推荐术后化疗[4]。欧洲妇科肿瘤学会(European Society of Gynecologic Oncology,ESGO)联合欧洲儿童肿瘤学会(European Society for Paediatric Oncology,SIOPE)指南建议,对于完全切除的ⅠA期且术后肿瘤标志物正常或阴性的MOGCT,首选推荐密切随访。对于ⅠA期卵黄囊瘤患者,术后可补充2个周期的辅助化疗[80]。本共识推荐除ⅠA期无性细胞瘤和ⅠA期G1级未成熟畸胎瘤外,其他MOGCT均推荐术后辅助化疗。欧洲内科肿瘤学会(European Society for Medical Oncology,ESMO)指出,ⅠA期无性细胞瘤和ⅠA期G1级未成熟畸胎瘤定期复查;ⅠB~ⅠC期无性细胞瘤、ⅠA期G2~3级未成熟畸胎瘤及ⅠA~ⅠB期卵黄囊瘤,若手术详细探查的临床分期准确,肿瘤标志物阴性,患者有强烈生育需求且顾虑于化疗对生育能力的损伤,可在完全知情同意的前提下密切监测随诊[71]。
博来霉素+依托泊苷+顺铂(BEP)化疗方案是MOGCT的一线化疗方案[81],其剂量及用法如下:第1~5天,顺铂20 mg/m2静脉滴注;第1~5天,依托泊苷100 mg/m2静脉滴注;第1、8、15天,博来霉素30 mg静脉滴注。21天为1个周期,共治疗3~4个周期。无性细胞瘤预后较好,从减轻细胞毒性的角度出发,部分ⅠB~Ⅲ期无性细胞瘤也可替换为依托泊苷+顺铂(EP)方案[82]。某些情况下,对于>40岁、肾功能异常、肿瘤处于晚期及既往存在肺部疾病的患者,不耐受博来霉素肺毒性的可能性较大,可考虑不使用博来霉素,替代选用EP或依托泊苷+卡铂(EC)方案,EC方案的剂量及用法如下:第1天,卡铂400 mg/m2静脉滴注;第1~3天,依托泊苷120 mg/m2静脉滴注。28天为1个治疗周期,共治疗3个周期。
Ⅰ期MOGCT推荐3个周期化疗,Ⅱ期及以上推荐4个周期化疗,复发患者6~8个周期化疗。为避免肺毒性,在第4个周期化疗后不再联合博来霉素(最大总累积剂量≤360 mg)[65]。化疗过程中注意肿瘤标志物的监测,推荐肿瘤标志物正常后再巩固化疗2个周期。特别值得注意的是,第2个周期化疗后若肿瘤标志物下降不理想则视为高风险,应酌情延长化疗周期,第4个周期化疗后肿瘤标志物未达到阴性,则判为化疗无效,考虑更换化疗方案。进一步的风险分层国际生殖细胞共识分类(International Germ Cell Consensus Classification,IGCCC)标准[12](表5)中的“预后一般”和“预后差”等级可以帮助识别高风险患者。

表5 评价预后的IGCCC标准
复发性MOGCT推荐的二线化疗方案:①可能有效的方案。大剂量化疗+骨髓移植,或紫杉醇+异环磷酰胺+顺铂(TIP)方案;②姑息化疗方案。EP方案,或多西他赛,或多西他赛+卡铂,或紫杉醇,或紫杉醇+异环磷酰胺,或紫杉醇+卡铂,或紫杉醇+吉西他滨,或依托泊苷+异环磷酰胺+顺铂(VIP)方案,或长春花碱+顺铂+异环磷酰胺(VeIP)方案,或长春新碱+达卡巴嗪+环磷酰胺(VAC)方案,或TIP方案[4]。
推荐意见:除ⅠA期无性细胞瘤以及ⅠA期G1级未成熟畸胎瘤外,其他类型及分期的MOGCT均推荐BEP方案化疗。Ⅰ期推荐3个周期,Ⅱ期及以上推荐4个周期,复发患者6~8个周期,推荐在第4个周期后不再联合博来霉素。不耐受博来霉素毒性或无性细胞瘤患者,建议使用EP或EC方案。VeIP/VIP/TIP/VAC等方案对生育能力的影响较大,可推荐用于持续性或复发性患者。(推荐级别:2B类)
7 妊娠期MOGCT
妊娠期附件肿块的发生率为1%~6%,约4%为恶性肿瘤,其中MOGCT约占30%,最常见的MOGCT是未成熟畸胎瘤和无性细胞瘤[83]。妊娠12周后胎盘形成,妊娠12周前手术会增加流产的风险[83]。妊娠14周后胎盘可以提供足够的激素维持妊娠,盆腹腔有可观的手术操作空间;妊娠24周后,随着子宫的进一步增大,手术导致不良结局的风险增加,故最佳手术时间为妊娠14~24周[84]。若出现腹痛怀疑卵巢囊肿蒂扭转或肿瘤破裂,不论孕周如何,都应立即手术。卵巢囊肿蒂扭转多发生于妊娠20周之前[85]。有研究表明,腹腔镜手术造成胎儿不良事件(流产、死产、早产)的发生率低于开腹手术[86-87]。腹腔镜手术创伤小、术后恢复快,是孕中期手术治疗的首选方式。
一项对1170例妊娠合并恶性肿瘤患者的研究发现,妊娠期化疗导致胎儿畸形的风险较低,但可能会增加低体重儿和新生儿重症监护的可能[88]。妊娠5~10周是胎儿器官分化的关键期,此期间暴露于细胞毒性药物会增加胎儿畸形的风险[84]。妊娠中晚期接受肿瘤化疗,新生儿结局良好。为防止化疗药物对胎儿肝肾功能的损害以及母体和新生儿造血功能的抑制,建议在妊娠35周后和分娩前3周停止化疗[89]。对于妊娠期MOGCT,BEP、EP和顺铂+长春新碱+博来霉素(PVB)方案的使用已有报道,对胎儿无明显不良影响[90]。
推荐意见:妊娠期MOGCT患者的最佳手术时间为妊娠14~24周,妊娠期化疗胎儿畸形的风险较低,妊娠期若需化疗应在妊娠14周后进行,推荐在妊娠35周后和分娩前3周停止化疗。(推荐级别:2A类)
8 管理及随访
10%~20%的成熟畸胎瘤患者会出现复发,大多发生在术后3年内[33],有生育要求的患者可在术后月经正常来潮后备孕。MOGCT总体对化疗敏感,但仍有10%~20%的患者复发[91],其中约75%的复发发生在初始治疗结束后1年内[80],保留生育功能的MOGOT患者治疗结束后的最佳妊娠时机尚无统一意见。术后早期妊娠有肿瘤复发的可能,而术后延迟妊娠,会因输卵管粘连、患者年龄增大等降低生育能力。考虑到术后辅助化疗的不良反应和处理妊娠期卵巢肿瘤的棘手性,建议在初始治疗结束12个月后妊娠。另有研究表明,激素避孕不增加MOGCT的复发风险[92],避孕方式可根据患者的需要自行选择。
成熟畸胎瘤可通过定期复查妇科盆腔超声进行随访。推荐MOGCT规范治疗后的前6个月内每个月进行体格、超声和肿瘤标志物检查。经典的血清肿瘤标志物包括AFP、β-HCG、抑制素B、抗米勒管激素、糖类抗原125、CA19-9和LDH。肿瘤标志物在正常范围内时,复查间隔可延长至2个月1次,第2年为3个月1次,第3年为3~6个月1次,第4~5年为6个月1次,此后每年复查1次直至第10年。最初随访的两年内,每6个月应做一次胸部X线或低剂量CT检查,腹部和盆腔MRI或CT[83]。
9 小结
本共识旨在为OGCT的临床诊疗提出指导性建议,在共识制订过程中,专家团队虽已广泛检索文献集思广益,唯恐挂一漏万,仍难以面面俱到。故专家团队希冀在临床诊治过程中,综合兼顾肿瘤病情、患者和家属意愿以及不同地区的医疗卫生水平和资源,以期做到规范化和个体化处理。本共识不排除其他合理治疗措施的可行性。参与本共识制定的专家与任何商业集团均无利益冲突。
执笔专家:梁栩芝(广西医科大学第一附属医院);叶元(桂林医学院附属医院);黄建邕(广西医科大学第五附属医院);范江涛(广西医科大学第一附属医院);张师前(山东大学齐鲁医院);王玉东(上海交通大学医学院附属国际和平妇幼保健院);王建东(首都医科大学附属北京妇产医院);张颐(中国医科大学附属第一医院);王延洲(陆军军医大学第一附属医院);孙阳(福建省肿瘤医院);陈刚(华中科技大学同济医学院附属同济医院);何海景(广西医科大学第一附属医院)
讨论专家(排名不分先后):王玉东(上海交通大学医学院附属国际和平妇幼保健院);王永军(北京大学第四临床医学院);韦业平(广西医科大学第二附属医院);王延洲(陆军军医大学第一附属医院);王建东(首都医科大学附属北京妇产医院);方梓羽(广西医科大学附属第四医院);王颖梅(天津医科大学总医院妇产科);叶元(桂林医学院附属医院);卢淮武(中山大学孙逸仙纪念医院);农文政(广西医科大学附属广西民族医院);孙阳(福建省肿瘤医院);刘军秀(中山大学附属第一医院);纪妹(郑州大学第一附属医院);刘畅(兰州大学第一医院);刘勋姣(广西壮族自治区桂林市妇幼保健院);刘梅(广西医科大学第十附属医院);刘淑娟(空军军医大学西京医院);孙篷明(福建省妇幼保健院);陈升才(右江民族医学院附属医院);陈司邦(上海交通大学医学院附属国际和平妇幼保健院);陈刚(华中科技大学同济医学院附属同济医院);张师前(山东大学齐鲁医院);沈杨(东南大学附属中大医院);陈昌益(广西壮族自治区人民医院);杨英捷(贵州省肿瘤医院);李俊东(中山大学附属肿瘤医院);吴笑颜(广西壮族自治区百色市人民医院);何海景(广西医科大学第一附属医院);张颐(中国医科大学附属第一医院);陈煜岊(广西壮族自治区柳州市人民医院);况燕(广西医科大学第一附属医院);范江涛(广西医科大学第一附属医院);周圣涛(四川大学华西第二医院);赵仁峰(广西壮族自治区人民医院);姚德生(广西医科大学附属肿瘤医院);贺红英(广西医科大学附属柳铁中心医院);凌媚(广西壮族自治区防城港市第一人民医院);黄建邕(广西医科大学第五附属医院);梁栩芝(广西医科大学第一附属医院);符淳(中南大学湘雅二医院);黄巍(广西中医药大学第一附属医院);曾定元(广西壮族自治区柳州市妇幼保健院);雷嘉(广西壮族自治区梧州市红十字会医院);蔡丽萍(南昌大学第一附属医院)
