奥沙利铂辅助治疗对中晚期肝癌患者预后的影响
2022-12-06邱发凯程媛胡洋张琴阳穆旭东
邱发凯,程媛,胡洋,张琴阳,穆旭东
陕西省肿瘤医院微创介入科,西安 710061
原发性肝癌是一种以早期病情隐匿、无典型症状、肿瘤生长快、侵袭性高为主要特征的恶性肿瘤,其发病率较高,据相关数据显示,于全球范围内,中国每年肝癌新发病例可占50%左右,同时由于早期无典型体征,初诊时,70%左右的患者已进入中晚期,使临床治疗难度提高[1-2]。因此,对于此种错失手术机会的中晚期肝癌患者,有效的化疗手段是改善患者临床症状、延长生存期的重要方式。近年来随着抗代谢类核苷类抗肿瘤药物吉西他滨及铂类药物奥沙利铂的出现,中晚期肝癌患者的治疗效果及生存期得到有效提升,对机体产生的不良反应小[3-4]。但目前采用奥沙利铂联合吉西他滨治疗中晚期肝癌的相关研究较少,且仍存在一定不足。鉴于此,本研究探讨奥沙利铂辅助治疗对中晚期肝癌患者预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年1月至2021年1月陕西省肿瘤医院收治的中晚期肝癌患者的病历资料。纳入标准:①符合《中国常见恶性肿瘤诊治规范》[5]中肝癌的诊断标准;②活检诊断为原发性肝癌;③存在可测量病灶;④TNM分期为Ⅲ~Ⅳ期。排除标准:①合并肝细胞性黄疸;②合并心肝肾功能障碍;③伴随出血风险;④合并认知及精神障碍;⑤化疗禁忌证;⑥合并严重内科疾病。根据纳入、排除标准,共纳入120例中晚期肝癌患者,依据治疗方法不同分为观察组及对照组,每组60例。观察组中,男39例,女21例;年龄37~76岁,平均(52.14±3.16)岁;病程 0.5~2.6年,平均(1.26±0.20)年;肿瘤直径5.2~10.0 cm,平均(8.15±1.01)cm;TNM分期:Ⅲ期46例,Ⅳ期14例;疾病类型:结节型28例,巨块型32例。对照组中,男37例,女23例;年龄38~77岁,平均(53.01±3.25)岁;病程0.6~2.7年,平均(1.24±0.20)年;肿瘤直径 5.0~10.1 cm,平均(8.13±1.10)cm;TNM分期:Ⅲ期43例,Ⅳ期17例;疾病类型:结节型26例,巨块型34例。两组患者各临床特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方法
对照组患者采用吉西他滨治疗,第1、8天,吉西他滨1250 mg/m2静脉滴注治疗,8天为1个周期,连续治疗2~5个周期。观察组患者采用奥沙利铂辅助吉西他滨联合治疗,第1、8天,吉西他滨1000 mg/m2静脉滴注治疗,奥沙利铂85 mg/m2静脉滴注治疗,8天为1个周期,连续治疗2~5个周期。
1.3 观察指标
①疗效:依据实体瘤疗效评价标准评价两组患者治疗效果。治疗后临床症状全部消失,病灶消失,且时间维持在4周以上为完全缓解;临床症状基本得到改善,且病灶缩小,缩小比例大于原病灶的30%,且时间维持在4周以上为部分缓解;临床症状得到有效改善,病灶缩小比例为原病灶的30%及以下,或病灶增大比例为原病灶的20%及以下为稳定;临床症状未得到有效缓解或存在加重现象,病灶增大,增大比例大于原病灶的20%,或出现新病灶为进展。疾病控制率=(完全缓解+部分缓解+稳定)例数/总例数×100%[6]。②血清肿瘤标志物水平:分别于治疗前及治疗后采集两组患者空腹肘静脉血5 ml,并以3000 r/min的离心速率离心15 min,处理结束后,采集上层血清置于-80℃环境待检,采用酶联免疫吸附试验检测癌胚抗原(carcinoembryonic antigen,CEA)、组织多肽抗原(tissue polypeptide antigen,TPA)、甲胎蛋白(α-fetal protein,AFP)水平,采用荧光磁微粒酶免法检测糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平,检验过程均严格按照试剂盒步骤进行。③不良反应:主要包括中性粒细胞减少、恶心/呕吐、肾功能减退、脱发、肝功能减退、皮疹、神经毒性、血小板减少。④预后:术后对两组患者进行电话随访,了解并记录两组患者生存情况。
1.4 统计学方法
采用SPSS 20.0统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 疗效的比较
观察组患者疾病控制率为90.00%(54/60),高于对照组的75.00%(45/60),差异有统计学意义(χ2=4.675,P<0.05)。(表1)
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者CEA、CA19-9、AFP、TPA水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者CEA、CA19-9、AFP、TPA水平均较治疗前降低,且观察组患者CEA、CA19-9、AFP、TPA水平均低于对照组,差异均有统计学意义(P<0.05)。(表2)
2.3 不良反应发生情况的比较
两组患者中性粒细胞减少、恶心/呕吐、肾功能减退、脱发、肝功能减退、皮疹、神经毒性、血小板减少发生率比较,差异均无统计学意义(P>0.05)。(表3)
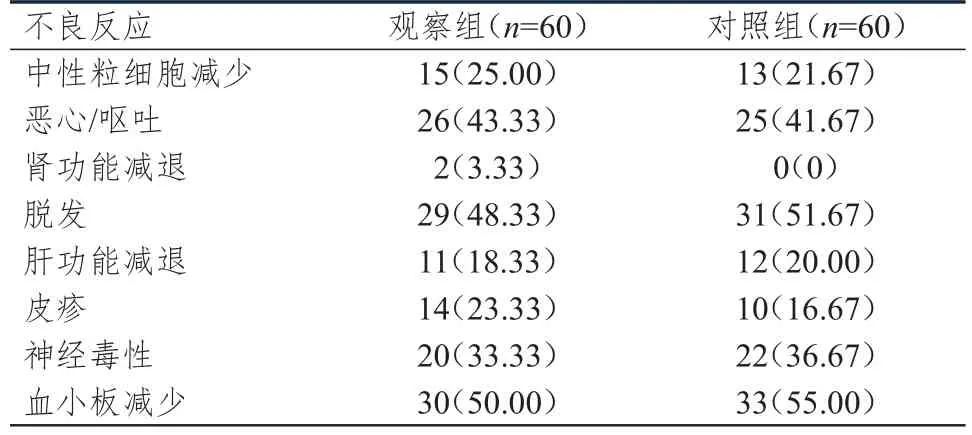
表3 两组患者的不良反应发生情况[n(%)]
2.4 预后的比较
术后3个月、6个月,两组患者生存率比较,差异均无统计学意义(P>0.05);术后12个月,观察组患者生存率高于对照组,差异有统计学意义(P<0.05)。(表4)

表4 两组患者生存情况的比较[n(%)]
3 讨论
吉西他滨是临床一种新型的核苷类抗肿瘤药物,其抗肿瘤机制主要以抑制DNA合成为主要原理,从而延缓疾病进展,达到抗肿瘤效果,且不良反应低,临床应用效果显著[7-8]。奥沙利铂与顺铂的抗肿瘤机制相同,均可针对细胞DNA的修复及合成作用产生较强的抑制作用,同时可与吉西他滨产生协同作用,降低机体对吉西他滨的耐药性,由此提升抗肿瘤效果[9-11]。本研究探讨奥沙利铂辅助吉西他滨治疗中晚期肝癌的效果。
本研究结果显示,观察组患者疾病控制率高于对照组,与温娟和王军[12]研究结果类似。说明中晚期肝癌在吉西他滨治疗的基础上进行奥沙利铂辅助治疗可有效提升疾病的控制效果。分析原因在于,奥沙利铂是一种广谱铂类化合物,其部分抗肿瘤机制与顺铂相同,可发挥细胞DNA修复及合成的抑制作用,同时可与吉西他滨产生协同作用,治疗效果显著[13-14]。2013年国家食品药品监督管理局批准,针对可能存在转移性、晚期的不可手术切除治疗的肝癌患者,可通过奥沙利铂进行保守治疗,因此也肯定了其有效性及安全性[15-16]。CEA是一种可反映胃癌、肺癌、乳腺癌、大肠癌等多种肿瘤的广谱肿瘤标志物,可作为消化道肿瘤诊断过程中的辅助性指标[17]。AFP主要来源于胚胎肝细胞,是临床用于筛查、诊断肝癌的血清肿瘤标志物,可反映肿瘤的侵袭能力及分化程度,由于其在健康者血清中含量较低,在80%肝癌患者中呈现高表达,且随疾病进展及恶化,其表达水平可显著升高,因此,临床还将其用于肝癌患者预后及治疗效果的评估[18-19]。CA19-9在胃癌、直肠癌、胰腺癌等恶性肿瘤中均存在较高表达,可与CEA、AFP联合应用,提高恶性肿瘤检测的灵敏度。乳腺癌、肺癌、消化道肿瘤及急性肝炎的多数患者中,均存在TPA高表达,同时随着疾病进展,TPA水平会显著升高[20-22]。本研究结果显示,治疗后,两组患者相关血清肿瘤标志物水平均降低,且观察组低于对照组,说明中晚期肝癌在吉西他滨治疗的基础上进行奥沙利铂辅助治疗,可改善机体癌性病变,延缓疾病进展。分析原因在于,吉西他滨作为临床一种新型的抗肿瘤药物,可有效抑制肿瘤扩散,延缓疾病进展,在此基础上,通过奥沙利铂予以辅助,二者可产生协同作用,不仅增加了药物浓度,还可在抑制疾病恶化的基础上,针对细胞DNA的修复及合成产生较强的抑制作用,以此增强抗肿瘤效果,降低血清肿瘤标志物水平[22-23]。本研究结果显示,两组患者不良反应发生率比较,无较大差异,与刘静和阚庆生[24]相关研究结果类似。中晚期肝癌在吉西他滨治疗的基础上进行奥沙利铂辅助治疗,不会导致不良反应发生率明显提高,且不良反应可在调整方案或停药后得到相应缓解,但同样发现除脱发、恶心、呕吐等化疗常见不良反应外,大多数患者出现神经毒性、血小板及中性粒细胞减少现象,这种不良反应可能与吉西他滨在抗肝癌治疗过程中的作用机制相关,因此在治疗过程中,可通过以下方式降低不良反应对患者产生的影响,如通过其他药物治疗方案进行替代性治疗;针对较为常见的血小板减少采用血小板输注的方式予以提升;通过药物改善恶心、呕吐状况;通过药物进行保肝治疗,减轻肝损伤;进行保肾干预,降低肾损伤;针对皮疹、脱发等反应予以抗生素干预。本研究结果显示,两组患者术后3个月、6个月的生存率无差异,术后12个月,观察组患者生存率高于对照组。说明中晚期肝癌在吉西他滨治疗的基础上进行奥沙利铂辅助治疗可进一步提升患者远期预后。
综上所述,中晚期肝癌患者在吉西他滨治疗的基础上增加奥沙利铂辅助治疗可明显提升治疗效果,改善血清肿瘤标志物水平,具有较高安全性,且远期预后较单药治疗效果更佳,临床应用价值高。
