非小细胞肺癌和乳腺癌患者癌痛发生风险预测模型的构建及验证△
2022-12-06李侠刘瑞汤俊刘亚锋谢军
李侠,刘瑞,汤俊,刘亚锋,谢军#
1安徽理工大学附属肿瘤医院肺癌诊治中心,安徽 淮南 232000
2淮南东方医院集团肿瘤医院肺癌诊治中心,安徽 淮南 232000
3安徽理工大学医学院,安徽 淮南 232000
近年来,胸部肿瘤发病率逐年升高,肿瘤进展至中晚期时治疗效果较差,其中肺癌是中国最常见的恶性肿瘤之一[1]。肺癌的发病率及病死率逐年增加,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占原发肺癌类型的80%~85%。骨是肺癌常见的远处转移部位,易引起剧烈疼痛,严重影响患者的生活质量[2]。2020年全球癌症统计报告显示,女性乳腺癌的发病率已超过肺癌[3]。由于乳腺癌晚期可向脑、骨、肺等部位转移,瘤体压迫周围神经丛和堵塞周围血管易引起组织坏死,从而导致剧烈疼痛,肿瘤治疗过程中也会产生明显疼痛[4]。
癌因性疼痛(简称癌痛)会严重影响患者的生活质量,同时疼痛也会导致患者抑郁、焦虑、睡眠状态差,形成恶性循环,进一步加剧疾病进展[5]。本研究通过筛选NSCLC及乳腺癌患者发生癌痛的危险因素,构建列线图来早期预测NSCLC和乳腺癌患者发生癌痛的风险,为临床医师及早发现并实施干预措施提供可靠依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2021年3月至2022年2月安徽理工大学附属肿瘤医院收治的NSCLC及乳腺癌患者。纳入标准:①经病理检查确诊为NSCLC或乳腺癌;②均接受数字分级评分法(numerical rating scale,NRS)评分;③既往15天内未接受过放化疗、阿片类止痛药物及双膦酸盐类等药物治疗。排除标准:①严重心、肝、肾功能障碍;②合并其他躯体疼痛性疾病;③意识不清,对疼痛没有判断力,不能配合进行疼痛评估。依据纳入和排除标准,本研究共纳入115例NSCLC和39例乳腺癌患者。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 资料收集及NRS 评分方法
收集NSCLC和乳腺癌患者的临床特征,如性别、年龄、吸烟史、病理类型、T分期、N分期、肿瘤部位、骨转移情况、Ca2+水平、中性粒细胞(neutrophil,NEU)百分比、淋巴细胞(lymphocyte,LYM)百分比、嗜碱性粒细胞(basophil,BAS)百分比、淋巴细胞绝对值(lymphocyte absolute value,LYM#)、总蛋白(total protein,TP)水平、白蛋白(albumin,ALB)水平、糖类抗原 50(carbohydrate antigen 50,CA50)水平、糖类抗原 125(carbohydrate antigen 125,CA125)水平等。采用NRS对所有患者的疼痛程度进行评分,该量表总分0~10分,0分为无痛,1~3分为轻度疼痛(不影响睡眠),4~6分为中度疼痛(入眠浅),7~10分为重度疼痛(睡眠严重受扰),将无痛和轻度疼痛患者纳入无痛组,将中重度疼痛患者纳入疼痛组。
1.3 统计学方法
采用Empower Stats软件对数据进行统计分析,正态分布计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验;非正态分布计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用非参数检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;在训练集中采用单因素分析和多因素Logistic回归分析筛选独立影响因素;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),验证各因素单独及联合检测对NSCLC和乳腺癌患者发生癌痛的预测价值;构建NSCLC和乳腺癌患者癌痛发生风险的列线图模型;采用RMS软件绘制列线图的校准曲线,评价该模型用于预测NSCLC和乳腺癌患者癌痛发生风险的可靠性和准确性;通过决策曲线分析法(decision curve analysis,DCA)评价列线图的临床获益度。以P<0.05为差异有统计学意义。
2 结果
2.1 不同疼痛程度NSCLC 和乳腺癌患者临床特征的比较
115例NSCLC患者中,无痛组75例,疼痛组40例;无痛组与疼痛组NSCLC患者性别、年龄、病理类型、T分期、N分期、吸烟史、肿瘤部位比较,差异均无统计学意义(P>0.05);无痛组与疼痛组NSCLC患者骨转移情况、Ca2+水平、NEU、LYM、BAS、LYM#、TP水平、ALB 水平、CA50水平、CA125水平比较,差异均有统计学意义(P<0.05)(表1)。39例乳腺癌患者均为女性,其中,无痛组28例,疼痛组11例;无痛组与疼痛组乳腺癌患者年龄、NEU、ALB水平比较,差异均无统计学意义(P>0.05);无痛组与疼痛组乳腺癌患者骨转移情况比较,差异有统计学意义(P<0.01)(表2)。
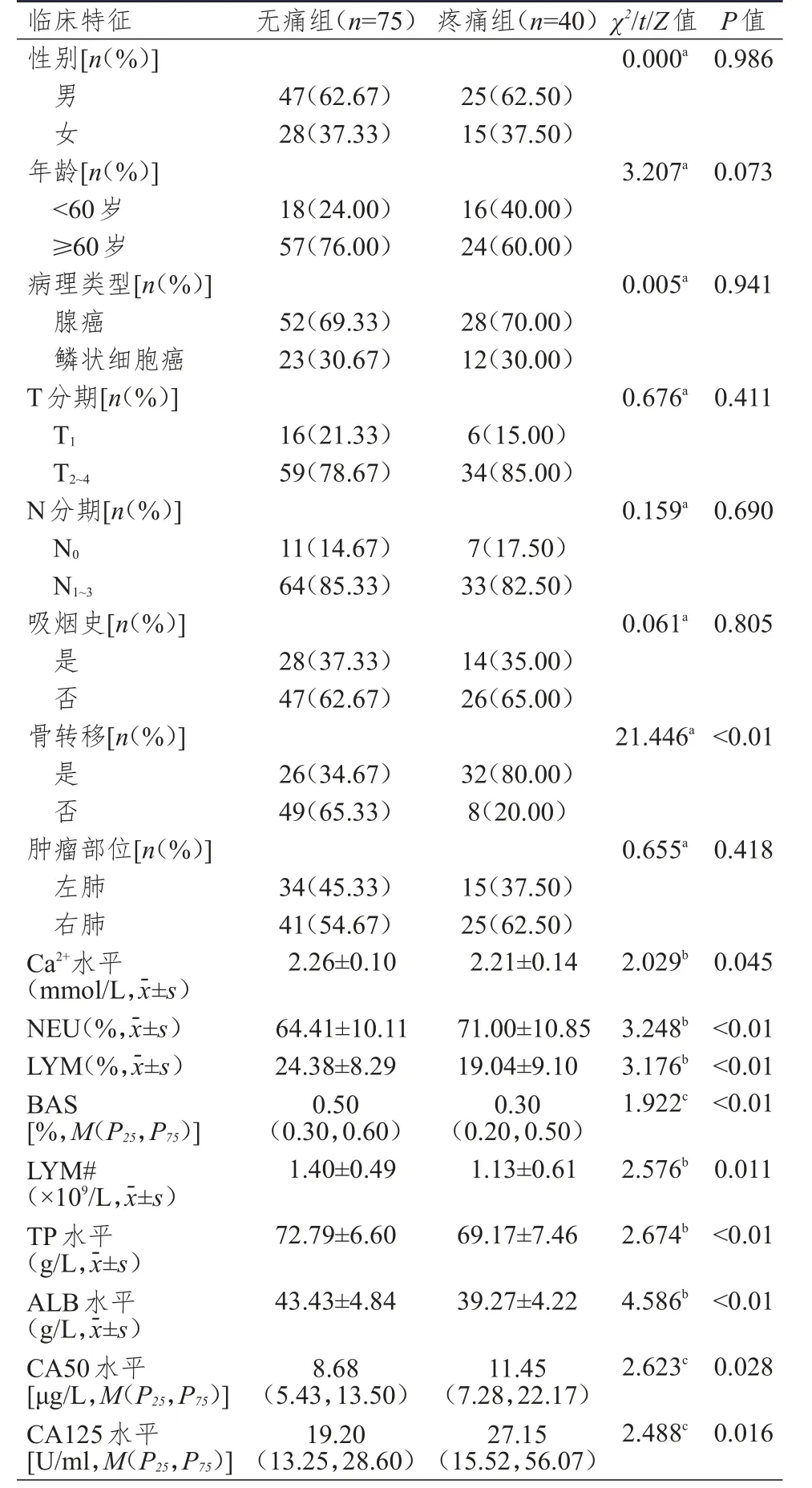
表1 不同疼痛程度NSCLC患者(训练集)临床特征的比较(n=115)
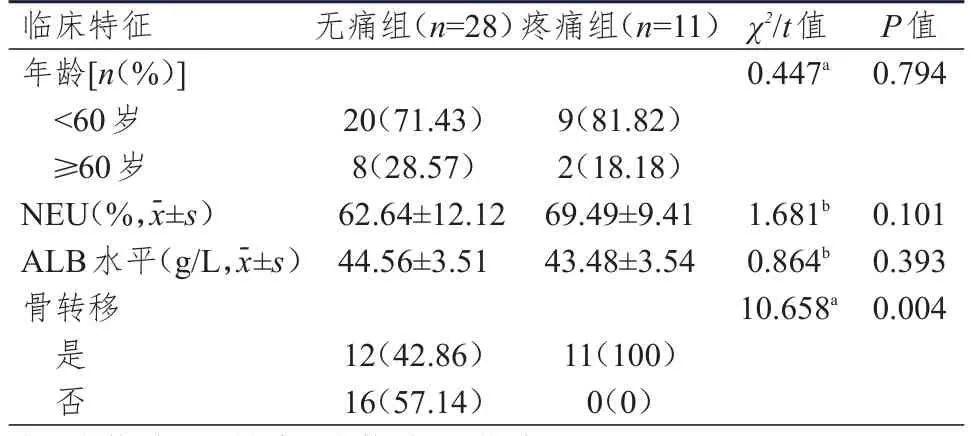
表2 不同癌痛情况乳腺癌患者(验证集)临床特征的比较(n=39)
2.2 NSCLC 患者癌痛发生影响因素的单因素及多因素分析
单因素分析结果显示,性别、年龄、病理类型、T分期、N分期、吸烟史、肿瘤部位均可能不是NSCLC患者癌痛发生的影响因素(P>0.05);骨转移情况、Ca2+水平、NEU、LYM、LYM#、TP水平、ALB水平、CA50水平、CA125水平均可能是NSCLC患者癌痛发生的影响因素(P<0.05)。将单因素分析中差异有统计学意义的因素作为自变量,NSCLC患者癌痛发生情况作为因变量纳入Logistic回归分析,结果显示,骨转移、NEU升高、ALB降低均是NSCLC患者癌痛发生的独立危险因素(P<0.05)。(表3)
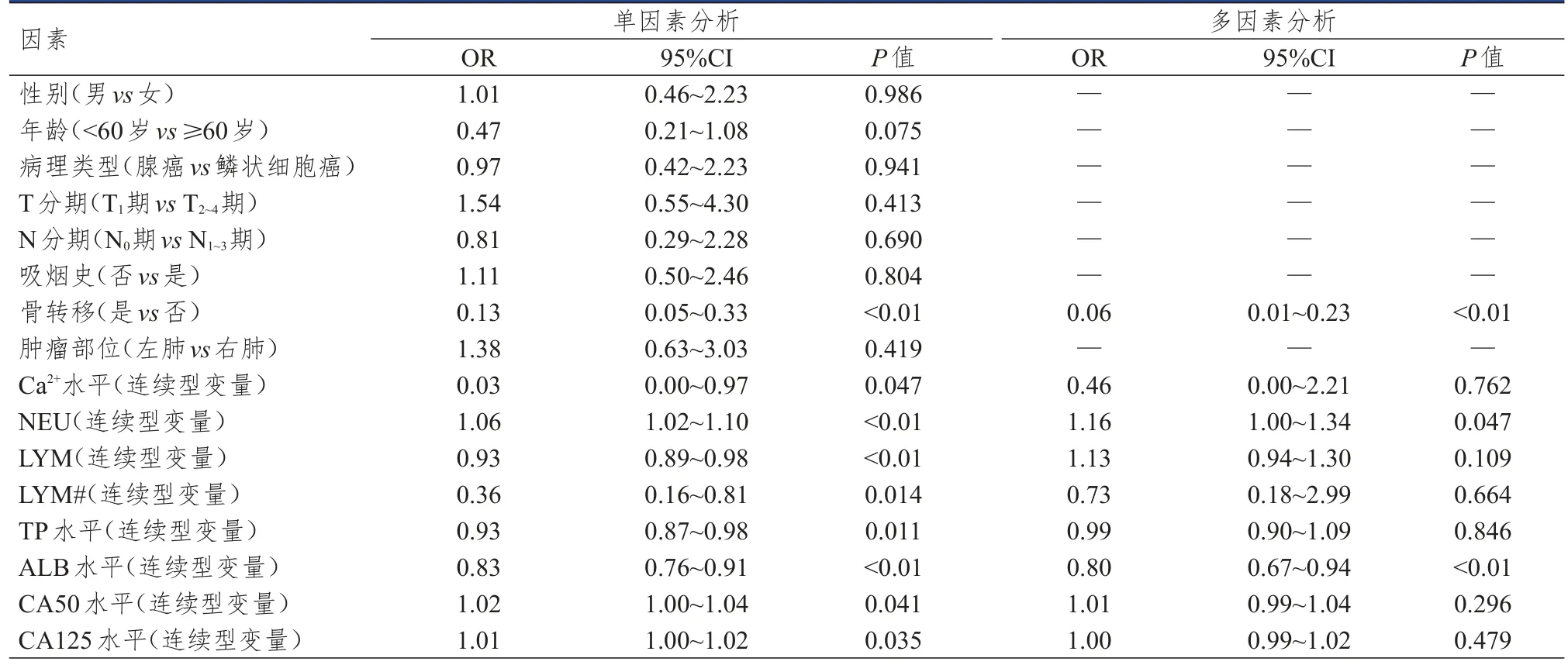
表3 NSCLC患者癌痛发生影响因素的单因素及多因素分析
2.3 骨转移情况、NEU、ALB 水平单独及联合检测对NSCLC 和乳腺癌患者癌痛发生风险的预测价值
将多因素分析筛选出的独立危险因素(骨转移情况、NEU、ALB水平)作为自变量,以是否发生癌痛为因变量,建立NSCLC和乳腺癌患者癌痛发生风险的预测模型,预测指数(predictive index,PI)=9.28411+0.05989×NEU-0.24133×ALB-2.88120×是否发生骨转移。对训练集绘制ROC曲线,结果显示,骨转移情况、NEU、ALB水平单独及联合检测预测NSCLC患者癌痛发生的AUC分别为0.727、0.667、0.750、0.874,其中联合检测的AUC最大,灵敏度、特异度分别为0.900、0.720(表4)。对验证集绘制ROC曲线,结果显示,骨转移情况、NEU、ALB水平单独及联合检测预测乳腺癌患者癌痛发生的AUC分别为0.786、0.640、0.581、0.799,其中联合联测的AUC最大,灵敏度、特异度分别为1.000、0.607(表5)。
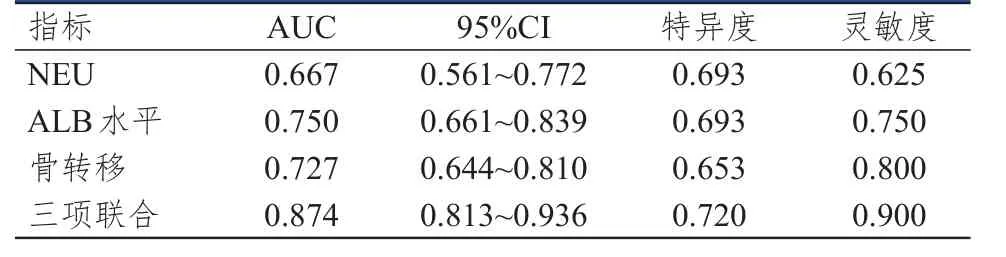
表4 骨转移情况、NEU、ALB水平单独及联合检测对NSCLC患者发生癌痛的预测价值
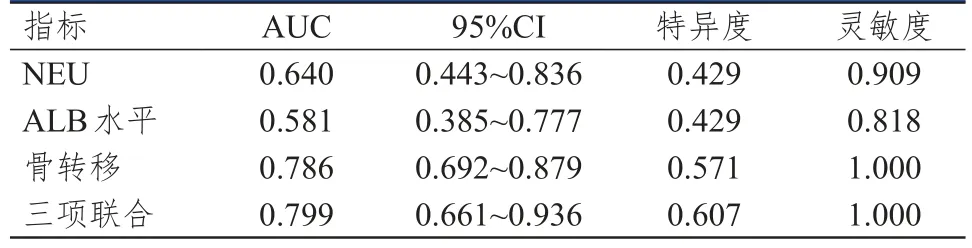
表5 骨转移情况、NEU、ALB水平单独及联合检测对乳腺癌患者发生癌痛的预测价值
2.4 建立并验证预测NSCLC 和乳腺癌患者癌痛发生风险的列线图模型
将多因素分析筛选出来的骨转移情况、NEU、ALB水平纳入预测模型,使用RMS软件包建立预测NSCLC和乳腺癌患者癌痛发生风险的列线图。分数表示每个危险因素对应的分值,总分表示全部危险因素对应的分值相加得到的总分,每个总分对应下方的癌痛发生风险,将患者分为低风险人群和高风险人群。(图1)
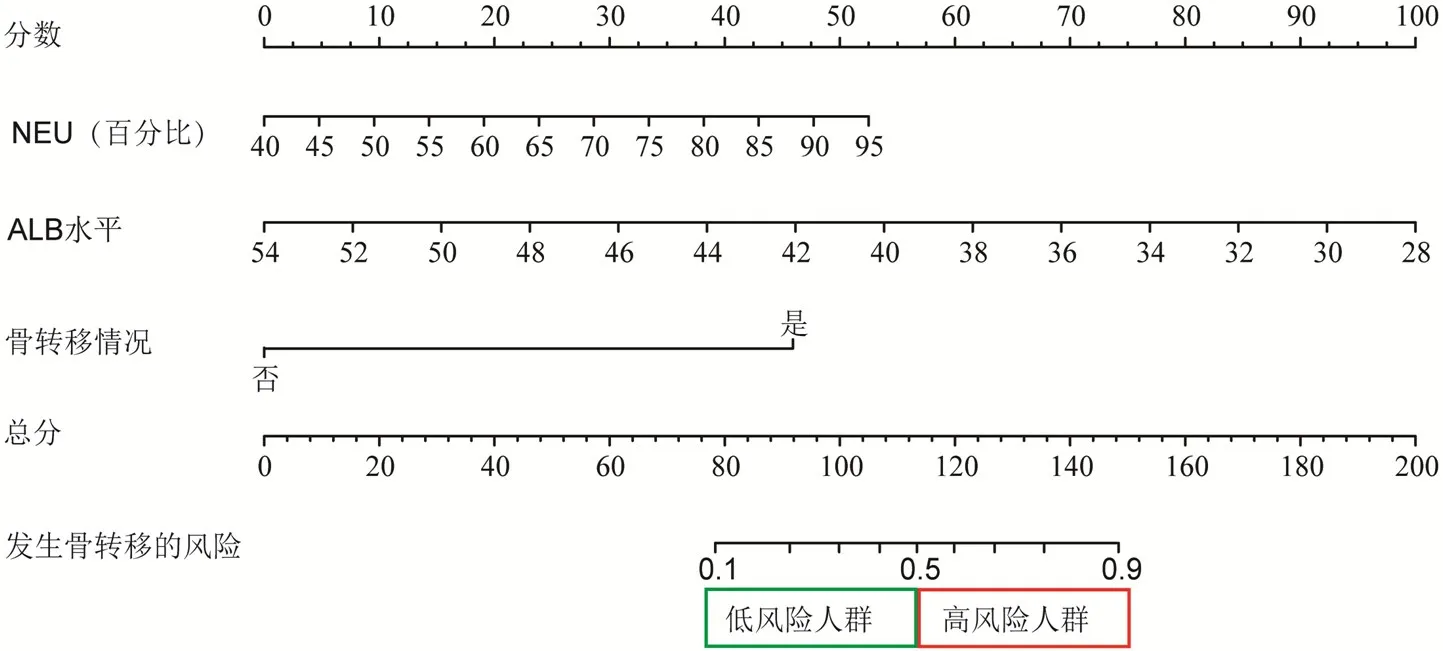
图1 预测NSCLC 和乳腺癌患者癌痛发生风险概率的列线图
2.5 列线图预测模型的评估及验证
绘制预测NSCLC和乳腺癌患者癌痛发生风险概率列线图的校准图,结果显示,预测曲线趋势与理想曲线贴合程度尚可,表明该模型预测NSCLC和乳腺癌患者癌痛的发生风险较为可靠(图2)。采用DCA评价预测模型的临床适用性,表明该列线图模型在很大的风险阈值概率范围内对NSCLC和乳腺癌患者癌痛发生风险的预测能力较高(图3)。
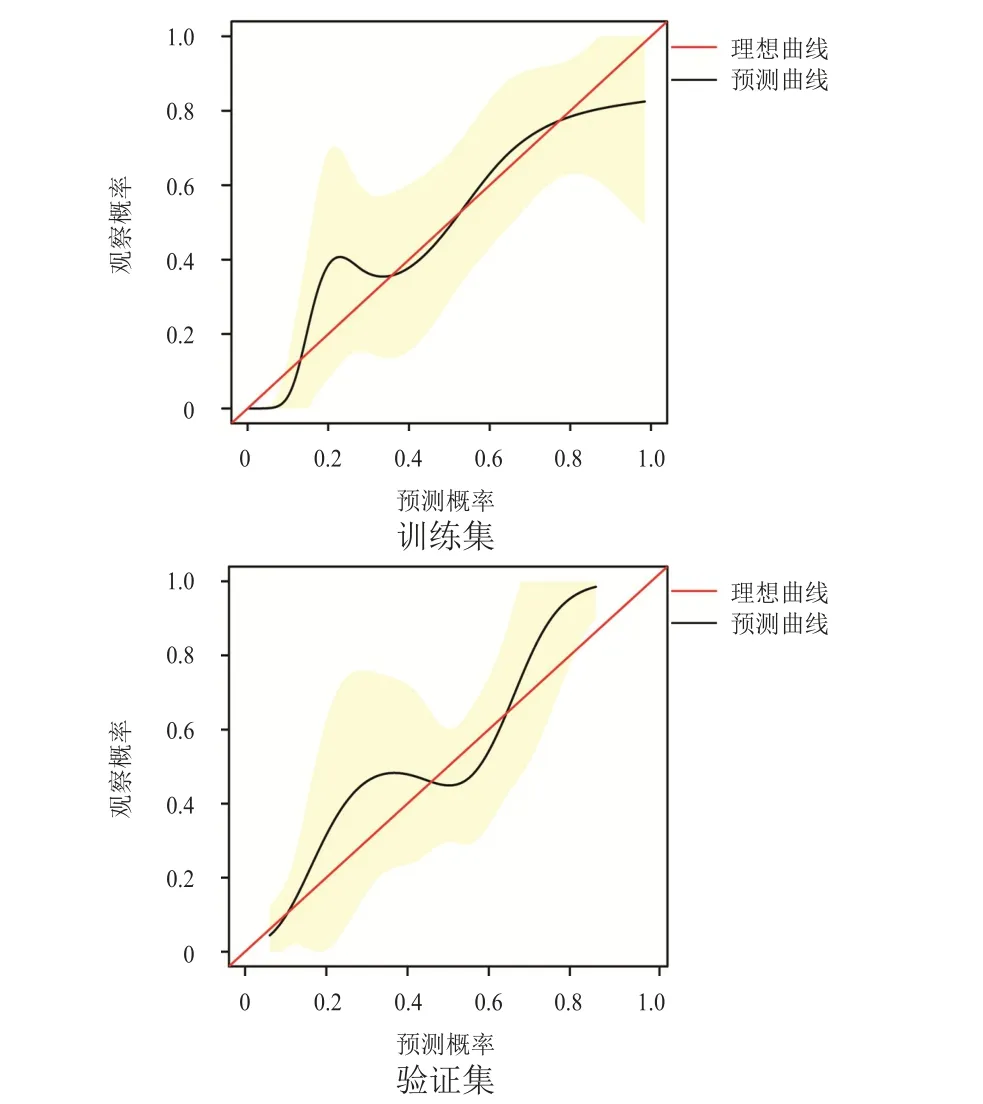
图2 预测模型的校准曲线
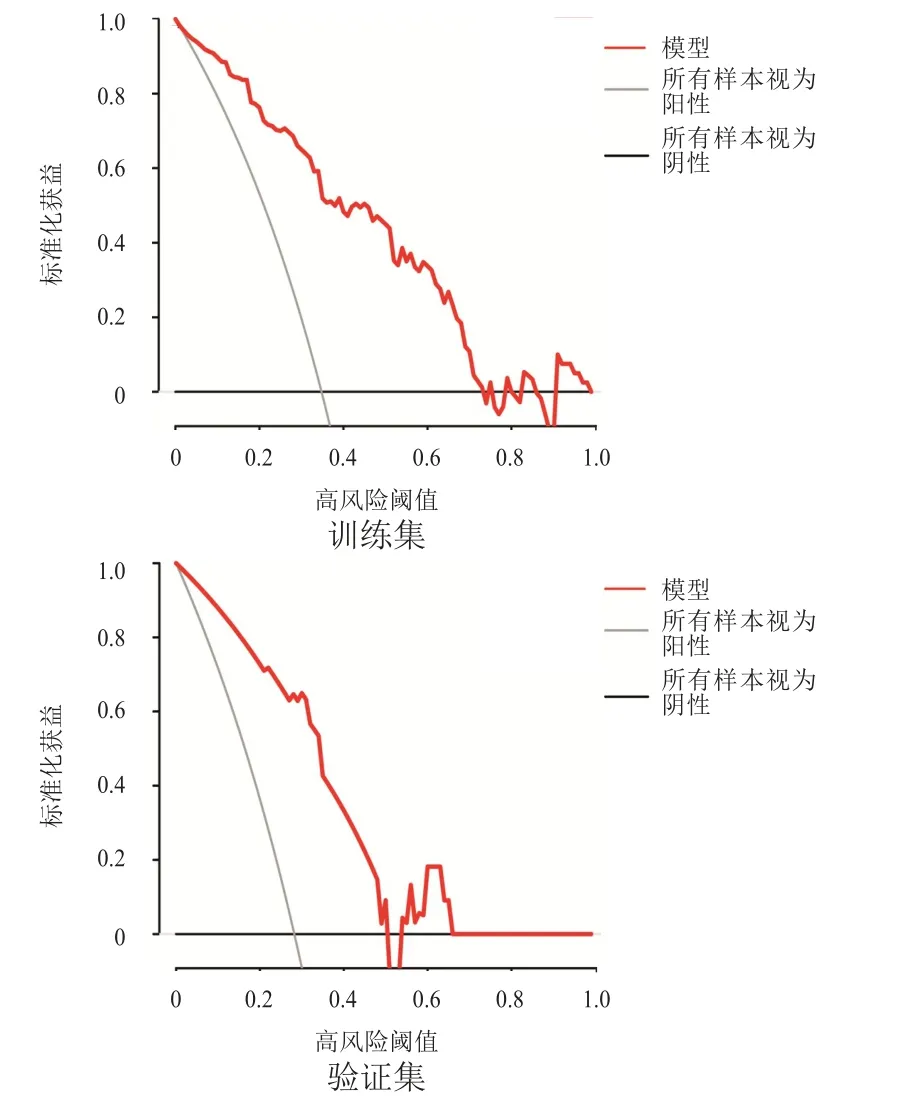
图3 预测模型的决策曲线
3 讨论
癌痛一般由肿瘤组织膨胀性生长或溃破、感染等使末梢神经或神经干受到刺激或压迫引起,是中晚期肿瘤患者较常见的临床表现[6],且这种疼痛会随着病情加重而愈演愈烈。目前用于治疗癌痛的一线药物主要包括吗啡、羟考酮等阿片类药物,长期使用易引发消化道反应、呼吸抑制等不良反应[7]。疼痛会明显降低患者的生活质量,同时还会影响患者的情绪,并可能对后续治疗产生影响。因此,寻找简单有效的生物标志物来预测肿瘤患者癌痛发生的早期风险,对临床医师的早期诊断及患者的预后有十分重要的意义。本研究将患者简单易得的实验室指标和临床特征纳入研究以筛选与NSCLC及乳腺癌患者癌痛发生的相关危险因素,其中骨转移、NEU升高、ALB降低均是NSCLC患者癌痛发生的独立危险因素。癌痛最常见的疼痛类型是骨痛,骨骼是第三大常见的转移部位(仅次于肺和肝)。研究显示,骨是晚期恶性肿瘤最常见的转移部位之一,尤其是晚期乳腺癌和肺癌患者,转移可能会侵犯骨骼[8-9]。肿瘤在骨骼中的生长会导致疼痛,也可能是骨折或脊髓受压的结果,破骨细胞在骨癌疼痛的发生机制中发挥了重要作用。破骨细胞能够被肿瘤产物和由成骨细胞及免疫细胞释放的破骨细胞刺激物激活,破骨细胞刺激物被介质激活,而介质本身由肿瘤产生。破骨细胞也能通过空泡H+ATP酶分泌质子并创造酸性微环境来降解骨矿物质。已知细胞外质子是伤害感受器的有效激活剂,因此,破骨细胞能通过质子分泌引起疼痛[10-11]。本研究结果表明,无论是在NSCLC患者还是乳腺癌患者中,与没有骨转移的患者相比,有骨转移的患者癌痛发生的风险更高。
炎症与肿瘤的发生发展密切相关,炎症因子在肿瘤细胞增殖、侵袭及转移中发挥着重要作用。但NEU在疼痛中的作用是有争议的:①NEU可激活和敏感感觉神经元,进而释放激活NEU的介质。白细胞介素-1β(interleukin-1β,IL-1β)的释放导致NEU释放活性氧或前列腺素,从而导致过度伤害感受[12-13]。NEU也可以通过释放细胞因子和趋化因子促进初级传入神经元的敏化,这些细胞因子和趋化因子作为正反馈激活NEU,触发补充替代途径来放大痛觉反应[14-15]。②有研究表明,NEU可分泌镇痛介质,如阿片肽(β-内啡肽、甲脑啡肽和强啡肽-A),还可激活外周感觉神经元上的阿片受体,从而抑制伤害传递[16]。本研究结果显示,NEU高的患者发生癌痛的风险更高。在一项关于血清ALB水平是否影响芬太尼对接受阿片类药物治疗的癌痛患者的镇痛效果的研究中,血清ALB≥3.0 g/dl比ALB<2.5 g/dl的患者对芬太尼的反应率更高[17]。类似的,本研究结果显示,ALB水平低的患者比ALB水平高的患者癌痛的发生风险更高。
列线图又称Nomogram图,是一种可以将复杂的统计预测模型用简单图形表示的预测工具,已广泛应用于多种肿瘤中,临床医师可以用其计算出特定临床事件的概率[18]。该模型可预测10%~90%的癌痛发生风险。假设1例NSCLC或乳腺癌患者测得NEU百分比为90%,ALB水平为33 g/L,并且发生了骨转移,那该患者的总分=47.5(NEU百分比为90%)+80(ALB=33 g/L)+46(发生骨转移)=173.5分,说明该患者此刻癌痛的发生风险超过90%,癌痛的发生风险较大,建议尽快行相关预防治疗。由于本研究建模组纳入数量不足,不能够拆分进行外部验证,因此将与肺癌发病位置相近的乳腺癌纳入验证,证实了预测模型的泛化能力,本研究结果表示单一肿瘤的疼痛预测模型具有潜在的外扩能力,这也为后续通用性模型的构建提供了参考意见。
综上所述,NEU、ALB水平、骨转移发生情况联合检测对NSCLC及乳腺癌患者癌痛发生风险具有较好的预测价值,建立的列线图模型对NSCLC及乳腺癌患者是否发生癌痛具有良好的预测效能,建议在临床实践中利用该预测模型较早地预测NSCLC及乳腺癌患者癌痛的发生风险,以达到尽早发现、及时诊治的目的,从而改善肿瘤患者的生活质量。但本研究仍存在不足之处,如本研究为回顾性分析,具有一定的选择偏倚,未来可能需要前瞻性研究加以证实,以增加研究结果的可靠性。
