胰腺实性假乳头状瘤超声表现及病理特点
2022-12-02单立奎叶显俊
单立奎,叶显俊*,余 跃
[1.中国科学技术大学附属第一医院(安徽省立医院)超声科,2.消化科,安徽 合肥 230001]
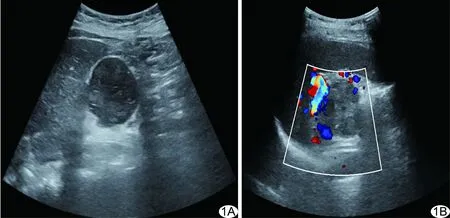
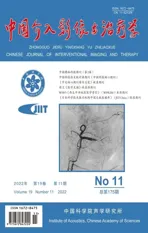
图1 SPTP患者,女,37岁 A.腹部二维声像图示胰尾部实性肿物长径51 mm、短径47 mm,边界清,形态规则,可见假包膜,内部回声不均匀,可见低回声裂隙; B.CDFI见边缘血流信号(Adler Ⅲ级)
胰腺实性假乳头状瘤(solid-pseudopapillary tumor of pancreas, SPTP)临床少见,好发于年轻女性,具有恶性潜能[1-2];其来源尚未明确,可能与胰腺具有分化潜能的干细胞有关。SPTP临床表现缺乏特异性,超声、CT、MRI等影像学检查有助于早期诊断SPTP[3-4]。本研究观察37例SPTP的超声表现及病理特点。
1 资料与方法
1.1 一般资料 回顾性分析2015年7月—2020年2月37例于安徽省立医院经术后病理确诊的SPTP患者,男7例、女30例,年龄9~74岁、平均(33.6±16.4)岁;22例上腹痛、腹部不适及恶心、呕吐等,15例无症状而于体检时发现胰腺或腹膜后占位性病变。纳入标准:①经术后病理学确诊SPTP,且临床资料完整;②术前接受腹部超声、肿瘤标志物等检查;③首诊,入院前未进行相关治疗。排除标准:①胰腺炎、腹部外伤史及手术史;②合并精神障碍或沟通困难、依从性差。
1.2 仪器与方法 检查前嘱患者空腹8 h。嘱患者仰卧或取半坐位,采用Philips iu-22型彩色多普勒超声诊断仪、频率3.5 MHz L12-5凸阵探头常规扫查腹腔脏器,重点观察肝门区及胰腺周围,发现胰尾占位时重点扫查脾门区,并注意有无肿大淋巴结;以CDFI观察血流信号。而后行超声造影,经肘正中静脉团注造影剂声诺维1.5~2.0 ml,再以5 ml生理盐水快速冲管,开始计时并启动存储功能,存储时间不少于4 min。
由2名具有5年以上工作经验的超声科医师分析造影图像,意见不同时经协商达成一致。采用QontraXt软件分析病变造影增强模式及造影剂灌注特点;根据病变实性、囊性成分占比将其分为实性(实性成分>75%)、囊实性(实性成分25%~75%)或囊性(实性成分<25%);采用Adler法[5]将血流分为0~Ⅲ级,即0级为无血流、Ⅰ级少许点状血流、Ⅱ级少许条状血流、Ⅲ级边缘有血流。参照文献[6]标准诊断SPTP。
1.3 检测血清肿瘤标志物 取空腹静脉血5 ml,离心后取血清,以放射免疫法测定血清糖类抗原199(carbohydrate antigen 199,CA199)、癌胚抗原(carcino embryonic antigen, CEA)、CA50及甲胎蛋白(alpha-fetoprotein,AFP)水平。正常参考范围:CA199为0~37 IU/ml,CEA 0~6 ng/ml,CA50为0~35 U/ml,AFP为0~25 μg/L。
1.4 统计学分析 采用SPSS 23.0统计分析软件。计量资料均符合正态分布,以±s表示,行独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 超声表现 病灶均单发,呈圆形或类圆形不均质低回声,长径16~136 mm、平均(49.43±5.17)mm,短径11~102 mm、平均(39.51±4.18)mm;其中21例病灶长径与短径均>30 mm、16例长径与短径均≤30 mm;12例病灶位于胰头,位于胰尾11例、胰体10例、胰颈4例;32例病灶边界清,5例不清;21例可见包膜(8例包膜完整、13例不完整),16例未见包膜;29例形态规则、8例欠规则;8例可见钙化(其中2例见壁钙化)、29例无钙化;28例见低或无回声裂隙,9例未见;26例呈囊实性,11例实性;8例少许点状血流(Adler Ⅰ级),2例少许条状血流(Adler Ⅱ级),10例边缘有血流(Adler Ⅲ级),17例无血流(Adler 0级)。见图1、2。
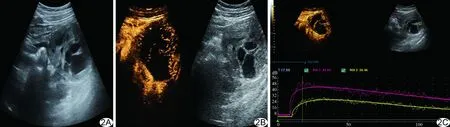
图2 SPTP患者,女,20岁 A.腹部二维声像图示胰体尾部囊实性肿物长径107 mm、短径93 mm,边界清,形态规则,可见假包膜,内部回声不均匀; B.超声造影图示胰体尾部囊实性肿物包膜环状强化及囊性无增强区; C.时间-信号强度曲线示肿物呈持续性低增强
2.2 实验室检查 37例血清CA199为(10.53±8.54)IU/ml,CEA为(1.34±0.93)ng/ml,CA50为(4.10±0.53)U/ml,AFP为(2.54±1.62)μg/L。1例CA199、CA50、CEA分别为40.35 IU/ml、38.44 U/ml、7.59 μg/L,均高于正常范围;1例CA199、CA50分别为38.67 IU/ml、38.03 ng/ml,均高于正常范围;1例CA199、CEA、AFP分别为38.99 IU/ml、7.06 ng/ml、26.73 μg/L,均高于正常范围;其余34例肿瘤标志物均在正常范围。
2.3 手术及病理结果 13例接受胰部分切除术,9例接受胰体尾联合脾切除术,7例接受胰头十二指肠切除术、8例接受胰体尾切除术,手术切缘均阴性。
大体病理显示肿瘤呈类圆形或不规则形。光镜下实性区肿瘤细胞较小且大小一致,排列紧密呈巢片状,细胞核呈圆形或卵圆形,胞质丰富,多数(34例)异型性不明显;5例浸润胰腺,浸润肠壁肌层、浸润十二指肠各1例,3例同时浸润多个部位, 27例未见浸润邻近组织。
3例血清肿瘤标志物升高者(长径均>110 mm,短径均>90 mm)病灶与周围组织分界不清,肿瘤细胞见明显异型性及坏死,核分裂活性增加,判定为恶性。
3 讨论
SPTP具有恶性潜能,但侵袭性低,完全切除后预后较好;其组织学形态与胰腺神经内分泌肿瘤、胰腺腺泡细胞癌存在重叠,易误诊。本病好发于年轻女性,病灶可见于胰腺各部位,一般不引起胰管、胆管扩张[7-9]。ANIL等[10]报道,SPTP的男女发病比例约为1∶8.37,女性平均发病年龄为29岁。本组37例中,男7例、女30例,平均年龄33.6岁,病灶位于胰头12例、胰尾11例、胰体10例、胰颈4例,与文献[9-12]报道相符。本病临床常无特殊表现,多于体检或检查其他部位时偶然发现,发现时体积多已较大。文献[11]报道SPTP直径约4.9~8.4 cm。本组SPTP病灶长径16~136 mm、平均(49.43±5.17)mm,短径11~102 mm、平均(39.51±4.18)mm,其中21例长径及短径均>30 mm。
影像学检查有助于发现并辅助诊断SPTP,但病灶影像学表现多缺乏特异性。本组37例SPTP超声可见病灶多呈圆形、类圆形不均质低回声,其中70.27%(26/37)呈囊实性,75.68%(28/37)有低或无回声裂隙,56.76%(21/37)可见包膜,多与周围脏器分界清晰(32/37,86.49%)、形态规则(29/37,78.38%),部分瘤体或边缘可见血流信号,钙化相对较少(8/37,21.62%),与既往研究[13-14]观察结果基本一致。囊性成分较多的SPTP病灶内部透声效果较好,但易发生缺血坏死或出血较多时透声效果较差,回声低而弱;囊性成分少的肿瘤生长较缓慢,滋养血管较少且细,故超声显示血流信号较少。此外,多数SPTP病灶边界清晰,其对周围组织结构以推挤、压迫为主,少见浸润,故极少导致胰管或胆管扩张。
肿瘤标志物中,CA199在多种肿瘤组织及正常胰腺、胃肠道黏膜中均可表达;CA50为广谱肿瘤标志物;CEA为细胞表面糖蛋白家族成员,与胰腺癌发生、发展关系密切;AFP作为糖蛋白具有运输、双向调节、免疫抑制等多种功能[15]。刘洋等[16]发现,90%的SPTP患者CA125、CA199、CA724、AFP及CEA均呈阴性,仅少数可见CA125、CA199轻度升高。本组37例中,34例CA199、CA50、CEA及AFP均在正常范围;1例CA199、CA50、CEA升高,1例CA199、CA50升高,1例CA199、CEA、AFP升高,结合超声特征(病灶和周围组织分界不清等)诊断为恶性SPTP。
综上所述,SPTP的超声表现有一定特征性,结合血清肿瘤标志物有助于定性诊断。但本研究样本量小,有待积累更多病例后进一步观察。