FOLFOX-肝动脉灌注化疗联合靶向及免疫治疗巴塞罗那临床肝癌C期肝细胞癌
2022-12-02王雅静徐竟益任志忠王天霄汪桠琴张跃伟
王雅静,徐竟益,刘 影,任志忠,王天霄,汪桠琴,张跃伟*
(1.清华大学临床医学院,北京 100084;2.清华大学附属北京清华长庚医院肝胆胰中心,北京 102218;3.山东大学齐鲁医学院第二医院肝胆外科,山东 济南 250033)
85%肝细胞癌(hepatocellular carcinoma, HCC)确诊时已为中晚期,多无法手术切除,患者中位生存时间仅为6~10个月[1-3];对其中12%~32%合并门静脉癌栓(portal vein tumor thrombus, PVTT)[4]者应以索拉非尼作为标准治疗方案,但单药治疗后患者中位总生存期(overall survival, OS)仅 3.1~6.0个月[5-6],肝动脉灌注化疗(hepatic artery infusion chemotherapy, HAIC)可为伴血管侵犯及肝外转移者明显获益[7]。以FOLFOX(奥沙利铂、5-氟尿嘧啶、叶酸)-HAIC治疗HCC肿瘤反应率及患者生存率均较好[8];联合靶向药物[9]及程序性死亡蛋白-1(programmed cell death protein-1, PD-1)治疗不可切除HCC具有明显优势[10]。本研究观察FOLFOX-HAIC联合靶向及免疫治疗用于巴塞罗那临床肝癌(Barcelona clinic liver cancer, BCLC)-C期HCC的疗效及其安全性。
1 资料与方法
1.1 一般资料 回顾性分析2019年1月—2021年9月21例于清华大学附属北京清华长庚医院接受HAIC+靶向及免疫治疗的BCLC-C期HCC患者,男20例,女1例;年龄37~69岁,平均(55.4±11.2)岁;东部肿瘤协作组评分为1分10例、2分11例;Child-Pugh肝功能A级8例、B级13例;其中19例乙型肝炎病毒阳性;谷草转氨酶(glutamic-oxaloacetic transaminase, GOT)为46.70(28.65,63.65)U/L,谷丙转氨酶(glutamic-pyruvic transaminase, GPT)为57.60(42.30,87.35)U/L,总胆红素(total bilirubin, TBIL)为(22.56±2.21)mmol/L,白蛋白(37.47±1.16)g/L,甲胎蛋白(α-fetoprotein, AFP)为363.00(61.60,14 701.61)μg/L,异常凝血酶原Ⅱ(protein induced by vitamin K absence or antagonist-Ⅱ, PIVKA-Ⅱ)为2 347.96(140.56,26 162.92)mAU/ml。21例均为多发HCC,病灶平均直径(74.71±7.96)mm,其中16例伴肝外转移;PVTT分型为VP1~2型8例、VP3型8例、VP4型5例;部分患者既往曾接受TACE、放射及靶向治疗等,其中10例为TACE后复发或抵抗,5例靶向药物治疗后进展,3例放射治疗后复发,2例于同时接受放射、靶向及免疫治疗后进展。纳入标准:①经病理学确诊HCC,上腹部增强CT或增强MRI资料完整,BCLC-C期;②Child-Pugh肝功能为A/B级;③根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors, mRECIST)确定至少1个病灶可测量;④胆红素水平≤2倍正常上限。排除标准:①术后复发接受治疗;②HAIC或靶向免疫治疗不规律;③临床资料不完整。
1.2 治疗方案
1.2.1 HAIC 以Siemens Artist zeeⅢ biplane数字减影血管造影机为引导设备。局麻下以Seldinger技术穿刺右侧股动脉,置入动脉鞘,引入5F RH导管行腹腔干动脉造影,根据肿瘤供血情况,采用以奥沙利铂为基础的FOLFOX-HAIC化疗方案行HAIC:奥沙利铂每日50 mg输注2 h,予1~3日;5-氟尿嘧啶每日1.5 g输注12 h,予1~3日;亚叶酸钙每日300 mg输注2 h,予1~3日。间隔3~8周行1个周期化疗,直至肝内病变完全缓解(complete response, CR)、疾病进展(progressive disease, PD)或出现药物不耐受。采用美国国家癌症研究所不良事件通用术语标准(5.0版)评估治疗期间不良事件;根据欧洲肿瘤医学会临床实践指南[11]对免疫相关不良事件进行诊断、治疗和随访。
1.2.2 靶向治疗 对既往未服用靶向药物者,在HAIC治疗前1~4周予口服仑伐替尼或索拉非尼,仑伐替尼每日4 mg,索拉非尼200 mg,2次/日;若无法耐受,则改为口服阿帕替尼或瑞戈非尼,阿帕替尼每日250 mg,瑞戈非尼每日80 mg,根据患者耐受情况适当调整剂量。若因酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)不良事件而中止治疗,当不良事件恢复至1~2级时可继续口服TKI。
1.2.3 免疫治疗 于HAIC治疗周期内予静脉输注免疫检查点抑制剂(immune checkpoint inhibitors, ICI)PD-1抑制剂信迪利单抗200 mg/卡瑞丽珠单抗200 mg/特瑞普利单抗240 mg,每3周1次;遇疾病进展或出现肝功能损害时则停药,继续行HAIC及靶向治疗。
1.3 疗效评价 每2个周期HAIC后复查增强CT或MRI,根据mRECIST评价治疗效果;复查血常规、肝功能、AFP及PIVKA-Ⅱ等。记录患者OS、无进展生存期(progression free survival, PFS)、总缓解率(overall response rate, ORR)及疾病控制率(disease control rate, DCR)。
1.4 统计学分析 采用SPSS 27.0统计分析软件。以中位数(上下四分位数)表示不符合正态分布的计量资料,采用Wilcoxon符号秩和检验比较治疗前后AFP、PIVKA-Ⅱ差异。应用Kaplan-Meier生存曲线估算中位OS及PFS。P<0.05为差异有统计学意义。
2 结果
治疗2个周期后, AFP中位水平为184.07(9.45,7 147.93)ng/ml,PIVKA-Ⅱ中位水平为289.99(33.35,2 893.90)ng/ml,均较治疗前明显降低(Z=-3.883、-3.549,P均<0.001)。
2.1 生存评价 治疗3个月后,ORR、DCR分别为57.14%(12/21)和95.24%(20/21)。共随访4~33个月、中位时间15个月,期间13例因肿瘤进展死亡,患者中位OS为11.0[(95%CI(6.47,15.52)]个月,中位PFS为5.0[95%CI(4.23,5.76)]个月。见图1、2。
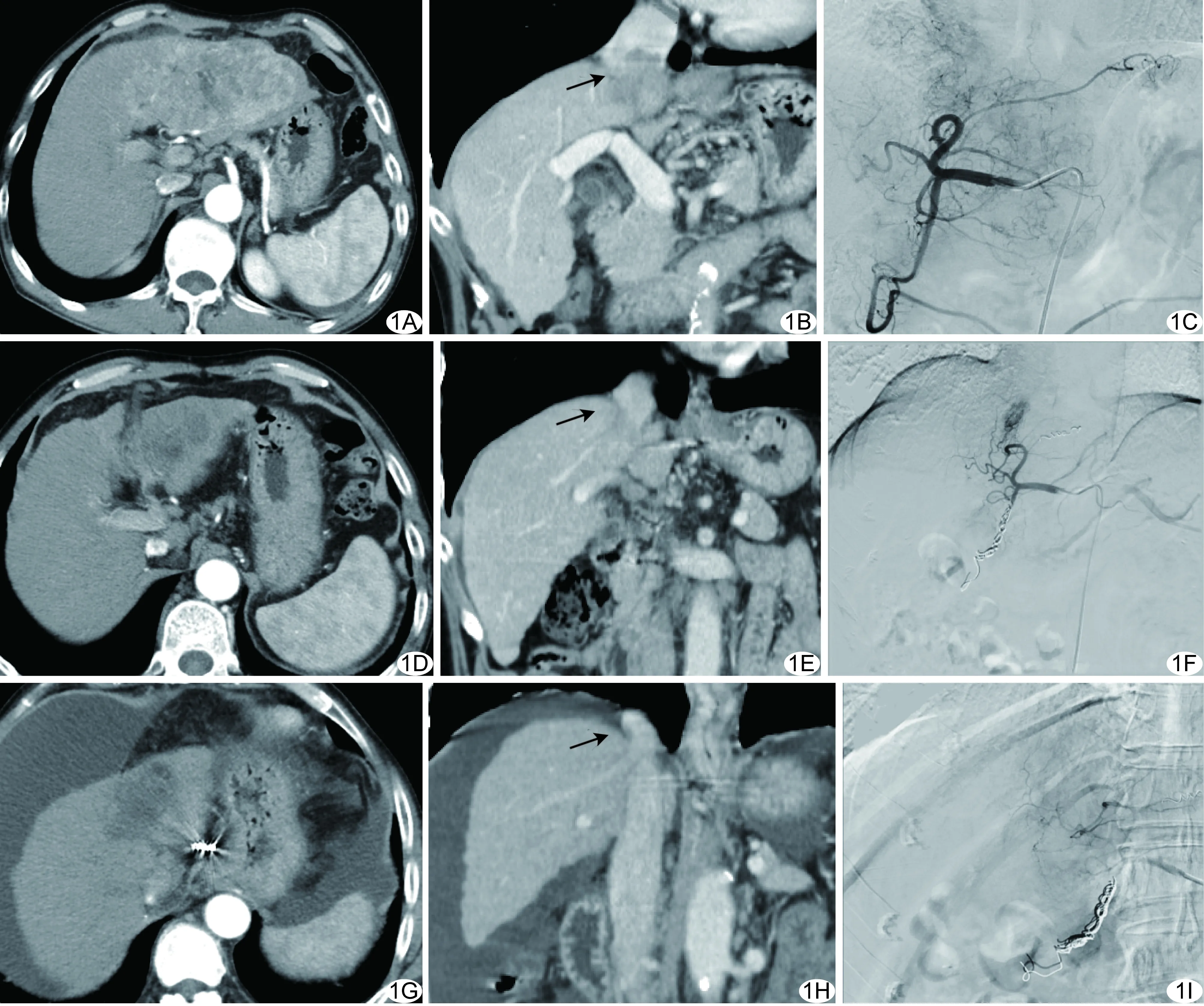
图1 患者女,64岁,HCC A~C.治疗前腹部轴位增强CT图(A)示肝内137 mm×70 mm×70 mm占位累及Ⅱ、Ⅲ及Ⅳ段,侵犯肝左、肝中静脉及门静脉左支(B,箭),造影图(C)示团块状肿瘤染色及条带状静脉癌栓染色,主要由肝左动脉供血; D~F.治疗2个周期后,增强CT图(D)示肿瘤体积缩小为54 mm×86 mm×47 mm,呈不均匀强化,肝中静脉显影(E,箭),造影显示肿瘤染色较前减少(F); G~I.4个周期治疗后,增强CT图(G)示肿瘤体积55 mm×30 mm×36 mm,可见肝中、肝左静脉及门静脉左支(H,箭),造影见肿瘤染色消失(I)
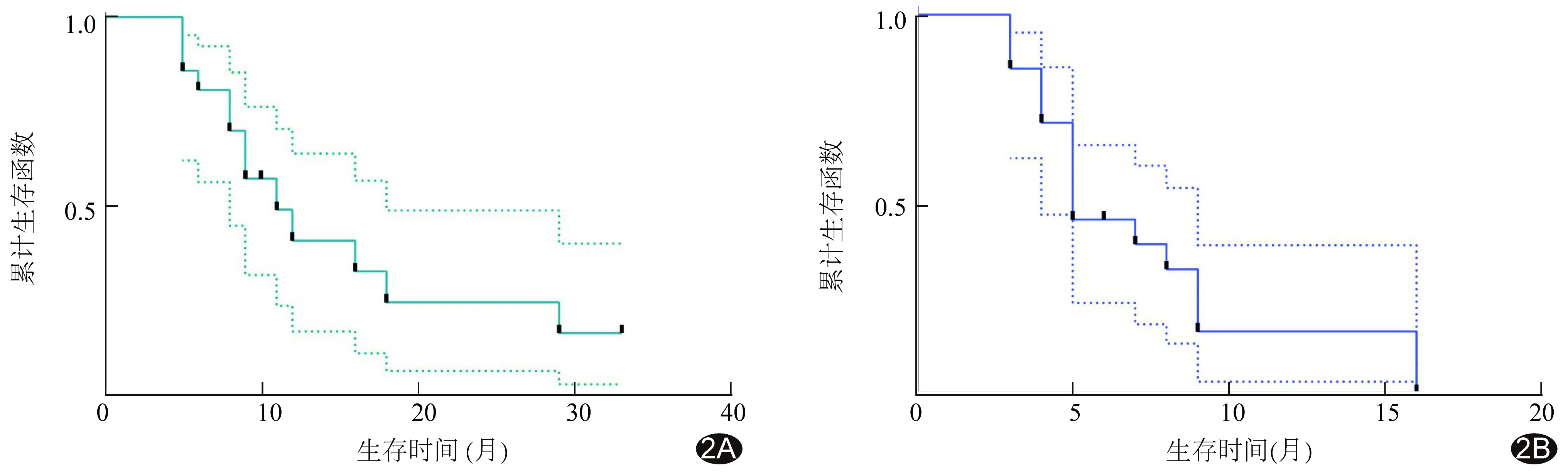
图2 接受FOLFOX-HAIC联合靶向及免疫治疗的BCLC-C期HCC患者生存曲线 A.OS; B.PFS
2.2 安全性和耐受性 治疗期间常见1~2级不良事件包括AST升高、TBIL升高、乏力;免疫相关不良事件包括急性糜烂性胃炎、甲状腺功能减退、高血压及手足综合征等,见表1。16例出现3级不良事件,其中1例发生免疫相关性肺炎并死于全身多器官脏器衰竭,其他15例不良事件均于下一治疗周期前恢复。
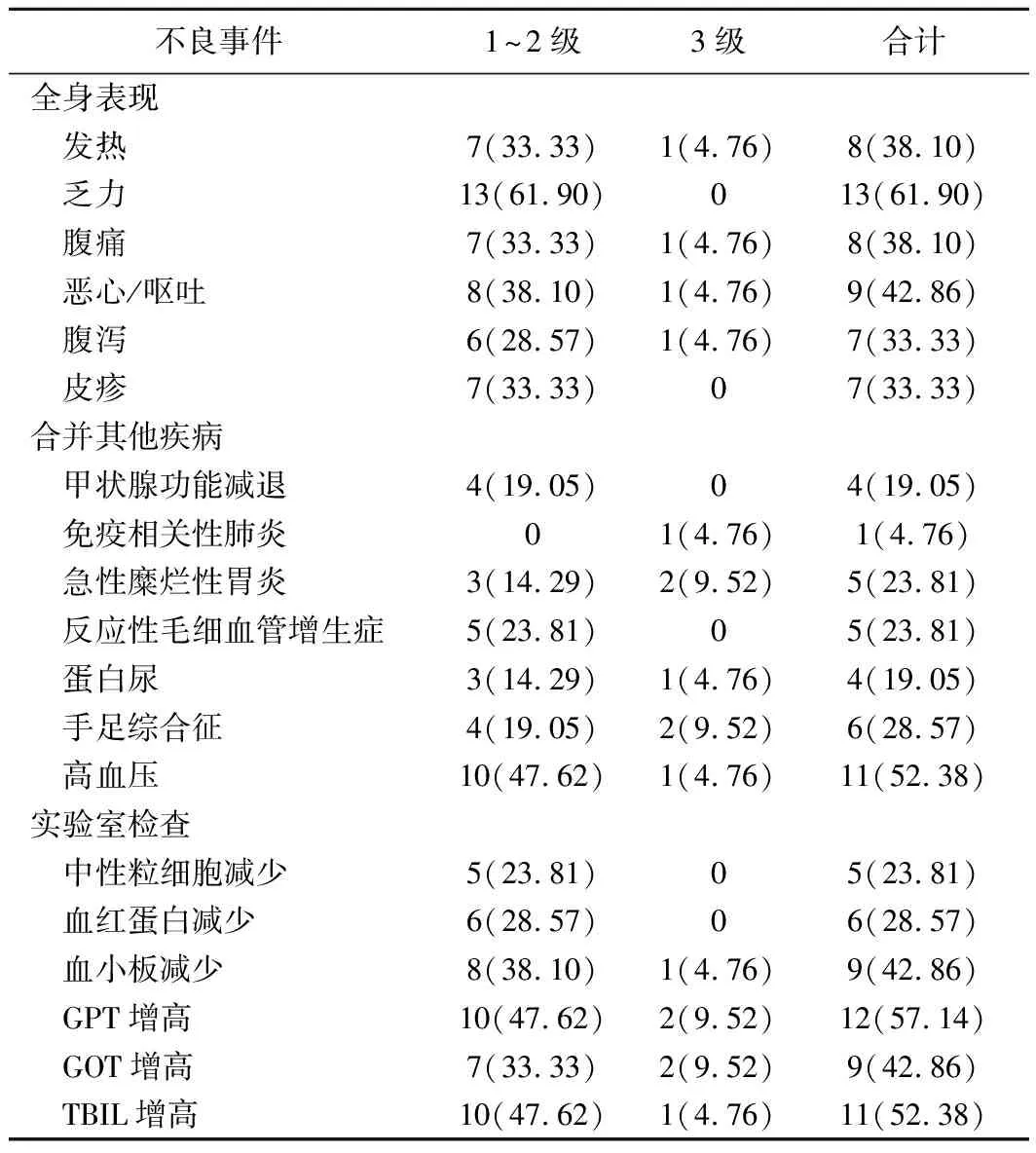
表1 FOLFOX-HAIC联合靶向、免疫治疗BCLC-C期HCC不良事件 [例(%),n=21]
3 讨论
TKI治疗晚期HCC后患者PFS约3.6个月,长期生存获益少[12];KEYNOTE-524 Ⅰb期研究中,免疫联合TKI治疗不可切除初治肝癌的PFS为8.6个月[13]。HAIC联合免疫治疗大体积、多发肝内HCC可使患者获益[14],但伴门静脉癌栓及肝外转移者并无明显生存获益[15-16]。UESHIMA等[7]对2 006例HCC患者进行分层对照研究,发现HAIC可为已发生血管侵犯及肝外转移的HCC患者带来显著生存获益。HAIC联合靶向治疗不仅可明显提高PFS和OS,也是治疗BCLC-C期HCC的潜在一线方案[17]。仑伐替尼联合帕博立珠单抗治疗BCLC-B/C期HCC具有一定效果[16]。对比单药,HAIC联合仑伐替尼、特瑞普利单抗可为晚期HCC患者带来显著生存效益,而毒性反应在可接受范围内,联合治疗后,初治且不伴PVTT的HCC患者的中位PFS达11.1个月[9]。LIU等[18]报道,HAIC联合靶向及免疫治疗初治晚期HCC同样安全、有效。
以索拉非尼和仑伐替尼作为一线治疗用于不伴PVTT或肝门部转移的晚期HCC后,患者PFS为3.6~7.4个月[12,19-20];而TKI不适用于肝功能较差者。PD-1或PD-L1抗体是治疗晚期HCC的二线方法,ORR较低而完全缓解率极低,PD-1抑制剂治疗晚期HCC的PFS约2.1个月[21]。联合阿替利珠单抗和贝伐珠单抗于2021年成为首个生存率优于索拉非尼的方案,并已作为治疗不可切除HCC的新一线标准方案[10,22]。仑伐替尼联合帕博利珠单抗治疗初治晚期肝癌后患者OS长达22个月[23]。HAIC联合靶向、免疫治疗不伴肝外转移的BCLC-C期HCC特别是对伴血管侵犯的晚期HCC[7]也显示出良好的安全性和有效性[9,14,18]。
HCC伴PVTT、肝门部转移多不能耐受全身化疗或确诊时已失去手术机会,伴PVTT者预后更差[5];而反复抗肿瘤治疗可能加重肝功能损伤或使肝储备功能下降。HAIC中,奥沙利铂可直接激活肿瘤微环境中的抗原表达及T细胞功能;TKI为多靶点酶抑制剂,在抑制血管内皮生长信号通路的同时增强PD-1抑制剂效果。HAIC联合免疫及TKI可提高BCLC-C期HCC伴PVTT/肝门部转移患者部分缓解率。免疫、靶向治疗可进一步清除残留病灶,使患者获得生存获益。本研究发现,HAIC联合ICI及TKI治疗后,ORR、DCR分别为57.14%和95.24%,与既往研究[21]相比提高了ORR(57.14%vs. 26.5%)。
本组随访4~33个月,中位时间15个月,患者中位OS为11.0个月、中位PFS为5.0个月,远低于上述报道,与本组病例均伴PVTT(其中76.19%伴肝外转移),且大部分为TACE抵抗或放疗、靶向治疗后复发或进展有关;而所获PFS与既往研究[5]相近。治疗期间1例因免疫性肺炎致重症感染,后死于多脏器衰竭,但多数不良反应可控,且停药后或下一治疗周期前均可好转,提示HAIC联合靶向及免疫治疗晚期HCC安全且可耐受。
综上,HAIC联合靶向及免疫治疗BCLC-C期HCC安全、有效。但本研究样本量小,且为单中心、回顾性研究,有待加大样本、开展多中心前瞻性研究进一步观察。