基于NMR和1H-MRI技术的不同糖度锦绣黄桃耐贮性评价
2022-12-01周慧娟叶正文张志强杜纪红曾思懿
周慧娟 叶正文 张志强 杜纪红 曾思懿
(1. 上海市农业科学院林木果树研究所,上海 201403;2. 上海市设施园艺技术重点实验室,上海 201403; 3. 上海思而腾农业科技发展有限公司,上海 201407)
锦系列鲜食黄桃是中国长江以南的主栽品种[1],常温不耐贮运,长期的低温冷藏易出现果肉褐变、糖酸比失调、挥发性物质丧失或异常积累等冷害症状。糖代谢可介导果实的风味代谢和成熟衰老进程,因此糖含量与黄桃果实冷害程度[2]和果实的贮运特性密切相关[3-4]。贮藏期间,水分通过参与果实的新陈代谢而影响内外品质的变化,水分状态和含量与果实的新鲜度和风味特征密切相关[5]。Herppich等[6]报道,胡萝卜水分状态与贮藏期间果实的硬度变化显著相关。
传统的果实水分测定方法无法区分水分状态,不能科学地解释水分与果实品质的相关性。核磁共振技术(NMR)通过测定氢质子密度变化来判定果蔬中水分的状态、分布及迁移规律,是一种无损检测技术[7-8]。Zhu等[9]采用NMR及成像技术研究贮藏期樱桃水分变化,结果表明樱桃样品组织的软化现象与水分损失密切相关,新鲜组织中水分分布均匀,随着贮藏时间的延长,游离水含量逐渐增加,从而引起组织内部损伤。Fundo等[10]利用NMR技术检测鲜切梨的水分状态,发现贮藏过程中水的状态变化与果实硬度、色差等密切相关。质子核磁共振成像(1H-MRI)技术可以激发物体吸收射频(RF)能量的能力,它不仅可以提供果蔬内部结构的高分辨率图像,还可以检测果蔬的内部损伤并评估果蔬耐贮性[11-15]。
研究拟以上海市农业科学院自主育成的锦绣黄桃为研究对象,测定不同糖含量黄桃在贮藏期间的TSS含量、呼吸强度、乙烯释放速率、果实质构的变化再利用NMR和1H-MRI技术测定贮藏期和货架期黄桃的水分含量及分布状态以评估黄桃的耐贮性,以期为果实品质智能检测提供技术支撑。
1 材料与方法
1.1 材料与仪器
以上海市农业科学院果树种植基地种植的锦绣黄桃果实为试材,试验园树龄10年,果实套黄袋。2021年8月16日,分别于60株树冠外围高约1~2 m处随机采取5 000个硬度一致、大小均匀、色泽均一、无机械伤和病虫害的果实,立即运回上海市农业科学院林木果树研究所实验室和冷库进行处理。
防雾保鲜袋:0.03 mm,零度包装科技有限公司;
无损糖度计:H100F型,北京阳光亿事达科技有限公司;
质构仪:TA. XT. Plus C型,英国SMS公司;
折光仪:ATAGO-1型,日本ATAGO公司;
气相色谱仪:GC7890A型,美国安捷伦科技公司;
红外线CO2气体分析仪:GXH-305型,泰仕电子工业股份有限公司;
核磁共振分析与成像系统:MZsoMR23-150H-I型,苏州纽迈分析仪器股份有限公司。
1.2 试验方法
1.2.1 试验处理 在果肉组织硬度一致的前提下(果肉组织硬度15~21 N),用无损糖度计对5 000个果实进行糖度测定并按照可溶性固形物含量(TSS)大小,将果实分为高糖组、中糖组、低糖组,详细见表1。每个处理组200个果实,每组设3个平行,共计1 800个果实。将各组果实置于温度为2~4 ℃、相对湿度为85%~90%的冷库中预冷和贮藏,在冷藏第0,14,21,28,35,(35+3)(即贮藏35 d后置于货架常温存放3 d)天时测定果实的呼吸强度、乙烯释放速率、可溶性固形物含量和果实质构,并利用NMR和1H-MRI技术测定各组果实的A2、T2及质子密度像。

表1 高、中、低糖组果实入库初始品质
1.2.2 指标测定
(1) 乙烯释放速率:参照王淼等[16]的方法稍加修改。15 ℃条件下,将5个桃子放置于容器为4 L的密闭容器中密封1 h,吸取1 mL混合气体,注入气相色谱仪中测定乙烯含量。
(2) 呼吸强度:参照周慧娟等[1]的方法,随机取5个果实,称重,置于与红外线CO2分析仪气路相连的4 L密闭塑容器中,15 ℃下测定CO2释放速率。
(3) 可溶性固形物(TSS):随机取20个果实,取果实缝合线左右赤道处对称部位果肉,用手持阿贝折光仪测定未经稀释的汁液可溶性固形物含量。
(4) 质构测定:质构仪的圆柱形探头(P/5)直径为5 mm,选用Two Deformation Test (TDT)进行两次下压,测前速度60 mm/min,测试速度120 mm/min,测后速度600 mm/min,触发力0.049 N。第一次下压距离为3 mm,测定参数为果皮硬度、果皮脆性,第二次下压距离为20 mm,获得参数为果肉硬度、果肉紧实度、果肉脆性。
(5) 自由水含量(A2)、弛豫时间(T2)和质子密度像:核磁共振分析与成像系统参数设置:硬脉冲90°脉宽5.8 μs,硬脉冲180°脉宽为10.64 μs,重复采样等待时间为6 000 ms,回波个数为15 000,重复采样次数为4,接受机带宽为50 kHz。将所得的测试数据进行10万次反演,得到横向弛豫时T2图谱。
1H-MRI运用MRI成像软件及MSE多层自旋回波序列采集样品横断面的质子密度图像。MRI成像参数:GSliceZ为-210,GPhaseY为40,GReadX为-40,TR为2 000 ms,TE为120 ms,累加2次,空间大小256×256。
1.3 数据处理
所有试验均设3次重复,使用Simca-p软件和SPSS 17.0软件进行主成分分析(PCA)和方差统计分析(ANOVA);采用Tukey方法对数据进行显著差异分析,结果以平均值±标准偏差表示。利用苏州纽迈分析仪器股份有限公司自主研发的核磁共振分析应用软件Ver 1.0分析图谱;利用Origin软件分析横向弛豫时间T2图谱。
2 结果与分析
2.1 可溶性固形物含量
由图1可知,高、中、低糖组果实均在贮藏的第28天出现TSS峰值,高糖组和中糖组果实TSS峰值显著高于低糖组果实(P<0.05)。贮藏后期(第28~35天)各组TSS呈下降趋势,说明果实品质劣变;货架期间,高、中、低糖组果实TSS含量均呈上升趋势,说明贮藏35 d后的锦绣黄桃,放置于常温(20~25 ℃)货架时,仍存在内含物代谢进程;整个贮藏期间,高糖组和中糖组果实TSS含量显著高于低糖组(P<0.05),说明提高果实的糖含量有利于提高果实的低温耐贮性,果实入库品质对贮藏和货架品质及后熟代谢进程密切相关[17]。

同一贮藏时间点字母不同表示处理间差异显著(P<0.05)
2.2 乙烯释放速率和呼吸强度
由图2可知,高、中、低糖组果实均在贮藏第28天出现呼吸强度高峰,且峰值无显著性差异。贮藏第0~21天,中、低糖组果实的呼吸强度显著高于高糖组的;货架期间,高、中、低糖组果实的呼吸强度均呈急剧上升趋势且高、低糖组果实的呼吸强度显著高于中糖组的(P<0.05)。
在贮藏的第14天,低糖组果实出现乙烯释放高峰,高、中糖组果实较低糖组果实延缓14 d出现乙烯释放高峰,且乙烯释放高峰值显著低于低糖组果实(P<0.05),与高糖含量可较好地维持冷藏期间桃果实膜稳定性、增强耐冷性有关[18];货架期间,高、中、低糖组果实乙烯释放速率呈急剧上升趋势,高糖组果实的乙烯释放速率显著高于中、低糖组果实的(P<0.05)。高糖组果实的呼吸强度高但乙烯释放速率低,具体机理需进一步研究。

同一贮藏时间点字母不同表示处理间差异显著(P<0.05)图2 各组果实呼吸强度和乙烯释放速率随时间变化规律Figure 2 The respiratory intensity and ethylene release rate of furits in each group changed with time
2.3 质构
由图3可知,贮藏前期(0~21 d),高、中、低糖组果实的带皮硬度、果肉组织硬度、果肉紧实度及果实咀嚼性均较稳定,贮藏后期(21~35 d),各组的质构参数值呈下降趋势。贮藏0~28 d时,高糖组果实的带皮硬度、果肉组织硬度、果肉紧实度及果实咀嚼性均高于低糖组果实的,说明高糖组果实质构特性佳;高、中糖组果实的果肉组织硬度、果肉紧实度及果实咀嚼性无显著差异。货架期间,高、中、低糖组果实的带皮硬度、果肉组织硬度、果肉紧实度及果实咀嚼性进一步下降,且各组间无显著差异,说明在同等成熟度条件下,当锦绣黄桃果实的可溶性固形物含量低于12%时,贮藏期间果实的质构会受到一定的影响,进一步说明入库品质对贮藏和货架品质影响的重要性。
可溶性固形物含量、果实呼吸强度、乙烯释放速率和果实质构的测定均损坏了果实样品,而NMR和1H-MRI是无损测定技术,可用于评价不同糖度等级黄桃果实耐贮性的差异性。

同一贮藏时间点字母不同表示处理间差异显著(P<0.05)图3 高、中、低糖组果实质构特性的变化Figure 3 Changes of fruit texture properties in high, medium, and low sugar groups
2.4 T2和A2
T2反映了氢质子的结合力和自由度,与果实质地密不可分[19]。束缚的氢质子越多或自由度越小,T2越短;T2拉长,峰值右移[20]。图4为锦绣黄桃的T2弛豫谱,T2在500~1 000 ms时,果肉细胞毛细管中的水被定义为自由水,其对应的峰积分面积经计算后得自由水含量为A2,与Zhou等[21]的结论一致,与冯蕾[5]在黄瓜和樱桃中报道的4个峰值有一定差异,可能与锦绣黄桃果实中的水主要以自由水的状态存在有关。

图4 入库时锦绣黄桃果实的弛豫时间和自由水含量
2.5 果实内部质子密度及水分分布
贮藏期间,果蔬的细胞结构和完整性发生改变,膜的渗透性增加,从而导致水分迁移[22]。1H-MRI技术可直接评估贮藏和货架期间高、中、低糖组果实内部水分分布和迁移情况,质子密度图中蓝色表示质子密度低,红色表示质子密度高,红色区域内氢质子、水分含量越多,亮度越大[23]。由表2可知,新鲜样品(贮藏第0天)的水分分布比较均匀,水分含量较高,且果皮、果肉及果核的轮廓较清晰。随着贮藏时间的延长,果实水分含量下降。对于低糖组,贮藏0~14 d,果实质子密度无显著性变化,果实水分变化较小;贮藏21~35 d,果实内部质子密度降低,可能是因为破裂细胞的液体取代了细胞间隙中的空气,减少了磁场梯度上的总界面面积,这与此期间果实带皮硬度、果肉组织硬度、果肉紧实度及果实咀嚼性下降的趋势一致[9],说明该时间点为果实内部自由水含量降低的关键点,与果实品质劣变的关键时间点一致;货架期间,低糖组果实内部质子密度进一步降低,与A2变化趋势一致,果核周围的水分散失较为明显,果核与果肉间明显出现一条缝隙,果肉中靠近果皮的水分也在轻微的减少,可能是因为货架期间温度骤然升高导致黄桃果实呼吸强度增强从而加速水分散失,靠近果核处的呼吸强度较靠近果皮处的强,与黄瓜样品果实水分含量的变化和迁移过程主要发生在果肉部分的结论[5]一致。对于高糖组,贮藏0~21 d,果实内部质子密度变化不显著,水分分布比较均匀,水分含量较高;贮藏21~35 d及货架期间,果实内部质子密度呈增加趋势,亮度增加,说明果实内部自由水含量较高,较好地保持了果实固有品质。Mazhar等[22]研究表明,水分含量的变化及水分迁移的过程与果实细胞壁的分解等物理化学变化密切相关。低糖组锦绣黄桃果实自由水含量损失较多可能是因为长期冷藏导致果实细胞及细胞器膜通透性增加,使得水与大分子物质之间接触而发生相互作用,从而产生相对流动性更强且易挥发的自由水[24-25]。综上,高含量的可溶性固形物可以较好地保持锦绣黄桃贮藏期间果实细胞膜的完整性,产生抗冷性,提高果实的贮藏性。
2.6 基于自由水含量的主成分分析
为了观察不同贮藏时间点高、中、低糖组黄桃果实的自由水含量是否有显著差异,采用主成分分析方法对果实的自由水含量进行分析,如图5所示。经过降维处理后贮藏期间高、中、低糖组黄桃果实两个主成分的累计贡献率为90.6%,其中第一主成分(PC1)的贡献率为70.2%,第二主成分(PC2)的贡献率为20.4%。结果表明,PC1和PC2可较好地反映样本的自由水含量信息,高、中、低糖组及6个贮藏时间的果品在主成分空间中处于相对独立的空间,得到了有效区分。PC1与3个变量(高糖组、中糖组和低糖组)较强相关,PC2主要与自由水信号和T2相关。由图5可知,在PC1的投影上,高、中、低糖组果实的自由水含量和T2均随贮藏时间发生了显著性变化,且在同一贮藏时间下,高、中、低糖组果实从低到高变化的范围逐渐变小,说明贮藏时间可以调控各组的自由水含量和T2的变化;在PC2的投影上,自由水含量和T2在不同组间的变化差异明显大于组内的,说明可溶性固形物含量对果实自由水含量和T2的变化有显著的调控作用。
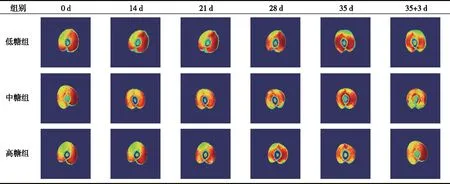
表2 贮藏和货架期间果实质子密度成像图
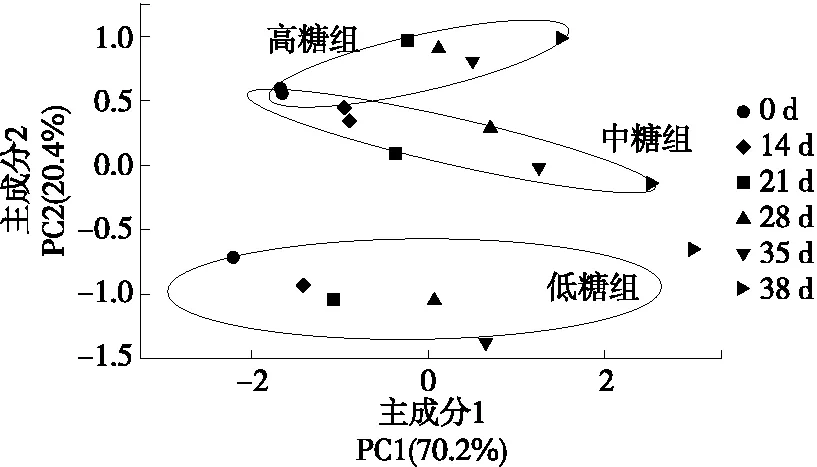
图5 贮藏期间黄桃果实自由水含量的主成分分析
2.7 基于自由水含量的聚类分析
选用层次聚类分析法中的最短距离法对贮藏及货架期间高、中、低糖组果实自由水含量进行聚类分析,结果如图6所示。高、中、低糖组果实的自由水含量被聚为3个类群,即由高糖组果实组成的类群Ⅰ,由中糖组果实组成的类群Ⅱ,由低糖组果实组成的类群Ⅲ,结果表明高糖组、中糖组和低糖组果实的自由水含量有显著差异。

图6 贮藏期间黄桃果实自由水含量的聚类分析Figure 6 Cluster analyses of free water content of yellow peach fruit during storage
在聚类分析的基础上结合黄桃果实的自由水含量可进一步将不同贮藏时间的高、中、低糖组果实样品聚为4个类群,类群Ⅰ包含贮藏0 d和14 d的果品,类群Ⅱ包含贮藏21 d的果品,类群Ⅲ包含贮藏28 d和35 d的果品,类群Ⅳ包含第38天(即货架期第3天)的果品,聚类结果与黄桃果实贮藏品质的结果一致,随着时间的延长,果实的品质和自由水含量发生变化。
2.8 果实内部水分迁移及水分流动性
冯蕾[5]报道,果蔬内部有4种状态的水存在,分为细胞壁水、细胞质水、细胞间隙水及液泡水,其中液泡水(自由水)流动性最强。贮藏期间,自由水最先流失,自由水含量(A2)是果实品质的重要指标[26],黄桃果实T2和A2与果实的软化密切相关[21]。NMR技术可有效地监测和预测桃贮藏过程中的水分含量。由表1和图7可知,随着贮藏时间的延长,中糖和低糖组果实A2呈下降趋势。低糖组果实在贮藏的第14天出现乙烯释放高峰,在贮藏的第21天出现果实硬度和自由水含量呈急剧下降趋势,最后在贮藏第28天出现呼吸强度释放高峰,说明自由水含量的变化与果实的质构密切相关[21]。高含量的糖可抑制贮藏期间果实A2的下降,使果实保持较高的自由水含量和果肉组织硬度及紧实度;货架期间,高糖组果实A2呈显著上升趋势,进一步说明了高糖组果实可保持较高的新鲜度和较好的固有品质状态,与Zhu等[9]报道的樱桃样品组织的软化现象与贮藏过程中的水分损失密切相关的结论一致。
随着贮藏时间的延长,低糖组果实自由水含量降低,果肉水分逐渐向内迁移,与陈森等[27]报道的樱桃在常温贮藏和低温条件下的水分迁移规律一致,说明贮藏期间低糖组果实内自由水含量降低,且货架期间果实的软化未引起汁液的增加,与冷害的发生症状一致。中、高糖组果实可保持较高的自由水含量,抑制果实自由水变为结合水而导致的果实冷害的发生,与Møller等[28]报道的低温贮藏可以降低黄桃中细胞质水和细胞间隙水的含量,提高液泡水的含量的结论一致。
T2对氢质子的状态变化较为敏感,而果蔬中的氢质子主要来源于水分子及糖类物质,因此在贮藏过程中,由于代谢作用,驰豫时间随水分及糖含量发生变化。由图8可知,在贮藏第0~21天时,中糖组和低糖组果实弛豫时间(T2)不变,说明果实中被束缚的氢质子较多,内部结构紧密,结合力大;随着贮藏时间的延长(贮藏21~35 d及货架期间),中糖和低糖组果实弛豫时间延长,峰值持续右移,说明果实中被束缚的氢质子降低或自由度变大,与该期间果实带皮硬度、果肉组织硬度、果肉紧实度及果实咀嚼性下降的趋势一致。贮藏14~35 d及货架期间,高糖组果实弛豫时间(T2)延长,峰值持续右移,高糖组持续时间较果实软化点提前7 d出现,说明果实中的含糖量可能影响弛豫时间,与高糖果实中被束缚的氢质子较少或自由度大有关[20]。整个贮藏和货架期间,高、中糖组果实A2和T2显著高于低糖组果实,说明整个冷藏期内高中糖组果实可保持较高的自由水含量,货架期间果实可正常软化,汁液丰富。

同一贮藏时间点字母不同表示处理间差异显著(P<0.05)图7 贮藏和货架期间锦绣黄桃的自由水含量的变化

同一贮藏时间点字母不同表示处理间差异显著(P<0.05)图8 贮藏和货架期间锦绣黄桃的弛豫时间的变化
3 结论
以锦绣黄桃为研究对象,测定不同贮藏期间黄桃的可溶性固形物含量、呼吸强度、乙烯释放速率、果实质构的变化,再利用核磁共振技术和质子核磁共振成像技术测定贮藏期和货架期黄桃的水分含量及分布状态以评估黄桃的耐贮性。结果表明,入库时可溶性固形物含量低于12%时,贮藏期的果实品质下降,因此入库时可溶性固形物含量应不低于12%;低、中、高糖组黄桃中,高糖组黄桃的自由水含量最高,耐贮性最好,可以通过抑制果实自由水变为结合水从而保持较好的品质;0~14 d为高、中糖组锦绣黄桃的优质保鲜期,21 d为安全保鲜期,28~35 d为品质劣变期,货架期可达3 d。果实自由水含量和质子核磁共振成像与果实质地的相关性需进一步研究和验证,如何将质子核磁共振成像技术与果品的无损分选设备相结合也是未来的研究方向之一。
