扩散峰度与扩散张量成像对比评估兔周围神经急性挤压伤
2022-12-01万齐余煜栋包盈莹夏晓颖王鹏彭玉刘洁琼谢晓斌李新春
万齐,余煜栋,包盈莹,夏晓颖,王鹏,彭玉,刘洁琼,谢晓斌,李新春
扩散峰度成像(diffusion kurtosis imaging,DKI)是传统扩散张量成像(diffusion tensor imaging,DTI)技术上的延伸,可用于反映组织内非高斯分布水分子扩散情况[1]。目前DKI已逐步应用于中枢神经系统且在部分中枢神经系统疾病中被证明能较DTI提供额外信息[2-4];但目前使用DKI评估周围神经创伤的相关报道很少。与DTI相比,DKI能否在评估周围神经急性创伤时亦提供额外信息目前尚不明确。本研究使用DKI及DTI对兔坐骨神经挤压伤模型进行监测,以期明确DKI在周围神经损伤评估的可行性及对比两者在评估周围神经病变的价值。
材料与方法
1.模型建立
选用清洁级新西兰大白兔27只(广东省动物实验中心提供),雌雄不限,体重1.8~2.3 kg。速眠新肌注诱导麻醉后,经耳缘静脉注射3%戊巴比妥钠麻醉,常规消毒备皮。实验兔取左侧卧位,于右侧大腿上段沿股骨背侧长轴纵向切口约2 cm,钝性分离股二头肌与股直肌及内收长肌间隙,暴露坐骨神经,速眠新肌间隙内滴注局部麻醉,合上血管钳轻轻提起坐骨神经远端并用自制扁嘴钳夹持坐骨神经30 s,见神经纤细变薄但未离断,然后以丝线分层缝合切口。左后肢行假手术,以相同方式暴露坐骨神经并滴注速眠新后直接缝合创口。
2.MRI扫描及测量
采用超导型3.0T MR机(Achieva,Philips)及兔专用线圈,分别于术前、1天、3天、1、2、4、6、8周行MRI扫描。扫描序列:T2WI/SPAIR:TR 3000 ms,TE 66 ms,NSA 2,层厚2 mm,采集矩阵172×137,重建矩阵528×528,FOV 120×120。DKI序列:TR 1129 ms,TE 111 ms。层厚/层间距:2 mm/0 mm,b值(0,750,1500)s/mm2,扩散编码方向medium(15方向),FOV 120 mm×120 mm,采集矩阵80×79,体素1.4×1.4 mm。DTI序列:TR 1092 ms,TE 106 ms。层厚/层间距:2 mm/0 mm,b值(0,1000)s/mm2,采集矩阵80×79,体素1.4 mm×1.4 mm,扩散编码方向medium,FOV 120 mm×120 mm。
DKI及DTI图像后处理采用IMAge/enGINE Beta V2.0.3(Vusion Tech,Hefei,China.)由2名有经验的影像科医师协商一致后在损伤侧神经手动勾画感兴趣区(ROI)行数据测量(图1),然后将ROI 复制到假手术侧神经进行测量。MRI数据分析采用在各时间点均有完整数据的11只兔进行分析。

图1 DTI及DKI定量参数测量ROI放置示意图。a)T2WI-SPAIR;b)DTI图(b=1000 s/mm2;c)FADKI伪彩图;d)ADC图;e)MK图。测量ROI的放置与神经走行保持一致(箭),面积约15mm2,避开周围脂肪、肌肉等组织。
3.病理检查
于各时间点随机选取2只兔子,使用过量麻醉将兔处死并解剖兔的下肢。兔取侧卧位双大腿屈曲,取股骨下横向切口为入口,沿肌间隙钝性分离,暴露、游离坐骨神经,取损伤段神经一段立即置于4%戊二醛磷酸缓冲液中预固定,l%四氧化锇后固定,系列乙醇脱水,Epon812 环氧树脂包埋,LKB-Ⅲ型超薄切片机切半薄切片定位,再切超薄切片,片厚50 nm,经醋酸铀和柠檬酸铅双重染色后用Hitachi H-600电子显微镜观察。
4.统计学分析
结 果
1.坐骨神经损伤后常规MRI表现
兔坐骨神经挤压伤后1天,T2WI/SPAIR序列显示兔子坐骨神经信号增高,神经所在肌间隙增宽,神经及周围软组织水肿;3天~1周损伤段神经肿胀加重,信号进一步增高,边界模糊,神经及周围软组织水肿持续存在;至损伤后2周,神经肿胀增粗及信号增高较前稍改善。损伤后4~8周,损伤段神经形态、信号逐渐恢复,水肿基本消退。假手术侧神经在损伤后1天,T2WI信号稍增高,神经所在间隙稍增宽,周围软组织少许水肿,损伤后3天~2周神经信号逐步恢复,周围软组织少许水肿基本消退,其后各时间点对照侧神经形态信号未见明确异常(图2)。

图2 兔坐骨神经挤压伤前后T2WI/SPAIR信号改变系列图像。a)损伤前坐骨神经在T2WI/SPAIR上表现为均匀线状高信号影;b)损伤后1天,损伤段(箭)坐骨神经信号稍模糊,远端神经肿胀,周围软组织水肿;假手术侧神经亦稍模糊,周围见少许高信号影;c)3天,损伤侧神经走行稍扭曲呈条状高信号影,粗细不均,周围软组织高信号增多;假手术侧神经信号升高,边界较清; d)1~2周,损伤侧神经高信号影走行变直,神经中段见明显膨隆,软组织高信号影逐渐吸收;假手术侧坐骨神经信号较前减低,形态均匀,趋于正常; e)2周,损伤侧神经局部仍肿胀,对照侧神经信号基本恢复正常;f)4~8周,损伤侧神经水肿逐步减轻,信号逐渐减低;g)6周,损伤侧神经水肿进一步减轻;h)8周,神经信号进一步降低。
2.坐骨神经损伤后DTI及DKI各参数值变化
DTI参数:损伤后第1天,损伤侧FADTI下降至最低点;3天~8周各时间点FA值逐步回升,至8周上升至最高点,各时间点FADTI值与假手术侧差异有统计学意义(P<0.001)。双侧ADC值于损伤后第1天明显升高,差异无统计学意义。损伤侧第3天-第6周ADC值逐渐降低,第8周时稍升高;假手术侧第3天-第8周ADC值逐渐降低。第8周两侧ADC值差异有统计学意义(P=0.038),余时间点差异均无统计学意义。
DKI参数:术后第1天损伤侧及假手术侧神经MK值明显下降,此后开始缓慢、曲折上升趋势,损伤侧与假手术侧MK值在术后第2周(P=0.022)、第4周(P=0.018)、第6周(P=0.016)及第8周(P=0.016)差异有统计学意义。双侧FADKI值于损伤后第1天均明显下降,损伤侧 FADKI值下降幅度明显大于假手术侧,差异有统计学意义(P=0.001);3天-8周双侧FADKI值呈逐渐上升趋势,以假手术侧上升较损伤侧快,各时间点差异均有统计学差异(P=0.001、0.004、0.000、0.000、0.001、0.000)。双侧RK值在第1天明显下降,其后各时间点RK值波动较大,第6周双侧神经RK值差异有统计学意义(P=0.018)。双侧AK值损伤后各时间点差异均无统计学意义(图3、表1~3)。
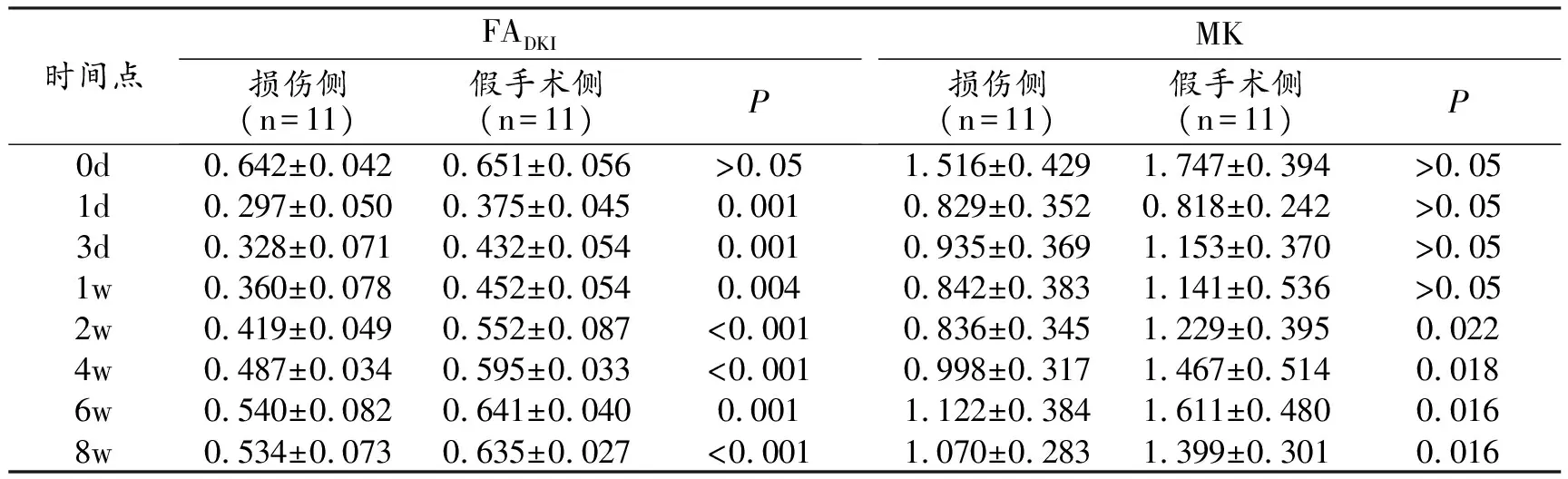
表1 DKI参数(FADKI与MK)在损伤侧与假手术侧不同时间点的比较

图3 坐骨神经损伤侧及对照侧DTI及DKI各时间点参数值变化;a)FADTI值;b)ADC值;c)MK值;d)FADKI值;e)RK值;f)AK值。*P<0.05,**P<0.005。
3.电镜改变
正常神经髓鞘结构完整,髓鞘呈层板状,轴索排列整齐,走行平直、分布均匀。损伤后第1天、第3天有髓神经呈脱髓鞘状的洋葱皮样改变,轴索轻度萎缩,见大量神经微丝,线粒体肿胀、空化。施万细胞胞质见溶酶体,同时见大量自噬体形成,核染色质凝集、边集。损伤后第1周、第2周,有髓神经结构较前改善,髓鞘轻度皱缩,轴索见大量神经微丝,部分轴索轻度萎缩,见少量蜂窝状结构形成,周围见少量新生薄髓神经。损伤后第4周,轴索开始增生,雪旺细胞开始增生,并见神经外膜与神经束膜之间炎症细胞浸润减少。损伤后第6周,髓鞘逐渐增厚, 髓鞘菲薄且不均匀,再生轴索较前明显并成熟,雪旺细胞广泛增生,板层结构稍紊乱,周围大量新生薄髓纤维。损伤后第8周,轴索密度、直径较前增加,髓鞘明显较前增厚,板层结构逐渐恢复接近正常,厚薄欠均匀(图4)。

表2 DKI参数(RK与AK)在损伤侧与假手术侧不同时间点的比较
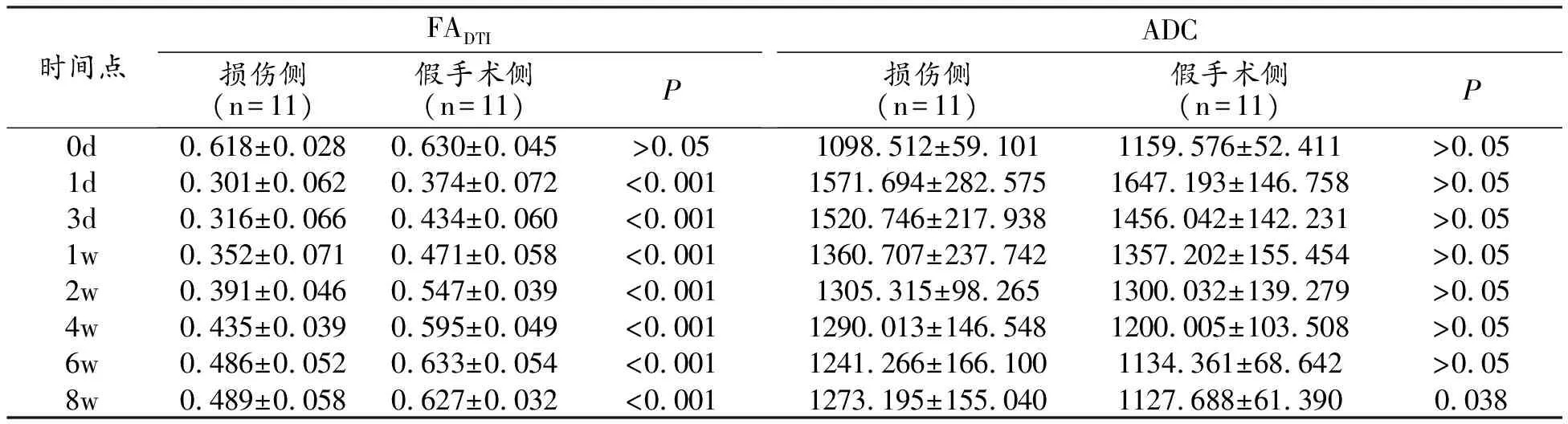
表3 DTI参数(FADTI与ADC)在损伤侧与假手术侧不同时间点比较

图4 兔坐骨神经挤压伤后各时间点电镜检查(×10000)。a)正常兔坐骨神经髓鞘结构完整,髓鞘呈层板状,轴索排列整齐,走行平直、分布均匀;b)损伤后第1天,有髓神经呈脱髓鞘状的洋葱皮样改变,轴索轻度萎缩,见大量神经微丝,线粒体肿胀、空化;c)损伤后第3天,神经髓鞘明显破坏,见大量炎性细胞聚集;d)损伤后第1周,神经髓鞘轻度皱缩,轴索见大量神经微丝,部分轴索轻度萎缩;e)损伤后第2周,见少量蜂窝状结构形成,周围见少量新生薄髓神经;f)损伤后第4周,见部分新生轴索,雪旺细胞增生,神经外膜与神经束膜之间炎症细胞浸润减少;g)损伤后第6周,髓鞘较前增厚,不均匀,再生轴索较前明显并成熟,大量新生薄髓纤维;h)损伤后第8周,轴索较前增加,髓鞘明显较前增厚,板层结构逐渐恢复接近正常。
讨 论
扩散峰度成像是一种可量化组织内水分子非高斯运动的一种新的扩散成像技术,是对传统DTI技术的扩展与补充,其对组织某些特性如异质性更加敏感[1,5]。研究表明 DKI在评估轻度脑外伤疾病[6]、急性脑梗塞[7]、阿尔兹海默病[3]等中枢系统疾病时能比DTI显示更多的组织信息及微观改变;然而目前两者在周围神经系统对比研究较少。
本研究中损伤侧和假手术侧神经的ADC值在各时间点几乎均无统计学意义,说明手术与假手术侧造成的水肿与消退的变化在各时间点几乎一致。本研究结果显示无论DTI还是DKI,其所得FA值具有类似的时间变化曲线。FA值均在术后第1天明显降低至最低值,这可能是由于神经内部结构的破坏,神经局部炎性反应及水肿造成周围神经水分子扩散各向异性降低[8]。损伤后第3天-第8周,损伤段FA值持续升高,这一方面可能与损伤后的大量微丝、微管及施万细胞的增殖以及炎性细胞对崩解残余物质的清除、水肿消退有关;另一方面,2周后神经内逐渐出现轴突的增生、新生薄髓神经增多并成熟,原受损的有髓神经的修复,这使得各向异性增加,FA值升高所致[9]。这与其他DTI评估周围神经损伤的文献中在神经退变时FA值减低而神经再生时FA值升高一致[10-12]。
MK值为平均扩散峰度,其大小与感兴趣区域内组织结构的复杂程度有关。组织结构越复杂,平均峰度的数值越大,反之亦然。本研究术后第一天,损伤侧及假手术侧MK值明显下降,这与两侧神经都出现了明显水肿有关;另外神经损伤后发生脱髓鞘改变也会降低MK值[13]。此后MK值开始缓慢、曲折上升的趋势,仅在2周后各时间点与假手术侧差异具有统计学意义,这可能与微丝、微管及施万细胞的增殖及有髓神经的修复导致受损神经结构的复杂性增加有关。我们发现与FA值相比MK在评估周围神经方面未能优于FA;这与之前的一项周围神经的研究[14]相似,但与中枢神经系统的研究[15]不同。这可能是由于MK对于复杂纤维排列区域(如大脑)的异常更为敏感,而周围神经(如坐骨神经)的结构相对简单直接,故MK在周围神经的应用可能并无优势。
RK、AK值分别反应纵向和轴向方向上的平均扩散峰度,两者分别量化了平行和垂直方向上的非高斯扩散受限程度。在损伤后第1天,损伤侧与假手术侧RK值较损伤前显著下降,这说明在垂直方向上的水分子非高斯扩散受限程度明显降低;但同一时间点两组间RK值并无明显差异,这可能是由于损伤侧与假手术侧神经及其周围间隙都出现了明显水肿所致。此后,损伤侧与假手术侧RK值逐渐恢复,其中假手术侧恢复明显更快,但两组RK值差异仍无统计学差异,这可能是由于RK值具有较大的标准差所致,这也反映出RK值具有较大的变异度。这一方面可能是由于高b值弥散图像的噪音对参数计算产生影响[16];另一方面可能由于兔坐骨神经较为细小,测量容易受到部分容积效应的影响。
本研究显示AK值在各时间点出现轻度波动并与病理改变无明显相关性,这与中枢神经损伤的相关研究[3]中AK值出现下降的情况并不一致。这可能与周围神经中枢神经的解剖结构有一定差异有关。由于周围神经存在包括神经内膜、神经束膜和神经外膜在内的多层结构包裹,限制了垂直于轴突长轴方向的水分子的运动,从而使得轴向扩散性增高,这种特点可能会导致轴向方向上非高斯扩散受限程度较低,以至于周围神经损伤后改变不足以引起明显的AK值变化。
本研究存在一些局限性。首先,本研究所使用的后处理软件不支持提供DTI的本征向量值参数;其次,兔坐骨神经较为细小,故定量参数的测量可能受到容积效应的影响;最后,本研究未进行观察者一致性的评价,需在今后进一步研究中完善。
总之,DKI可用于周围神经挤压伤的评估;FA、MK值可作为评价周围神经挤压伤后神经损伤和修复的指标;但扩散张量参数FA优于包括MK在内的其他扩散峰度参数。虽然DKI也能提供DTI参数,但与DTI相比,DKI具有更长的成像时间且未能提供额外的价值,故在评估周围神经急性损伤方面,DTI可能是临床应用的更好选择。
