米曲霉β-半乳糖苷酶的定向进化、高效表达及应用
2022-11-30李晨霞向芷璇江正强闫巧娟马俊文
李晨霞, 向芷璇, 李 敬, 江正强*, 闫巧娟, 马俊文
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业大学 工学院,北京 100083)
β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23),又称乳糖酶,具有水解和转糖苷两种催化活性[1],广泛存在于植物、动物和微生物中。微生物β-半乳糖苷酶具有发酵周期短、产酶量大、催化活性高和稳定性好等优点。目前,工业应用的β-半乳糖苷酶主要来源于曲霉属(Aspergillus sp.)和克鲁维酵母属(Kluyveromyces sp.),曲霉属β-半乳糖苷酶是胞外酶,最适pH在酸性范围内(pH 2.5~5.4),最适温度一般为50~60℃[2]。米曲霉(Aspergillus oryzae)的基因组中包含有6个β-半乳糖苷酶基因,目前已报道的3个来源于米曲霉的β-半乳糖苷酶基因(O58、AO、O76)均属于GH35家族,可在毕赤酵母GS115表达[3]。其中,米曲霉β-半乳糖苷酶(AO)具有优良的水解和转糖苷活性,研究较多,尤其是在分子改造和固定化方面[4-7]。采用密码子优化和组成型启动子PGAP将该酶在毕赤酵母SMD1168H中高效表达[4];通过组成型启动子PGCW14和源自酵母的自我复制序列(PARS)构建关于该酶的非甲醇诱导游离型表达载体[5];经过定点突变,获得突变体(N140C/W806F)的转糖苷能力提高了24.1%[6];通过制备共聚物(Col-Al/Col-Al-Glu)将该酶进行固定化,实现该酶的重复利用[7]。米曲霉β-半乳糖苷酶能够水解牛奶中的乳糖,可有效改善乳糖不耐症,在乳制品行业中具有重要的应用价值,但水解效率和表达水平亟待提高。
通过分子改造提高β-半乳糖苷酶的水解效率,是提升其应用价值的有效方法之一。定向进化将乳酸克鲁维酵母(Kluyveromyces lactis)β-半乳糖苷酶水解乳糖的效率提高2倍[8];凝结芽孢杆菌(Bacillus coagulans)β-半乳糖苷酶第148位Asn突变为Asp,降低水解产物半乳糖的抑制作用,提升水解效率,但突变体的酶活力仅为野生型的13.5%[9];嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)β-半乳糖苷酶第351位Glu突变为Arg,提高了该酶对于乳糖的亲和力,突变体的最适pH提高了0.5,比活力由1.86 U/mg提高到6.56 U/mg[10];极端嗜热古菌(Pyrococcus furiosus)β-半乳糖苷酶第415位Asn突变为Ser,改变了活性中心疏水基团的结构,提高了该酶在巴氏灭菌温度下牛奶中乳糖的水解效率,但突变体的酶活力仅120 U/mL[11]。这些研究通过定向进化及定点突变提高了水解效率,但β-半乳糖苷酶的表达水平较低。毕赤酵母具有胞外高效表达、发酵工艺成熟、成本低等特点,已用于表达多种β-半乳糖苷酶[12],如亮白曲霉(Aspergillus candidus)β-半乳糖苷酶在毕赤酵母中表达的酶活力达3 600 U/mL[13]。米曲霉β-半乳糖苷酶在毕赤酵母中表达的酶活力为4 239 U/mL[4]。因此,同时提高米曲霉β-半乳糖苷酶的水解效率及表达水平,更有利于工业化应用。
米曲霉β-半乳糖苷酶(AoBgal35A)最适pH及温度分别为pH 4.5及60℃[6]。作者利用定向进化技术对AoBgal35A进行分子改造,在毕赤酵母中高效表达水解率提高的突变体,进一步评价突变酶在制备无乳糖牛奶中的应用潜力。
1 材料与方法
1.1 主要试剂及仪器
Fast Pfu DNA聚合酶:北京全式金生物技术公司产品;rTaq DNA聚合酶和DNA Marker:Takara公司产品;限制性内切酶和T4 DNA连接酶:New England Biolabs公司产品;真菌基因组DNA提取试剂盒:北京百泰克生物技术有限公司产品;Axyprep DNA凝胶回收试剂盒:AxyGen公司产品;总RNA提取试剂盒和质粒提取试剂盒:天根生化科技(北京)有限公司产品;Lowry法蛋白质浓度试剂盒:北京索莱宝公司产品;MyCycler PCR自动扩增仪:美国BIO-RAD公司产品;CBIO-GelPro凝胶成像分析系统:北京赛百奥科技有限公司产品;FUG-5 L单层玻璃机械搅拌发酵罐:上海国强生化工程装备有限公司产品;GL-20B高速冷冻离心机:上海安亭科学仪器厂产品;蛋白质纯化系统:上海青浦沪西仪器厂产品;Q-Sepharose强阴离子交换柱:美国GE Healthcare公司产品;TU-1800PC紫外可见分光光度计:北京普析通用仪器设备有限责任公司产品;Kieselgel 60硅胶板:德国Merck公司产品;高效液相色谱(high performance liquid chromatography,HPLC)系统:Agilent Technologies公司产品;其他试剂如无特殊说明均为分析纯。
1.2 菌株及培养基
米曲霉(中国普通微生物菌种保藏管理中心NO.3.0411)菌株由作者所在实验室保藏[14];大肠杆菌DH5α感受态细胞和毕赤酵母GS115:北京全式金生物有限公司产品;质粒pPIC9K:美国Invitrogen公司产品。
MM(minimal methanol)培养基:YNB 13.4 g/L,生物素4×10-4g/L,甲醇10 g/L,琼脂15 g/L;其他培养基的配置与文献[12]相同。
1.3 实验方法
1.3.1 β-半乳糖苷酶随机突变体文库的构建使用真菌基因组DNA提取试剂盒和总RNA提取试剂盒分别提取米曲霉基因组DNA和总RNA,采用PolyATract mRNA Isolation Systems(Promega)从 米曲霉总RNA中纯化mRNA,并合成cDNA第一链。根据AoBgal35A基因序列(GenBank登录号为KF857462),设计引物AoBgal35AF:5′-ATGAAGCT CCTCTCTGTTGCT-3′和AoBgal35AR:5′-TTAGTATG CTCCCTTCCGCT-3′,以米曲霉基因组cDNA为模板,扩增基因。PCR反应体系:5×Fast Pfu Buffer 10 μL,2.5 mmol/L dNTPs 4 μL,10 μmol/L上、下游引物各1 μL,模板1 μL,Fast Pfu DNA聚合酶1 μL,补ddH2O至50 μL。PCR反应条件:95℃,3 min;95℃,20 s,55℃,20 s,72℃,3 min;反应循环34次;72℃,5 min。胶回收PCR产物作为易错PCR模板。设 计 特 异 性 引 物Ao-F:5′-GTCATTAC GTAGCTT CCATCAAGCATCGTCTC-3′和Ao-R:5′-CTCAGCC TAGGTTAGTATGCTCCCTTCCGCTG-3′,采用不同浓度的Mg2+和Mn2+对米曲霉β-半乳糖苷酶基因(AoBgal35A)进行易错PCR扩增。易错PCR反应体系如下:0.1 mmol/L Mn2+或0.2 mmol/L Mn2+1 μL,5 mmol/L Mg2+或7 mmol/L Mg2+1 μL,0.2 mmol/L dGTP和dATP各1 μL,1.0 mmol/L dCTP和dTTP各1 μL,0.2 μmol/L Ao-F/R各1 μL,1.25 U rTaq DNA聚合酶1 μL,模板1 μL,5×rTaq Buffer 10 μL,用纯水补足至50 μL。易错PCR反应条件:95℃,3 min;95℃,30 s;55℃,30 s;72℃,3 min;反应循环34次;72℃,10 min。
易错PCR产物经1 g/dL琼脂糖凝胶电泳验证后进行胶回收,用限制性内切酶SnaBⅠ和AvrⅡ分别酶切胶回收产物和载体pPIC9k。用T4 DNA连接酶于16℃连接过夜,连接产物热激转化大肠杆菌DH5α感受态细胞,涂布于含氨苄青霉素(100 μg/mL)的LB平板,37℃倒置培养12~16 h,即为随机突变体文库。经菌落PCR验证,选取10个阳性转化子测序。收集随机突变体文库所有转化子接入LB培养基中,于37℃摇床培养4~5 h,提取质粒经限制性内切酶Pme I线性化,通过乙醇沉淀回收,电击转化毕赤酵母GS115感受态细胞,转化步骤参考毕赤酵母发酵手册(Version B,053002,Invitrogen)操作。转化产物均匀涂布于MD平板,于30℃培养箱静置培养72 h。
1.3.2 β-半乳糖苷酶随机突变体文库的筛选利用X-gal固体培养基进行初筛,牙签挑取MD平板上的单克隆,点到涂有20 mg/mL X-gal溶液的MM平板上,30℃培养48 h。产β-半乳糖苷酶的菌株经甲醇诱导产酶后,可水解X-gal,从而形成深蓝色菌落。挑取初筛具有β-半乳糖苷酶酶活力的菌株,接种于BMGY培养基,30℃、200 r/min培养24 h后转接于BMMY培养基中,在30℃、200 r/min培养72 h,每隔24 h补加0.5%(体积分数)的甲醇诱导产酶。发酵液经离心,收集上清液即为粗酶液。粗酶液进行水解活性复筛,以5 g/dL乳糖为底物,加酶量5 U/mL,在pH 4.5、50℃条件下反应4 h后,将样品煮沸5 min灭酶。采用薄层层析法(thin layer chromatography,TLC)定性分析水解产物,样品于TLC分析板上展层2次,展层剂为正丁醇、乙醇、水(体积比为5∶3∶2),用显色剂完全浸湿吹干后在180℃显色,显色剂为浓硫酸和甲醇(体积比为5∶95),标准品为葡萄糖、半乳糖和乳糖。乳糖水解率提高的突变体为正向突变体。将筛选到的正向突变体mAoBgal35A进行基因测序,与野生型AoBgal35A的基因进行序列比对分析,确定mAoBgal35A的突变位点。
1.3.3 β-半乳糖苷酶突变体(mAoBgal35A)的高密度发酵及纯化选取正向突变体mAoBgal35A转化毕赤酵母GS115,进行高拷贝筛选。用无菌水将MD平板上的His+转化子重悬,菌液适当稀释后,分别涂布于不同浓度G418-YPD平板上,30℃倒置培养2~5 d。挑取不同转化子,摇瓶发酵3 d,测定上清液的酶活力。选择酶活力最高的菌株进行高密度发酵,采用5 L发酵罐进行发酵,发酵方法及相关培养基配制参照毕赤酵母发酵手册(Version B,053002,Invitrogen)操作。发酵液于4℃、12 000 r/min离心15 min,收集上清液即为粗酶液,粗酶液在缓冲液(20 mmol/L磷酸钠盐,pH 7.0)中透析过夜。利用QSepharose强阴离子交换柱纯化重组蛋白质,以0.4 mL/min流量上样。交换柱预先用10个柱体积的缓冲液(20 mmol/L磷酸钠盐,pH 7.0)平衡,经含0~500 mmol/L NaCl的20 mmol/L(pH 7.0)磷酸钠盐缓冲液线性洗脱,收集具有酶活力的组分,采用SDSPAGE分析蛋白质纯度,纯化后的蛋白质于pH 5.0柠檬酸缓冲液中透析。
1.3.4 β-半乳糖苷酶的酶活力及蛋白质质量浓度的测定β-半乳糖苷酶酶活力的测定参照文献[15]的方法。在1.5 mL的离心管中加入75 μL 15 mmol/L的oNPG和150 μL 50 mmol/L的柠檬酸-柠檬酸三钠缓冲液(pH 5.0),55℃预热3 min后加入25 μL适当稀释的酶液,55℃反应10 min后加入750 μL的2 mol/L Na2CO3终止反应,在410 nm下测定释放的邻硝基苯酚(oNP)的量。酶活力单位定义:在上述反应条件下,每分钟催化oNPG水解释放1 μmol邻硝基苯酚所需的酶量定义为1个酶活力单位(U)。参照Lowry法[16]测定蛋白质的质量浓度,以牛血清蛋白(bovine serum albumin,BSA)作为标准蛋白质。
1.3.5 β-半乳糖苷酶的酶学性质测定最适pH测定:采用50 mmol/L不同pH的缓冲溶液(柠檬酸-柠檬酸三钠,pH 3.0~6.0;磷酸氢二钠-磷酸二氢钠,pH 6.0~7.0;Tricine,pH 7.5~8.0),按照标准方法测定不同pH下的酶活力,以酶活力最高点为100%,分别计算不同pH下的相对酶活力。
pH稳定性测定:参照文献[17]的方法,用上述不同pH的缓冲液稀释酶液至约1 mg/mL于50℃保温30 min,然后迅速将样品置于冰水浴中冷却30 min,按照标准方法测定其残余酶活力,以未经处理的纯酶液酶活力为100%计算相对酶活力。
最适温度测定:分别在不同温度条件下(30~75℃)的柠檬酸-柠檬酸三钠缓冲液(pH 5.0)中测定酶反应最适温度。以酶活力最高点为100%,分别计算不同温度下的相对酶活力。
温度稳定性测定:参照文献[17]的方法,酶液用柠檬酸-柠檬酸三钠缓冲液(pH 5.0)稀释至约1 mg/mL后,置于不同温度(30~75℃)下保温30 min,然后迅速将样品置于冰水浴中冷却30 min,测定其残余酶活力,以未经处理的纯酶液酶活力为100%计算相对酶活力。
动力学参数测定:以50 mmol/L最适pH缓冲液配制1.5~5.0 mmol/L的oNPG为底物,按照标准方法于最适温度下反应5 min后测定其比活力。通过GraphPad Prism 6软件,根据Michaelis-Menten进行非线性拟合计算突变酶的动力学参数。
1.3.6 β-半乳糖苷酶突变体mAoBgal35A的水解特性及制备无乳糖牛奶水解特性:利用柠檬酸-柠檬酸三钠(pH 5.0)缓冲液配置的5 g/dL乳糖为底物,在55℃和加酶量5 U/mL的条件下水浴保温,分别在5 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h取样,样品煮沸5 min灭酶。TLC检测方法如1.3.2所示。HPLC检测方法:以葡萄糖、半乳糖、乳糖的混合溶液(终质量浓度为1 mg/mL)作为标准品,色谱柱为BP-800Pb++,检测器为示差折光检测器(RAD),流动相为纯水,进样体积为10 μL,流量为0.6 mL/min,柱温为80℃。水解率的计算公式为:
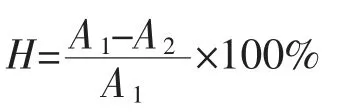
式中:H为水解率,%;A1为初始乳糖质量浓度,g/dL;A2为取样时乳糖质量浓度,g/dL。
制备无乳糖牛奶:在鲜牛乳中添加β-半乳糖苷酶mAoBgal35A,在室温下优化加酶量(1、2、3、4、5 U/mL),定时取样后样品煮沸5 min灭酶,以乳糖质量浓度及水解率为指标,通过HPLC进行定量分析。
1.3.7 数据处理与分析采用Origin 9.0进行数据统计分析和绘图。
2 结果与分析
2.1 米曲霉β-半乳糖苷酶(AoBgal35A)随机突变体文库的筛选
调整易错PCR体系中Mg2+和Mn2+的浓度使碱基随机错配,从而构建随机突变体文库[18]。当Mg2+为5 mmol/L、Mn2+为0.1 mmol/L时,随机突变体文库的氨基酸突变率为0.26%,处于合理突变范围内[19]。平板初筛10 000个突变体,300个突变体具有β-半乳糖苷酶活性,TLC分析水解产物,153个突变体具有水解活性。复筛到一个水解率明显提升的正向突变体,命名为mAoBgal35A,经序列比对,突变第955位的苏氨酸Thr突变为丙氨酸Ala。
2.2 突变体mAoBgal35A的高密度发酵及纯化
突变体经G418-YPD平板筛选,摇瓶发酵酶活力最高为48 U/mL。经5 L发酵罐高密度发酵,甲醇诱导168 h后,发酵液中β-半乳糖苷酶的平均酶活力和蛋白质质量浓度分别为4 760 U/mL和22 mg/mL,菌体质量浓度为390 g/L(见图1(a))。SDS-PAGE结果表明(见图1(b)),随着发酵时间的延长,相对分子质量为110 000处的蛋白质条带逐渐变粗,与野生型AoBgal35A的相对分子质量一致[4],发酵上清液中β-半乳糖苷酶的含量逐渐增多。经QSepharose强阴离子交换柱纯化得到电泳级纯酶(见图1(c)),比活力由216 U/mg提高到250 U/mg,纯化倍数1.2,回收率57.3%。
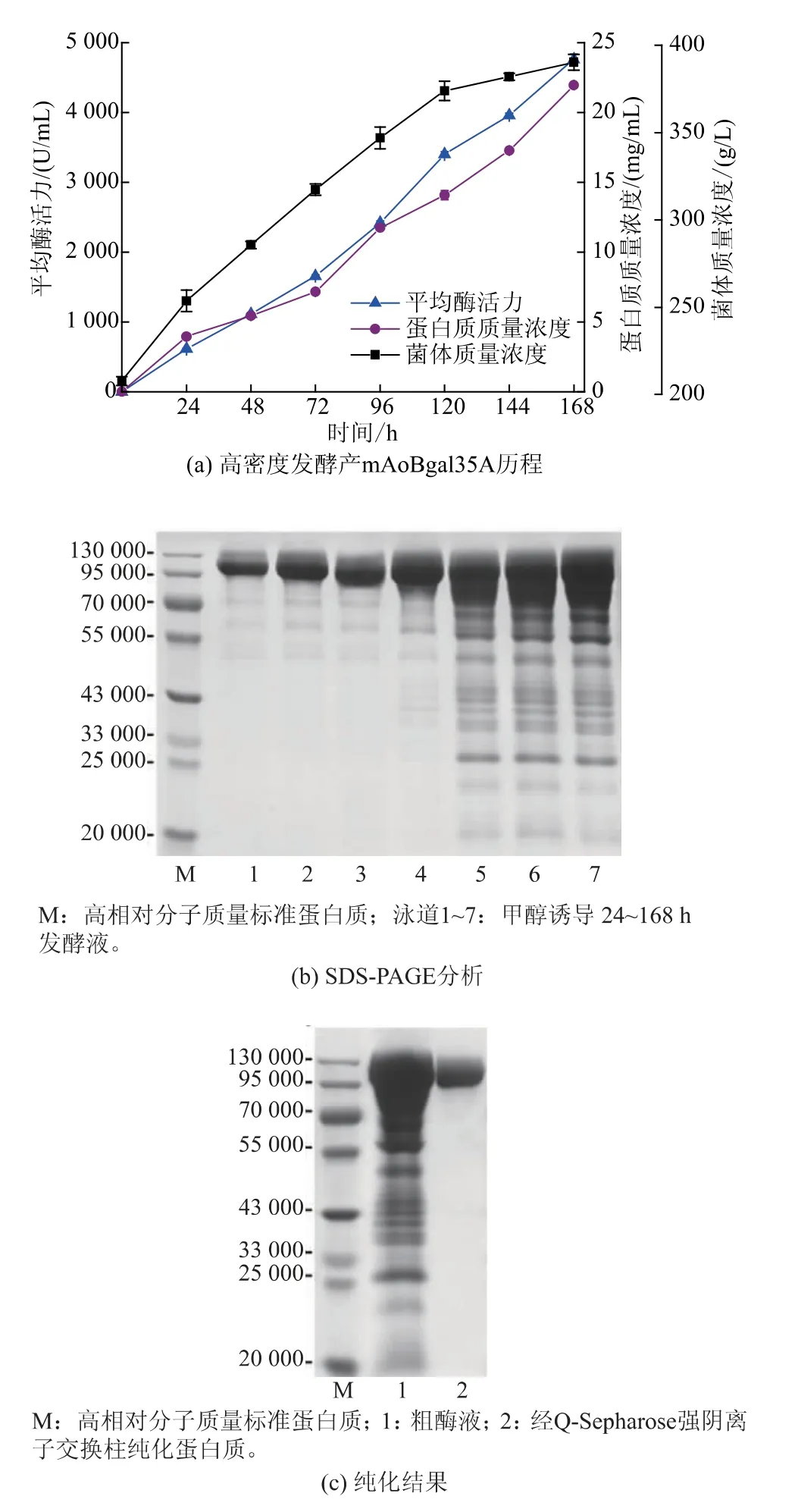
图1 毕赤酵母高密度发酵产mAoBgal35A历程、SDSPAGE分析及纯化Fig.1 Time-course of mAoBgal35A produced by Pichia pastoris,SDS-PAGE and purification of the extracellular fermentation
2.3 突变体mAoBgal35A的酶学性质
mAoBgal35A的最适pH为5.0,比野生型(pH 4.5)提高0.5(见图2(a)),在pH 4.0~7.0保持80%以上的酶活力,比野生型(pH 4.5~5.5)在更广泛的范围内保持稳定(见图2(b))。mAoBgal35A的最适温度为55℃,比野生型(60℃)降低5℃(见图2(c)),mAoBgal35A在60℃以下保持80%以上的酶活力,较野生型(≤55℃)稳定性稍有提高(见图2(d))。mAoBgal35A对oNPG的Km为(2.89±0.18)mmol/L,低于野生型((4.51±0.30)mmol/L),表明突变体对底物具有更高的亲和力。同时,mAoBgal35A对oNPG的催化效率(kcat/Km)为246.98 mmol/(L·s),是野生型 (191.61 mmol/(L·s))的1.3倍,表明mAoBgal35A具有更高的催化效率。
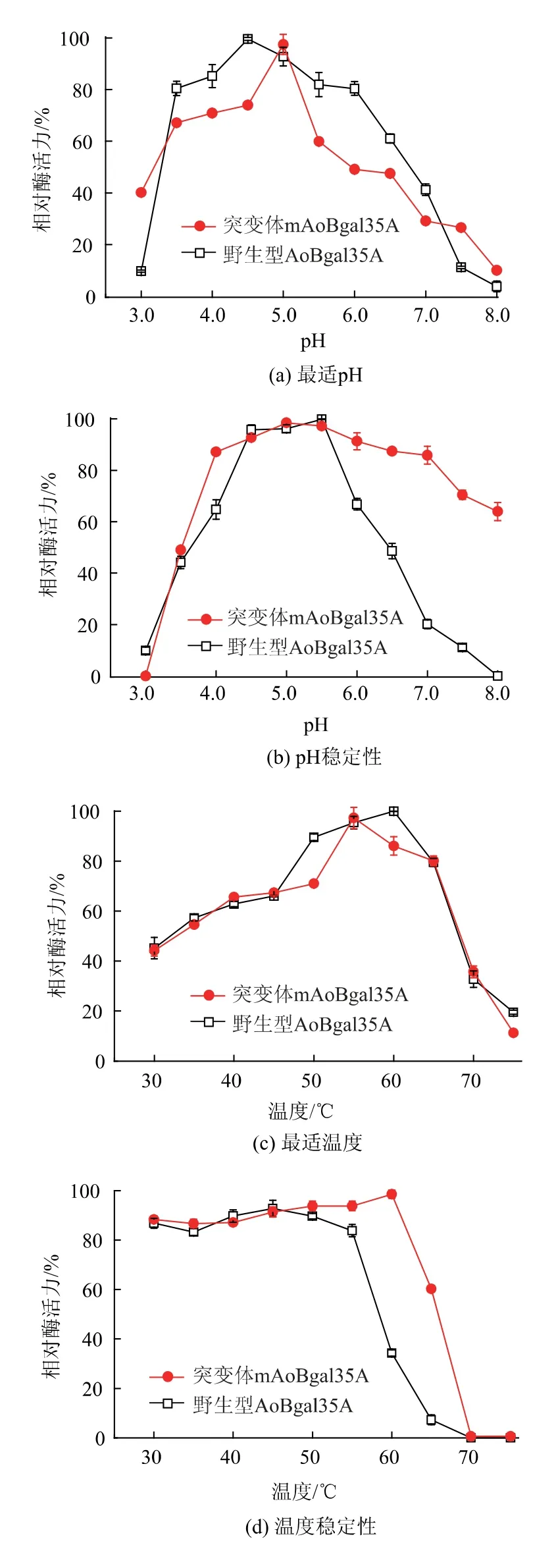
图2 AoBgal35A和突变体mAoBgal35A的最适pH、pH稳定性、最适温度及温度稳定性Fig.2 Optimal pH,pH stability,optimal temperature and thermostability of AoBgal35A and mAoBgal35A
2.4 突变体mAoBgal35A水解特性及制备无乳糖牛奶
mAoBgal35A水解乳糖的结果如图3所示,以5 g/dL乳糖为底物,在pH 5.0和55℃的条件下反应4 h,水解率由84.2%提高到95.2%。
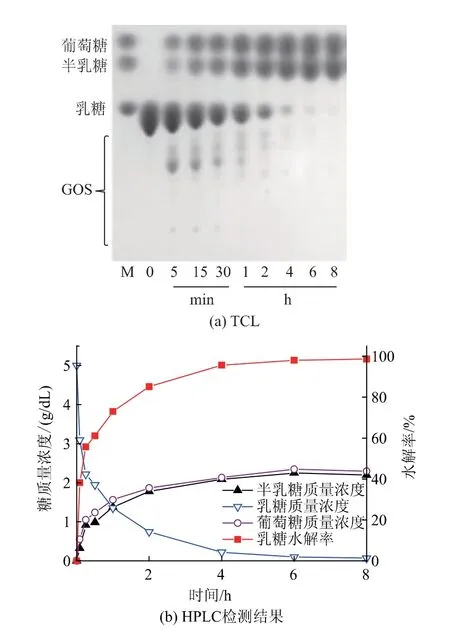
图3 mAoBgal35A水解乳糖的TLC和HPLC检测结果Fig.3 TLC and HPLC of hydrolysis lactose in milk by mAoBgal35A
mAoBgal35A水解牛奶中乳糖的结果如图4所示,主要考察在室温条件下突变体mAoBgal35A水解牛奶中的乳糖的应用。通过加酶量优化,发现随着加酶量的增加,水解相同含量的乳糖所需的时间逐渐缩短,当加酶量为2 U/mL时,水解72 h,牛奶中的乳糖基本被完全水解,乳糖水解率为90.0%,牛奶中乳糖质量浓度为0.38 g/dL,根据我国《食品营养标签管理规范》中有关《食品营养声称和营养成分功能声称准则(卫监督发[2007]300号)》,达到了无乳糖牛奶标准(乳糖质量浓度≤0.5 g/dL)。牛奶色泽乳白,奶香浓郁,无不良风味。
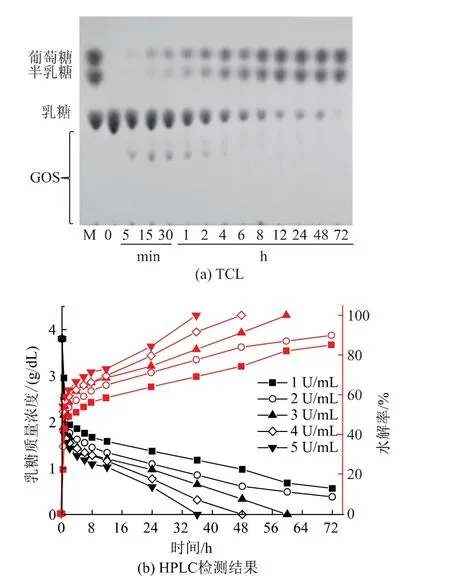
图4 mAoBgal35A水解牛奶中乳糖的TLC和室温下加酶量优化的HPLC检测结果Fig.4 TLC and HPLC of hydrolysis lactose in milk with different enzyme dosage at room temperature by mAoBgal35A
3 讨论
目前提高β-半乳糖苷酶水解能力主要采用定向进化和定点突变的方法[8-11]。作者通过易错PCR对米曲霉β-半乳糖苷酶AoBgal35A进行定向进化,获得一个乳糖水解率明显提高的突变体mAoBgal35A。突变体在毕赤酵母GS115中异源表达,经高密度发酵,胞外酶活力为4 760 U/mL,高于米曲霉β-半乳糖苷酶在毕赤酵母KM71(4 239 U/mL)[4]、毕赤酵母GS115(1 434 U/mL)[20]和黑曲霉(2 640 U/mL)[21]中 的 表 达 水 平。 同 时, 产 酶(mAoBgal35A)水平也高于大多数β-半乳糖苷酶在毕赤酵母的表达水平,如来源于亮白曲霉(Aspergillus candidus,3 600 U/mL)[13]、 节 杆 菌(Arthrobacter sp.,1 926 U/mL)[22]及 泡 盛 曲 霉(Aspergillus awamori,347.8 U/mL)[23]等的β-半乳糖苷酶。mAoBgal35A的高效表达使其在工业生产中具有较好的应用潜力。
mAoBgal35A的最适pH及温度分别为5.0和55℃,比野生型AoBgal35A(pH 4.5和60℃)分别提高了0.5和降低了5℃。mAoBgal35A的最适催化条件与大多数霉菌来源的β-半乳糖苷酶相似,如铜绿拟青霉(Paecilomyces aerugineus,pH 4.5和60℃)[24]、黑曲霉(Aspergillus niger,pH 3.5~4.5和50~60℃)[25]和构巢曲霉(Aspergillus nidulans,pH 5.0和60℃)[26]等,但高于乳酸克鲁维酵母(Kluyveromyces lactis,pH 4.4和37℃)[27]来源的β-半乳糖苷酶。mAoBgal35A的pH稳定性比野生型AoBgal35A(pH 4.5~5.5)有所提高,在pH 4.0~7.0保持稳定,与泡盛曲霉(Aspergillus awamori,pH 4.7~7.5)[23]来源的β-半乳糖苷酶相近,优于黑曲霉(Aspergillus niger,pH 3.5~5.5)[25]和土曲霉(Aspergillus terreus,pH 4.5~6.5)[28]来源的β-半乳糖苷酶。
序列分析表明,AoBgal35A与米曲霉来源β-半乳糖苷酶(AobGal,PDB:4IUG)有99%的同源性。AobGal的三维结构由6个结构域组成,一个中心催化域被5个反平行的β-三明治结构域包围,排列成马蹄形或字母C形[29]。突变体分析如图5所示,mAoBgal35A中突变的氨基酸Thr955位于第五结构域的β-片层结构,与其周围的Asp897和Asn951形成氢键相互作用。苏氨酸突变为丙氨酸减少了一个Thr955和Asp897之间的氢键,可能使其最适温度有所降低。苏氨酸突变为丙氨酸,替换了苏氨酸的长侧链,疏水残基Ala取代了亲水残基Thr,可能会影响蛋白质亲疏水平衡,从而对蛋白质的稳定性有一定的影响。如扩展青霉脂肪酶突变体K202A与随机突变体(ep8)叠加突变使其热稳定性有一定的提高[30]。同时,极性残基Thr突变为非极性残基Ala,使该部分区域极性下降,可能是最适pH变化的原因之一[31]。Thr955位于酶分子表面,远离催化口袋,与底物没有直接的相互作用。Thr955突变为丙氨酸增强了蛋白质的疏水性,这可能有助于在水溶液条件下形成更紧密的酶-底物复合物,从而提高水解活性[32]。如位于蛋白质结构表面的突变体V88A和S157P、K207G和D37V由于增加了蛋白质的疏水性而提高了酶活性[33]。
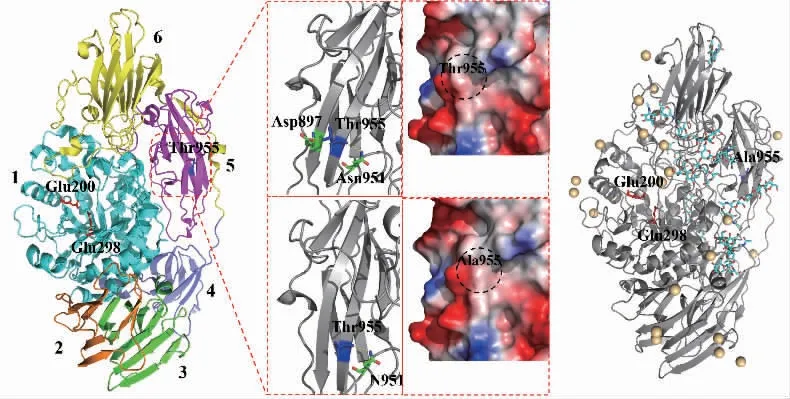
图5 AoBgal35A和mAoBgal35A的结构、改变位点、作用力及表面电荷分布示意图Fig.5 Structure,mutant sites,molecular force changes and surface charge distribution of AoBgal35Aand mAoBgal35A
牛奶的pH为6.5~6.8,突变体mAoBgal35A在pH 7.0仍能保持80%以上的酶活力,适合水解牛奶中的乳糖。mAoBgal35A在室温及加酶量为2 U/mL水解72 h时,牛奶中乳糖质量浓度为0.38 g/dL,达到无乳糖牛奶标准。而野生型AoBgal35A在加酶量为20 U/mL时,室温水解72 h,牛奶中乳糖质量浓度为0.6 g/dL[4]。可见,mAoBgal35A的加酶量仅需野生型的10%,即可达到更好的水解效果。欧文氏菌(Erwinia sp.E602)来源的β-半乳糖苷酶在加酶量为3 U/mL时,12 h水解牛奶中60%的乳糖[34]。嗜冷杆菌(Cryobacterium sp.LW097)来源的β-半乳糖苷酶Bgal322在加酶量为5 U/mL时,24 h仅水解牛奶中8.4%的乳糖[35]。因此,mAoBgal35A优良的水解特性使其在制备无乳糖牛奶方面具有很好的工业化应用价值。
4 结语
对米曲霉β-半乳糖苷酶(AoBgal35A)基因进行定向进化,筛选到正向突变体mAoBgal35A,在毕赤酵母中高效表达,酶活力达4 760 U/mL,为目前米曲霉β-半乳糖苷酶在毕赤酵母中表达的最高水平。相比于野生型AoBgal35A,mAoBgal35A的最适温度降低至55℃,最适pH提升至5.0,在pH 4.0~7.0和60℃以下保持稳定。mAoBgal35A室温下高效水解牛奶中的乳糖,在制备无乳糖牛奶方面具有潜在的工业化应用价值。
