包装方式和贮藏温度对羊肉微生物数量、细菌多样性和代谢途径的影响
2022-11-30张建海王勇亮周丽媛朱迎春
王 莹,张建海,王勇亮,来 静,张 鑫,周丽媛,朱迎春,*
(1.山西农业大学食品科学与工程学院,山西 太谷 030801;2.山西农业大学动物医学学院,山西 太谷 030801;3.山西省食品研究所,山西 太原 030000)
羊肉中丰富的营养物质为腐败微生物生长繁殖提供了适宜条件,如假单胞菌、乳酸菌、大肠杆菌和李斯特氏菌等,它们对羊肉的感官和品质有直接影响。目前,羊肉生产和销售过程中最常见的包装方式有托盘包装、真空包装(vacuum packaging,VP)和气调包装等。这些包装技术可以防止冷鲜肉二次污染、抑制微生物的生长繁殖、保持肉品的嫩度和颜色,同时还可以抑制蛋白质分解和脂肪氧化,减少质量损失[1]。马惠敏等[2]研究托盘包装、VP、高氧气调包装(75% O2+25% CO2)和低氧气调包装(50% O2+50% CO2)对4 ℃贮藏羊肉品质的影响,发现采用VP的羊肉剪切力较低,亮度(L*值)和红绿度(a*值)明显高于托盘包装和气调包装,保鲜效果最好。dos Santos-Donado等[3]研究VP、高氧气调包装(75% O2+25% CO2)和一氧化碳气调包装(60% CO2+0.2% CO+39.8% N2、40% CO2+0.4% CO+59.6% N2)对(2±1)℃贮藏牛排品质的影响,认为一氧化碳气调包装和VP牛排的脂肪及蛋白质氧化程度较低,且一氧化碳气调包装的牛排颜色更红,与高氧气调包装相比品质更好。贴体包装(skin packaging,SP)作为近年来新兴的一种VP形式,不仅具有VP氧含量低的特点,而且其包装膜更适应食品外形,减少了包装褶皱,降低了汁液损耗和血水析出,并且与普通VP相比,肉品颜色更为红艳[4]。Li Xin等[5]将牛排经SP、VP和高氧气调包装(80% O2+20% CO2)后贮藏7 d,发现SP能更好地维持牛排颜色稳定性,而且品质优于其他两种包装方式。
冰温贮藏技术是一种将生鲜食品贮藏于0 ℃以下、冰点以上的冰温带,使食品始终处于非冻结状态的低温保鲜技术,其避免了因冻结而使食品组织结构损伤、汁液流失增多的缺陷,能够较长时间地保持食品的新鲜状态[6]。辜雪冬等[7]分析冰温(-2 ℃)和冷藏(0 ℃)条件下用聚乙烯/尼龙复合自封袋包装牦牛肉感官品质、菌落总数、丙二醛含量变化以及水分迁移的规律,结果表明,冰温保鲜对牦牛肉的贮藏效果更好,可使贮藏期延长6 d,同时冰温下牦牛肉结合水、蛋白质分子结构更加稳定。Zhang Xinxiao等[8]将鸡肉经气调包装(80% CO2+20% N2)后分别在冰温(-2 ℃)和冷藏(4 ℃)条件下贮藏,发现冰温条件下鸡肉货架期延长了16 d。
高通量测序是最近10 年新兴发展起来的免培养的新一代测序技术[9]。近年来,基于16S rDNA的高通量测序广泛应用于分析微生物的组成和多样性,有助于全面了解食品中微生物群落动态,以便提高食品品质、控制微生物安全[10]。而利用高通量测序监测食品贮藏过程中微生物菌群变化对于构建适当的贮藏条件、抑制特殊腐败菌增殖具有非常重要的意义。
本实验主要探讨空气包装(air packaging,AP)、VP和SP以及(4±1)℃冷藏和(-1.7±0.2)℃冰温贮藏对宰后羊肉贮藏过程中微生物数量及菌落多样性的影响,并基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对微生物菌群代谢途径进行分析,以期为冷鲜羊肉保鲜贮藏过程中有效实施质量安全控制提供理论参考。
1 材料与方法
1.1 材料与试剂
羊肉 山西边塞牧羊科技服务有限公司。选取体质量相近、饲养方式相同的36 月龄盖州绒山羊10 只(公羊、去势)进行屠宰,宰后在排酸库(4 ℃)成熟48 h后取背最长肌作为实验材料。
MRS培养基、营养琼脂培养基、甘露醇高盐琼脂(manitol salt agar,MSA)培养基、假单胞菌CFC选择性培养基、孟加拉红培养基 青岛海博生物技术有限公司;细菌基因组DNA检测试剂盒 北京索莱宝科技有限公司;真空包装袋、贴体包装盒及盖膜、空气包装盒及盖膜 上海珺一实业有限公司。包装材料主要参数如表1所示。
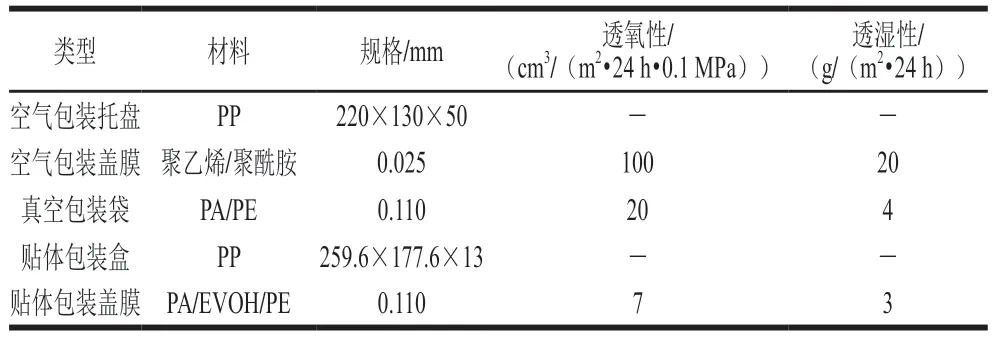
表1 包装材料主要参数Table 1 Information about packaging materials tested in this study
1.2 仪器与设备
LDZX-50KBS立式高压蒸汽灭菌锅 上海深安医疗器械厂;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;HPP-9272电热恒温培养箱 北京东联哈尔仪器制造有限公司;BCD-267WKR3NPGA冷藏冷冻变温冰箱 青岛海信容声冰箱有限公司;SC-228D冷藏冰柜青岛海尔特种电冰柜有限公司;DZ/DZQ-5002SB真空包装机 杭州艾博机械工程有限公司;DQ440VSL型真空贴体包装机 温州达盛智能设备有限公司;T100梯度聚合酶链式反应(polymerase chain reaction,PCR)仪、GelDoc XR+凝胶成像系统 美国伯乐生命医学产品有限公司。
1.3 方法
1.3.1 样品处理
将宰后成熟的羊背最长肌剔除多余脂肪后切成(200±12)g,分别进行AP、VP、SP,AP为PP托盘,用聚乙烯/聚酰胺膜封口;VP真空度为0.2 kPa(极限真空);SP采用PP托盘,用PA/EVOH/PE作为盖膜,极限真空小于0.2 kPa。每个处理组共30 个样品,将包装好的样品置于含冰袋的保温箱中,在2 h内运回实验室,分别于(4±1)℃冷藏和(-1.7±0.2)℃冰温下贮藏,在贮藏第0、5、10、15、20、30天时分别从每个处理组中随机选择3 盒/袋取样进行微生物计数。每个样品作3 个生物学重复。同时在第0、10、20、30天时于无菌环境下对各处理组取样,每个样品取3 个重复,放入自封袋内,置于-80 ℃冰箱贮藏用于后续高通量测序。
编号设置:冰温贮藏标记为A,冷藏标记为B。样品编号方式为包装方式+贮藏温度+贮藏时间,例如样品SPA10表示SP、冰温贮藏10 d的样品。0 d样品作为对照组编号为CK。
1.3.2 微生物指标测定
微生物菌落总数(total viable count,TVC)测定按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》[11];假单胞菌数按照SN/T 4044—2014《出口肉及肉制品中假单胞菌属的计数方法》[12]进行测定;乳酸菌数按照GB 478935—2010《食品卫生微生物学检验 乳酸菌检验》[13]进行测定;霉菌酵母菌数按照GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》[14]进行测定;嗜冷菌数测定用琼脂培养基于7 ℃培养10 d;葡萄球菌/微球菌数测定用MSA培养基于37 ℃培养48 h。实验前根据肉样的新鲜程度选取2~3 个合适的稀释度,每个稀释度作3 个平行,实验结束后将培养皿放置于恒温培养箱中培养并计数。
1.3.3 总DNA提取
用细菌基因组DNA提取试剂盒对不同贮藏时间的羊肉样品基因组DNA进行提取,每个样品3 个重复,之后用1%琼脂糖凝胶电泳检测DNA的纯度和浓度。
1.3.4 PCR扩增及高通量测序
以提取的基因组DNA为模板,对样品16S rDNA的V3~V4区域进行扩增,扩增结束后,用2%琼脂糖凝胶电泳进行鉴定,纯化后的样品用DNA检测试剂盒进行定量,产物回收后送至嘉兴迈维代谢生物科技有限公司进行高通量测序。
1.3.5 生物学信息分析
将测序得到的PE Reads根据Overlap关系进行拼接,然后对序列进行过滤得到高质量数据,之后对样本进行可操作分类单元(operational taxonomic units,OTUs)聚类分析,基于OTUs进行物种多样性分析及细菌群落结构的统计分析。
1.4 数据处理与分析
所有实验均进行3 次生物学重复,用Excel 2020软件和Statistix 8.0软件进行数据整理和分析,用Origin 8.1软件作图。
2 结果与分析
2.1 不同贮藏条件下微生物数量的变化
肉的腐败变质是一个复杂的过程,由多种微生物作用引起,包装方式和贮藏温度对肉中的微生物生长繁殖具有很大影响。TVC是衡量肉新鲜与否的重要指标。根据GB/T 16869—2005《鲜、冻禽产品》[15]规定,冷鲜肉菌落总数超过6(lg(CFU/g))即视为腐败变质,不可食用。由图1A可知,羊肉的初始TVC为2.96(lg(CFU/g)),贮藏至30 d时,冷藏的AP、VP和SP组TVC分别为8.76、7.89(lg(CFU/g))和7.60(lg(CFU/g)),而冰温贮藏20 d时AP、VP和SP组TVC达到6.13、5.95(lg(CFU/g))和5.63(lg(CFU/g)),其中SP组和VP组仍未超过6(lg(CFU/g))。比较而言,冰温条件下SP组和VP组羊肉货架期较冷藏延长了10 d,AP组延长了5 d。
乳酸菌是一种兼性厌氧菌,在有氧环境中生长受到抑制,一般认为乳酸菌是无氧条件下的优势菌群[16]。由图1B可知,随贮藏时间延长,冷藏组羊肉中乳酸菌数快速增长,至30 d时,乳酸菌数达到8.18~8.43(lg(CFU/g)),显著高于冰温贮藏组的6.39~6.67(lg(CFU/g))(P<0.05)。即使是有氧包装的AP组,冷藏30 d时乳酸菌数也高达8.43(lg(CFU/g)),这可能是贮藏后期AP内氧气被消耗,有利于厌氧的乳酸菌生长繁殖,此外乳酸菌产生乳酸,乳酸积累导致pH值降低,为厌氧乳酸菌的生长繁殖提供了适宜条件。
葡萄球菌/微球菌在自然界中分布广泛,Li Miaoyun等[17]认为葡萄球菌/微球菌是冷却肉贮藏过程中的主要菌群。由图1C可知,冷藏和冰温贮藏的各组羊肉中葡萄球菌/微球菌数量在贮藏期间均快速上升。贮藏10~30 d,冰温组除AP外,VP和SP葡萄球菌/微球菌的数量显著低于冷藏组(P<0.05),特别是SP冰温贮藏组,第30天时其葡萄球菌/微球菌数为6.14(lg(CFU/g)),显著低于其他各组(P<0.05)。
假单胞菌是典型的嗜冷菌,具有很强的产生氨气等腐败产物的能力,是冷鲜肉腐败的重要原因。由图1D可知,贮藏0~5 d,冷藏和冰温组假单胞菌数无显著差异(P>0.05),但从10 d开始,冷藏组假单胞菌数急剧上升(P<0.05),尤其是AP组上升数量最多。到贮藏结束时,冰温组假单胞菌数仍在6(lg(CFU/g))以下,特别是冰温SP和VP组,假单胞菌数均低于5 (lg(CFU/g)),显著低于其他组(P<0.05)。贮藏后期假单胞菌数较乳酸菌数低1~2 个数量级,这是因为低温环境下乳酸菌的生长速率远大于假单胞菌,此外,乳酸菌在生长过程中产生的乳酸和乳酸菌素等也会抑制假单胞菌的生长[18]。
霉菌和酵母菌也会造成肉品腐败变质,但其致腐能力较低。图1E反映了羊肉贮藏过程中霉菌和酵母菌数量的变化。羊肉中的初始霉菌和酵母菌数量为1.30(lg(CFU/g)),随着贮藏时间延长,各处理组霉菌和酵母菌数量均有所上升,其中冷藏AP组快速上升(P<0.05),30 d时达到5.11(lg(CFU/g)),而其他5 个处理组霉菌和酵母菌数量增长相对缓慢,在贮藏终点均未超过5(lg(CFU/g))。
嗜冷菌数是评价低温贮藏肉品微生物安全性的一项重要指标。由图1F可知,随贮藏时间延长,所有样品的嗜冷菌数均呈上升趋势,贮藏20 d时,冷藏AP组达到6.27(lg(CFU/g)),显著高于其他5 组(P<0.05);不同贮藏温度比较,冰温贮藏效果整体优于冷藏,30 d时,冰温SP组的嗜冷菌数为6.16(lg(CFU/g)),显著低于其他处理组(P<0.05)。
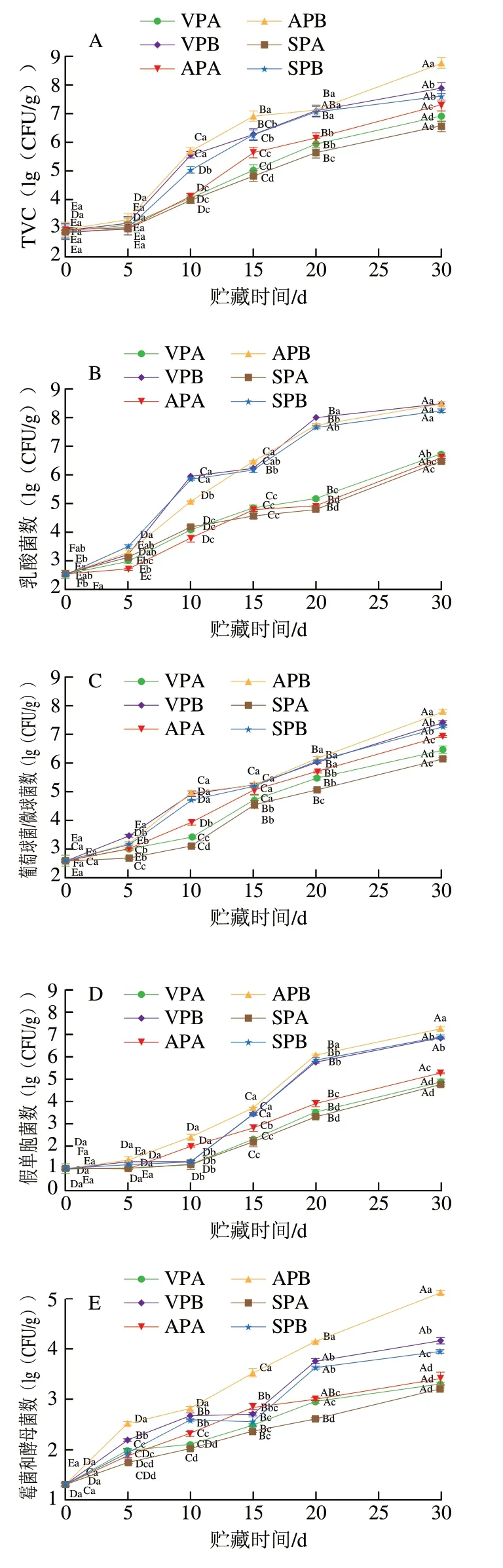
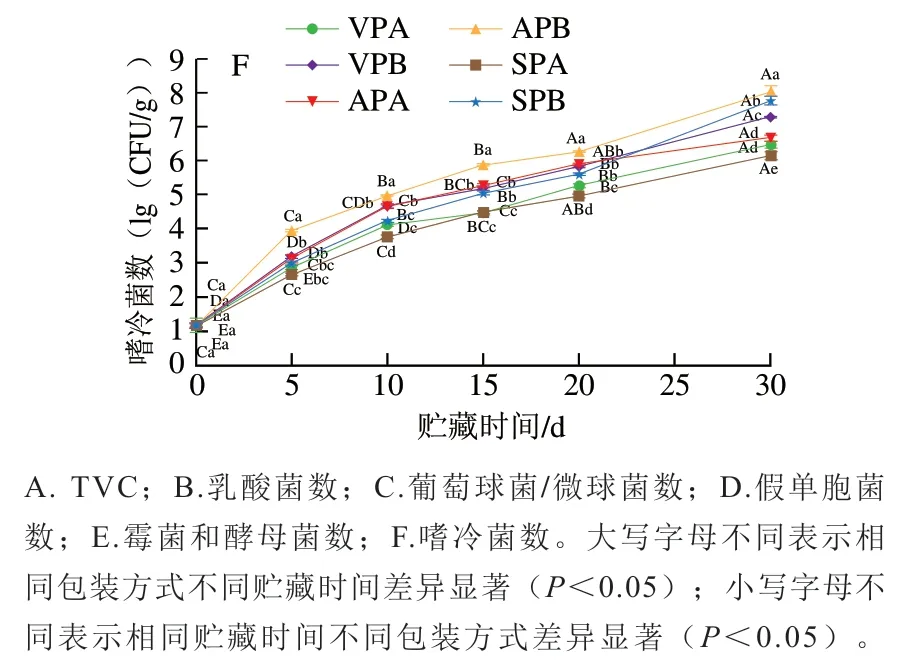
图1 羊肉贮藏过程中微生物数量的变化(n=3)Fig. 1 Changes in microbial load in mutton during storage (n = 3)
2.2 测序数据统计与OTU分析结果
57 个羊肉样品经高通量测序获得的原始序列总数为5 730 342,经质控和优化后共得到3 593 277 条平均长度为424 bp的有效序列,在97%相似水平下对样品序列进行后续分析。
Venn图可用于统计多个样本中所共有和独有的物种数目,能够比较直观地表现样本的物种组成相似性及重叠情况[19]。由图2可知,冰温和冷藏10、20、30 d后,AP、VP和SP组的共有OTU数分别为25、33和60,说明随贮藏时间延长羊肉中微生物种类逐渐趋于相似。此外,冰温贮藏组OTU数明显低于冷藏组,其中SP组OTU数低于AP和VP组。
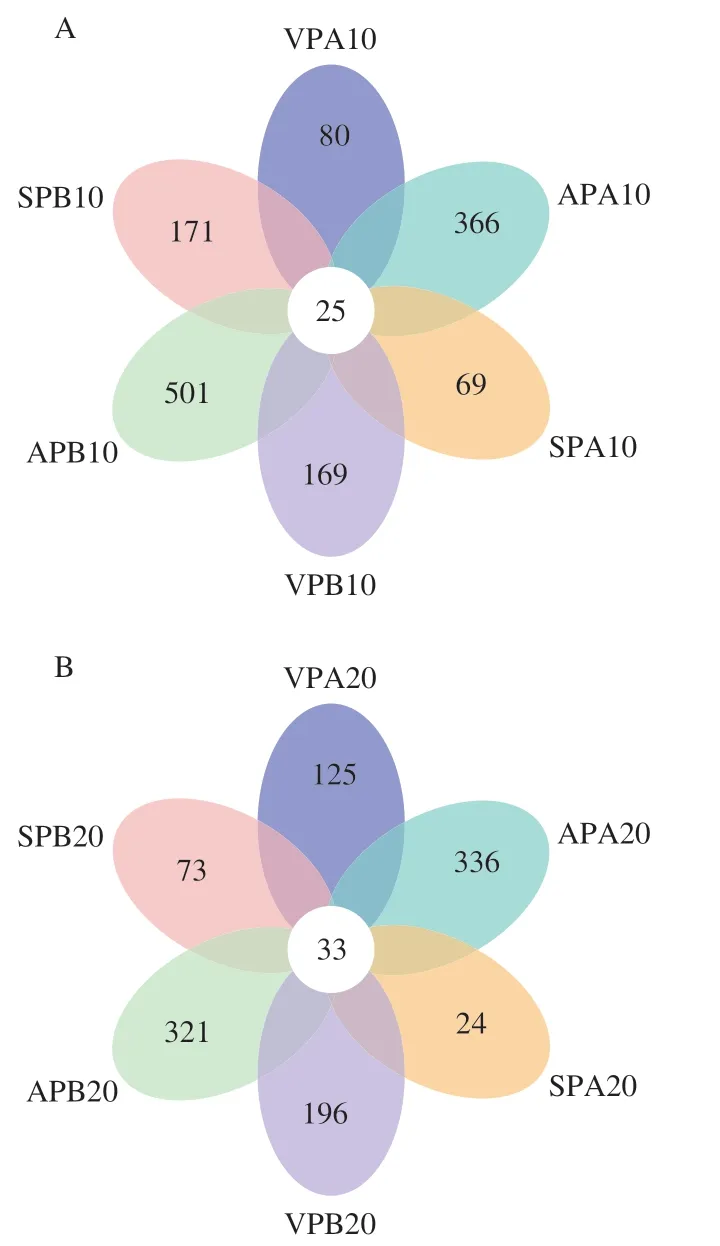
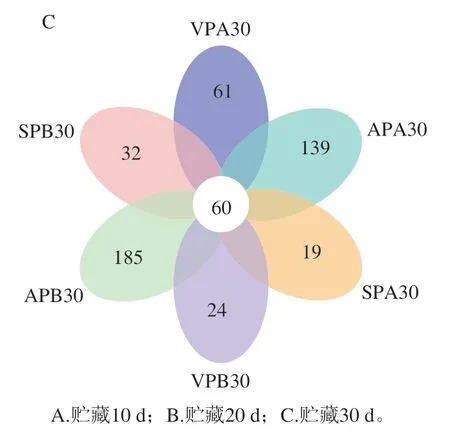
图2 羊肉样品基于OTU水平的Venn图Fig. 2 Venn diagrams showing the numbers of unique and shared OTUs among mutton samples
2.3 Alpha多样性分析结果
采用Alpha多样性指标的ACE、Chao1、Shannon及Simpson指数对微生物物种丰富度和多样性进行评估[20]。ACE和Chao1指数越大表明菌落丰富度越高;Shannon指数越大说明群落多样性越高。
由表2可知,所有样品的Coverage指数均达99%以上,说明测序结果能够有效反映样本微生物的多样性。与CK组相比,贮藏终点时样品的ACE、Chao1和Shannon指数呈下降趋势(除冷藏VP组),说明微生物物种多样性和丰富度整体随贮藏时间延长而降低,冷藏组ACE和Chao1指数均高于冰温组,说明冷藏羊肉菌落丰度较高,如冷藏10 d SP组的Chao1指数为548.19±51.23,而冰温贮藏10 d SP组为273.60±21.06。不同包装方式比较,贮藏期间SP组羊肉中微生物的丰富度和多样性整体低于其他两种包装方式,如冰温贮藏10 d时,SP组的Shannon指数为2.52±0.08,而AP和VP组分别为4.07±0.09和4.54±0.06。
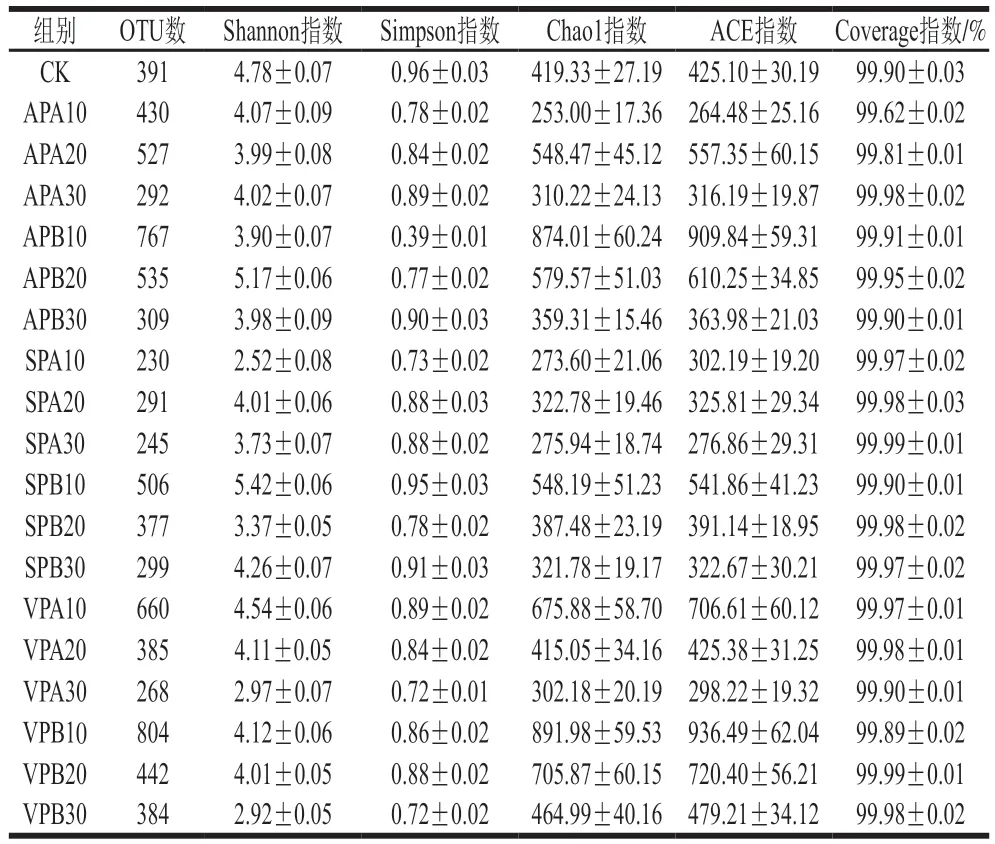
表2 贮藏期间羊肉中微生物的Alpha多样性变化(n=3)Table 2 Variation in microbial alpha diversity in mutton during storage (n = 3)
2.4 细菌群落结构分析结果
不同包装羊肉贮藏过程中微生物菌群门水平相对丰度变化如图3所示。所有样品的细菌群落分属于10 个门,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidota)是主要的细菌门。CK中变形菌门和厚壁菌门占主导地位,相对丰度分别为58.43%和21.03%,其次是不动杆菌门和拟杆菌门,相对丰度分别为7.16%、2.21%。
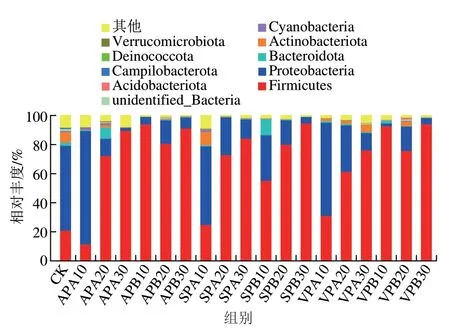
图3 羊肉贮藏过程中微生物群落门水平相对丰度变化(n=3)Fig. 3 Changes in relative abundance of microflora at the phylum level in mutton during storage (n = 3)
冷藏期间,AP、VP和SP组样品中厚壁菌门相对丰度均大幅升高,贮藏结束时相对丰度由贮藏初始的21.03%分别增加至91.36%、94.20%和94.85%;变形菌门相对丰度从初始的58.43%降低到30 d的4.37%~7.56%。冰温贮藏下虽然贮藏终点时厚壁菌门相对丰度也上升到76.24%~89.77%,但低于冷藏组;变形菌门总体呈下降趋势,贮藏终点时相对丰度达到2.06%~13.32%。贮藏终点时,冰温贮藏和冷藏条件下各组拟杆菌门和不动杆菌门相对丰度均下降;除冰温贮藏30 d VP组拟杆菌门相对丰度为5.16%,其余处理组丰度均小于1%。
不同包装羊肉贮藏过程中微生物菌群属水平相对丰度变化如图4所示。CK组中假单胞属(Pseudomonas)占优势地位,相对丰度为19.77%,其余依次是芽孢杆菌属(Bacillus)(13.06%)、卡斯特兰尼氏菌属(Castellaniella)(8.89%)和Diaphorobacter(6.91%)。
冰温贮藏10 d AP组假单胞菌属迅速增长至相对丰度为65.01%,成为优势菌属,之后显著降低,冰温贮藏30 d时仅为0.88%,而肉食杆菌属(Camobacterium)、环丝菌属(Brochothrix)和乳杆菌属(Lactobacillus)明显增加,相对丰度分别为18.00%、14.79%和53.21%,此时乳杆菌属占主导地位。冷藏AP组中主要菌属的变化趋势与冰温贮藏AP组类似,贮藏30 d假单胞菌属比例下降为5.35%,而乳杆菌属持续增长至相对丰度为34.88%,成为优势菌属。
冰温贮藏10 d SP与CK组微生物菌落结构较为相似,之后肉食杆菌属相对丰度呈上升趋势,贮藏30 d时相对丰度达到11.70%;而此时环丝菌属和乳杆菌属的相对丰度分别为27.32%和43.54%,乳杆菌成为优势菌属。冷藏过程中,SP组乳杆菌属相对丰度增至最大值(47.89%,20 d)后略有下降(43.38%,30 d),但仍为优势菌属,其次为肉食杆菌属(25.83%,20 d)和环丝菌属(17.78%,30 d)。
VP组在冰温贮藏前期以不动杆菌(29.25%,10 d)和发光杆菌(Photobacterium)(18.41%,10 d)为主,冰温贮藏中期肉食杆菌属相对丰度增至13.52%(20 d),冰温贮藏后期环丝菌属(25.20%,30 d)和乳杆菌属(43.51%,30 d)成为优势菌属。冷藏过程中,贮藏20 d VP组环丝菌属相对丰度升高至21.89%,但贮藏30 d时降低至8.29%,此时乳杆菌属和肉食杆菌属相对丰度分别为41.55%和21.00%,乳杆菌属依然占优势地位。
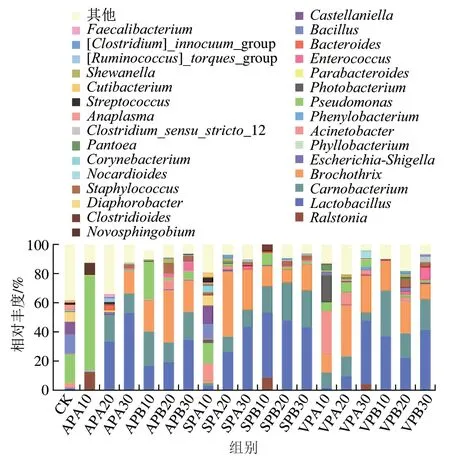
图4 羊肉贮藏过程中微生物群落属水平相对丰度变化(n=3)Fig. 4 Changes in relative abundance of microflora at the genus level in mutton during storage (n = 3)
2.5 Beta多样性分析结果
主坐标分析(principal co-ordinates analysis,PCoA)是一种非约束性的数据降维分析方法,用于研究样本群落组成的相似性或差异性[21]。样本距离越接近,表示物种组成结构越相似。如图5所示,PC1贡献率为44.73%,PC2为36.33%,PC1与PC2的综合差异能够解释全部结果的81.06%,可以解释组间差异。SPB30、VPB30和VPB20等聚集在第4象限,APA10、APA20和VPA10等聚集在第3象限,表明贮藏温度对菌落结构组成的影响大于包装方式。值得注意的是,SPA10和CK聚集在第2象限,这表明SP结合冰温保鲜羊肉在贮藏10 d时其菌落结构仍与新鲜羊肉相似。冷藏20 d和30 d的AP、VP和SP样品在图中距离较近,说明冷藏条件下贮藏后期各处理组菌群结构相似性较高。
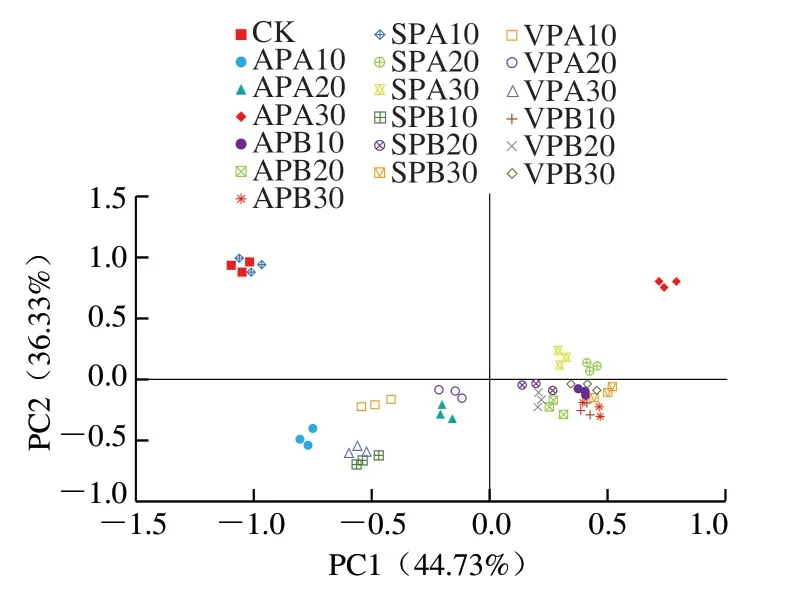
图5 羊肉贮藏过程中微生物群落结构PCoA图Fig. 5 PCoA of microfloral structure in mutton during storage
由图6可知,所有样品的遗传相似系数在0.10~0.85之间,其中SPB30和APB30、APB20和VPB20相似系数最大为0.83,这与PCoA分析结果一致,进一步说明冷藏条件下,无论何种包装方式,贮藏后期的细菌群落结构均趋于一致。SPA30、SPA20和APA30相似系数均接近0,这表明冰温条件下,即使是贮藏后期,包装方式的不同也会导致细菌群落结构存在较大遗传差异。
此外,SPA20、APB10和VPB10遗传相似系数均大于0.7,表明冰温条件下SP贮藏20 d的样品与冷藏条件下VP、AP贮藏10 d的样品遗传相似度较高,进一步说明了冰温贮藏的有效性。此外,CK和SPA10的相似系数接近0.7,再次证明冰温贮藏10 d SP羊肉菌落结构与新鲜羊肉相似,表明SP结合冰温贮藏保鲜效果较好。
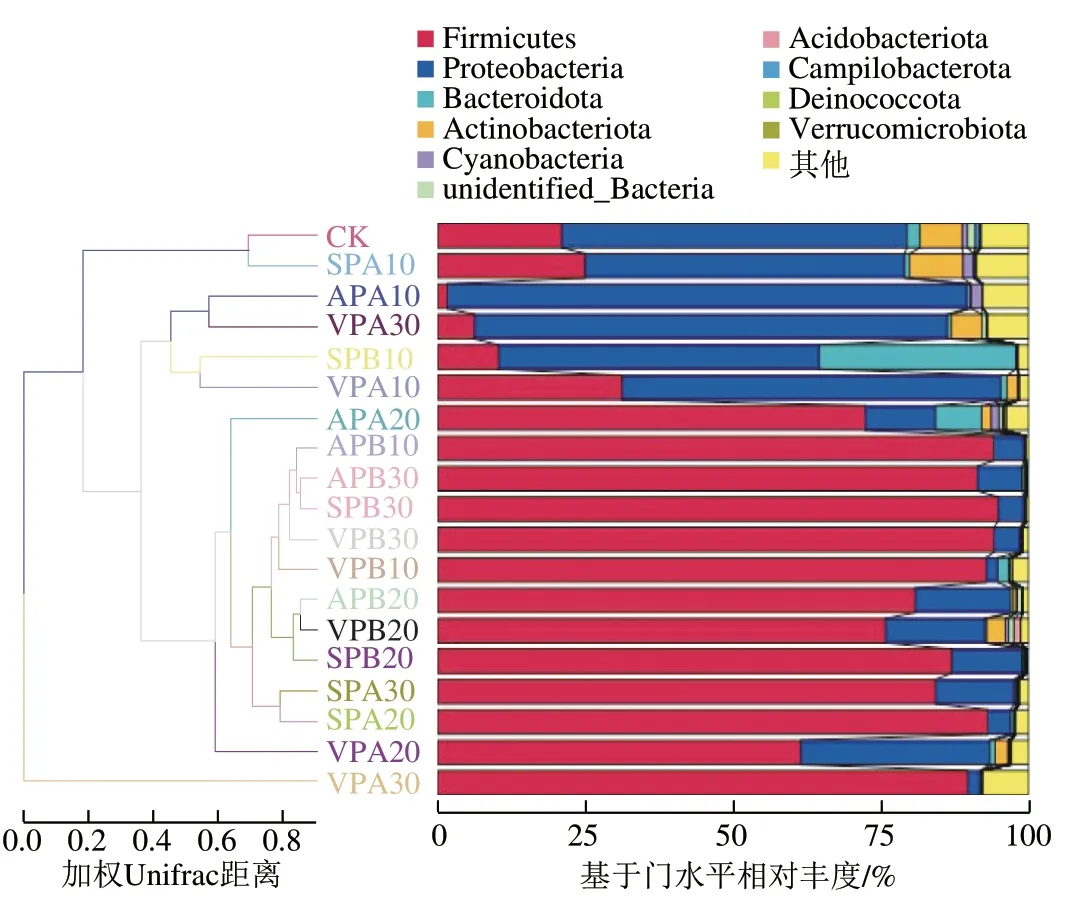
图6 羊肉贮藏过程中微生物群落聚类分析图Fig. 6 Clustering analysis of bacterial community in mutton during storage (n = 3)
2.6 差异基因的KEGG富集分析结果
微生物代谢途径的丰富程度能够反映食品中成分进行物质代谢的状态,可以了解食品中微生物的代谢活性和食品变质过程[22],通过差异基因的KEGG富集分析可以进一步深入了解不同代谢途径(碳水化合物代谢、氨基酸代谢和核苷酸代谢)对羊肉变质进程的影响。根据16S rDNA测序结果绘制样品中微生物主要代谢途径,如图7所示,包装方式和贮藏温度不同,微生物的代谢途径有所差异。本实验中富集基因较多的代谢通路包括碳水化合物代谢、氨基酸代谢和核苷酸代谢。CK组样品氨基酸代谢通路的基因相对丰度最高,随着贮藏过程的进行,氨基酸代谢通路的基因相对丰度降低。冷藏条件下,AP、VP和SP组氨基酸和核苷酸代谢通路基因的相对丰度均低于冰温贮藏,而碳水化合物代谢通路的基因相对丰度均高于冰温贮藏。
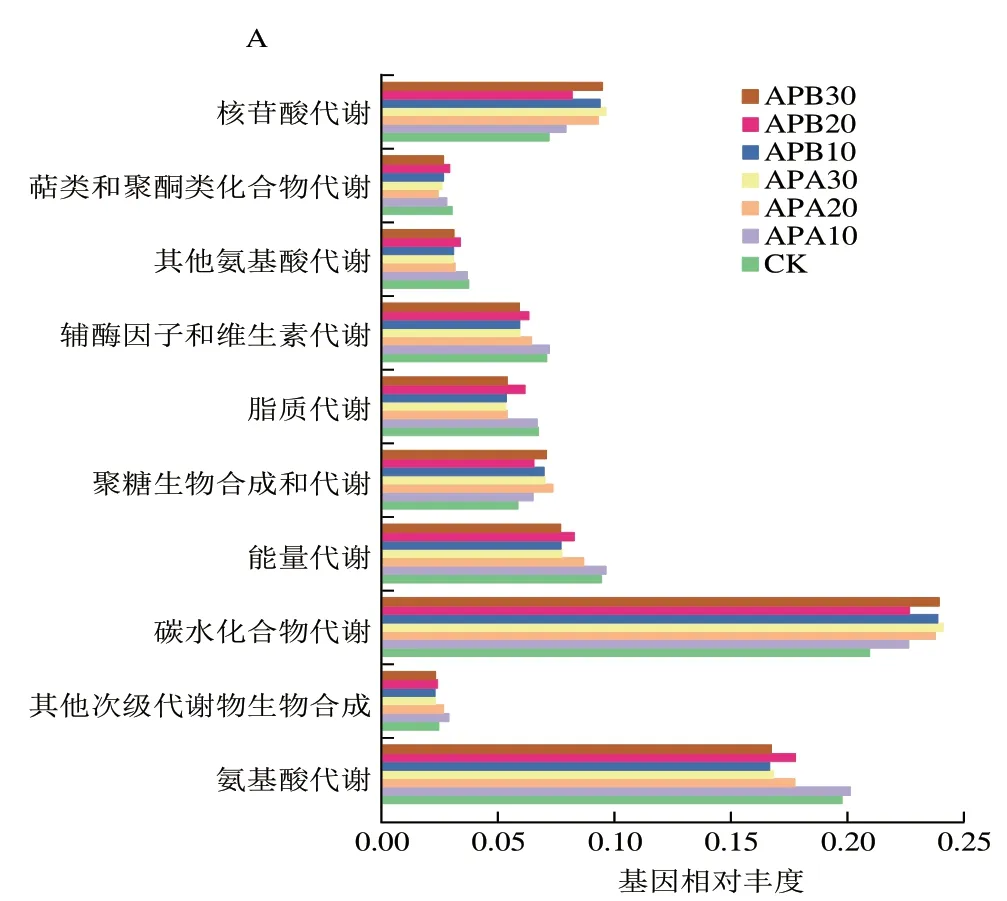
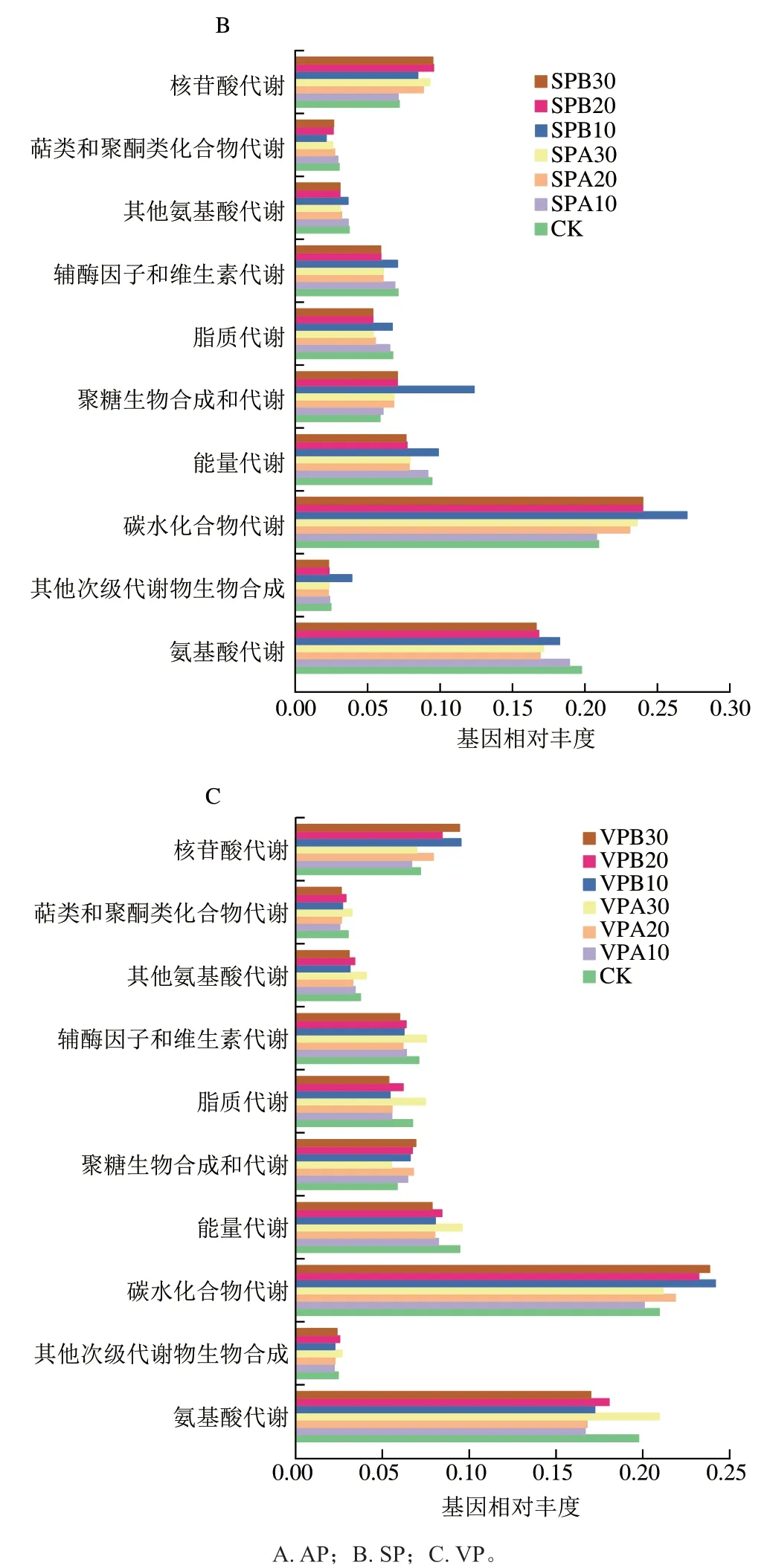
图7 羊肉贮藏过程中微生物群落代谢功能预测Fig. 7 Predicted metabolic functions of microbial community in mutton during storage
3 讨 论
本实验利用高通量测序技术协同平板计数方法考察包装方式和贮藏温度对微生物数量和群落组成的影响。实验首先通过鉴别性培养基培养计数的方法考察了羊肉贮藏过程中常见6 种微生物数量的变化,发现冰温(-1.7 ℃)组TVC、乳酸菌数、假单胞菌数、嗜冷菌数、葡萄球菌数及霉菌和酵母菌数均明显低于冷藏(4 ℃)组。冰温贮藏是继冷冻和冷藏之后的第三代保鲜技术,既可防止食品中冰晶的形成,避免食品组织结构受到损伤,又能很好地抑制微生物生长,延缓生理生化反应速率。文献报道显示冰温贮藏能较好地抑制羊肉中腐败菌的生长并延长货架期[23],本实验通过传统微生物培养方法再一次证明了该结论。特别是与冷藏相比,冰温贮藏组乳酸菌数、葡萄球菌/微球菌数和假单胞菌数均降低了2 个数量级。就包装方式而言,SP作为近些年出现的新型包装方式,具有方便、经济和高效的特点。本实验中,与AP和VP比较,SP降低了微生物数量,这可能是因为SP的表面与羊肉贴合更紧密,减少了包装褶皱,汁液无法渗出,减少了微生物繁殖[24]。刘义等[25]也证实SP鲟鱼片微生物数量显著低于SP和托盘包装。
高通量测序技术可以全面研究羊肉贮藏过程中微生物的物种组成及丰度信息,实验发现随贮藏时间延长,微生物群落多样性下降但某些菌属的丰度上升,尤其在贮藏末期,乳杆菌属、环丝菌属和肉食杆菌属占据羊肉微生物物种的80%以上,说明这些菌属成为优势致腐菌并抑制其他菌属的生长。
假单胞菌是典型的嗜冷菌,即使在低温条件下也能生长繁殖,同时还是好氧微生物,在有氧条件下可分解肉中的蛋白质和脂肪等产生具有特殊气味的硫化物、酯和酸等代谢产物[26-27],导致羊肉腐败变质。本实验中,AP样品贮藏10 d时假单胞菌快速生长繁殖,成为优势菌群,相对丰度最高达到65.01%(冰温),而贮藏30 d时,乳杆菌属成为优势菌属;冷藏10 d时VP和SP组的优势菌属均为乳杆菌,冰温贮藏10 d时VP和SP的优势菌属分别为不动杆菌和卡斯特兰尼氏菌,但贮藏30 d时,VP和SP的优势菌属均为乳杆菌属。乳杆菌属作为兼性厌氧菌,能够利用肉中的碳水化合物产生乳酸,还会使肉产生酸腐味和奶酪味,为无氧条件下的优势腐败菌[28],贮藏过程中还会通过氨基酸代谢产生大量二氧化碳,进一步降低包装中氧气浓度,为自身生长提供有利条件[29]。本实验发现无论何种包装方式和贮藏温度,乳杆菌属均为贮藏终点的优势菌属,特别是冷藏结束时SP组和VP组丰度分别达到43.38%和41.55%。Zhao Fan等[30]研究也发现乳杆菌为真空包装猪肉低温贮藏结束时的优势微生物。
环丝菌属无论在有氧还是无氧条件下都能够生长繁殖,无氧包装对其抑制效果不显著,该菌属具有很强的蛋白质和脂肪分解能力,在猪肉、牛肉和羊肉中均存在,会产生恶臭的奶酪或乳制品腐败气味,产生绿色液体使肉发绿,是原料肉中的主要腐败菌[31]。本实验中环丝菌属在6 组样品的不同贮藏时期丰度均较高,特别是SP组样品,丰度最高达到44.54%(SPA20),贮藏30 d时,冰温VP和SP组样品中环丝菌属相对丰度高于AP组,而冷藏VP和SP组的环丝菌属相对丰度低于AP组。Li Miaoyun等[17]研究表明,环丝菌是真空包装猪肉贮藏末期的优势腐败菌。
肉食杆菌属存在于鱼、肉和其他各种食物中,该菌属能够分解糖类产生乳酸,降低贮藏环境的pH值,它还能够利用精氨酸产生氨类物质,产生不愉快气味[32]。Egan[33]研究发现,真空包装牛肉在0 ℃下贮藏10~12 周,肉食杆菌属为其优势腐败菌之一。本实验中肉食杆菌属多存在于冷藏样品中,特别是在贮藏30 d后,3 种包装样品中肉食杆菌属的丰度达到18.94%~25.00%,高于冰温贮藏样品的2.68%~13.31%,可见冰温贮藏对肉食杆菌属生长具有抑制作用。
微生物代谢途径决定了食品腐败变质的程度。本实验中富集基因较多的代谢通路包括碳水化合物代谢、氨基酸代谢和核苷酸代谢,与Reis等[34]对冷鲜羊肉的研究结果一致。
本实验中所有样品中碳水化合物代谢富集最显著,碳水化合物代谢是能量代谢的过程。羊肉表面存在着大量代谢活跃的微生物,在酶作用下微生物利用葡萄糖等碳水化合物进行自身生长代谢。其中假单胞菌、乳酸菌和环丝菌主要以葡萄糖、蔗糖、半乳糖和一些其他糖为底物,分解代谢产生乳酸、甲酸和乙酸,最终导致食品基质pH值的降低[28]。酸性物质的积累有利于乳酸菌的生长,所以贮藏后期乳酸菌大量繁殖,冷藏样品的乳酸菌数高于冰温贮藏,而对应碳水化合物代谢的基因相对丰度也较高。
氨基酸代谢包括两个途径:一为合成自身蛋白质等含氮物质的途径,可为微生物生长提供氮源;二为分解氨基酸为α-酮酸、胺类及二氧化碳的途径,而且其中α-酮酸可转化为糖、脂质或非必需氨基酸,也可以参与三羧酸循环生成二氧化碳和水,并释放能量[35]。Li Ning等[22]认为,与碳水化合物代谢相比,假单胞菌属对氨基酸代谢贡献更大,本实验支持该结论。本实验中氨基酸代谢主要表现在贮藏前期,假单胞菌和肉食杆菌等利用氨基酸代谢为自身生长繁殖提供能量,但随着假单胞菌在贮藏后期丰度的减弱,氨基酸代谢通路的基因相对丰度也降低。与冷藏比较,冰温贮藏样品中假单胞菌数低2~3 个数量级,但冰温样品的氨基酸代谢通路的基因相对丰度略高于冷藏样品。
核苷酸分为嘌呤核苷酸和嘧啶核苷酸两大类,这两种核苷酸的代谢均包括合成和分解代谢。核苷酸水解酶将核苷酸水解生成核苷,最终生成碱基和磷酸核糖,参与糖酵解或三羧酸循环[36]。核苷酸代谢为羊肉中微生物生长提供了可利用的碳源,增强了微生物的增殖能力。研究显示乳酸菌中含有调控核苷酸合成代谢的两个主要调节因子——嘌呤和嘧啶调节因子[37],这表明乳酸菌的生长繁殖过程与核苷酸的合成代谢密切相关,本实验中核苷酸代谢通路基因相对丰度的变化与乳酸菌数量变化一致,说明乳酸菌增殖的过程也是核苷酸代谢的过程。
4 结 论
微生物计数结果表明无论何种包装方式,冷藏AP、VP和SP组羊肉货架期均为10 d,而冰温贮藏SP和VP组羊肉货架期为20 d,AP组为15 d。贮藏第20天时,冰温SP组TVC仅为5.63(lg(CFU/g)),显著低于其他贮藏组(P<0.05),由此说明SP协同冰温贮藏可提高羊肉的微生物安全性。通过高通量测序技术在不同包装的冷藏和冰温贮藏羊肉微生物中鉴定出10 个菌门和30 个菌属,厚壁菌门和变形菌门为优势菌门;新鲜羊肉的优势菌属为假单胞菌和芽孢杆菌,贮藏后期环丝菌属、肉食杆菌属和乳杆菌属为所有样品的优势菌属。多样性分析结果表明冰温贮藏能够有效降低羊肉微生物菌群的多样性和丰富度,代谢途径分析结果显示贮藏前期以氨基酸代谢为主,贮藏后期主要以碳水化合物代谢和核苷酸代谢为主。包装方式和贮藏温度的不同导致羊肉贮藏期间的菌群数量、组成发生差异,从而导致代谢途径及丰度不同,而SP协同冰温贮藏具有较好的贮藏效果。
