姜黄素联合乙二胺四乙酸对荧光假单胞菌的光动力灭活作用
2022-11-30赵瑜玲陈孟涵张锦锦臧明伍赵紫华郝建雄韩俊华
王 洋,赵瑜玲,陈孟涵,张锦锦,臧明伍,赵紫华,郝建雄,韩俊华,*
(1.河北科技大学食品与生物学院,河北 石家庄 050018;2.中国肉类食品综合研究中心,北京 100068)
荧光假单胞菌(Pseudomonas fluorescens)属于假单胞菌属,广泛分布于自然界中,在4 ℃条件下能快速生长繁殖,是果蔬、乳、肉等食品中一种常见的嗜冷性腐败菌。它能够产生极耐热的蛋白酶和脂肪酶,这些酶即使在高温下也难以灭活,在食品贮藏过程中严重影响食品的风味、口感、组织状态等,并能在食品、食品加工设备及包装材料等表面形成生物膜,对食品持续进行污染[1],严重危害食品质量与安全。
光动力灭活(photodynamic inactivation,PDI)因其高效、经济、环保的优点成为食品行业的一种新型杀菌方法[2]。PDI过程是一种光物理和光化学反应,需要氧气、可见光和光敏剂同时存在[3]。目前,已经发现并合成了许多新型光敏剂,包括抗菌光敏剂、抗癌光敏剂等[4]。在这些光敏剂中,姜黄素因具有成本低、安全性高、杀菌效果好等特点而被广泛应用[5-7]。姜黄素是从姜黄根茎中提取出的一种植物多酚化合物,常被用作天然色素或膳食补充剂[8-9],其可在蓝光(400~500 nm)下被激发而产生活性氧[10]。此外,姜黄素的光激发还可以产生姜黄素自由基,从而导致严重的DNA损伤[11]。基于姜黄素光动力作用的杀菌技术在食品贮藏和保鲜方面已显示出巨大的应用潜力。例如,姜黄素介导的PDI已成功应用于鲜切苹果[12]和梨[13]的保鲜。到目前为止,已有诸多研究者尝试利用PDI替代或辅助传统杀菌技术[14-16]。
本实验探究以姜黄素为光敏剂的PDI技术对果蔬、乳品及肉品中的优势嗜冷菌——荧光假单胞菌的灭活效果;分析乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)对姜黄素介导PDI的协同增效作用;采用自行研制的小型光动力设备进行新鲜猪肉的PDI处理,初步分析自制设备的保鲜效果,从而为姜黄素介导的PDI在食品领域中的应用提供理论参考和技术支持。
1 材料与方法
1.1 材料与试剂
荧光假单胞菌由本课题组分离自原料乳中,现保藏于河北科技大学食品生物技术与食品安全实验室;新鲜猪肉购于石家庄市北国超市。
姜黄素(纯度99%) 山东西亚化工有限公司;壳聚糖(脱乙酰度≥95%) 上海阿拉丁试剂有限公司;EDTA 天津市永大化学试剂有限公司;胰蛋白胨、酵母浸粉、琼脂粉 北京奥博星生物技术有限责任公司;氯化钠、无水乙醇均为分析纯;实验用水为无菌去离子水。
1.2 仪器与设备
YT-CJ-1N超净工作台 北京亚泰科隆仪器技术有限公司;SHZ-82A恒温振荡器 常州市国旺仪器制造有限公司;TGL-16C高速离心机 上海安亭科学仪器厂;SPX-100B-Z生化培养箱 上海博迅实业有限公司医疗设备厂;BM-103CE生物显微镜 厦门麦克奥迪实业集团有限公司;BS600+电子天平 上海友声衡器有限公司;CR-400色差仪 深圳市欧亚精密仪器有限公司;pH211哈纳酸度计 北京泰亚赛福科技发展有限公司。
实验用PDI装置(装置1)为实验室自制,由96 孔板、LED灯珠(3.0~3.2 V、2.0 mA、460 nm)、LED调光器等组成,光功率密度为200 mW/cm2。
小型应用型PDI装置(装置2)为实验室自制,由箱体(40 cm×40 cm×40 cm)、LED灯条(12~24 V、460 nm)、变压器等组成,光功率密度为100 mW/cm2。
1.3 方法
1.3.1 荧光假单胞菌的培养
将荧光假单胞菌(-20 ℃保存于25%(体积分数)甘油管中)接种于LB液体培养基中,28 ℃、150 r/min摇床恒温培养24 h,按照2%(体积分数)进行传代,同样条件下培养24 h,10 000×g离心5 min,收集菌体,用无菌生理盐水清洗2 次并稀释至浓度约1×108CFU/mL,备用。
1.3.2 光敏剂配制
称取0.036 8 g姜黄素,用无水乙醇定容至100 mL,得到1 mmol/L的姜黄素母液。取0.5 g壳聚糖置于烧杯中,加入99 mL无菌去离子水,不断搅拌,再加入1 mL冰醋酸使壳聚糖充分溶解,得到0.5%(质量分数,下同)的壳聚糖溶液。以此壳聚糖溶液为溶剂稀释姜黄素母液,配制浓度分别为5、25、50、75、100 μmol/L的姜黄素溶液,并在60 ℃恒温水浴锅中避光孵育15~20 min,避光保存备用。
1.3.3 姜黄素联合EDTA的PDI条件确定
1.3.3.1 姜黄素浓度
按照200 μL/孔在48 孔板中加入1.3.1节荧光假单胞菌菌悬液,然后按照100 μL/孔分别加入0.5%(质量分数,下同)EDTA溶液,孵育10 min(室温,下同),再按照200 μL/孔加入不同浓度(0(对照组)、5、25、50、75、100 μmol/L)的姜黄素溶液,避光孵育10 min,随后放入装置1光照20 min,光照结束后,每孔取100 μL混合液涂布于LB固体培养基,27 ℃恒温培养24 h后进行菌落计数。
1.3.3.2 光照时间
按照200 μL/孔在48 孔板中加入1.3.1节荧光假单胞菌菌悬液,然后按照100 μL/孔分别加入0.5% EDTA溶液,孵育10 min后按照200 μL/孔加入75 μmol/L姜黄素溶液,避光孵育10 min,随后放入装置1分别光照0(对照组)、5、10、20、30、40 min,光照结束后,每孔取100 μL混合液参照1.3.3.1节方法测定菌落数。对照组不进行光照。
1.3.3.3 EDTA质量分数
按照200 μL/孔在48 孔板中加入1.3.1节荧光假单胞菌菌悬液,然后按照100 μL/孔分别加入不同质量分数(0(对照组)、0.1%、0.3%、0.5%、0.7%、0.9%)的EDTA溶液,孵育10 min后按照200 μL/孔加入75 μmol/L的姜黄素溶液,避光孵育10 min,利用装置1光照20 min,光照结束后,每孔取100 μL混合液参照1.3.3.1节方法测定菌落数。
1.3.4 姜黄素联合EDTA对荧光假单胞菌生物膜的PDI作用分析
1.3.4.1 显微镜观察荧光假单胞菌生物膜
按照2 mL/孔在6 孔板(放置了20 mm×20 mm的玻璃盖玻片)中加入LB液体培养基,同时每孔加入200 μL 1.3.1节荧光假单胞菌菌悬液,于27 ℃下恒温培养,分别在0、6、12、24、36、48、60、72 h用无菌镊子将盖玻片取出,用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)冲洗数次盖玻片以除去浮游菌,然后用无水甲醇固定10 min,随后用PBS冲洗3 次,自然干燥。在盖玻片表面滴加1.0%(质量分数)结晶紫染液,静置2 min,用PBS洗去多余染液,自然干燥后置于生物显微镜下观察生物膜,放大倍数100 倍。
1.3.4.2 PDI处理玻璃表面荧光假单胞菌生物膜
按1.3.4.1节方法培养72 h后,将附着有荧光假单胞菌生物膜的盖玻片取出,用无菌水冲洗除去表面浮游细菌后置于6 孔板中。75 μmol/L姜黄素-0.5% EDTA组加入0.5 mL 0.5% EDTA溶液,孵育10 min后加入1 mL 75 μmol/L的姜黄素溶液,避光孵育10 min;75 μmol/L姜黄素组加入0.5 mL无菌水,孵育10 min后加入1 mL 75 μmol/L的姜黄素溶液,避光孵育10 min;0.5%壳聚糖组加入0.5 mL无菌水溶液,孵育10 min后加入1 mL 0.5%壳聚糖溶液,避光孵育10 min;0.5%壳聚糖-0.5% EDTA组加入0.5 mL 0.5% EDTA溶液,孵育10 min后加入1 mL 0.5%壳聚糖溶液,避光孵育10 min;空白组加入1.5 mL无菌水,孵育10 min。将6 孔板于装置1中光照0、20 min,然后吸取100 μL混合液参照1.3.3.1节方法测定菌落数。
1.3.4.3 PDI处理丙烯腈二乙烯丁二烯树脂板表面荧光假单胞菌生物膜
参照1.3.4.1节生物膜的制备方法,用厚度为0.5 mm的丙烯腈二乙烯丁二烯树脂(acrylonitrile-butadienestyrene,ABS)方格板(4 cm2)代替玻璃盖玻片。生物膜培养完成后按照1.3.4.2节方法进行分组和处理,测定处理后的菌落数。
1.3.5 新鲜猪肉PDI处理效果分析
1.3.5.1 新鲜猪肉的PDI处理
将新鲜猪肉用无菌水清洗后用吸水纸将猪肉表面水分吸干,在超净台中将其切分成猪肉片(4.0 cm×4.0 cm×0.5 cm),采用体积分数75%乙醇溶液浸泡5 min,进行表面杀菌,用无菌水冲洗3 次,置于超净台中风干5 min。吸取100 μL荧光假单胞菌菌悬液(取1.3.1节荧光假单胞菌菌悬液调整浓度约6.0×107CFU/mL)均匀涂抹在猪肉片表面,静置30 min,使荧光假单胞菌充分黏附。空白组、壳聚糖对照组、PDI组分别在猪肉片表面均匀喷洒0.5 mL无菌水,PDI+EDTA组喷洒0.5 mL 0.5% EDTA,孵育10 min;然后空白组喷洒1.0 mL无菌水,壳聚糖对照组喷洒1.0 mL 0.5%壳聚糖溶液,PDI+EDTA组和PDI组分别喷洒1.0 mL 75 μmol/L姜黄素,避光孵育10 min后,将PDI+EDTA组和PDI组样品置于装置2中光照处理20 min。处理完成后,各组样品于4 ℃下贮藏。
1.3.5.2 猪肉荧光假单胞菌菌落数的测定
取贮藏第0、1、3、7、10天的猪肉,参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》测定猪肉表面荧光假单胞菌菌落数。
1.3.5.3 猪肉质量损失率的测定
在处理前用电子天平称量样品质量m0/g,PDI处理后,用吸水纸将各组样品表面的水吸干,称量贮藏0、3、6、9 d后的样品质量m1/g,精确至0.01 g,按式(1)计算质量损失率。
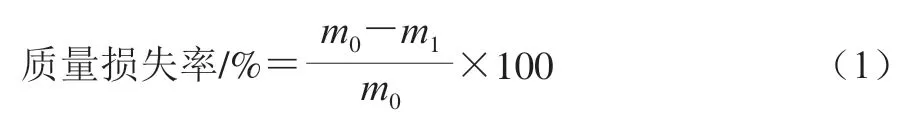
1.3.5.4 姜黄素溶液和猪肉色泽的测定
在24 孔板各孔中加入1 mL浓度分别为5、25、50、75、100 μmol/L的姜黄素溶液,在装置1中照射20 min,同时设置未光照组,对光照前后姜黄素溶液的颜色变化进行拍照观察。
参照1.3.5.1节方法切分猪肉,立即测定样品的亮度(L*值)、红绿度(a*值)、黄蓝度(b*值),在猪肉片(4.0 cm×4.0 cm×0.5 cm)表面喷洒0.5 mL 0.5% EDTA,孵育10 min,然后分别喷洒1.0 mL不同浓度(5、50、75 μmol/L)姜黄素溶液,对照组喷洒等体积无菌水,避光孵育10 min后,立即将样品置于装置2中光照处理20 min。处理完成后,各组样品于4 ℃下贮藏。
取光照处理后贮藏第0、3、6、9、12天的猪肉,采用色差仪分别测定各处理样品的L*、a*、b*值,并按式(2)计算色差(ΔE)。
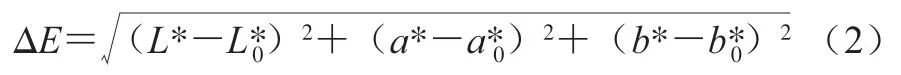
式中:L*、a*、b*值分别表示样品贮藏一定时间的亮度、红绿度、黄蓝度;值分别表示样品在第0天光照处理前的亮度、红绿度、黄蓝度。
1.3.5.5 猪肉pH值的测定
取1.3.5.1节贮藏第0、2、4、6、10天的猪肉,根据GB 5009.237—2016《食品安全国家标准食品pH值的测定》测定猪肉的pH值。
1.4 数据统计与分析
实验中每组样品设置3 个平行,数据以平均值±标准差表示。采用SPSS Statistics 24.0软件对实验所得数据进行单因素方差分析,采用Duncan’s多重比较检验进行显著性分析,P<0.05表示差异显著。采用OriginPro 8.0软件作图。
2 结果与分析
2.1 PDI对荧光假单胞菌的灭活作用
2.1.1 姜黄素浓度对PDI作用的影响
姜黄素浓度对荧光假单胞菌的PDI作用的影响如图1所示。随着姜黄素浓度的增加,荧光假单胞菌的菌落数明显降低。当姜黄素浓度为5 μmol/L时,与对照组相比,荧光假单胞菌菌落数对数值减小1.84(lg(CFU/mL))(P<0.05);随着姜黄素浓度的增大,对荧光假单胞菌的PDI效果也随之增强,当姜黄素浓度增加至75 μmol/L时,PDI效果达到最大,荧光假单胞菌菌落数对数值减小7.46(lg(CFU/mL)),灭活效果显著强于其他组(P<0.05)。姜黄素浓度为100 μmol/L时,对荧光假单胞菌的灭活效果不再增强,反而略有降低。推测原因可能是,姜黄素浓度过高时,蓝光的照射剂量有限,部分姜黄素未能吸收蓝光而不能发生光敏化,从而影响PDI效果;也可能是姜黄素浓度增加到一定程度时,会在荧光假单胞菌细胞内外形成动态平衡,阻碍姜黄素进一步进入细胞,从而降低PDI效果[17]。于金珅[18]在研究姜黄素浓度对鲜切马铃薯表面大肠杆菌PDI效果的影响时也发现,在姜黄素浓度为30 μmol/L时,对大肠杆菌表现出最佳杀菌效果,进一步提高姜黄素浓度,杀菌效果反而下降,本研究结果与之相似。综上,选择75 μmol/L的姜黄素溶液进行后续PDI处理。
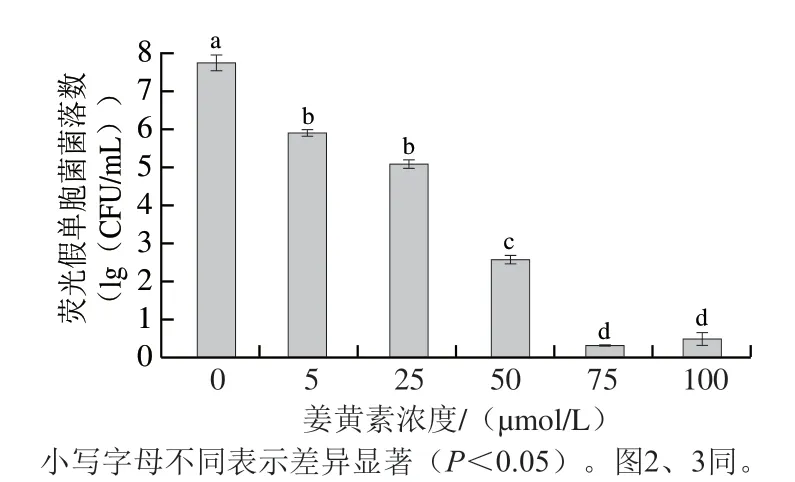
图1 姜黄素浓度对荧光假单胞菌菌落数的影响Fig. 1 Effect of curcumin concentration on total count of P. fluorescens
2.1.2 光照时间对PDI作用的影响
光照时间对荧光假单胞菌的PDI作用的影响如图2所示。光照时间对荧光假单胞菌的PDI效果影响显著,且呈现出随光照时间延长先增强后减弱的趋势。光照时间为20 min时,光动力杀菌效果达到最佳,选择此条件进行后续实验。与对照组相比,荧光假单胞菌菌落数对数值显著减小6.40(lg(CFU/mL))(P<0.05)。随着光照时间的继续延长,灭活效果反而减弱。实验结果表明,并非光照时间越长杀菌效果越好,这可能是光照时间过长导致周围环境的温度升高,更有利于荧光假单胞菌的生长繁殖[19]。因此,PDI技术在进行工业化应用时,应在保证杀菌效果的同时,尽量缩短光照时间,力求在符合生产标准的前提下满足杀菌要求,提高生产效率。综上,选择光照20 min进行后续PDI处理。
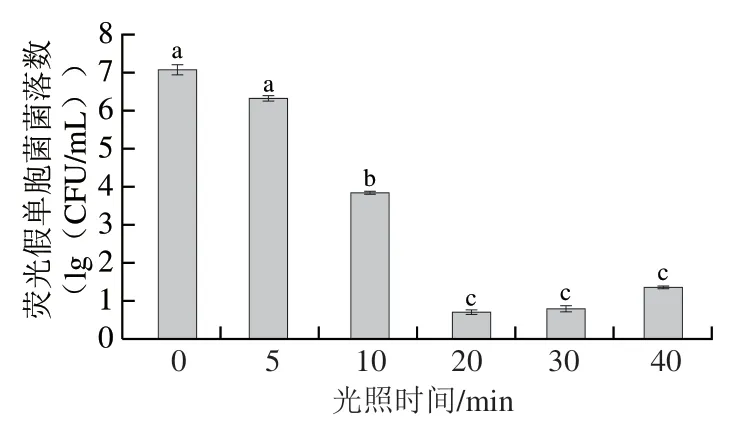
图2 光照时间对荧光假单胞菌菌落数的影响Fig. 2 Effect of illumination time on total count of P. fluorescens
2.1.3 EDTA质量分数对PDI作用的影响
革兰氏阴性菌细胞壁外层含有脂多糖层,相对于革兰氏阳性菌更能耐受PDI处理[5]。EDTA作为一种金属螯合剂能够螯合革兰氏阴性菌表面稳定生物膜基质所需的二价金属离子[20],会破坏革兰氏阴性菌细胞外膜[21]。已有报道称EDTA可以增加非阳离子光敏剂对革兰氏阴性菌的PDI效果[22]。如Hu Jiamiao等[23]发现EDTA可以促进对洋葱伯克霍尔德菌的PDI作用。因此本实验进一步分析EDTA作为协同剂对革兰氏阴性菌——荧光假单胞菌PDI作用的促进效果。
如图3所示,EDTA对PDI的协同增效作用随着其质量分数的增加呈先增强后减弱的趋势。与对照组相比,当EDTA质量分数分别为0.1%、0.3%时,荧光假单胞菌菌落数对数值分别显著降低了0.37、0.91(lg(CFU/mL))(P<0.05);当EDTA质量分数增加至0.5%时,PDI协同促进效果最佳,荧光假单胞菌菌落数对数值显著下降2.29(lg(CFU/mL))(P<0.05);之后随着EDTA质量分数的增加,其对PDI的协同效果反而逐渐减弱。这很可能是由于EDTA质量分数过高,与姜黄素的稀释剂-壳聚糖发生酸碱反应,间接影响姜黄素的结构,从而降低了其光敏性。可见,EDTA对姜黄素介导的PDI作用确实表现出对荧光假单胞菌的显著的协同促进效果,很可能是通过破坏细菌细胞外膜的稳定性,增强了光敏剂向胞内的渗透。这对于后续优化EDTA的PDI协同剂量具有一定的参考价值。综上,选择0.5% EDTA溶液进行后续PDI处理。
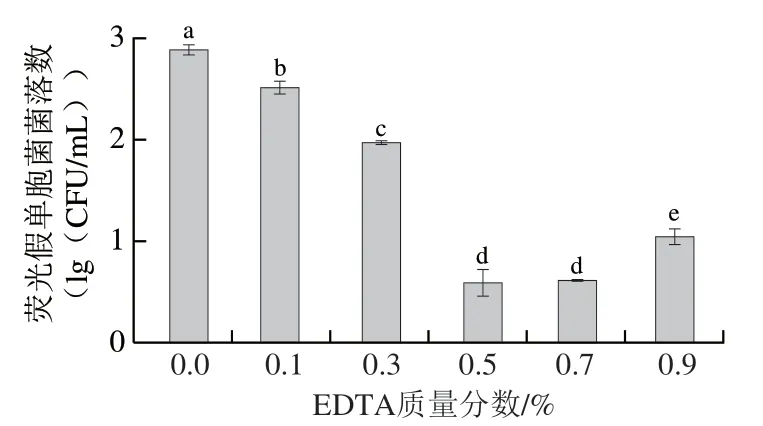
图3 EDTA质量分数对荧光假单胞菌菌落数的影响Fig. 3 Effect of EDTA concentration on total count of P. fluorescens
2.2 荧光假单胞菌生物膜的形成
了解生物膜的形成过程,有助于早期对食品表面及食品加工设备表面生物膜形成的不同阶段进行干预,为生物膜的去除提供有价值的参考。采用结晶紫染色法观察荧光假单胞菌在玻璃表面形成生物膜的过程。图4A~H分别为培养0、6、12、24、36、48、60、72 h后的荧光假单胞菌生物膜经结晶紫染色后的显微图片。图4A无生物膜形成;图4B、C的荧光假单胞菌稀疏分散,随着培养时间的延长,菌体分布逐渐密集;图4D的菌体数量明显增多,菌体之间相互聚集;培养至60 h时,生物膜已经相对成熟,菌体之间更加密集(图4G);培养至72 h,荧光假单胞菌已经将盖玻片完全覆盖(图4H)。可见,荧光假单胞菌从开始的游离状态到形成致密的生物膜是一个动态过程。综上,选择培养72 h后形成的荧光假单胞菌生物膜用于后续PDI处理效果研究。
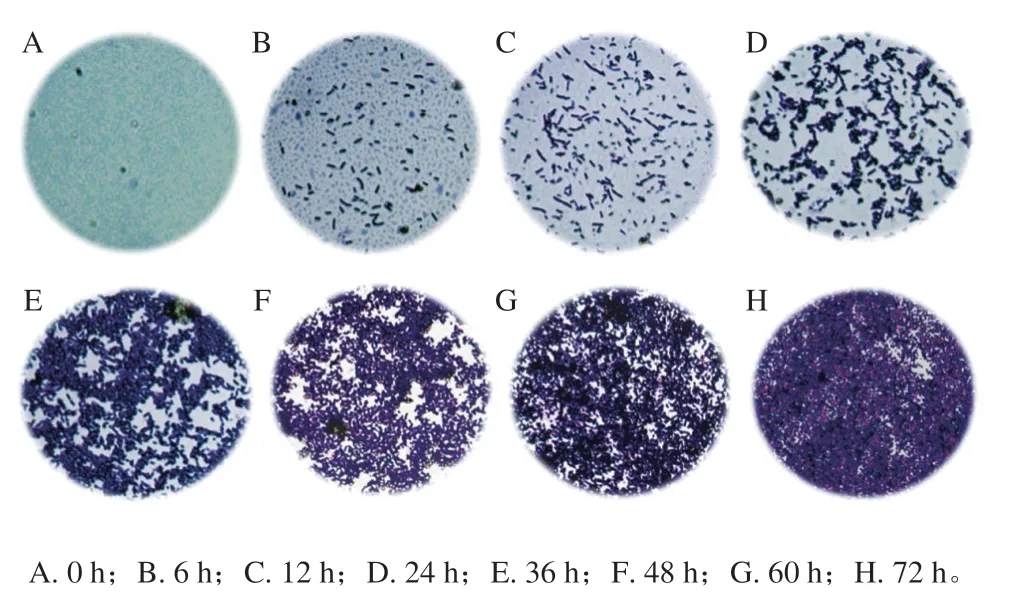
图4 荧光假单胞菌生物膜的形成Fig. 4 Formation process of P. fluorescens biofilm
2.3 姜黄素介导的PDI对荧光假单胞菌生物膜的破坏效果
2.3.1 对玻璃表面荧光假单胞菌生物膜的破坏效果
随着冰箱、冷柜等冷藏设备的普及,冷藏和冷冻食品在日常饮食中所占比例逐渐增加。荧光假单胞菌为一种优势嗜冷菌,常常黏附在冰箱、冷柜内部,逐渐形成生物膜,进而污染食品,导致食物发生腐败[24]。本实验采用冰箱、冷柜内部玻璃板作为载体,在其表面培养并形成荧光假单胞菌生物膜,研究姜黄素介导的PDI对其表面形成生物膜的破坏作用。姜黄素介导的PDI对玻璃表面荧光假单胞菌生物膜的破坏效果如表1所示。与空白组相比,光照条件下的姜黄素对荧光假单胞菌生物膜有显著的破坏效果,菌落数对数值减小3.44(lg(CFU/mL)),加入EDTA后菌落数对数值减小4.57(lg(CFU/mL)),EDTA显著提高了姜黄素的PDI作用(P<0.05)。而无光照条件下的姜黄素对荧光假单胞菌生物膜的破坏作用有限,加入EDTA溶液后,灭活效果仍未得到改善。姜黄素处理浮游荧光假单胞菌的PDI作用可使菌落数对数值减小7.00(lg(CFU/mL))以上(2.1.1节结果),明显优于对生物膜中细菌的PDI效果,这是由于细菌生物膜具有特殊的结构。致密的生物膜中包含大量的胞外多糖保护层,较浮游细菌具有更强的抵抗化学和热灭活能力[25]。
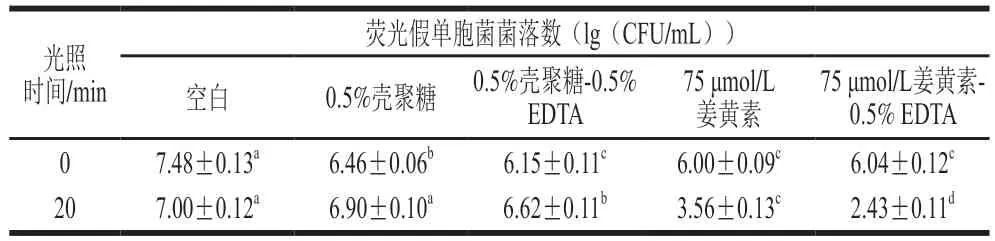
表1 PDI处理对玻璃表面生物膜的破坏效果Table 1 Destructive effect of PDI on P. fluorescens biofilm formed on glass
2.3.2 对ABS板表面荧光假单胞菌生物膜的破坏效果
实验进一步采用冰箱、冷柜等内部材质ABS板作为载体,在其表面培养并形成荧光假单胞菌生物膜,研究姜黄素介导的PDI对其表面形成生物膜的破坏效果。由表2可知,姜黄素介导的PDI处理使其表面生物膜菌落数对数值下降4.42(lg(CFU/mL));加入0.5% EDTA溶液后,菌落数对数值减小约6.60(lg(CFU/mL)),显著提高了PDI效果(P<0.05)。
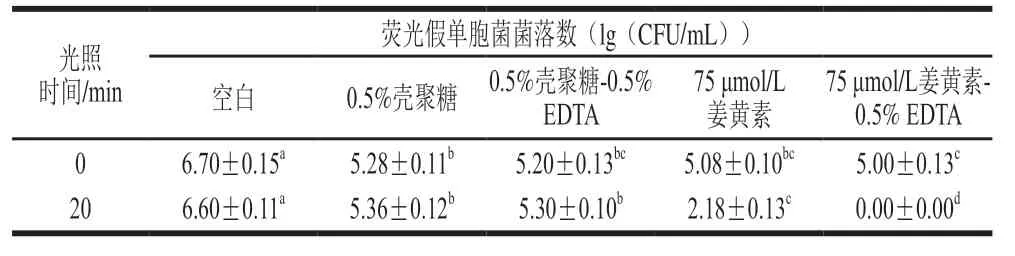
表2 PDI处理对ABS板表面生物膜的破坏效果Table 2 Destructive effect of PDI treatment on biofilm formed on ABS plates
单一及混合生物膜的形成会加速食品的腐败,引起食品安全问题,甚至造成食品加工设备的损坏。对食品表面、食品包装材料表面及食品加工设备表面微生物生物膜的去除,是食品领域有待解决的一项难题。Cai Zhiyu等[26]研究报道,抗菌剂联合PDI处理能显著降低钛表面金黄色葡萄球菌生物膜中的微生物数量。本课题组前期研究[27]报道了以姜黄素作为光敏剂的PDI处理可以有效灭活玻璃和不锈钢表面金黄色葡萄球菌生物膜中的微生物。檀利军等[28]也报道了姜黄素介导的光动力技术对副溶血性弧菌、腐败希瓦氏菌生物被膜的清除效果。可见,姜黄素及联合EDTA等协同剂的PDI处理可为传统杀菌技术提供有效的补充,为去除微生物生物膜提供一种新型、经济有效的方法。
2.4 PDI处理对新鲜猪肉的保鲜效果
2.4.1 荧光假单胞菌菌落数变化
不同猪肉4 ℃贮藏期间荧光假单胞菌的菌落数变化如图5所示。贮藏0 d,与空白组相比,PDI处理猪肉表面荧光假单胞菌菌落数对数值减小了2.68(lg(CFU/g)),添加0.5% EDTA后,猪肉表面菌落数对数值减少3.23(lg(CFU/g)),表明PDI处理对新鲜猪肉表面的荧光假单胞菌具有良好的灭活效果,而且EDTA能够进一步提高其灭活效果。随贮藏时间的延长,空白组猪肉表面的荧光假单胞菌快速生长,第3天时菌落数增长至7.90(lg(CFU/g)),而经PDI处理后的猪肉中荧光假单胞菌生长缓慢,第3天时PDI组的菌落数为5.00(lg(CFU/g)),显著低于空白组(P<0.05);第10天时,空白组猪肉的荧光假单胞菌菌落数增长至8.99(lg(CFU/g)),而PDI组的菌落数为6.57(lg(CFU/g)),PDI+EDTA组猪肉中荧光假单胞菌菌落数仅为5.94(lg(CFU/g)),显著低于其他处理组(P<0.05),表明PDI+EDTA处理对新鲜猪肉表面的荧光假单胞菌具有更好的抑菌效果。
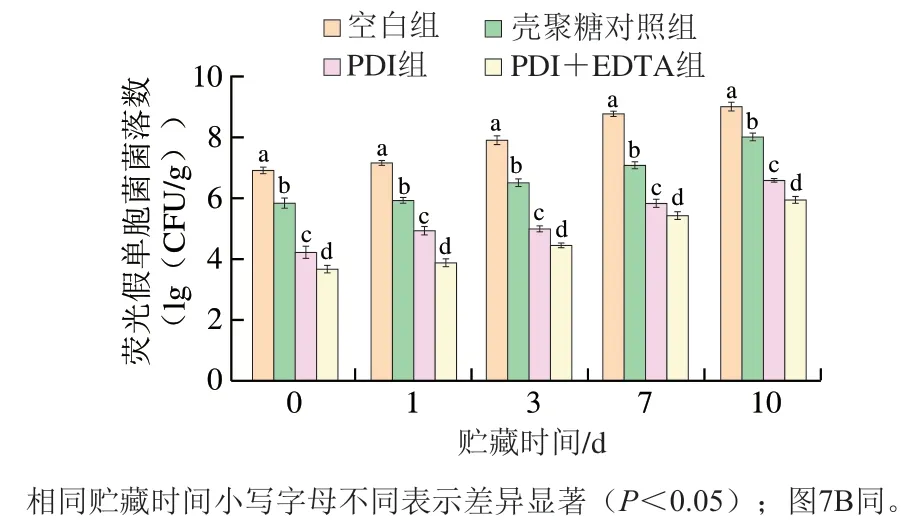
图5 贮藏期间猪肉表面荧光假单胞菌菌落数的变化Fig. 5 Changes in P. fluorescens count on pork during storage
本课题组前期研制了姜黄素/壳聚糖/γ-聚谷氨酸可食性复合膜,并评价了该可食性膜对培根和火腿的光动力保鲜效果,该膜具备优良的物理特性和一定的机械强度,经PDI处理后对培根和火腿表面微生物起到显著的抑制作用,且提升了产品的感官品质[29]。因此,在后续的研究中可以结合本次实验的结果,进一步优化光动力杀菌条件,提高杀菌效果,同时开发更好的涂膜或包装材料用于食品表面杀菌或保鲜。
2.4.2 质量损失率的变化
如图6所示,在经过PDI处理后的当天,PDI组质量损失率最大,为2.14%;PDI+EDTA组的质量损失率为1.79%。壳聚糖对照组及PDI组猪肉的质量损失率随着贮藏时间的延长逐渐增大。猪肉经一定时间的光照处理后,表面温度出现短暂、轻微的升高,这可能与猪肉质量损失有一定的关系。这也提示本实验所用PDI处理设备需要增加冷却装置或提高光照强度以缩短光照时间。总之,解决光照引起的升温及设备内部散热差的问题,对于PDI技术及设备的应用是非常必要的。
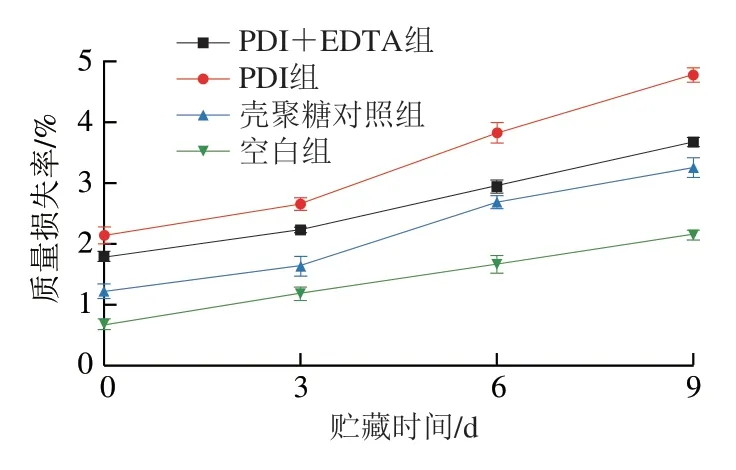
图6 贮藏期间猪肉的质量损失率Fig. 6 Mass loss percentage of pork during storage
2.4.3 色泽的变化
姜黄素是一种天然的黄色色素,由于其着色力强,具有一经着色就不易褪去等特点,在一定程度上限制了其在各个领域的广泛应用[30]。而通过实验发现,姜黄素经蓝色LED灯照射一段时间后,其颜色变浅,这一发现有助于拓展姜黄素在食品杀菌领域的应用范围。光照处理前后不同浓度的姜黄素溶液颜色如图7A所示,光照20 min后,不同浓度的姜黄素溶液颜色均较光照前明显变浅。王雪梅等[31]研究发现,乙醇溶液中的姜黄素在光照后会分解产生香草醛和阿魏酸,导致姜黄素溶液颜色变浅。
为了进一步探明不同浓度姜黄素在猪肉上的使用效果,采用色差仪分别测定不同浓度姜黄素PDI处理后猪肉的色泽,并计算ΔE,结果如图7B所示,新鲜猪肉的ΔE与姜黄素浓度总体呈现正相关关系。75 μmol/L的姜黄素溶液处理猪肉经光照后,第0天ΔE为3.03,显著高于对照组(P<0.05),但感官上可以接受。姜黄素浓度越大,ΔE越大。同时,随着新鲜猪肉贮藏时间的延长,ΔE没有呈现出明显的变化规律,且同一浓度姜黄素处理的猪肉无显著性差异(P>0.05)。
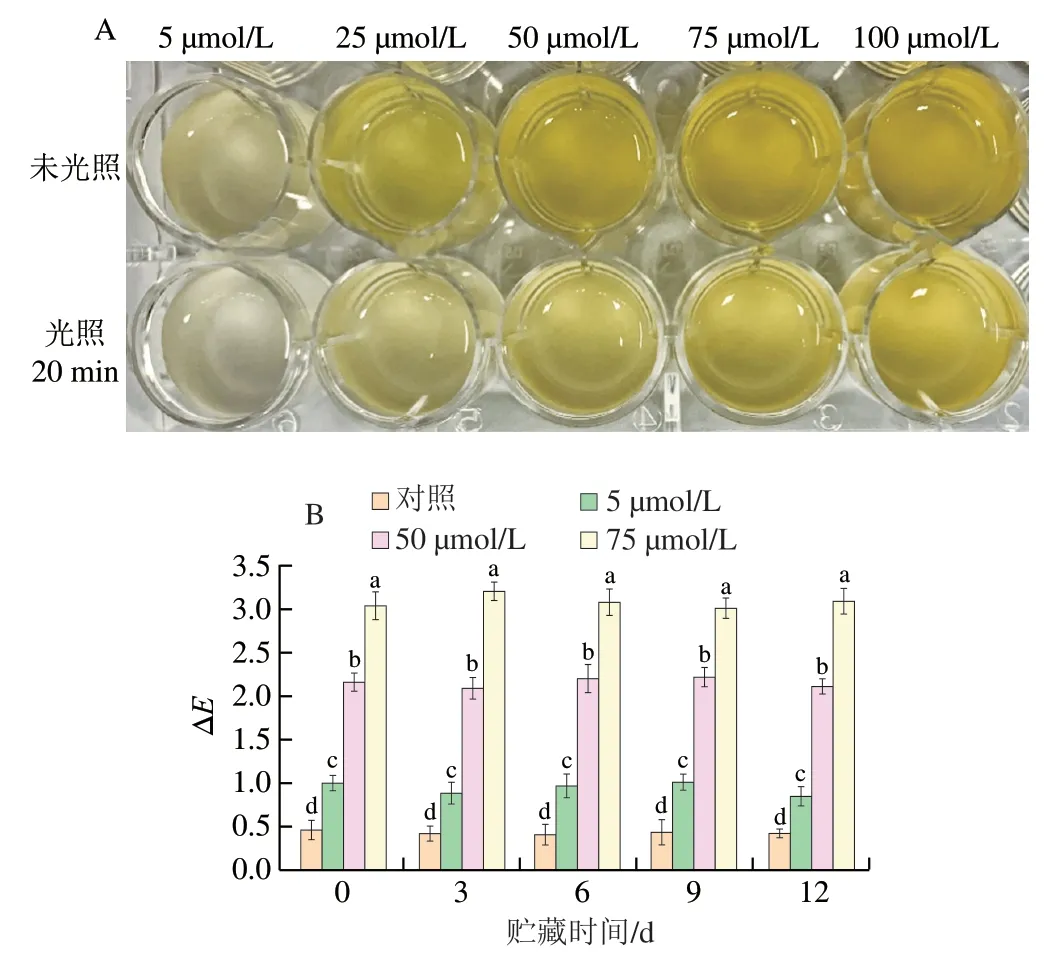
图7 姜黄素溶液(A)和猪肉(B)色泽的变化Fig. 7 Color changes of curcumin solution (A) and changes in ΔE of pork (B)
2.4.4 pH值的变化
pH值是反映肉品质的重要指标之一。如图8所示,随着贮藏时间的延长,各处理组猪肉的pH值逐渐升高,这主要是由于猪肉中细菌数量的增加其蛋白质和氨基酸发生降解,形成氨和胺类等碱性物质[32]。在10 d的贮藏期内,PDI+EDTA组猪肉pH值从5.87增加至6.17,与空白组及其他处理组相比,pH值增加相对平缓。由此可以看出,PDI+EDTA作用能够减缓猪肉在贮藏过程中的腐败速率,更好地保持猪肉的新鲜程度。
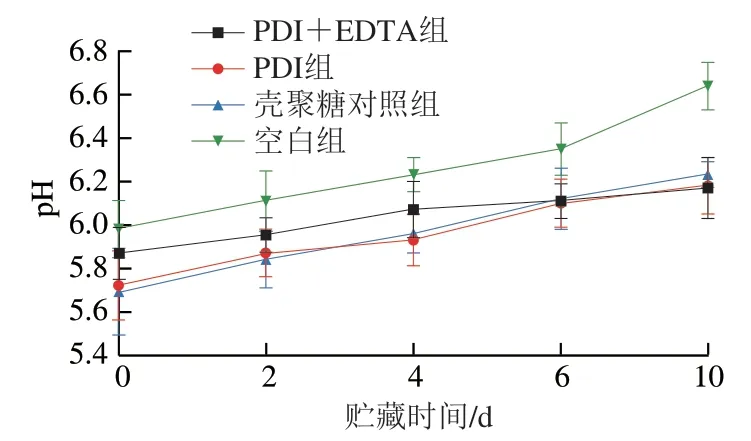
图8 贮藏期间猪肉pH值的变化Fig. 8 Changes in pH of fresh pork during storage
3 结 论
本研究结合光敏剂姜黄素浓度、光照时间、协同剂EDTA,优化了对荧光假单胞菌PDI作用的最佳条件,明确了姜黄素协同EDTA的PDI作用对荧光假单胞菌生物膜的去除效果。应用实验室自行研制的光动力杀菌装置,尝试分析EDTA联合姜黄素的PDI作用对新鲜猪肉的保鲜效果。结果表明,姜黄素联合EDTA的PDI作用对优势嗜冷性腐败菌-荧光假单胞菌及其生物膜均具有良好的灭活效果,并能显著抑制新鲜猪肉表面的荧光假单胞菌,改善猪肉感官品质,延长猪肉的保鲜期。
PDI作为一种新型的非热杀菌技术在食品领域逐渐显示出巨大的应用潜力。但该技术在实际应用中还存在一定的局限性,结合他人研究以及本实验室开展的工作,认为后续研究可集中在以下方面进行:1)可以结合光动力协同剂、成膜剂等,研发可用于食品包装、食品表面涂膜、加工设备杀菌的新型光动力杀菌材料,以提高杀菌效率和安全性;2)光动力杀菌设备的研发和优化,包括选择合适的光源、光强度,并考虑温度控制、对不同样品的适应性等,以扩大光动力杀菌技术的应用范围,实现可操作性;3)探讨光动力杀菌与热杀菌、化学杀菌等传统杀菌技术的结合,尝试将其运用在实际生产中,弥补传统杀菌的缺陷和不足,以充分发挥光动力杀菌技术的优势。
