滩羊肉宰后成熟期间ATPase活力变化对微观结构及保水性的影响
2022-11-30刘吉娟罗瑞明
姬 琛,罗 辉,刘吉娟,罗瑞明,,*
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
滩羊是分布于陕西、甘肃、宁夏的优质特色畜种,由于其肉质鲜美、营养丰富备受消费者喜爱。保水性是衡量滩羊肉品质的重要指标之一,可用滴水损失表征[1]。宰后成熟过程中肌肉会发生复杂的生理生化变化,对肉的保水性有重要影响。目前,宰后成熟过程中过度的汁液流失仍是影响滩羊肉外观、营养价值、经济价值的主要问题之一。因此,研究宰后成熟过程中滴水损失的形成对于指导滩羊肉生产加工具有重要意义。
宰后成熟过程中肉品的保水性受诸多因素影响,如成熟条件、糖酵解、肌肉pH值等,最终由结构蛋白的降解程度及空间排列决定,这些因素通过引起肌纤维和肌细胞的收缩来调节水分贮留[2-3]。钙蛋白酶(Calpains)与细胞凋亡酶——胱天蛋白酶(Caspases)是目前公认宰后成熟过程中水解结构蛋白质的主要酶类[4]。Koohmaraie[5]认为Calpain-1对结构蛋白水解起主要作用。然而,由于宰后Calpain逐渐失活,其水解作用受限。慕妮[6]的研究结果表明鸡肉成熟9 h时Calpain-1基本完全失活,但结构蛋白的降解仍在发生。近些年,细胞凋亡理论被引入宰后肉品品质形成研究中,Caspases被认为是宰后肌纤维骨架蛋白降解的主要贡献者,尤其是Caspase-3,研究证实其是宰后成熟过程中调控肌原纤维蛋白降解程度的主要酶之一,其活性主要受细胞凋亡相关通路调控。Huang Ming等[7]研究发现Caspase-3可体外降解鸡肉中的伴肌球蛋白、伴肌动蛋白和α-辅肌动蛋白,并弱化Z线与I盘的连接。Chen Lin等[8]研究发现Caspase-3可体外降解鸡肉中的肌钙蛋白-T。宰后成熟期间ATPase可调控引发细胞凋亡的相关通路,通过级联反应激活Caspase-3,从而水解结构蛋白。Chaves等[9]发现Na+-K+-ATPase通过改变膜通透性,释放细胞色素c,启动Caspases级联反应,影响肌肉细胞的凋亡和纤维化,破坏肌质网结构,从而影响肉的保水性。Sierra等[10]阐明了宰后Ca2+-ATPase通过向细胞外泵出Ca2+,促使H+流入细胞内,引起细胞内离子稳态失衡,导致线粒体膜通透性改变,启动细胞凋亡,激活Caspase-3降解肌纤维蛋白。
本实验选取滩羊背最长肌为研究对象,成熟8 d,通过测定ATPase活力、Caspase-3活力、微观结构与品质指标变化,确定滩羊肉保水性对ATPases活性变化的响应,以期为指导滩羊肉生产加工提供理论依据。
1 材料与方法
1.1 材料与试剂
滩羊背最长肌由宁夏盐池县大夏牧场食品有限公司提供,选取9 只体质量相近的6 月龄公滩羊,屠宰前统一管理。屠宰后立即采集胴体右侧背最长肌,剔除可见脂肪与结缔组织后放置于保鲜袋中,于4 ℃、风速3 m/s、相对湿度85%条件下成熟0、4、8 d。
1.2 仪器与设备
DW3.0.1型超低温冰箱 无锡冠亚恒温制冷技术有限公司;352型酶标仪 芬兰Labsystems Multiskan MS公司;AC8型洗板机 芬兰ThermoLabsystems公司;TG16W型离心机 湖南湘仪实验室仪器开发有限公司;GNP-9080型恒温培养箱 上海昕仪仪器仪表有限公司;Leica UC7型超薄切片机 德国徕卡公司;HT7700型透射电子显微镜 日本Hitachi公司;便携式pH计 上海德图仪器国际贸易有限公司。
1.3 方法
1.3.1 样品采集
采集成熟0、1、2、4、8 d的滩羊背最长肌约200 g,用于测定pH值与滴水损失率;采集不同成熟时间样品各20 g置于-30 ℃保存,用于测定蛋白溶解度;采集不同成熟时间样品各5 g封装于灭菌冷冻管中,置于-80 ℃保存,用于测定酶活力。
1.3.2 pH值测定
去除样品可见脂肪,使用pH计测定肌肉pH值。使用前pH计以3 种标准缓冲液(pH 9.18、6.86、4.0)进行校准。
1.3.3 滴水损失率测定
参照左惠心[11]的方法并稍作修改。取约60 g样品准确称质量后用绳子悬挂于自封袋中,确保样品与自封袋无接触,置于4 ℃冰箱中,24 h后用纸巾吸干样品表面水分后重新称质量。滴水损失率以两次称量的质量差占肉块初始质量的百分比表示。
在屋里做饭的媳妇听见孩子的哭声,急忙从屋里出来,边走边在围裙上擦着手,嘴里吆呼着:“狗蛋咋啦?狗蛋咋啦?”看见哥们儿朝洛蒙背着双肩包在黑地里高粱杆似的戳着。媳妇把狗蛋从地上抱起来,颠着哄:“奥奥奥,狗蛋别哭,狗蛋别哭,我们的狗蛋不哭。”
1.3.4 微观结构观察
参考Li Ke等[12]的方法,取不同成熟时间样品切成20 mm×20 mm×20 mm块状,戊二醛溶液预固定4 h后用磷酸缓冲液(0.1 mol/L、pH 7.4)漂洗3 次,每次15 min。再加入含1%锇酸的磷酸缓冲液(0.1 mol/L、pH 7.4)室温固定2 h,用磷酸缓冲液(0.1 mol/L、pH 7.4)漂洗3 次,每次15 min。乙醇梯度脱水,环氧树脂渗透包埋,用超薄切片机切成厚60 nm的超薄切片,铀铅双染色(2%醋酸铀饱和乙醇溶液、枸橼酸铅各染色15 min),切片室温干燥过夜,用透射电子显微镜进行拍照观察。
1.3.5 蛋白溶解度测定
参照李升升[13]的方法并稍作修改。准确称取1 g肉样剪碎置于10 mL离心管中,加入SDS溶液(85 ℃、50 g/L、1 mL),12 000 r/min均质3 min(每30 s间歇10 s)后15 000 r/min离心20 min,上清液即为总可溶性蛋白。
准确称取1 g肉样剪碎置于10 mL离心管中,加入1 mL超纯水,12 000 r/min均质2 min后15 000 r/min离心5 min,上清液即为水溶性蛋白溶液。收集上一步骤沉淀,加入1 mL低盐溶液(含0.116 9 g NaCl、0.038 0 g EGTA、0.305 0 g MgCl2、0.077 1 g二硫苏糖醇、0.003 5 g苯甲基磺酰氟、0.040 8 g NaH2PO4、0.042 9 g Na2HPO4),4 ℃、12 000 r/min均质2 min后,15 000 r/min离心5 min并收集上清液,即为低盐溶性蛋白溶液。收集低盐溶性蛋白溶液剩余的沉淀,加入1 mL高盐溶液(含0.19 g EGTA、0.305 g MgCl2、0.077 1 g二硫苏糖醇、0.003 5 g苯甲基磺酰氟、2.659 g Na2P2O7),4 ℃、12 000 r/min均质2 min后15 000 r/min离心20 min,上清液即为高盐溶性蛋白溶液。采用考马斯亮蓝法测定蛋白质量浓度。
1.3.6 Caspase-3、Na+-K+-ATPase及Ca2+-ATPase活力测定
根据试剂盒说明书,采用酶联免疫吸附测定法测定Caspase-3、Na+-K+-ATPase及Ca2+-ATPase活力。称取1 g切碎肌肉样品加入9 mL磷酸盐缓冲液(pH 7.2、0.01 mol/L)于4 ℃匀浆,然后4 ℃、5 000 r/min离心15 min,收集上清液。将上清液与共轭试剂(多聚半乳糖醛酸酶、果胶甲基酯酶)于37 ℃孵育30 min后采用蒸馏水梯度稀释加入96 孔微量滴定板中。加入酶标试剂并于37 ℃反应30 min。将50 µL显色液A(醋酸钠、柠檬酸、过氧化氢)和50 µL显色液B(EDTA-Na、柠檬酸、甘油、四甲基联苯胺)依次加入滴定板,37 ℃于避光处孵育15 min,最后加入50 µL硫酸溶液(1 mol/L)终止反应。使用酶标仪在450 nm波长处检测吸光度。采用梯度稀释法,用0.01 mol/L磷酸盐缓冲液稀释共轭试剂,绘制标准曲线,根据标准曲线方程计算酶活力(U/L)。以成熟0 d时初始酶活力为1,计算各成熟时间样品中Caspase-3、Na+-K+-ATPase及Ca2+-ATPase相对活力。
1.4 数据处理与分析
每个指标重复测定3 次,结果以平均值±标准差表示。采用SPSS软件对数据进行方差分析,P<0.05表示存在显著差异。采用Origin软件绘图。采用SPSS软件计算各指标间的皮尔逊相关性系数。
2 结果与分析
2.1 滩羊肉宰后成熟过程中pH值及滴水损失率的变化
由图1可知,宰后成熟期间滩羊背最长肌滴水损失率随成熟时间延长呈先升高后降低的趋势(P<0.05),并于成熟2 d时达到最大值(7.57%)。滴水损失率越高,肉的保水性越差,表明成熟2 d时滩羊肉的保水性较差,随着成熟时间的延长,肉中可流失水分含量总体减少,因此滴水损失率亦减小。本研究结果与惠小洋等[14]对4 ℃成熟过程中黄牛×西门塔尔杂交牛背最长肌滴水损失率变化规律的研究结果一致。肌肉中的水分可分为结合水、自由水、不易流动水,其中自由水储存于细胞间隙,最易流失;结合水由于与蛋白质紧密结合而不易受宰后成熟过程的影响;不易流动水约占肌肉水分含量的80%,由于其被固定在肌纤维结构中,但并不与蛋白质结合,因此最易受到肌原纤维蛋白降解和蛋白质电荷变化的影响[1],故肉品的保水性虽受诸多因素影响,但最终由细胞骨架蛋白的结构及其空间排列的变化决定。滩羊背最长肌保水性的变化表明宰后成熟过程中肌肉结构的完整性遭到破坏,肌肉中潴留的水分减少,成熟初期肌细胞间隙的自由水首先在重力作用下流失,随着成熟时间的延长,肌细胞收缩、肌原纤维蛋白降解及肌肉pH值下降,导致不易流动水流失,并在重力作用下形成滴水损失;成熟后期,由于绝大多数自由水及不易流动水已转化为滴水损失,肉中的水分含量总体减少,因此可转化为滴水损失的水分亦减少。
由图2可知,成熟0~2 d,滩羊肉pH值显著降低(P<0.05),并于成熟2 d时降至最低(5.55),2~4 d变化不显著(P>0.05),4 d后显著升高至5.63(P<0.05)。既往研究表明,宰后成熟初期家畜肌肉pH值可降至5.4~6.3[15-16],本研究结果符合这一规律。宰后成熟过程中,肌肉pH值下降的速率和程度显著影响代谢酶的活性,对于肉色、嫩度、保水性和风味前体的形成有重要影响[3]。糖原被认为是宰后成熟过程中肌肉中唯一的碳水化合物来源,研究表明宰后成熟初期肌肉中腺苷酸活化蛋白激酶活力升高,己糖激酶、果糖磷酸激酶、丙酮酸激酶、乳酸脱氢酶等被激活[17-18],进而促进糖原转化为乳酸,导致乳酸积累,该过程是引起肌肉pH值降低的主要原因。肌肉pH值被认为是宰后重要的品质评价指标之一,除影响肌原纤维蛋白降解相关酶活性外,蛋白质与水分的结合也受其影响,当肌肉pH值降至蛋白等电点时,蛋白对水分的吸引力降低[11],其主要机制为不易流动水储存于细胞内蛋白质交联所形成的空间内[1],pH值降低至一定程度会引起储存水分的蛋白质变性(如肌球蛋白头部)[19],导致存储水分的空间减小,从而引起滴水损失增加,造成肌肉保水性下降。成熟2 d时滩羊肉保水性较差可能与pH值降至最低时引起的肌球蛋白头部等蛋白变性有关,而成熟后期滴水损失有所降低可能与pH值偏离蛋白质等电点有关。因此,宰后成熟过程中肌肉pH值的变化对滴水损失有重要影响。
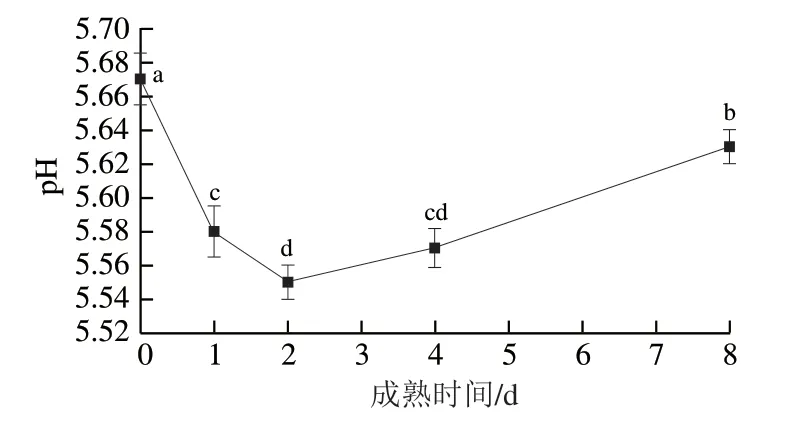
图2 滩羊肉宰后成熟期间肌肉pH值的变化Fig. 2 Variation in pH of Tan sheep meat during postmortem aging
2.2 宰后成熟期间滩羊背最长肌微观结构变化及肌原纤维蛋白降解情况
如图3所示,成熟0 d时,滩羊背最长肌肌原纤维排列紧密,相邻肌纤维间隙很小,肌纤维结构清晰、排列整齐;Z线结构清晰、排列整齐;H带结构清晰、连续;大部分肌纤维膜与肌原纤维紧密相连,相邻肌原纤维之间没有明显间隙。成熟4 d时,肌细胞整体呈中度水肿,肌纤维排列整齐、结构致密,分布略显稀疏,间隙明显增宽,肌节呈对称分布。Z线结构清晰、排列整齐,没有明显断裂;H带结构清晰;肌原纤维间隙较小,肌膜大部分与肌原纤维分离。成熟8 d时,肌细胞整体呈重度水肿,肌纤维结构稀疏、排列松散、边缘模糊,较多肌丝发生断裂、溶解现象,肌纤维不连续;Z线局部断裂、不连续;H带结构模糊、消失。

图3 宰后成熟过程中滩羊肉微观结构的变化Fig. 3 Variation in microstructure of Tan sheep meat during postmortem aging
以上结果表明,成熟0~4 d内仅部分肌原纤维蛋白发生降解,构成粗丝及细丝的肌动蛋白、肌球蛋白等可能被蛋白水解酶降解;随着成熟时间延长,Z线断裂、H带消失、肌纤维断裂、肌原纤维结构松散、肌纤维及肌膜之间形成间隙,可能是因为肌间线蛋白等结构蛋白在成熟后期发生了降解,且肌球蛋白、肌动蛋白等蛋白的持续降解导致肌丝之间的间隙扩大,这些间隙的形成为肉中水分的流失提供了通道。另外,研究表明宰后成熟过程中肌膜中整联蛋白的降解使肌原纤维和肌膜之间形成间隙[20-21]。因此,肌纤维与肌膜之间间隙的形成除了受肌原纤维蛋白降解的影响之外,可能还与成熟后期整联蛋白的降解有关。
由于水分主要储存于肌肉结构中,且微观结构的变化主要由结构蛋白的降解引起,因此,测定蛋白降解情况对于研究肉品保水性十分重要,而蛋白溶解度是衡量蛋白降解程度的重要指标。肌肉中的蛋白根据溶解性可分为水溶性蛋白、低盐溶性蛋白及高盐溶性蛋白,其中,水溶性蛋白与低盐溶性蛋白均属于肌浆蛋白,包括肌红蛋白、糖酵解酶、三羧酸循环酶、氧化磷酸化酶等[22];高盐溶性蛋白属于肌原纤维蛋白,包括肌球蛋白、肌动蛋白、原肌球蛋白、肌联蛋白等[23]。如图4A所示,滩羊背最长肌总可溶性蛋白质量浓度随成熟时间延长由28.01 µg/µL降至19.92 µg/µL(P<0.05),可能是内源酶降解蛋白所致。如图4B、C所示,水溶性蛋白质量浓度在成熟0~2 d变化不显著(P>0.05),第8天时显著降至2.09 µg/µL,低盐溶性蛋白在成熟0~8 d期间持续下降至2.14 µg/µL,可能是因为随着pH值的下降及成熟时间的延长,内源酶逐渐变性所致;如图4D所示,高盐溶性蛋白质量浓度在宰后成熟过程中呈显著下降趋势,由13.82 µg/µL降低至9.96 µg/µL,表明肌原纤维蛋白在整个成熟期内均发生降解。
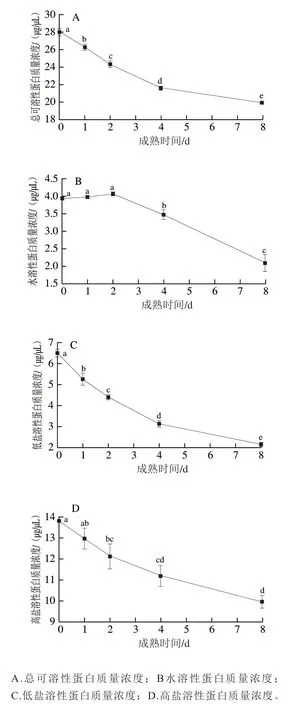
图4 滩羊肉宰后成熟期间蛋白质溶解度的变化Fig. 4 Variation in protein solubility of Tan sheep meat during postmortem aging
2.3 滩羊肉宰后成熟过程中ATPase及Caspase-3活力变化
如图5所示,宰后滩羊背最长肌细胞中Na+-K+-ATPase相对活力整体呈先上升后下降的趋势(P<0.05),成熟1 d时达到最高值,为0 d时的1.04 倍,8 d时降至最低,为0 d时的56%。Na+-K+-ATPase是哺乳动物细胞膜上进行离子转运的跨膜载体蛋白,负责维持细胞膜内Na+/K+电化学梯度[24],且可以加速降解ATP。本研究结果显示Na+-K+-ATPase活力于成熟1 d后显著降低,表明滩羊肉肌细胞在1 d内可能启动了离子交换系统,通过改变线粒体膜通透性启动细胞凋亡影响Caspase-3活力。研究表明宰后成熟过程中,Na+-K+-ATPase启动Na+与K+在线粒体膜、内质网膜两侧对向移动,激活Na+-H+、K+-H+交换系统,形成膜内外H+梯度差,从而改变线粒体膜通透性,释放细胞色素c,启动细胞凋亡[25]。此外,Na+-K+-ATPase有助于ATP水解,而ATP水解产物的积累可能也与成熟初期肌肉pH值的下降有关。Ca2+-ATPase介导Ca2+跨膜运输,其活力在0~1 d显著升高(P<0.05),并于1 d时升至最大值,为0 d的1.42 倍,1~2 d显著下降(P<0.05),2~4 d有所回升,4~8 d又显著降低(P<0.05)。宰后成熟初期Ca2+-ATPase活力显著升高,表明成熟初期大量离子交换导致Ca2+-ATPase被激活,Ca2+被Ca2+-ATPase泵出,导致细胞内Ca2+超载,1~2 d内其活力下降可能与pH值的降低有关。Ca2+-ATPase活力于宰后1 d达到最大值,表明滩羊肉肌细胞在宰后1 d内可能由于Ca2+超载启动了细胞凋亡级联反应。王琳琳等[26]研究发现宰后12 h牦牛背最长肌中Ca2+-ATPase活力达到最大值,本研究结果与其不一致,可能是由于物种不同。

图5 滩羊肉宰后成熟期间ATPase活力的变化Fig. 5 Variation in the activity of ATPase in Tan sheep meat during postmortem aging
如图6所示,成熟0~2 d,Caspase-3活力显著升高至最大值,为初始值的1.52 倍(P<0.05),2 d后其活力显著降低(P<0.05),宰后8 d降至0 d时的1.19 倍。王琳琳[4]的研究结果表明宰后成熟7 d时牦牛背最长肌中Caspase-3活力高于0 d时,与本研究结果一致。Caspase-3活力的变化趋势表明宰后2 d内滩羊肌细胞启动了细胞凋亡,并激活了凋亡效应酶Caspase-3。动物宰后受缺血、缺氧信号的调节,肌肉中糖原分解、代谢物积累、ATP消耗,从而引起细胞凋亡,这一过程依赖于内源线粒体信号途径[27]。牦牛肉在宰后成熟过程中活性氧的产生和Ca2+超载可能导致细胞色素c的释放,从而激活Caspase-3[28-29]。本研究结果表明,宰后成熟初期肌细胞内Na+-K+-ATPase与Ca2+-ATPase活力变化可能引起了细胞内离子失衡及Ca2+超载,促使细胞色素c从呼吸链上游离并释放至胞浆中,最终形成凋亡小体并激活下游Caspase-3。Caspase-3被认为有助于肌原纤维的水解,弱化Z盘与I盘的连接[7]。研究发现Caspase-3可以促进宰后成熟过程中西门塔尔牛肌肉中肌动蛋白、伴肌动蛋白和肌钙蛋白-T的降解[30]。另外,酸化的细胞环境有利于维持Caspase-3活力[31],因此,成熟后期肌肉组织内间隙增多可能与Caspase-3降解结构蛋白有关,并且较低的肌肉pH值维持了较高的Caspase-3活力。
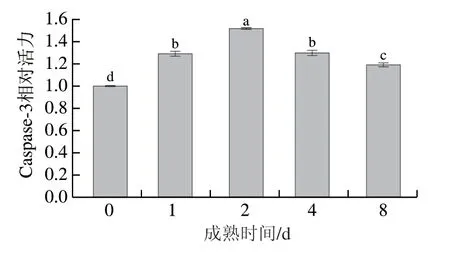
图6 滩羊肉宰后成熟期间Caspase-3活力的变化Fig. 6 Variation in the activity of caspase-3 in Tan sheep meat during postmortem aging
2.4 宰后成熟期间ATPase在滩羊肉保水性变化中的作用
对滩羊肉宰后成熟期间肌肉pH值、滴水损失率及Na+-K+-ATPase、Ca2+-ATPase、Caspase-3活力进行相关性分析,由表1可知,滩羊肉滴水损失率与肌肉pH值呈极显著负相关(P<0.01),与Na+-K+-ATPase及Caspase-3活力均呈极显著正相关(P<0.01);滩羊肉pH值与Na+-K+-ATPase、Ca2+-ATPase及Caspase-3活力均呈极显著负相关(P<0.01)。Caspase-3活力与Na+-K+-ATPase及Ca2+-ATPase活力均呈极显著正相关(P<0.01)。相关性分析结果表明,Na+-K+-ATPase与Ca2+-ATPase活力的变化会影响肌细胞内Caspase-3活力,进而调控肌原纤维蛋白的水解过程,影响肌肉结构的完整性,最终影响肉的保水性。而肌肉pH值与Na+-K+-ATPase、Ca2+-ATPase及Caspase-3活力均呈极显著负相关,可能是因为能量效应酶与宰后细胞内代谢相关,影响肌肉pH值下降的速率与程度,反之,pH值又会影响酶活性。Ca2+-ATPase活力与滴水损失率无明显相关性可能是由于Ca2+-ATPase通过影响肌肉pH值间接影响滩羊肉的保水性。

表1 滩羊肉Na+-K+-ATPase、Ca2+-ATPase、Caspase-3活力及pH值、滴水损失率的相关性Table 1 Correlation between activities of Na+-K+-ATPase, Ca2+-ATPase and caspase-3 and drip loss rate in Tan sheep muscle
3 结 论
滩羊肉4 ℃成熟过程中Na+-K+-ATPase与Ca2+-ATPase活力均先升高后降低,并于1 d时达到最大值;Caspase-3活力先升高后降低,2 d时达到最大值;滴水损失率先升高后降低,肌肉pH值先降低后有所回升;总蛋白、低盐溶性蛋白及高盐溶性蛋白质量浓度均逐渐减少,水溶性蛋白质量浓度于成熟2 d后显著降低;成熟至8 d时,肌原纤维断裂,肌纤维之间、肌束之间、肌纤维及肌膜之间形成间隙,Z线断裂、H带消失。滩羊肉宰后成熟过程中Na+-K+-ATPase与Ca2+-ATPase活力变化可能促使下游Caspase-3激活;肌肉pH值的降低可能使Caspase-3活力维持在较高的水平;Caspase-3水解结构蛋白促使肌肉组织在不同部位形成间隙;在重力作用下肌肉中的水分流入结构蛋白降解所形成的间隙中,引起滩羊肉滴水损失率升高,致使滩羊肉的保水性变差。
