青花椒精油对致龋菌的体外抑菌活性
2022-11-30程志敏陈彦荣王建辉刘冬敏牟鸣薇谢雨菲易金枝
程志敏,陈彦荣,王建辉,刘冬敏,方 芳,张 博,牟鸣薇,谢雨菲,易金枝
(长沙理工大学食品与生物工程学院,湖南 长沙 410114)
青花椒(Zanthoxylum schinifoliumSiebold & Zucc.)是芸香科(Rutaceae)花椒属植物,果实油腺饱满,气味芬芳独特,是我国传统香辛料[1-2]。在民间医学中,花椒属植物常被用于治疗牙痛、腹泻等疾病[3]。从青花椒果皮中提取得到的青花椒精油(Z. schinifoliumessential oils,ZSEOs)具有广谱抑菌活性。Lei Hong等[3]报道了花椒精油对大肠杆菌(Escherichia coli)的最小抑菌质量浓度(minimum inhibitory concentration,MIC)为24 mg/mL,能够显著抑制E. coli的生长并对其形态结构产生不利影响。Li Ren等[4]研究发现毛大叶臭花椒精油中芳樟醇的相对含量高达79.00%,对E. coli、金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、白色念珠菌(Candida albicans)、烟曲霉(Aspergillus funigatus)、鲍曼不动杆菌(Acinetobacter baumannii)和肺炎克雷伯菌(Klebsiella pneumonia)均具有抑菌活性。此外,ZSEOs对表皮葡萄球菌(Staphylococcus epidermidis)和枯草芽孢杆菌(Bacillus subtilis)也具明显抑制作用,最小杀菌质量浓度(minimum bactericidal concentration,MBC)均为5 mg/mL[5]。然而,关于ZSEOs对致龋菌如变形链球菌(Streptococcus mutans)的体外抑菌活性鲜有报道。
龋齿是人类最常见的传染病之一,是一种由特定细菌引起的多种微生物共同作用导致的疾病[6]。血链球菌(S. sanguinis)是最早定植于牙齿表面上的细菌之一,其定植后促进了S. mutans和其他细菌的定植与黏附[7-8]。研究表明,S. mutans和远缘链球菌(S. sobrinus)与人类龋齿密切相关[9-11]。目前,由于洗必泰(chlorhexidine,CHX)[12]等抗生素存在耐药性、毒副作用等不良影响,研究人员逐渐将目光转向具有抗龋活性的天然产物,如柠檬精油[11,13]等。研究结果显示,柠檬精油及其主要成分柠檬烯均能抑制S. mutans和S. sobrinus的增殖,柠檬精油对两种细菌的MIC均为4.50 mg/mL[11,13]。青花椒与柠檬同属芸香科植物,ZSEOs可能对致龋菌也存在抑制活性,但迄今鲜见理论数据支撑。
本实验采用水蒸气蒸馏法提取ZSEOs,通过全二维气相色谱-飞行时间质谱(comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry,GC×GC-TOFMS)确定ZSEOs的化学组成,通过测定抑菌圈直径、MIC、MBC、致龋菌生长曲线研究ZSEOs对3 种致龋菌的体外抑菌活性,并通过扫描电子显微镜(scanning electron microscopy,SEM)观察ZSEOs作用于致龋菌后菌体的形态变化,初步探讨ZSEOs抑菌机制,为ZSEOs作为潜在的天然龋病抗菌剂提供理论依据和参考。
1 材料与方法
1.1 菌种、材料与试剂
S. mutans(北纳保藏中心(BeNa Culture Collection,BNCC)234186)、S. sanguinis(BNCC 134927)和S. sobrinus(BNCC 353916)购买于商城北纳创联生物技术有限公司。
实验所用青花椒分别产自重庆江津、四川金阳、贵州德江以及云南昭通。
无水硫酸钠(分析纯)、95%(体积分数,下同)乙醇(分析纯)、叔丁醇(化学纯) 国药集团化学试剂有限公司;脑心浸出液肉汤(brain heart infusion,BHI)美国BD公司;琼脂粉、Gluta固定液(SEM专用,2.5%)北京索莱宝科技有限公司;CHX、碘硝基氯化四氮唑蓝(p-iodonitrotetrazolium chloride,INT) 上海源叶生物科技有限公司;厌氧产气袋C-01、厌氧指示剂C-22日本三菱瓦斯化学株式会社。
1.2 仪器与设备
LDZM-80L立式高压蒸汽灭菌器 上海申安医疗器械厂;BBS-SDC医用洁净工作台 济南鑫贝西生物技术有限公司;Pegasus®4D GC×GC-TOFMS仪 美国LECO公司;VERSA max酶标仪 美国分子仪器公司;JSM-IT500 SEM 日本电子株式会社。
1.3 方法
1.3.1 ZSEOs的提取
参考文献[14]采用水蒸气蒸馏法从产于重庆江津、贵州德江、四川金阳、云南昭通的青花椒果皮(图1)中提取ZSEOs,分别记为ZS1EO、ZS2EO、ZS3EO、ZS4EO。将ZSEOs收集于棕色螺纹瓶中,无水硫酸钠干燥12 h,4 ℃冷藏备用。按下式计算精油得率。


图1 4 个不同产地青花椒的干燥果皮Fig. 1 Dry pericarp of Zanthoxylum schinifolium from four production areas in China
1.3.2 ZSEOs组成分析
采用GC×GC-TOFMS分析ZSEOs组成:第一维柱DB×WAX(30 m×250 μm,0.25 μm),进样温度250 ℃、进样量0.5 μL,初始温度60 ℃保留1 min,以5 ℃/min升至260 ℃,保留4 min。以He(99.9999%,1.0 mL/min)为载气,分流比10∶1。第二维柱DB-17MS(2 m×100 μm,0.10 μm),柱温高于第一维柱15 ℃。调制解调器温度始终高于第二维柱15 ℃。全二维分析时调制周期4.0 s、接口温度270 ℃、离子源温度230 ℃、电子轰击离子源70 eV、检测器电压1 670 V、采集频率50 张/s,质谱扫描范围为m/z33~550。
GC×GC-TOFMS结果经NIST17 MS Search检索后进一步根据质谱图鉴定ZSEOs的组成。通过峰面积归一化法确定各组分的相对含量。
1.3.3 ZSEOs抑菌活性测定
1.3.3.1 菌悬液的制备
将保藏S. mutans、S. sanguinis和S. sobrinus标准菌株的甘油管于37 ℃水浴1 min快速解冻。在无菌条件下,按照5%(体积分数)接种量分别接种至BHI液体培养基中,37 ℃厌氧培养24 h[15](后同),然后分别划线接种至BHI琼脂平板上,37 ℃厌氧培养24 h后,挑取典型单个菌落接种至BHI液体培养基中培养。充分振荡混匀,测定630 nm波长处光密度值OD630nm,调整菌悬液浓度至1×107CFU/mL(OD630nm=0.2)备用。
1.3.3.2 抑菌圈直径的测定
采用牛津杯法[16]测定4 种ZSEOs对3 种致龋菌的抑菌活性。用95%乙醇溶液将受试ZSEOs稀释至质量浓度32 mg/mL备用。在无菌操作台中,将20 mL高温高压灭菌后的BHI琼脂培养基冷却至45~50 ℃,然后注入200 μL菌悬液(1.3.3.1节制备,浓度1×107CFU/mL,下同),振荡混匀,迅速倾入均匀放置了3 个牛津杯(直径6 mm)的无菌培养皿(直径9 cm)中,待培养基凝固后取出牛津杯,吸取4 种待测ZSEOs样液各100 μL,分别注入相应标记孔中。分别以等体积95%乙醇溶液和0.5 mg/mL CHX溶液作为阴性对照和阳性对照。将培养皿置于37 ℃厌氧培养24 h,观察并记录抑菌圈直径。实验独立重复3 次,结果取平均值。
1.3.3.3 MIC和MBC的测定
采用肉汤微量稀释法[17]测定ZSEOs对3 种致龋菌的MIC和MBC。首先,将ZSEOs用BHI液体培养基连续二倍稀释至终质量浓度分别为0.0625、0.125、0.25、0.5、1、2、4、8、16、32 mg/mL。吸取100 μL菌悬液和100 μL含不同质量浓度ZSEOs的BHI液体培养基加入96 孔板中,每个质量浓度6 个复孔。以等体积BHI液体培养基为阴性对照组,以等体积0.5 mg/mL CHX为阳性对照组。空白对照组中不添加菌液。将96 孔板于37 ℃厌氧培养24 h。然后每孔加入40 µL INT染剂(质量分数0.02%,下同)。在微生物存在的情况下,INT指示剂的颜色将从透明变为粉红色或红色[17]。MIC为加入INT染剂后微孔中溶液不变色的最低ZSEOs剂量。然后从所有未变色的微孔中分别吸取10 μL混合培养物,分别对应加入100 μL含不同质量ZSEOs的新鲜BHI液体培养基中,37 ℃厌氧培养24 h后加入20 µL INT染剂进行第二次INT染色。MBC为加入INT染剂不引起微孔中溶液变色的最低ZSEOs剂量。
1.3.3.4 致龋菌生长曲线的测定
由抑菌圈直径及MIC、MBC结果筛选出抑菌活性最优的青花椒精油(ZSXEO)。根据Lei Hong等[3]的方法作适当修改,通过测定致龋菌生长曲线,初步探讨ZSXEO对3 种致龋菌生长的影响。于96 孔板中,将菌悬液与新鲜BHI液体培养基按照体积比1∶10混合,于37 ℃厌氧培养。在细菌生长的延迟期和对数生长期分别向培养基中加入终质量浓度为MIC的ZSXEO。继续培养,每隔2 h采用酶标仪测定630 nm波长处的光密度值OD630nm,绘制生长曲线。阳性对照组中将ZSXEO替换为CHX(0.5 mg/mL),阴性对照组中不添加ZSXEO。
1.3.3.5 菌体微观结构观察
通过观察ZSXEO处理后3 种致龋菌的形态变化,初步探讨ZSXEO的抗菌机理。参考Khaleda等[18]报道的方法并作适当修改。将无菌细胞爬片置于24 孔板底,每孔加入1.5 mL BHI液体培养基和0.5 mL菌悬液,37 ℃厌氧培养24 h。观察到细菌附着生长于玻片上后,弃去上清液并用0.01 mol/L pH 7.2~7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)漂洗。用BHI液体培养基将ZSXEO稀释至MIC,取2 mL稀释液加入孔板,分别以等体积BHI培养基和CHX溶液(0.5 mg/mL)为阴性对照组和阳性对照组,37 ℃厌氧培养24 h。用PBS洗涤载菌玻片2 次,室温干燥后置于Gluta固定液(电子显微镜专用,2.5%)中固定4 h。弃上清液,PBS洗涤2 次,依次加入35%(体积分数,后同)、50%、75%、90%乙醇溶液和无水乙醇进行梯度脱水,而后加入叔丁醇脱去乙醇,30 min/次。最后,用阴极喷涂镀金,在20.0 kV加速电压下用SEM观察菌体形态变化。
1.4 数据处理与分析
实验设置3 个平行,数据采用Excel 2019软件进行处理,结果以平均值±标准差表示。采用SPSS Statistics 22.0软件进行单因素方差分析,采用Bonferroni检验进行显著性分析,以P<0.05表示差异显著。采用GraphPrism 9软件作图。
2 结果与分析
2.1 ZSEOs的得率
采用水蒸气蒸馏法对产自重庆江津、贵州德江、四川金阳和云南昭通的青花椒进行精油提取,ZSEOs得率分别为(5.21±0.15)%、(7.27±0.03)%、(6.61±0.36)%和(10.21±0.22)%,均为淡黄色油状液体。
2.2 ZSEOs的化学组成
重庆江津(ZS1EO)、贵州德江(ZS2EO)、四川金阳(ZS3EO)和云南昭通(ZS4EO)4 个产地的ZSEOs中相对含量在0.1%以上的化学成分分别有63、64、59 种和63 种,分别占精油总量的97.49%、97.65%、96.99%和98.05%(表1)。所有ZSEOs样品中均富含芳樟醇(18.86%~22.00%)、柠檬烯(9.56%~14.84%)、β-月桂烯(5.79%~12.70%)、桧烯(5.49%~8.93%)和β-蒎烯(3.33%~6.41%)。其次,橙花叔醇在ZS1EO(4.80%)、ZS2EO(4.09%)、ZS3EO(3.00%)中相对含量较高而在ZS4EO中相对含量较低(0.14%),ZS4EO中β-侧柏酮(6.19%)的相对含量较高。
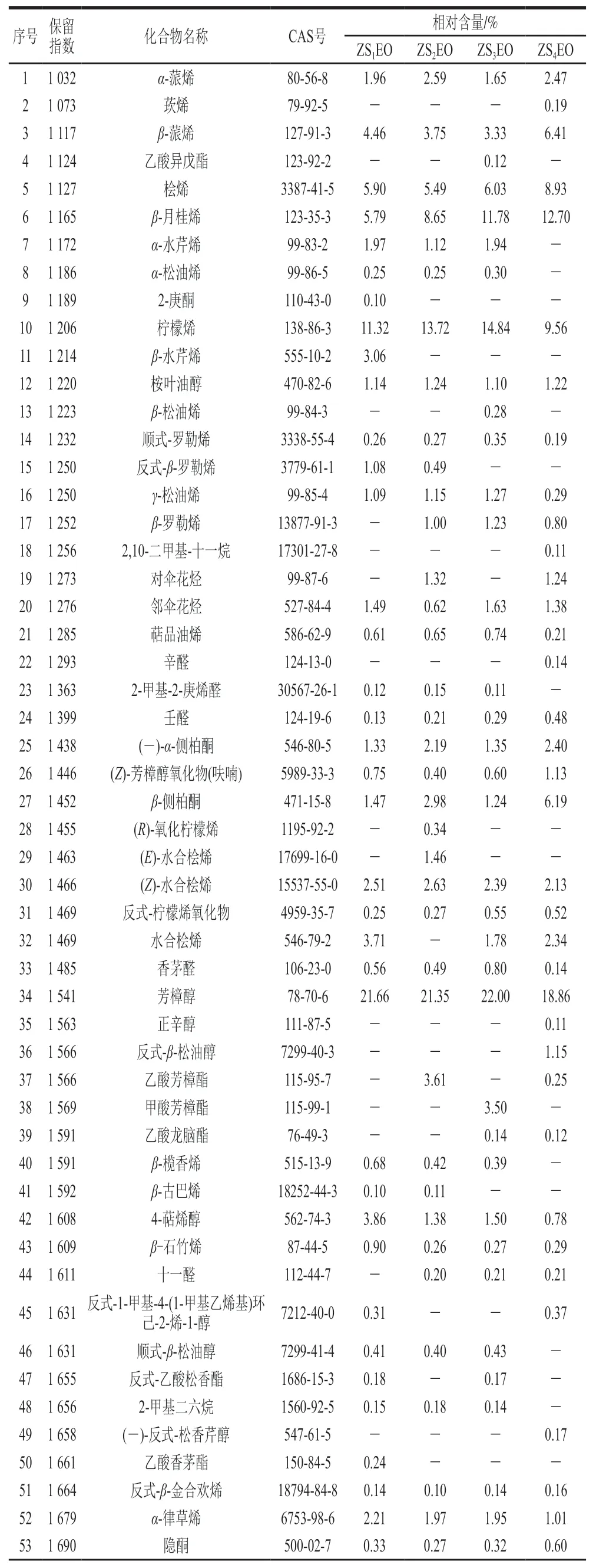
表1 我国4 个产地青花椒精油的化学成分GC×GC-TOFMS分析结果Table 1 Chemical compositions of ZSEOs from four different production areas as determined by GC × GC-TOFMS
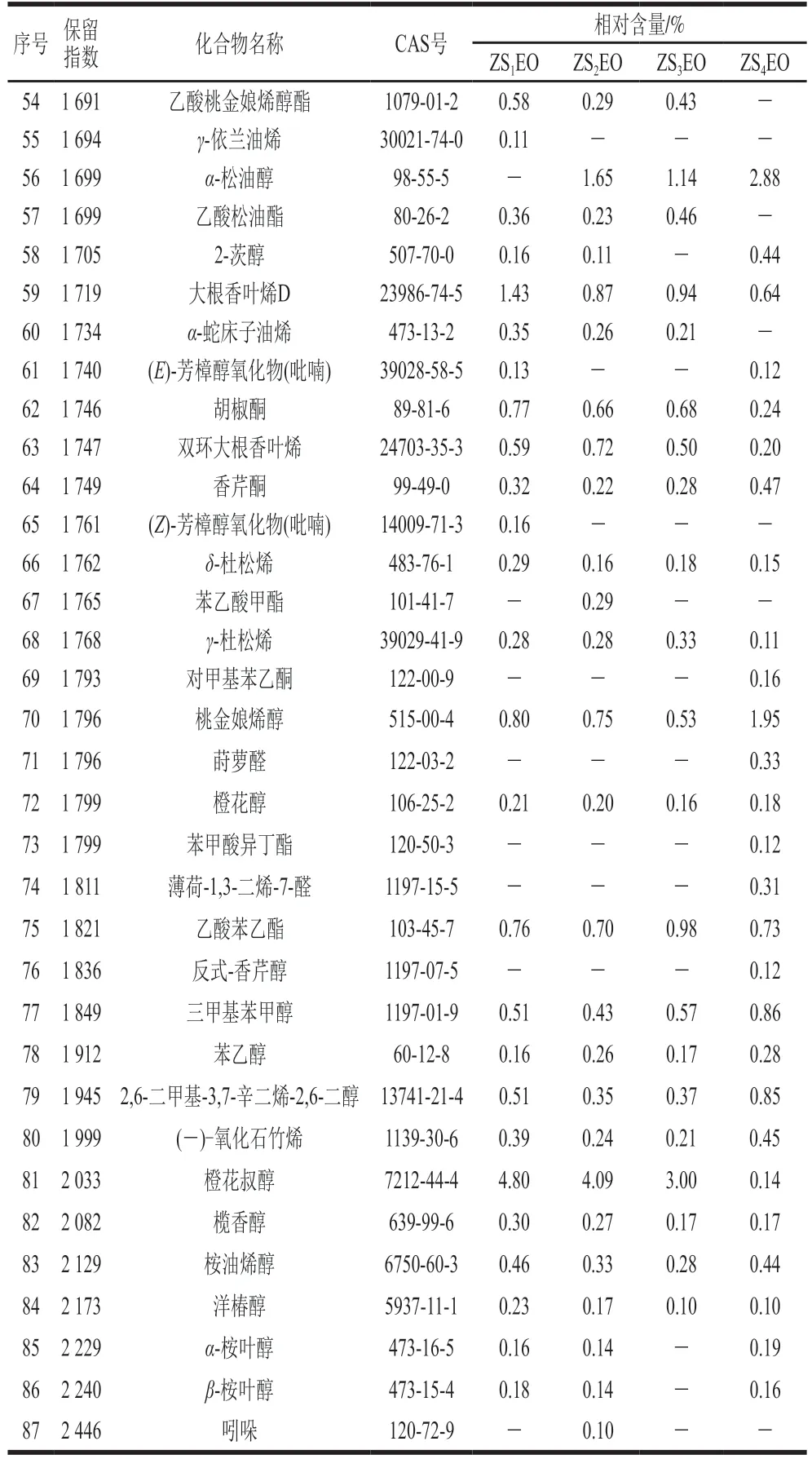
续表1
青花椒的精油提取率和化学组分间的差异可能与青花椒的品种、产地、提取与检测方法等因素有关[19]。Li Ren等[4]采用同时蒸馏萃取法从西双版纳青花椒果皮中提取精油,精油得率为4.8%,经气相色谱-质谱联用鉴定出25 种化合物(98.29%),主要成分为芳樟醇(79.00%)、柠檬烯(4.97%)和β-侧柏烯(4.29%)。此外,麻琳等[20]采用水蒸气蒸馏法从江津青花椒果皮中提取精油,精油得率为2.4%,经气相色谱-质谱联用鉴定出34 种化合物(99.55%),其中R-枞松油烯(36.51%)和芳樟醇(21.60%)含量丰富。本研究中4 个产地的ZSEOs中均含有芳樟醇(18.86%~22.00%)和柠檬烯(9.56%~14.84%),但未检出β-侧柏烯和R-枞松油烯。
芳樟醇(C10H18O)是一种广泛存在于植物精油中的单萜烯醇,对P.aeruginosa、S. aureus等多种微生物具有抑菌活性[21]。Liu Ying等[11]研究表明S. sobrinus对柠檬烯较为敏感。化合物分子的电荷密度与其抑菌活性密切相关[22]。芳樟醇中负电荷主要集中在氧原子和碳原子上,且羟基官能团上氧原子的电荷密度(密里根常数为-0.520 8)大于其他原子,因此更容易发生亲电反应,成为活性中心与菌体结合,进而发挥抑菌作用。柠檬烯(C10H16)分子结构中有2 个C=C,双键相邻甲基上的碳原子密里根常数分别为-0.420 4和-0.352 1,电荷密度较大,具有成为菌体结合位点的可能性。此外,亦有体外研究表明β-石竹烯(0.26%~0.90%)可有效抑制S. mutans的生长[23]。值得一提的是,4 个产地青花椒精油中鉴定得到的其他组分,如α-蒎烯[24](1.65%~2.59%)、(Z)-芳樟醇氧化物(呋喃)[25](0.40%~1.13%)、(-)-氧化石竹烯[26](0.21%~0.45%)等也被报道过具有良好的抑菌效果,表明本研究中含以上活性成分的ZSEOs也可能具有良好的抑菌活性。
2.3 ZSEOs的抑菌活性
2.3.1 抑菌圈直径
由表2和图2可知,受试ZSEOs对S. mutans、S. sanguinis和S. sobrinus的抑菌圈直径范围分别为13.41~17.73、15.18~20.95 mm和11.61~15.97 mm。S. sanguinis对ZSEOs的耐受力较弱,而S. sobrinus对ZSEOs的耐受力较强。值得注意的是,ZS1EO处理组的抑菌圈直径均为最大值。ZS1EO对S. mutans的抑菌圈直径((17.73±0.22)mm)大于其对S. sobrinus的抑菌圈直径((15.97±0.70)mm),但差异无统计学意义(P>0.05)。ZS1EO对S. sanguinis的抑菌圈直径最大,为(20.95±0.40)mm,显著大于其他精油处理组和阳性对照组(P<0.05)。本研究中,95%乙醇溶液处理对3 种致龋菌几乎均无抑制作用,相应抑菌圈直径与各ZSEOs处理组相比具有显著差异(P<0.05)。抑菌圈测定结果初步表明,ZSEOs对3 种致龋菌均有一定的体外抑制效果,其中ZS1EO的抑菌活性最为突出。
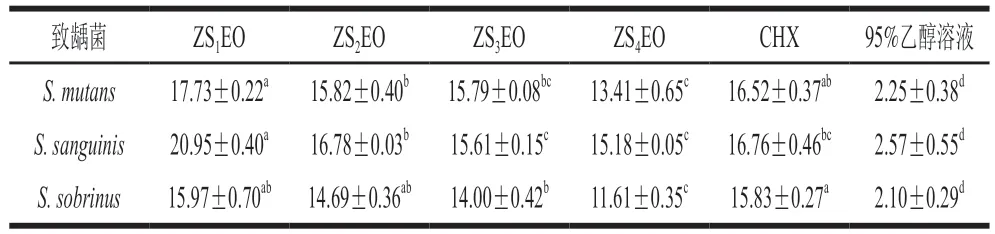
表2 青花椒精油对3 种致龋菌的抑菌圈直径Table 2 Diameters of inhibition zones of ZSEOs against three cariogenic bacteria mm

图2 青花椒精油对3 种致龋菌的抑菌圈Fig. 2 Inhibition zones of ZSEOs against three cariogenic bacteria
2.3.2 4 种ZSEOs的MIC和MBC
如表3所示,4 种ZSEOs对S. mutans、S. sanguinis和S. sobrinus的MIC范围分别为1~2、0.5~2 mg/mL和1~4 mg/mL,MBC的范围分别为1~4、1~4 mg/mL和2~8 mg/mL。ZSEOs对3 种链球菌有不同程度的抑制作用,其中ZS1EO的抑菌效果最优,此结果与抑菌圈实验结果基本一致。ZS1EO对S. sanguinis的MIC(0.5 mg/mL)最小,对S. mutans和S. sobrinus的MIC均为1 mg/mL。此外,S. sobrinus对ZSEOs的耐受力相对较强,ZS1EO对S. sobrinus的MBC为2 mg/mL。抑菌圈实验结果、MIC和MBC实验结果表明,4 种精油中ZS1EO对3 种致龋菌的抑菌活性最为突出。
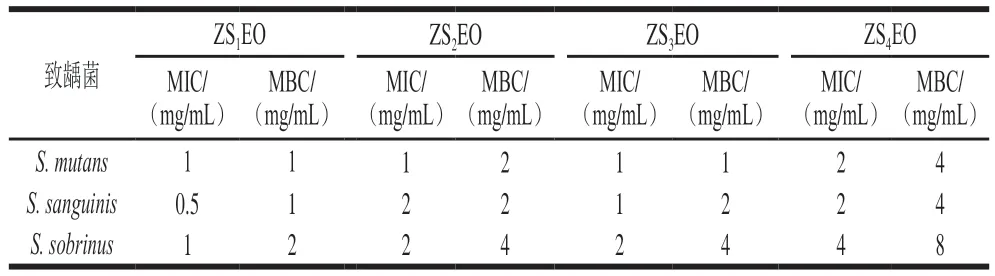
表3 ZSEOs对3 种致龋菌的MIC和MBCTable 3 MIC and MBC of ZSEOs against three cariogenic bacteria
植物精油对致龋菌的抑菌活性可分为3 个程度:强(MIC<0.1%(体积分数,下同))、中等(MIC≤1.0%)和弱(MIC>1.0%)[27]。基于此标准,在本研究中,ZS1EO(密度为0.83 g/mL)对S. sanguinis(MIC=0.5 mg/mL)具有较强的抑制作用,对S. mutans(MIC=1 mg/mL)和S. sobrinus(MIC=1 mg/mL)具有中等的抑菌活性。Lemes等[28]评估了来檬(Citrus aurantifolia)果皮精油对6 种致龋菌的抑制作用,结果显示来檬果皮精油对S. sanguinis和S. sobrinus的MIC分别为100 μg/mL和200 μg/mL,抑菌活性中等;对S. mutans的MIC为20 μg/mL,抑菌活性最强。不同精油对同种链球菌MIC与MBC的不同基本归因于精油化学组成间的差异。同种精油对不同链球菌抑菌活性的差异可能和细菌应激后的反应调节机制以及精油发挥抑菌作用的机制差异有关。综上,由于ZS1EO的抑菌活性最为明显,因此选择ZS1EO进行后续实验。
2.3.3 致龋菌的生长曲线
ZS1EO对S. mutans、S. sanguinis和S. sobrinus生长曲线的影响如图3所示。致龋菌生长经历了3 个明显的阶段,即延迟期、对数生长期和稳定期。S. mutans和S. sanguinis的对数生长期在4 h出现,持续8 h后进入稳定期。S. sobrinus的对数生长期在2 h出现,8 h后进入稳定期。在延迟期将MIC ZS1EO与细菌共同孵育,随着时间的延长,3 种致龋菌的OD值均与各自初始OD值持平,表明菌体停止增殖。于对数生长期初始阶段加入MIC ZS1EO,3 种链球菌的OD值均呈下降趋势。随着ZS1EO作用时间的延长,S. mutans和S. sanguinis的生长几乎完全被抑制。
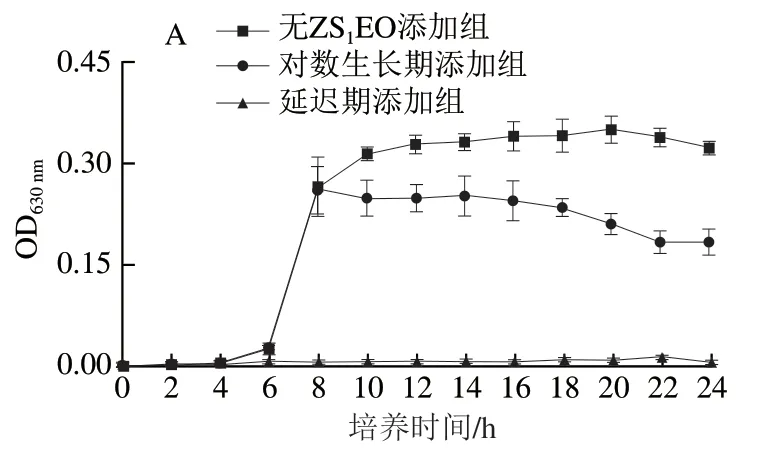
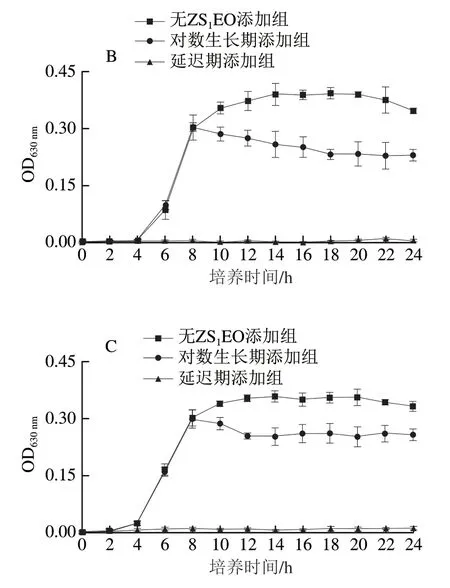
图3 MIC ZS1EO对3 种致龋菌生长曲线的影响Fig. 3 Effect of MIC ZS1EO on the growth curves of three cariogenic bacteria
生长曲线可以部分反映细菌在一定环境下的生长和增殖情况[21]。本实验结果表明,在细菌生长的延迟期和对数生长期初始阶段添加MIC ZS1EO均可导致3 种致龋菌停止增殖,ZS1EO对3 种致龋菌的抑菌活性较强。此结果与Lei Hong等[3]报道的花椒精油对E. coli生长的抑制效果类似,在延迟期和对数生长期加入0.5×MIC(12 mg/mL)精油,E. coli的生长均会受到影响。
2.3.4 致龋菌微观结构观察结果
通过SEM观察3 株致龋菌经MIC ZS1EO处理24 h后的形态变化,初步探讨ZS1EO的抑菌机制,结果如图4所示。与阴性对照组相比,处理后的细菌菌体发生了明显的形态学改变。阴性对照组链球菌细胞膜表面整齐、光滑、致密,链状结构完整。然而,经ZS1EO处理后的3 种致龋菌断链现象明显;菌体细胞呈现出明显的细胞膜形状异常,细胞膜出现凹陷、破裂和皱缩;菌体相互黏附。此结果与阳性对照组的结果相似。值得注意的是,与其他菌株相比,S. sanguinis菌株对ZS1EO的耐受力最弱,菌体破坏程度更明显,与抑菌圈实验和MIC、MBC实验结果相吻合。以上结果表明,ZS1EO对3 株致龋菌抑制作用由强到弱依次为S. sanguinis、S. mutans、S. sobrinus。
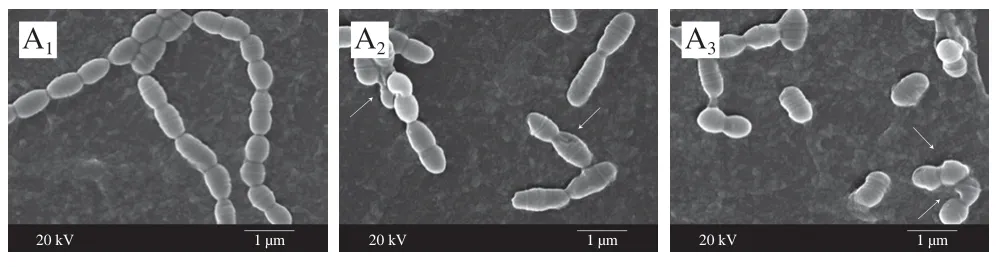
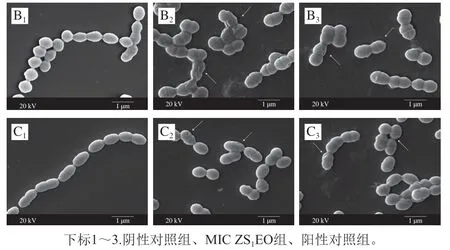
图4 3 种致龋菌的SEM图像(×20 000)Fig. 4 SEM micrographs of three cariogenic bacteria (× 20 000)
植物精油的亲脂性使精油能够穿过细菌的细胞膜和线粒体膜,破坏细菌的膜结构,使膜通透性增强,细菌细胞内容物外泄,从而导致菌体形态的改变[29]。陈梦玲等[30]研究发现经2×MIC(0.5%)牛至精油处理后,腐生葡萄球菌(Staphylococcus saprophyticus)表面破裂、外膜剥落,最终导致菌体死亡。SEM观察结果表明,ZS1EO可以通过破坏3 种致龋菌的链状结构与细胞膜完整性,使菌体产生不可逆损伤,从而发挥其抑菌作用。
3 结 论
本实验利用GC×GC-TOFMS技术分析了4 个产地ZSEOs的化学组成,并评估了ZSEOs对3 种常见致龋菌的体外抑菌活性。研究结果表明,受试ZSEOs的主要成分为芳樟醇(18.86%~22.00%)、柠檬烯(9.56%~14.84%)、β-月桂烯(5.79%~12.70%)、桧烯(5.49%~8.93%)和β-蒎烯(3.33%~6.41%)。4 个产地的ZSEOs对S. mutans、S. sanguinis和S. sobrinus生长均有不同程度的抑制效果,其中ZS1EO的抑菌活性最强。ZS1EO对3 种致龋菌的抑菌活性强度:S. sanguinis>S. mutans>S. sobrinus。此外,精油处理后3 种致龋菌链状结构的破坏以及细胞膜凹陷、破损所致菌体的不可逆损伤可以初步解释ZS1EO发挥其抑菌活性的机制。鉴于此,作为我国传统香辛料使用的青花椒可能是一种潜在的龋病抗菌剂的来源。本研究仅评价了ZSEOs对3 种致龋菌的体外抑菌活性,ZSEOs的抑菌成分及其抑菌机制有待进一步研究。
