肌减少症对实体瘤患者免疫检查点抑制剂治疗影响的meta分析
2022-11-28殷旭东
叶 倩,凌 志,殷旭东
(1.扬州市疾病预防控制中心,江苏 扬州 225001; 2.扬州大学附属医院肿瘤科,江苏 扬州 225100;3.扬州大学医学院,江苏 扬州 225100)
免疫治疗在肿瘤治疗的地位日益增高。以程序性细胞死亡蛋白-1(programmed cell death-1, PD-1)、程序性细胞死亡配体-1(programmed-death ligand 1, PD-L1)和细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte antigen 4, CTLA-4)为靶点的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs),包括纳武利尤单抗、阿特珠单抗、伊匹单抗等,已经彻底改变了晚期癌症患者的治疗方案[1]。尽管ICIs相比于化疗明显延长患者生存事件且安全性高,但在实际临床上获益的人群是有限的[2]。 因此,确定可靠的预测因素才能使肿瘤患者真正从ICIs治疗中获益,目前已证实的预测性生物标志物有PD-L1表达和肿瘤突变负荷[3]。 近几年,研究人员通过分析患者身体成分的变化预测免疫治疗的疗效和预后。肌减少症是以骨骼肌质量、肌力逐渐丧失为特点,并导致患者肢体功能不全、生活质量下降甚至死亡的一类复杂综合征[4]。肌减少症在癌症患者中的发病率约为38.6%,也与癌症患者的生存结果有关。目前常用的评估肌质量方法,包括计算机断层扫描(computed tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)、双能X射线吸收仪(dual energy X-ray absorptiometry,DEXA)扫描和生物电阻抗分析(bioelectrical impedance analysis,BIA)[5]。双能 X 线扫描和生物电阻抗分析并非临床常规检测项目,无法开展回顾性研究。因此,临床开始利用CT或MRI进行身体成分分析,其中,通过测量单一层面的骨骼肌总面积和(或)密度诊断肌减少症是目前常用的方法。关于肌减少症与肿瘤患者治疗效果和预后的关系是有争议的。有研究报道,对于接受ICIs治疗的晚期癌症患者而言,肌细胞减少是患者生存质量较差的显著的预测因子;然而小部分研究报道肌减少症可能对这些患者的生存没有影响。因此,本荟萃分析对相关的研究进行收集和整理,阐明肌减少症预测接受ICIs治疗的肿瘤患者近期疗效和预后的价值。
1 资料与方法
1.1检索策略 将nivolumab,pembrolizumab,avelumab,atezolizumab, lambrolizumab,durvalumab,ipilimumab,toripalimab,dumilumab,immune checkpoint inhibitor,PD-1 inhibitor,PD-L1 inhibitors,CTLA-4、 cancer,tumor,neoplasm,carcinoma,sarcopenia,muscle atrophy、muscle wasting,muscle attenuation,muscle depletion,muscle loss,muscle weak,muscle reduction,muscle strength,muscle mass,muscular atrophy,muscular wasting,muscular attenuation,muscular depletion,muscular loss,muscular weak,muscular strength,muscular mass作为关键词,使用PubMed、Web of Science和Cochrane Library数据库检索截至2021年6月发表的文献,对全文进行评价,分析是否含有肌减少症与肿瘤患者ICIs之间关系的相关研究。
1.2纳入标准与排除标准 纳入标准:①成年参与者(年龄≥18岁)已确诊为晚期癌症并经过肌成分评估; ②均接受ICIs治疗(PD-1/PD-L1/CTLA-4);③研究目的为肌减少症与免疫治疗效果、预后、相关不良反应之间的关系;④文章提供足够的信息计算风险比(hazard ratio,HR)值、危险比(risk ratio,RR)值及其95%置信区间(confidence interval,CI)。排除标准:①社论、病例报告、评论、信件、荟萃分析和文献综述;②重复的出版物或数据;③无法获得数据或全文的文献。
1.3文献筛选、数据整理和质量评价 由2位研究人员依据纳入和排除标准进行文献筛选、数据整理和质量评价,出现分歧时通过讨论达到一致。提取的信息:①第一作者姓名、发表国家和年份;②样本量、种类类型和ICIs药物种类;③诊断肌减少症方法、指标以及相应分界值;④总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)的HR及客观反应率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)和免疫相关不良反应(immune-related adverse events,irAEs)的RR。对于既有单因素分析和多因素分析的文献,优先提取多因素分析的RR。2名研究采用纽卡斯尔-渥太华质量评估量表(Newcastle-Ottawa Scale,NOS)对纳入文献进行质量评价,按照高质量(7~9分)、中等质量(4~6分)和低质量(≤3分)分类[6]。
1.4统计学方法 所有的数据分析采用RevMan 15.0软件和Stata SE 14.0软件进行。OS和PFS采用RR及95%CI作为效应分析统计量。ORR、DCR、irAEs采用RR及95%CI作为效应分析统计量。使用CochraneQ检验和I2统计法评估所纳入文献的异质性,I2>50%和(或)Q检验的P值<0.05为差异有统计学意义。如果异质性明显,则采用随机效应模型进行合并;否则,采用固定效应模型。通过进行亚组分析,进一步评估论证meta结果。利用漏斗图分析发表偏倚。进行敏感度分析评估排除每项研究后结果的稳定性。所有统计学检验均为双侧,P<0.05为差异有统计学意义。
2 结 果
2.1文献检索结果 依据制定的检索策略共检索到447篇文献,通过查阅标题和摘要排除411篇文献。36篇文献依据纳入和排除标准阅读全文进一步评估。最后,27篇文献,总计2 601例肿瘤患者纳入meta分析。流程图如图1所示。
2.2纳入文献特征 纳入文献包括26篇为回顾性研究和1篇为前瞻性研究。文献中研究对象分别来自亚洲和欧美人群。这些患者的癌症类型主要是非小细胞肺癌(non-small cell lung cancer,NSCLC)、黑色素瘤、胃癌(gastric cancer,GC)和肝癌(hepatoma carcinoma cell,HCC)。14篇[7-20]文献得分为7~8分(高质量)。12篇[21-32]文献得分为6分(中等质量)。1篇[33]文献得分为4分(低质量)。见表1。
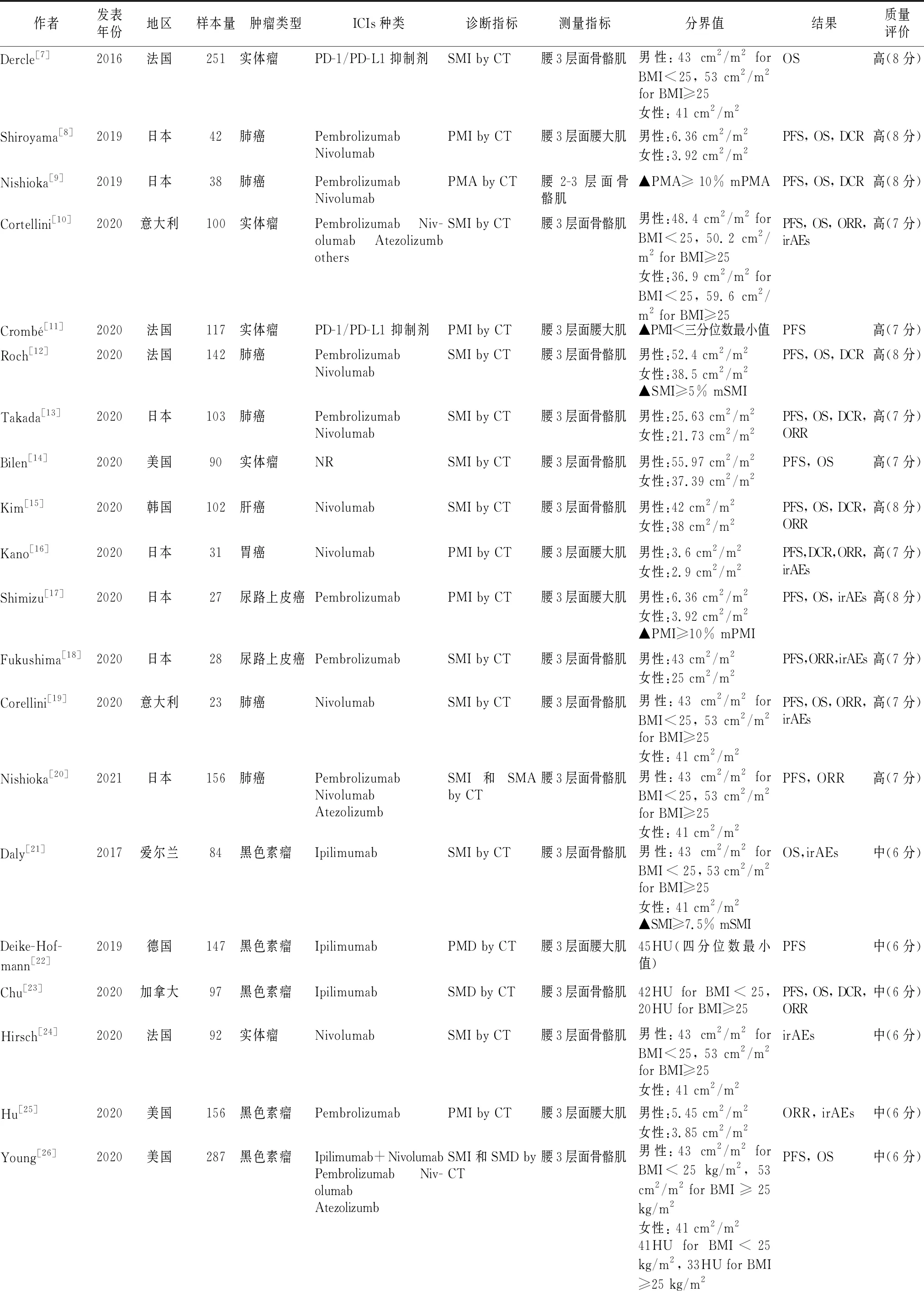
表1 纳入文献的一般特征

图1 文献筛选流程
2.3总生存期的meta分析 20篇文献报告了治疗前肌减少症与肿瘤患者OR之间的关系。异质性检验分析显示I2=57%,P<0.01,故采用随机效应模型。Meta分析显示,在接受ICIs治疗的患者中,合并治疗前肌减少症导致OS缩短的风险增加(HR=1.60, 95%CI:1.30~1.97,见图2a)。根据肿瘤类型、ICIs类型、诊断指标和地区进行亚组分析,结果与总体结果相似(表2)。此外,进一步对5篇文献关于治疗后肌减少与OS关系进行分析,结果显示,在免疫治疗过程中肌的减少也会增加OS缩短的风险(HR=2.38,95%CI:0.99~5.76,见图2b)。

表2 OS的亚组分析

图2 实体瘤患者肌减少症与总生存期关系 a.免疫治疗前肌减少症与总生存期关系;b.治疗期间的肌肉减少与总生存期关系
2.4无进展生存期的meta分析 17篇文献报告了治疗前肌减少症与肿瘤患者PFS之间的关系。异质性检验结果分析显示I2=58%,P=0.0001,故采用随机效应模型。Meta分析显示,在接受ICIs治疗的患者中治疗前合并肌减少症导致PFS缩短的风险增加(HR=1.40,95%CI:1.18~1.67,见图3a),同时也依据肿瘤类型、ICIs类型、诊断指标和地区进行亚组分析,结果与总体结果相似(表3)。3篇文献关于治疗后肌减少与PFS关系进行分析的结果表示,在接受ICIs免疫治疗的肿瘤症患者中,在免疫治疗过程中肌减少也会增加PFS缩短的风险(HR=2.81,95%CI:1.88~4.22,见图3b)。
2.5疾病控制率的meta分析 8篇文献报告治疗前肌减少症与疾病控制率之间的关系。与非肌减少症组患者相比,肌减少症降低接受免疫治疗患者的疾病控制率(RR=0.71,95%CI:0.59~0.85,见图4)。异质性检验结果显示文献间的异质性低,故采用固定效应模型。3篇文献报告了免疫治疗期间肌减少对DCR的影响。在免疫治疗期间,肌减少也会降低患者的疾病控制率(RR=0.55,95%CI:0.39~0.78)。

表3 PFS的亚组分析
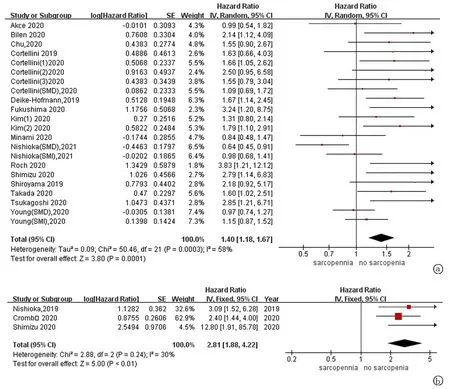
图3 实体瘤患者肌减少症与无进展生存期关系 a.免疫治疗前肌减少症与无进展生存期关系;b.治疗期间的肌减少与无进展生存期关系

图4 实体瘤患者放疗前肌减少症和疾病控制率关系
2.6客观反应率的meta分析 13篇文献报告了肌减少症与客观反应率之间的关系。结果显示,与非肌减少症组患者相比,肌减少症降低接受免疫治疗患者的客观反应率较低(RR=0.72,95%CI:0.59~0.88,见图5),但各文献之间无明显的异质性(I2=21%,P=0.24)。此外,2篇[9, 17]文献报告了免疫治疗期间肌肉减少对ORR的影响。在免疫治疗期间,肌减少也会降低患者的客观反应率(RR=0.11,95%CI:0.02~0.54)。
2.7肌减少症和免疫相关不良反应 8篇文献报告了肌减少症与免疫相关不良反应关系,所有患者均在结束免疫治疗前诊断为肌减少症。其中4篇文献描述了接受ICI治疗的癌症患者中,治疗前肌减少症和任何级别的免疫相关不良反应之间的关系。各项研究之间无明显异质性(I2=0%,P=0.89),因此采用了固定效应模型。合并肌减少症不会增加患者发生免疫相关不良反应风险(RR=0.65;95%CI:0.45~0.94,见图6a)。然而,进一步亚组分析显示,治疗前合并肌减少症不会增加患者发生轻度不良反应的风险(RR=0.92;95%CI:0.50~1.70,见图6b),但可能会增加发生严重(≥3级)不良反应的风险(RR=1.27;95%CI:0.74~2.19,见图6c)。

图5 实体瘤患者放疗前肌减少症和客观反应率关系

图6 实体瘤患者放疗前肌减少症和免疫相关不良反应关系 a.肌减少症和任何级别免疫相关不良反应关系;b.肌减少症和<3级免疫相关不良反应关系;c.肌减少症和≥3级免疫相关不良反应关系
2.7发表偏倚和敏感性分析 关于肌减少症与OS和PFS关系研究的漏斗图左右不对称,进一步采用剪补法验证分析合并效应结果与原先效应结果无明显变化(OS:HR=3.295,95%CI:2.574~4.217;PFS:HR=2.847,95%CI:2.368~3.424),提示各项研究之间不存在发表偏倚,结果稳定。通过逐篇剔除纳入文献的方式进行敏感性分析,逐以剔除文献后剩下研究所合并的HR均在meta分析中合并的HR的95%CI之内,表示针对OS和PFS的meta分析结果稳定、可靠,见图7~8。

图7 漏斗图 a.OS的漏斗图;b.剪补法验证后的OS漏斗图;c.PFS的漏斗图;d.剪补法验证后的PFS漏斗图
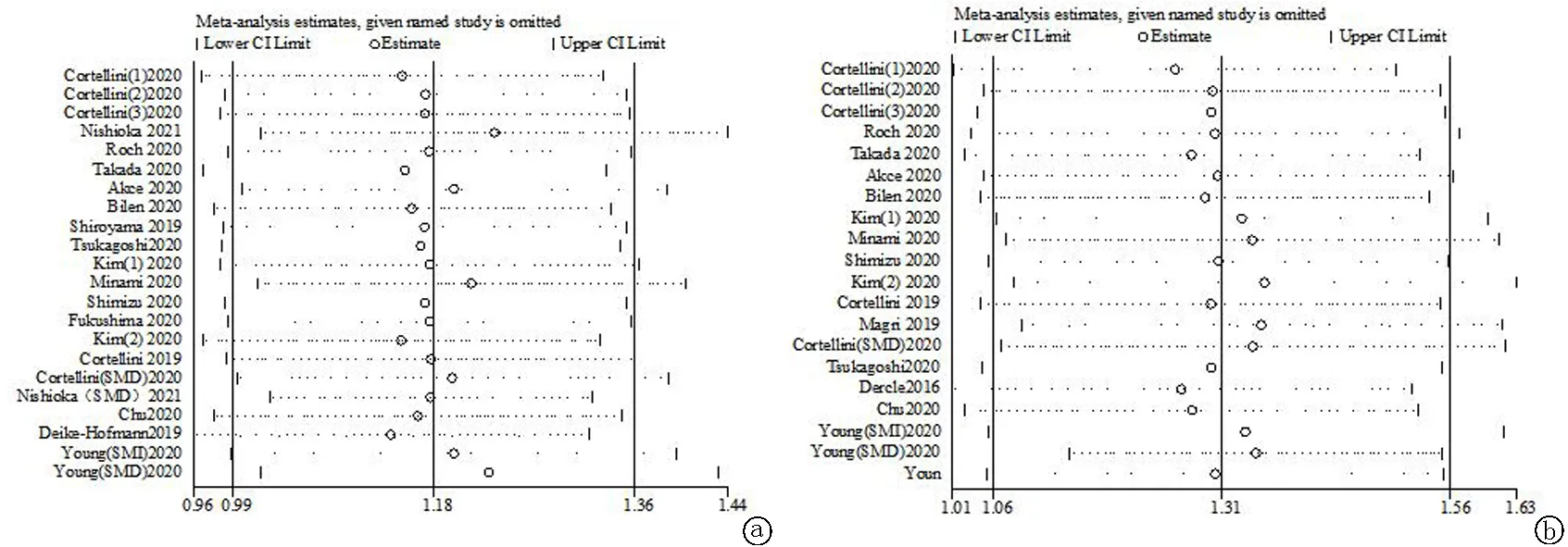
图8 敏感性分析 a.OS;b.PFS
3 讨 论
本研究结果显示治疗前肌减少症与接受免疫检查点抑制剂治疗实体瘤患者OS和PFS的缩短相关,在免疫治疗期间,肌减少症的发展或恶化也可预测较差的OS和PFS;与Wang等[34]和Deng等[35]的研究结果类似。肿瘤的发生发展与机体免疫功能密切相关,免疫功能下降是导致疾病进展和复发关键因素。骨骼肌组织是分泌白细胞介素(interleukin,IL)-15的主要部位,IL-15通过上调抗凋亡因子bcl-2确保自然杀伤(natural killer,NK)细胞的正常发育和存活[36-37]。因此,当患者发生肌细胞减少时,NK细胞计数减少,从而削弱患者抗肿瘤免疫反应,导致预后不良。
Tsukamoto等[38]研究结果显示,黑色素瘤患者使用PD-1阻断剂后血清中IL-6的水平增加,引起肌分解,导致患者预后不良。患者在治疗期间的肌减少症的发生可能与全身炎症反应相关,已有研究表示炎症反应是肿瘤患者预后不良的危险因素。如中性粒细胞与淋巴细胞比值被证明是ICIs治疗的负面预后的预测标志[39]。然而,要全面剖析肌减少症在ICIs治疗中的潜在功能作用,还需进一步分子研究。OS的亚组分析显示,骨骼肌指数(skeletal muscle index,SMI)、腰肌指数(psoas muscle index,PMI)、骨骼肌密度(skeletal muscle density, SMD)和腰肌密度(psoas muscle density, PMD)诊断肌减少症对免疫治疗的肿瘤患者OR的影响均有预测价值。PFS的亚组分析显示,SMI、PMI和PMD诊断肌减少症对免疫治疗的肿瘤患者PFS均具有预测价值[40-41]。Rutten等[42]研究卵巢癌患者的结果显示,单一层面的腰大肌面积不能用全身骨骼肌面积评估肌减少症。腰大肌仅占在L3层面肌面积的10%,通过手动勾画骨骼肌面积的方法导致的误差更大。尽管有专家认为肌减少症的诊断应同时包括肌含量减少和肌功能减退,但大部分回顾性研究仅根据肌含量减少或密度降低诊断肌减少症,仅有小部分研究进行肌含量和肌功能评估,期待更多前瞻性的研究验证结论。
随着ICIs广泛使用各种免疫相关的不良反应发生率也是临床医师所关心的重点问题[43]。已有研究表示肌减少症会增加患者化疗和放疗的毒性反应的发生率[35],但关于肌减少症与免疫相关不良反应的研究较少。本研究结果显示,在免疫治疗过程中,肌减少症与轻度不良反应的发生无关,但是会增加严重不良反应的发生率。药物毒性反应的发生与药物代谢动力学相关,而身体成分发生改变时会影响药物吸收、分布、代谢或清除。肌减少症没有纠正后会导致药物蓄积从而引起严重的毒性反应。Hirsch等[24]在对接受nivolumab治疗的肺癌患者研究显示,合并肌减少症患者发生严重免疫相关不良事件的风险显著增加(OR=3.84,95%CI:1.02~14.46)。尽管有研究表示轻中度的不良反应预示着较好的疗效,但是肌减少症可能会降低患者对治疗的敏感性,且并不能使患者从免疫治疗中获益。
本研究仍存在一些局限性:①本荟萃分析纳入的文献大部分为回顾性研究,故可能存在较大偏倚;②由于无法获得纳入研究的原始数据,也无法以体重指数、PD-L1表达水平、性别、年龄等预后相关因素进行分层分析;③纳入研究确有发表偏倚存在,可能的原因有:相较于阴性结果的研究,阳性结果的研究更易发表;由于仅纳入了英文文献,其他语言的研究未纳入其中,这也会导致一定程度的偏倚;④各研究关于肌减少症诊断指标的分界值不同,可能会增加研究结果的异质性。临床上,从免疫治疗真正获益的肿瘤患者数量有限。同时,除了昂贵的免疫治疗费用之外,处理免疫治疗引起相关不良事件也进一步增加了患者的经济负担。有效的预测指标可以帮助在治疗前或治疗中的早期阶段识别免疫治疗的获益者,但目前临床上缺乏有效的预测指标。本研究证明肌减少对ICIs治疗患者的疗效和预后的预测价值。然而,仅仅以肌减少症作为预测指标评估临床结果是有限的,需要联合其他预测因素进行综合评价。
