8例结直肠混合性腺神经内分泌癌临床病理分析
2022-11-28张一鸣李明昭
张一鸣,李明昭,顾 欣
(1. 天津市中西医结合医院(南开医院) 病理科,天津 300100;2. 天津市人民医院 病理科,天津 300121;3. 天津医科大学 生物医学工程与技术学院,天津 300070)
神经内分泌肿瘤是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤。2019年版世界卫生组织(World Health Organization,WHO)消化系统肿瘤分类及2020年中国神经内分泌肿瘤病理诊断共识(以下简称中国共识2020版)将神经内分泌肿瘤分为3类:神经内分泌瘤(neuroendocrine tumor,NET),神经内分泌癌(neuroendocrine carcinoma,NEC)和混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasms,MiNEN)[1-2]。混合性腺神经内分泌癌(mixed adeno-neuroendocrine carcinoma,MANEC)属于MiNEN,是一种高度恶性的肿瘤,腺癌和NEC成分各不少于30%[3]。随着对MiNEN和MANEC病理认识的提高,MANEC的诊断率有所提高,但结直肠MANEC相对罕见,临床病理特征难以确定,早期诊断较困难,且既往报道病例数较少。本研究通过回顾性分析天津市中西医结合医院(南开医院)经手术切除的结直肠MANEC的8例患者的临床资料,旨在提高对结直肠MANEC临床病理特征的认知。
1 资料与方法
1.1病例资料 收集天津市中西医结合医院(南开医院)2016年8月-2020年12月经手术切除的结直肠MANEC患者8例,收集其临床资料(一般资料、实验室检查、影像学检查、术前组织活检结果及手术病理资料等),并根据中国共识2020版定义重新分类。
1.2病理组织处理 对患者切除组织进行病理检查,标本经4%中性甲醛固定,常规脱水,石蜡包埋,4 μm厚切片,HE染色,光镜观察。免疫组织化学采用两步法。所用一抗细胞角蛋白8/18(cytokeratin8/18,CK8/18)、细胞角蛋白19(cytokeratin19,CK19)、癌胚抗原(carcinoembryonic antigen,CEA)、嗜铬素(chromogranin A,CgA)、突触素(synaptophysin,Syn)、白细胞分化抗原56(cluster of differentiation 56,CD56)、Ki-67及二抗均购自中杉金桥公司,二氨基联苯胺(diaminobenzidine,DAB)购自罗氏诊断公司。
1.3随访 通过电话获得随访信息,随访时间截至2021年1月。
2 结 果
2.1一般资料 女性3例,男性5例,平均年龄63岁。患者就诊时临床表现多为腹痛(6例)和血便(3例),其他临床表现包括排便习惯和排气改变(1例)、腹泻(2例),但均无特异的神经内分泌症状,见表1。
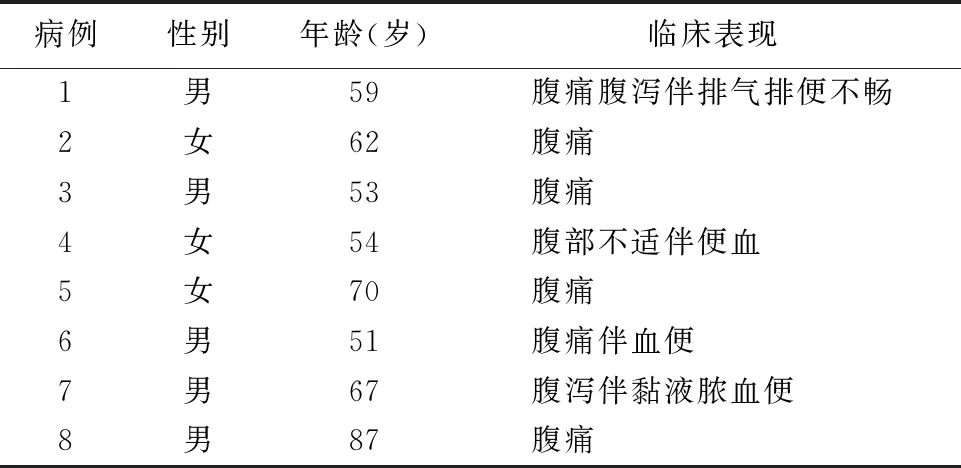
表1 纳入患者的一般资料
2.2实验室检查资料 肿瘤标记物检测示部分病例铁蛋白(2例)和癌胚抗原(2例)升高,所有病例甲胎蛋白和糖蛋白199均未见明显升高。
2.3影像学资料(全腹CT) 主要表现为肠占位(6例),可同时伴有淋巴结转移(2例)及肝结节(2例),也可表现为单独的肝占位(1例)和阑尾占位(1例)。
2.4术前组织活检病理资料 6例行术前肠镜活检,诊断为腺癌5例,腺癌或MANEC 1例。
2.5手术病理资料
2.5.1大体特征 肿瘤发生部位以结肠为主(6例),其中乙状结肠3例、升结肠2例、横结肠1例,直肠2例。溃疡型5例,隆起型3例,肿瘤最大径3~9 cm。见表2。

表2 纳入患者的手术病理资料
2.5.2光镜特征
2.5.2.1成分 所有肿瘤均由腺癌和NEC两种成分构成,且均不小于30%,见图1。
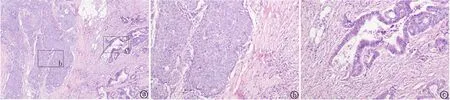
图1 肿瘤HE染色 a.肿瘤由腺癌和NEC两种成分组成,相互混杂,40×;b.NEC成分,肿瘤细胞呈实性片状分布,细胞较大,可见核仁,100×;c.腺癌成分,肿瘤细胞呈腺管状排列,细胞异型性明显,周围间质纤维化,100×
2.5.2.2腺癌分化程度 高-中分化4例,中分化1例,中-低分化3例,其中2例中-低分化伴有黏液腺癌,肿瘤细胞呈腺管状排列,细胞异型性明显,见图2。
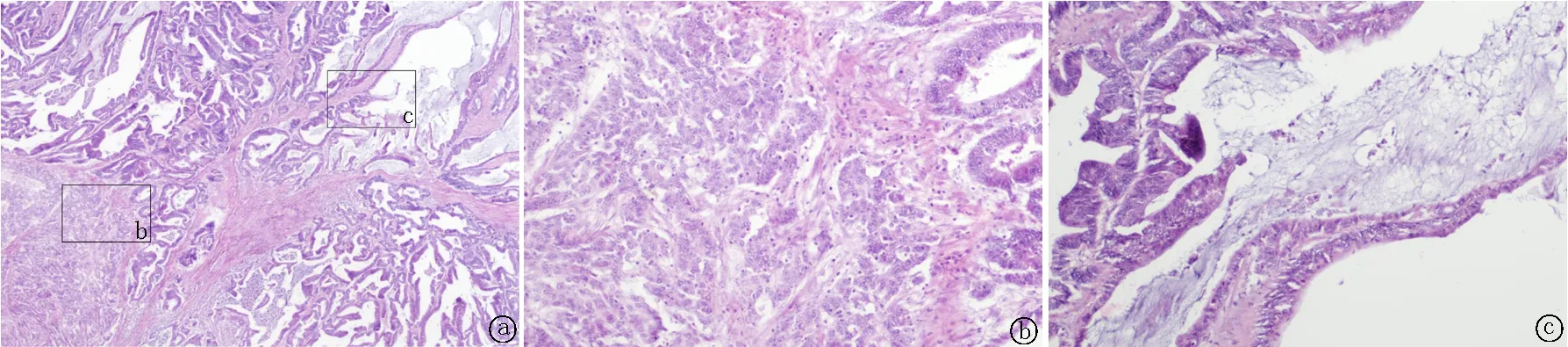
图2 黏液腺癌HE染色 a.肿瘤由腺癌和NEC两种成分组成,腺癌部分呈黏液腺癌,NEC可见坏死,20×;b.NEC成分,肿瘤细胞呈小巢状分布,细胞较大,100×;c 黏液腺癌成分(图2a中右侧方框),细胞外可见淡蓝色黏液,100×
2.5.2.3NEC类型 大细胞型7例,肿瘤细胞呈器官样、菊形团状排列或者弥漫分布,细胞较大,染色质粗颗粒状,核仁明显,胞浆丰富,易见核分裂象,常伴坏死;小细胞型1例,肿瘤细胞呈弥漫或者巢团样分布,细胞较小,圆形或卵圆形,染色质细颗粒状,核仁不明显,胞质稀少。
2.5.3病理诊断 (1)所有病例肿瘤均侵及肠壁全层,且均伴有脉管内癌栓或神经侵犯,切缘均阴性。(2)两种肿瘤成分均具有淋巴结转移能力,可见单一成分转移(腺癌1例,NEC 2例)或两种成分都发生转移(4例),且两种成分可同时转移到同一淋巴结(2例);其中,腺癌转移率62.5%,NEC转移率75%。(3)远处器官转移:病理证实NEC肝转移1例。
2.5.4免疫组织化学染色 腺癌成分CK8/18、CK19和CEA均不同程度阳性。NEC成分至少表达一种神经内分泌标记物,CgA阳性4例,阳性率达50%;Syn阳性8例,阳性率达100%;CD56阳性5例,阳性率达62.5%。Ki-67热点区阳性约40%~80%,大部分病例NEC阳性指数高于腺癌,见图3~8,表2。

图3 腺癌成分CK8/18免疫组织化学染色 a.NEC(细胞质+),腺癌(细胞质+),40×;b. NEC(细胞质+),100×;c. 腺癌(细胞质+),100×
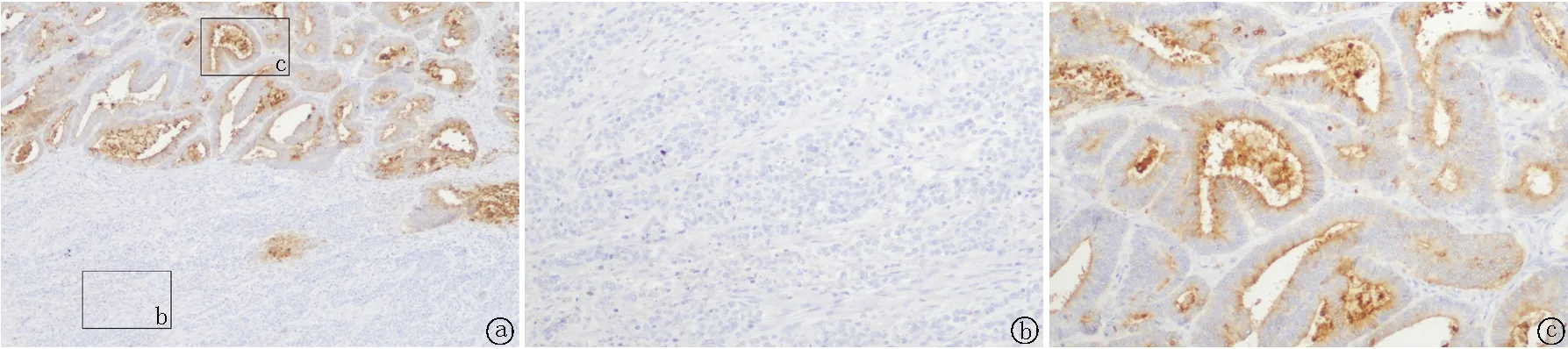
图4 腺癌成分CEA免疫组织化学染色 a.NEC(-),腺癌(细胞质+) 40×;b. NEC(-),100×;c. 腺癌(细胞质+),100×
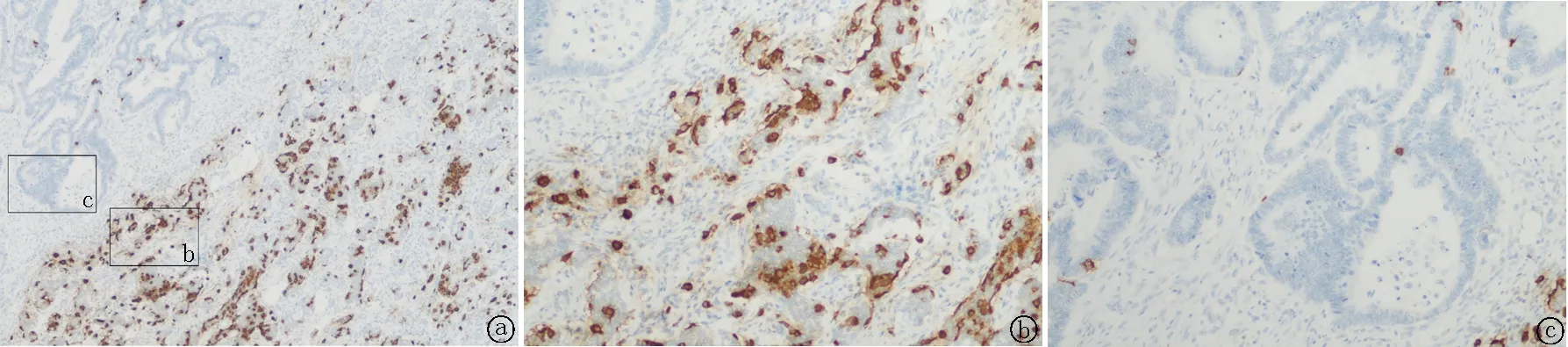
图5 NEC成分CgA免疫组织化学染色 a.NEC(细胞质+),腺癌(-),40×;b. NEC(细胞质+),100×;c. 腺癌(-),100×
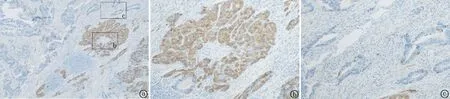
图6 NEC成分Syn免疫组织化学染色 a.NEC(细胞质+),腺癌(-),40×;b.NEC(细胞质+),100×;c. 腺癌(-),100×
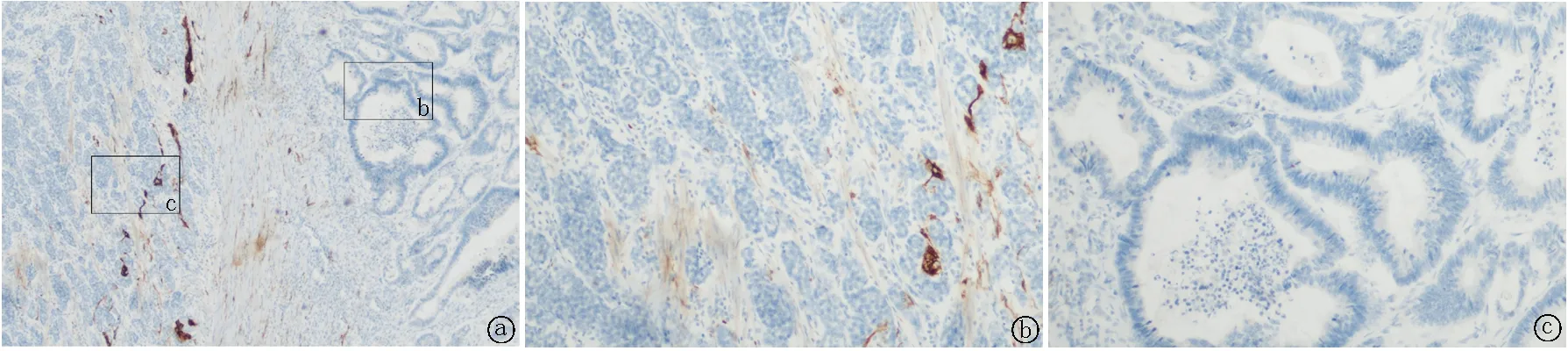
图7 NEC成分CD56免疫组织化学染色 a.NEC局灶(细胞膜+),腺癌(-),40×;b.NEC局灶(细胞膜+),100×;c. 腺癌(-),100×

图8 肿瘤Ki-67免疫组织化学染色 a.NEC和腺癌不同程度(+),20×;b. NEC阳性指数高,局灶约70%,100×;c. 腺癌阳性指数约40%,100×
2.6随访结果 死亡2例,平均生存8个月。随访7例,随访时间为3~26个月,5例存活,中位生存时间为17个月。
3 讨 论
近年来,全球胃肠胰神经内分泌肿瘤的发病率逐渐上升,1997-2012年期间增加了6倍以上,其中结直肠发病率增加了10倍[4]。结直肠神经内分泌肿瘤与腺癌并存比较罕见,原因可能是诊断的局限性及对疾病的认识不足[5]。而其病理诊断的命名也随着临床实践的积累和基础研究的发展而变化。但是对于神经内分泌肿瘤的成分为NET非NEC,非神经神经内分泌肿瘤的成分为鳞癌或者腺鳞癌的病例,采用MANCE命名似乎并不恰当。因此,2019年WHO将这一大类肿瘤更名为MiNEN,MiNEN是概念上的肿瘤类别,不是具体的诊断名称,需根据发生部位、成分和分级具体命名[2]。而MANEC属于MiNEN中的高度恶性肿瘤。
3.1起源 关于MANEC的起源有多种猜测,目前大部分研究者认为两种成分均来源于内胚层多能干细胞,在肿瘤的发生发展过程中,多能干细胞受到激素、微环境及基因稳定性的影响,产生了双向或多向分化[6]。中国共识2020版同时提出MiNEN仅适用于两种成分在克隆水平(基因水平)上有相关性的混合性肿瘤,即共同的单克隆来源,但是在实际工作中如何判断,有待进一步明确。已有研究报道,两种肿瘤成分共同的基因改变中以p53、KRAS、BRAF、APC等基因突变及微卫星不稳定性最常见[2, 7-8]。共同的遗传谱,提示MANEC可能对结直肠腺癌的化疗有反应[5]。
3.2病理诊断与鉴别诊断 MANEC中腺癌成分通常都比较典型,HE染色即可明确诊断;但NEC需结合HE染色及免疫组织化学辅助才可明确诊断,Syn、CgA和Ki-67是必要的免疫组织化学标记。值得注意的是,中国共识2020版提出重新分类的NET G3(原中国共识2013版中命名为高增殖活性NET)需与NEC鉴别,两者在分子机制、病理形态特征、治疗策略和预后转归等方面均存在差异[9-10]。大部分NET G3在病理形态上常伴有经典的NET G1/G2区域,可与NEC区分。而对于部分形态学鉴别困难,免疫组织化学染色可辅助诊断,NEC表现为肿瘤蛋白p53(tumor protein p53,TP53)和视网膜母细胞瘤肿瘤抑制蛋白(retinoblastoma protein,RB)异常表达、CXC趋化因子受体4(CXC motif chemokine receptor 4,CXCR4)阳性表达;NET G3表现为死亡结构域相关蛋白/伴α-珠蛋白生成障碍性贫血X连锁智力低下综合征蛋白表达缺失、生长抑素受体2A型(somatostatin receptor 2A,SSTR2A)高表达和簇集素的强表达[2]。Ki-67阳性指数对区别NET G3和NEC的作用有限,不建议使用Ki-67阳性指数作为区分的核心指标。诊断MiNEN还需排除腺瘤、碰撞瘤及新辅助治疗后等情况。同时在经典的腺癌中,免疫组织化学染色显示散在神经内分泌标记阳性细胞,不符合MANEC的诊断标准,也不建议使用“腺癌伴神经内分泌分化”的诊断名称,以免给临床医师带来概念上的混淆和治疗上的疑惑[3]。
3.3MANEC术前活检诊断困难 本文病例仅有1例(12.5%)术前活检提示MANEC,其余均由手术后病理确诊,与既往研究结果相似[11]。可能原因有:(1)活检组织取材局限,且受到肿瘤异质性影响,不能反映肿瘤全部形态;(2)HE染色和免疫组织化学染色证实存在两种成分,但难以对其所占比例做出准确的评估;(3)两种成分分化程度均较低,缺乏NEC典型的形态,因此易被诊断为腺癌。术前活检诊断依赖内镜医生充分取材和病理医生对HE染色的准确认识及免疫组织化学的辅助诊断。建议在手术切除整个肿瘤后,对标本进行全面评估。
3.4临床表现 本研究中男女比例接近,发病年龄较大,结肠病变临床表现多为腹痛,直肠病变表现为腹泻和便血,偶以肝转移病灶就诊,均不伴有神经内分泌症状,属于无功能性神经内分泌肿瘤。本研究结果与国内外临床观察结果相似,MANEC临床表现与传统腺癌类似,不具有特异性[12-14]。
3.5治疗 目前MANEC治疗尚不统一,且相对复杂。手术切除标本病理报告可帮助临床判读恶性程度更高的部分,分期参考结直肠腺癌。现有的治疗主要参照相应部位的腺癌行根治性手术及彻底的区域淋巴结清扫,对于已发生远处转移的患者,手术切除每个转移灶联合全身化疗可显著改善预后[15]。针对高级别NEC,推荐采用顺铂或卡铂联合依托泊苷方案进行一线治疗。如果存在高度微卫星不稳定性、错配修复缺陷、高肿瘤突变负荷及其他可检测到的基因突变,可考虑尝试程序性死亡蛋白1(programmed cell death protein 1,PD-1)等靶向免疫治疗,以提高生存率[16]。
3.6预后 有研究显示,MANEC患者的5年无病生存率和5年总生存率均显著低于腺癌患者[17],而MANEC和NEC没有差异[18-19]。且多数MANEC病例发现时已存在神经侵犯、血管癌栓、淋巴结侵犯和远处转移[20],更具侵袭性和预后不良的特点。区域淋巴结转移的主要病理成分目前仍无定论,有可能受到原发肿瘤内两种成分比例的影响[21],也有可能以NEC为主[13]。但NEC的肝脏转移更为常见,且当神经内分泌成分占比小于30%时仍可发生远处转移,表明神经内分泌成分侵袭性更强,生物学行为更差[11],很可能是MANEC高度恶性的主要原因之一。Ki-67指数高、NEC比例高、淋巴结侵犯、远处转移、临床分期高是影响预后的独立危险因素[13]。
本研究所有病例均存在脉管内癌栓,大部分存在淋巴结转移,与既往研究相符[11, 20]。本研究病例较少,未对原发肿瘤中两种肿瘤成分比例与转移的关系进行探究,需要扩大样本量、持续随访以进一步研究。
综上,结直肠MANEC发病率低,属于高度恶性肿瘤,易出现淋巴结转移,且预后较差,诊断主要依赖免疫组织化学辅助的病理检查,需准确识别两种肿瘤成分,结合临床给予恰当的治疗。
