LB-315锂离子电解液的热稳定性研究
2022-11-26江振宇鲁伊恒吴跃旭
江振宇,鲁伊恒,吴跃旭
(安徽理工大学化学工程学院,安徽 淮南 232001)
锂离子电解质在锂离子电池中起着决定性作用,其热稳定性对电池的寿命和火灾安全具有重要影响。对于锂离子电池短路、过充、高温热稳定性和安全性能等热点方面有大量的研究报道[1]。此外采用TG-DTG-DSC 热分析法研究六种单个电解质盐(LiClO4、LiCF3SO3、LiTFSI、TEABF4、LiBF4和LiPF6)固体状态热行为和分解动力学[2]、锂离子电池用LiPF6-碳酸盐[LiPF6/(EC+DMC),体积比为1∶1]电解质热分解驱动气体排放的实验评价[3]、了解碳酸氟乙烯在锂离子电池用LiPF6基电解质中的热不稳定性[4]、FEC 对LiPF6/EC 电解质溶剂化结构和还原反应的影响及其对固态电解质界面相形成的影响[5]、锂离子电池用有机氟化合物混合电解质溶液的热稳定性和氧化稳定性[6]、电解质与电极质量比[Li0.5CoO2-LiPF6/(EC+DEC),(EC 和DEC 体积比为2∶1,1∶1,1∶2 和1∶3)]对锂离子电池用电极热稳定性的影响[7]、锂离子电池电解液EC-DMC(质量比为1∶1)-1 mol/L LiPF6及憎水离子液体(Pyr14TFSI)的热稳定性和可燃性[8]、其他如含LiPF6的LiPF6盐和锂离子电池电解液(EC、PC、DMC 及EMC)的热稳定性、PF5和LiPF6在碳酸乙烯酯-碳酸二甲酯溶液中的化学反应性、LiPF6的热稳定性和热分解的量热研究等。尽管热降解研究报道较多,但是大部分为纯LiPF6,而工业上LiPF6在EC、EMC、DMC 和FEC 混合溶剂中呈溶解状态,模拟其热稳定性符合实际,但是其热降解动力学和热力学从未见文献报道。此外由于电解质被溶剂包裹,当溶剂气化完毕,会同时发生LiPF6的缓慢分解,因此本研究采用热分析技术借助分峰软件对不同峰温进行了分峰,研究了LiPF6的热降解动力学和热力学参数,可为工业上LB-315 在锂离子电池电解液领域中的应用提供基础数据。
1 实验
1.1 材料
锂离子电池电解液产品型号LB-315 含1 mol/L 的六氟磷酸锂(LiPF6),EC(碳酸乙烯酯)+EMC(碳酸甲乙酯)+DMC(碳酸二甲酯)(体积比为1∶1∶1)及3%的FEC(氟代碳酸乙烯酯)混合溶剂。符合HG/T4067-2008 标准,由湖北诺邦科技有限公司生产,外观为清澈透明液体,该电解液技术指标如表1 所示。
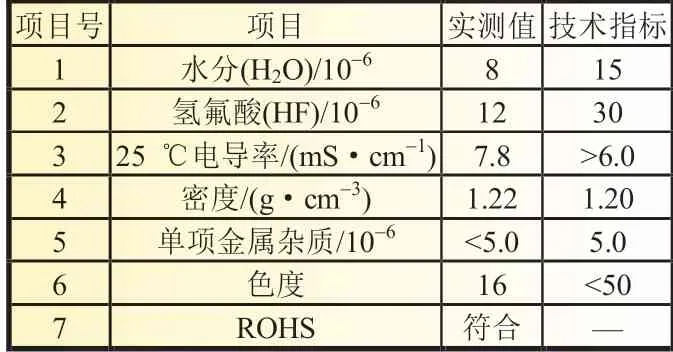
表1 LB-315 产品技术指标
1.2 热分析
LB-315 电解液的热重分析在热重分析仪TGA8000 型上进行,以氧化铝为参比物,氮气气氛,载气流量为60 mL/min,升温速率分别为5、10 和30 ℃/min,升温区间为30~700 ℃,试样质量为3~4 mg。
2 结果与讨论
2.1 LB-315 的热分解过程
锂离子电解液的TG 及DTG 曲线如图1 所示。图中LiPF6质量分数为11.46%,混合溶剂EC、EMC、DMC 和FEC质量分数分别为33.25%,25.4%,26.89%和3%;此外按照其沸点由低到高为DMC、EMC、DEC(碳酸二乙酯)(DEC 由两分子EMC 可逆反应生成)、EC 和FEC,依次为90、107、162.8、248和249 ℃。而纯六氟磷酸锂固体的分解温度为200 ℃。由图1(a)可见,当升温至250 ℃时,电解液残余物质量分数基本上气化及分解完毕,转化率为97.23%,最终高沸点残余物为氟化锂等,质量分数约为2.77%。由图1(b)可见,当升温速率为5 ℃/min 时,第一阶段为DMC 和EMC气化,温度区间为30.0~100.8 ℃;第二阶段为DEC、EC 和FEC 气化,温度区间为56.6~156.9 ℃;第三阶段为LiPF6分解,温度区间为137.1~162.8 ℃;第四阶段为含氟化锂高沸物的分解,其温度区间为275.9~700 ℃。升温速率为10 ℃/min 时,相应阶段分别为30.0~104.1 ℃,48.5~173.6 ℃,147.9~193.8 ℃和272.1~700 ℃;升温速率为30 ℃/min 时,相应阶段分别为30.0~159.3 ℃,80.3~208.0 ℃,177.9~237.7 ℃,245.2~700 ℃。当升温速率为30 ℃/min 时,室温至159.3 ℃为溶剂DMC 和EMC 气化阶段,80.0~208.0 ℃为DEC、EC 和FEC 气化阶段,177.9~237.7 ℃为电解质LiPF6的分解阶段,245.2~700 ℃为含氟化锂的高沸物分解阶段。电解液热分解的特性参数如表2 所示。
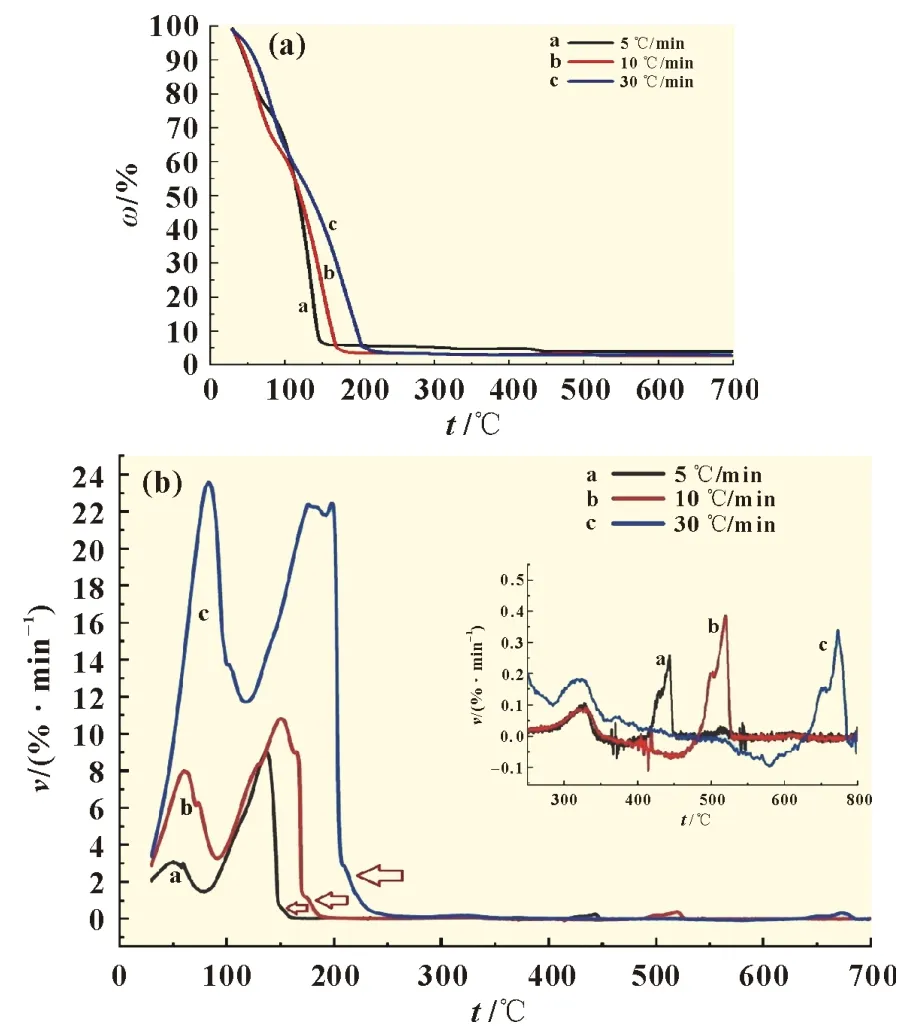
图1 锂离子电解液的TG及DTG曲线
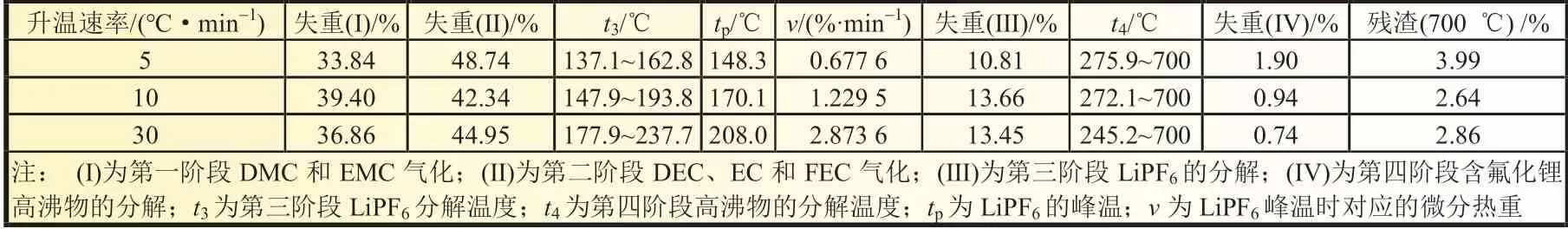
表2 电解液的特性参数
锂离子电解液的热分解由于LiPF6及添加剂成分的分解而发生变化,该热分解反应过程可以描述为:含LiPF6及EC、EMC、DMC 和FEC 的电解液→溶剂(气化及分解)+五氟化磷+含氟化锂的固体残渣。
当有游离HF 时,电解液中电解质LiPF6发生的分解反应如式(1)~(3),产物为固体残渣氟化锂和挥发性气体PF5、HF 和POF3:
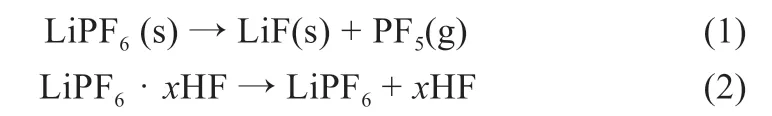
当存在微量水分时,LiPF6将发生反应[9],生成固体残渣LiF 和挥发性气体POF3及HF,如式(3)~(4):
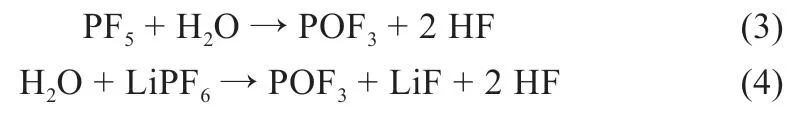
此外当EC 存在时,EC 与PF5将发生分解反应,生成的挥发性气体含有HF、乙烯、C2H5F、CO2、PF4OH、乙醚、PF3O 等,可能的平行和连串副反应如式(5)~(10)[10]:
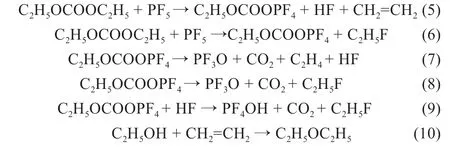
在热分解气氛中当电解液中存在碳酸甲乙酯(EMC)时,将发生分解反应[11],如式(11):
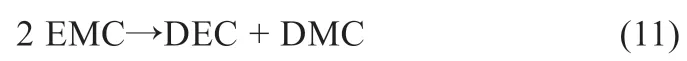
2.2 LB-315 的热分解动力学
该电解液的热失重包括溶剂气化及LiPF6电解质热分解的复杂反应,热失重包括物理变化和化学变化,转化率是热失重进展程度的物理量,可定义为:α=α1+α2,其中α1为混合溶剂的气化百分数,%;α2为LiPF6分解的转化率,%。电解质LiPF6的转化率α2如式(12)所示:

式中:m0,mT和mf分别表示热降解过程中溶于溶剂的溶质(LiPF6)的初始质量、温度T时溶质瞬时质量和最终的溶质剩余质量;α2的数值介于0 到1 之间。利用Kissinger[12]法计算其活化能,如式(13)所示:
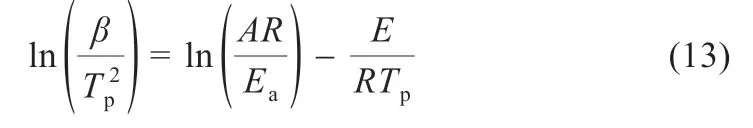
式中:β为线性升温速率dT/dt,℃/min;Tp为不同升温速率条件下的峰温,K;A为指前因子,s-1;R为气体常数8.314 J·K-1·mol-1;Ea为热分解反应的表观活化能,kJ/mol。当LiPF6线性升温(恒定速率加热)时,升温速率β=dT/dt,在转化率α固定条件下,通过对ln[β/Tp2]与1/Tp(峰温法),在不同线性升温速率条件下所得数据点的线性回归直线方程,通过斜率可推算出某个固定转化率α的表观反应活化能E。采用Systat Peakfit(谱峰拟合软件)v4.12,对不同升温速率的微分热重曲线进行分峰。不同升温速率的分峰曲线(0~250 ℃)如图2所示。按照电解液中各个溶剂及助剂的沸点结合分峰结果推断,曲线(a)Peak1、(b)Peak2、(c)Peak3分别为DMC、EMC、DEC气化速率曲线,(d)Peak4 为FEC 的气化速率曲线,(e)Peak5 为EC 的气化速率曲线,(f)Peak6 为LiPF6热分解速率曲线。
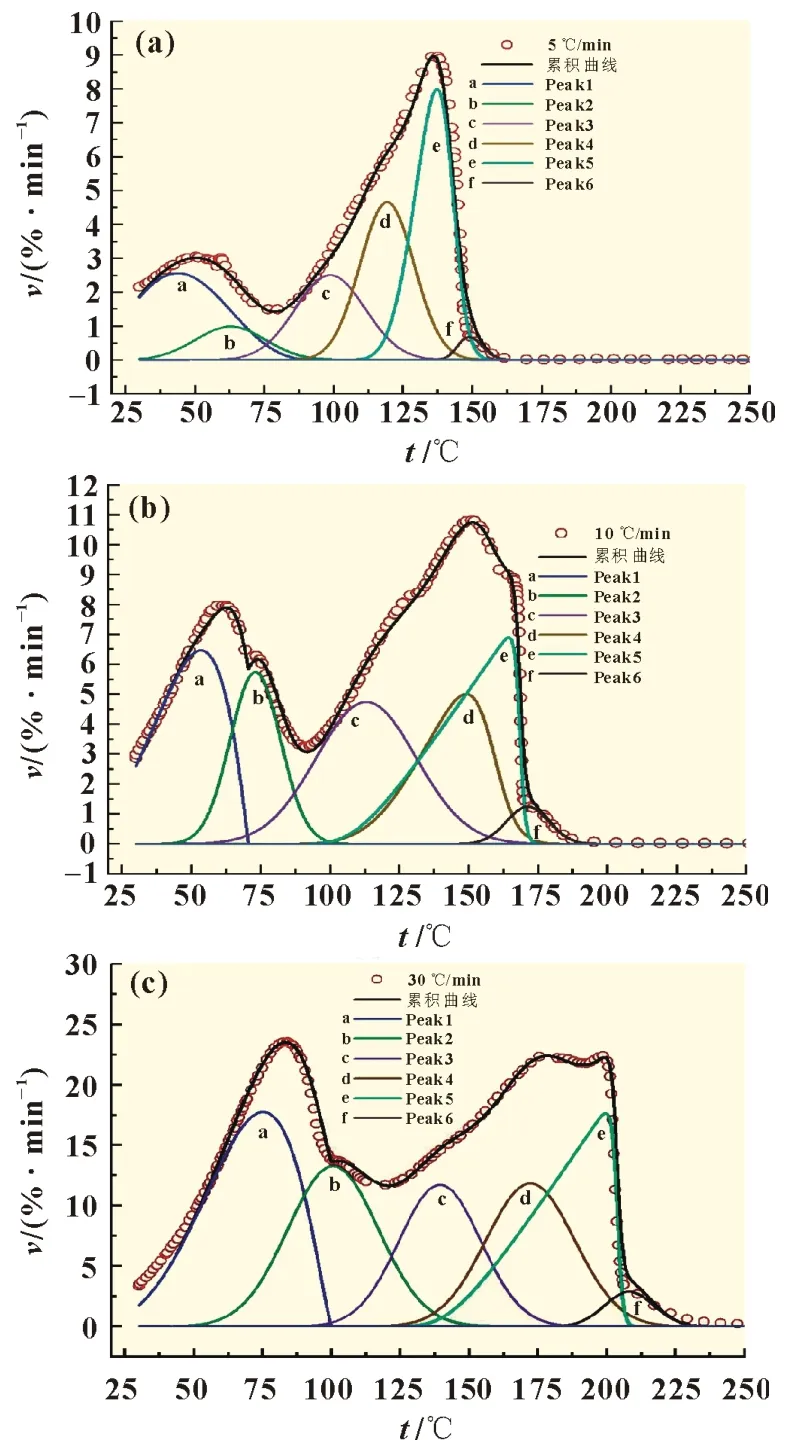
图2 不同升温速率时的分峰曲线(0~250 ℃)
当β从5 ℃/min 升高至30 ℃/min 时,DMC 的峰温从43.8 ℃升高至75.4 ℃;EMC 的峰温从63.0 ℃升高至100.3 ℃;DEC 的峰温从98.8 ℃升高至139.2 ℃;FEC 的峰温从119.4 ℃升高至172.1 ℃;EC 的峰温从137.3 ℃升高至199.5 ℃;LiPF6的峰温从148.3 ℃升高至208.02 ℃。可见,不同组分的峰温随着β的增大,向右移动明显。
此外,升温速率为5、10 和30 ℃/min 时拟合曲线的线性相关系数r2分别为0.994 9、0.998 0 和0.998 1。可见拟合系数较好,分峰拟合曲线较好地反映了微分热重实际。
利用对原始数据进行高斯分峰,所得LiPF6热分解的微分热重曲线(f)如图3 所示。当升温速率为5、10 和30 ℃/min 时,其峰温分别为148.3、170.1、和208.0 ℃,可见随着升温速率的增加,失重区间从137.1~162.8 ℃,移动至177.9~237.7 ℃区间。
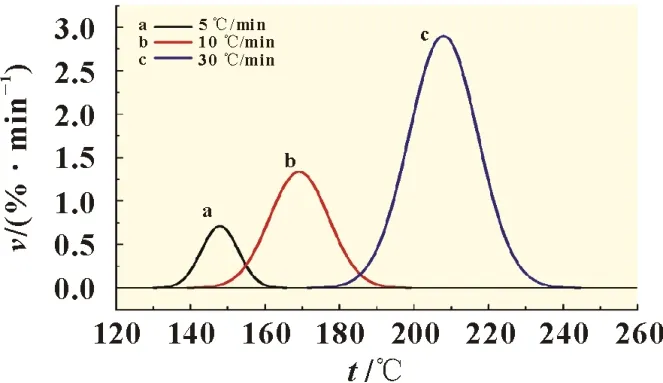
图3 LiPF6热分解的DTG曲线
分峰后LiPF6依据Kissinger 法获得的原始数据如表3 所示。
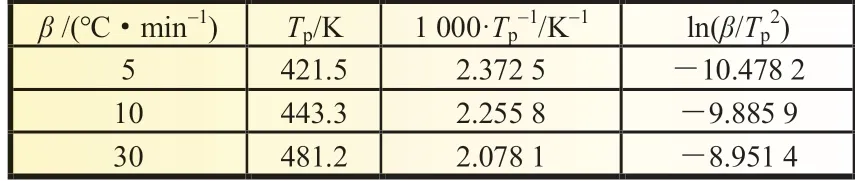
表3 分峰后LiPF6 依据Kissinger 法获得的原始数据
由表3 可得LB-315 电解液中LiPF6的ln(β/Tp2)与1/Tp的线性关系曲线,如图4 所示,其线性系数为0.999 9,线性关系较好,根据式(13)由拟合出的直线斜率(-5.192 12)可得LiPF6热降解的表观活化能为43.17 kJ/mol,根据其截距(1.834 98)计算出的指前因子A为1.96×106s-1。
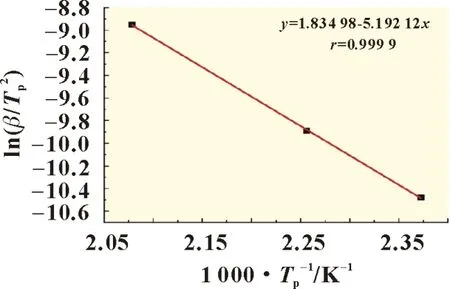
图4 LiPF6的ln(β/Tp2)与1/Tp的线性曲线
而Yang 等[13]报告了1 mol/L LiPF6在EC 中升温速率为10 ℃/min和氩气气氛下的TG-DTA研究,其流量为220 mL/min,显示电解液的失重区间为50~220 ℃。而本研究采用1 mol/L的LiPF6,EC、EMC、DMC(体积比为1∶1∶1)及3%的FEC(氟代碳酸乙烯酯)混合溶剂,升温速率为10 ℃/min、氮气气氛、流量为60 mL/min,TG 曲线显示失重区间为50~200 ℃,与文献报道基本一致。本实验获得的混合电解液中LiPF6热降解的表观活化能为43.17 kJ/mol,较纯LiPF6固体热降解的表观活化能如文献[14]报道的92.05 kJ/mol 下降明显。这可能是由于后者为纯固态LiPF6、分子间有较强的作用力、呈刚性状态;而前者LiPF6受到混合溶剂的溶解作用,导致电解质分子之间的作用力下降。鉴于本电解液中LiPF6的最低分解温度为137.1 ℃,故当温度<100 ℃时较为稳定。
(g)Peak7、(h)Peak 8、(i)Peak 9 分别为残渣1、残渣2 和残渣3,如图5所示。其拟合曲线的线性相关系数r2分别为0.994 9、0.998 0 和0.998 1。高沸物的特性参数如表4 所示。推断325 ℃附近生成的(g)Peak7 残渣1 为低聚物,而高沸物(h)Peak 8 和(i)Peak 9 分别为分解反应生成的高聚物。随着升温速率从5、10 ℃/min 增加至30 ℃/min,(g)峰温基本不变,而高聚物(h)和(i)的峰温分别从431.7 和443.7 ℃增加至651.7 和673.1 ℃,这表明高聚物随着升温速率增大向高温区移动。
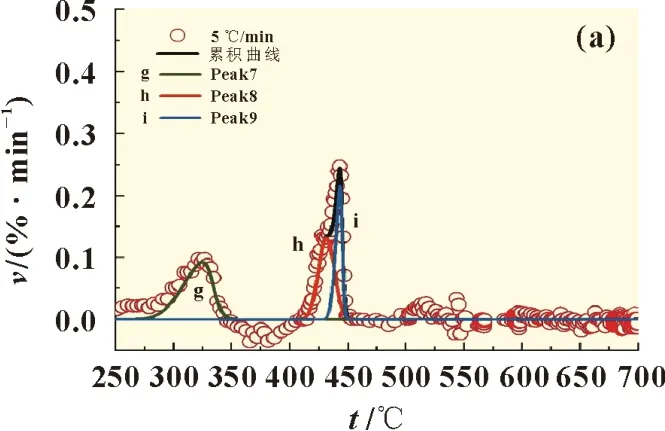
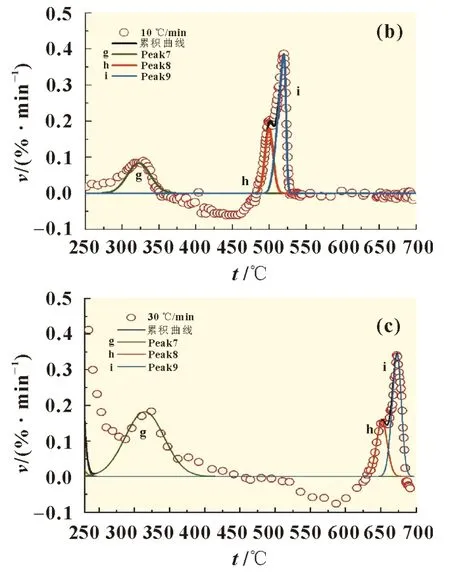
图5 不同升温速率时的分峰曲线(250~700 ℃)
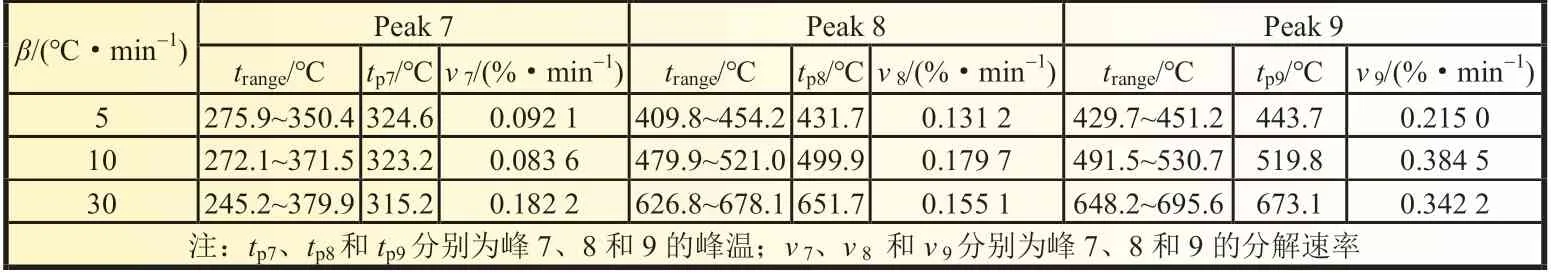
表4 高沸物的特性参数(250~700 ℃)
2.3 热力学参数
为了获得LiPF6在升温速率趋于零时的分解峰温(Tp0)及对应的活化焓(ΔH≠)、活化熵(ΔS≠)和活化吉布斯自由能(ΔG≠),采用式(14)~(17)[15]进行求解:
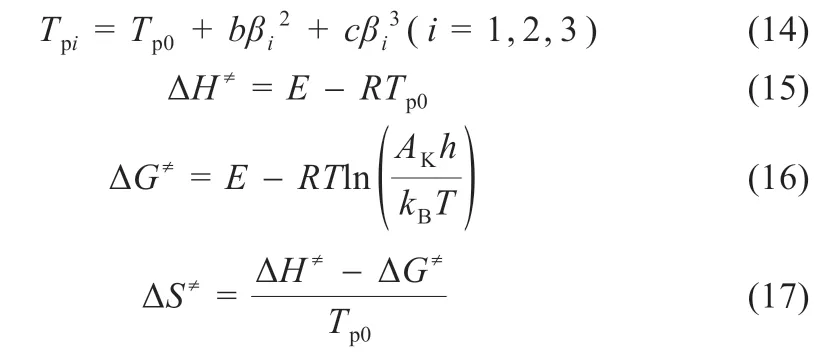
式中:kB为Boltzmann 常数,1.381×10-23J/K;h为Plank 常数,6.626×10-34J/s。将三个升温速率分别代入式(14),可求得Tp0为412.3 K,系数b为0.426 9,c为-0.011 68。由非等温热降解Kissinger 法获得的动力学参数如表5 所示。
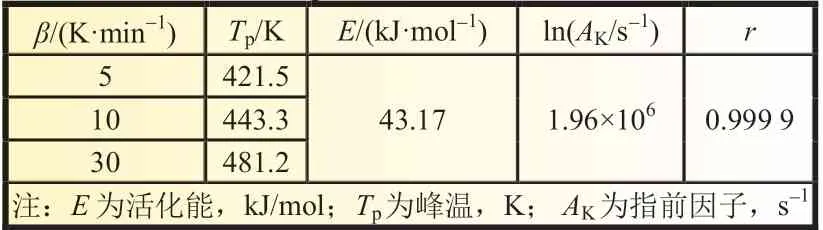
表5 由Kissinger 法获得LiPF6的动力学参数
根据以上公式计算得到LiPF6的热分解外推温度,即升温速率趋于零时的分解峰温Tp0为412.3 K。其ΔS≠、ΔH≠和ΔG≠分别为-135.48 J/(K·mol)、39.6 和95.60 kJ/mol。
3 结论
本文采用TGA 技术对工业级含LiPF6、EC、EMC、DMC 和FEC 的电解液进行了热重分析。结果表明当升温速率为5、10和30 ℃/min时,在氮气气氛下,热降解区间为30~700 ℃时,电解液最大质量损失为97.36%,含溶剂的气化、蒸发及LiPF6的分解,残渣为氟化锂2.64%。采用分峰后Kissinger法求解的电解液中LiPF6热分解的表观活化能为43.17 kJ/mol,指前因子为1.96×106s-1。外推初始温度Tp0为412.3 K,相应的ΔS≠、ΔH≠和ΔG≠分别为-135.48 J/(K·mol)、39.6和95.60 kJ/mol。
