超声造影在发育性肾脏假性肿瘤诊断中的临床应用研究
2022-11-23郝鹏柏根基
郝鹏 柏根基
肾癌是泌尿系中最常见的肿瘤之一,约占成人恶性肿瘤的2%~3%,农村肾癌发病率呈上升趋势[1]。血尿、腰痛、腹部肿块是临床诊断肾癌的三联症,但是上述症状在肾癌中仅占5%~10%[2],大多数肾脏肿瘤症状不典型,确诊时肿瘤多已发生转移,预后较差。
目前诊断肾癌的检查方法有多种,自CT和超声广泛应用以来,肾癌的早期诊断、治疗及预后都得到了很大的提高。常规超声诊断肾细胞癌的敏感性为82%~83%,特异性为98%~99%[3]。尽管常规超声在肾细胞癌中似乎有较高的诊断效能,但是在发育性肾脏假性肿瘤中,因其常规超声影像与恶性肿瘤相似,在鉴别诊断中存在一定困难。在相关研究中, 超声造影(contrast-enhanced ultrasound, CEUS)在肾脏肿瘤良恶性鉴别诊断中的灵敏性、特异性分别为71.4%、91.7%[4]。本文主要探讨CEUS在发育性肾脏假性肿瘤中的临床应用价值。
对象与方法
一、研究对象
选取2017年3月至2021年6月在我院通过常规超声检查考虑为发育性肾脏假性肿瘤的42例患者为研究对象,其中男17例,女25例,中位年龄50岁(42~63岁)。
纳入标准:①既往常规超声检查考虑为发育性肾脏假性肿瘤的患者;②除CEUS检查外,患者同时有CT增强或(和)MRI增强检查,或有组织病理结果;③有足够满意的影像(或图片)可供分析。
二、仪器与方法
1.超声仪器与试剂:声科超声诊断仪,探头频率3.0~5.0 MHz。造影剂声诺维(SonoVue,意大利Bracco公司)。
超声检查方法:患者仰卧位或侧卧位,通过二维灰阶超声检查,观察肾脏病变部位、大小、形态、境界及回声等。选择最佳切面,行彩色多普勒超声显像(color doppler flow imaging, CDFI),观察内部微循环、血管情况。最后切换至CEUS模式,避免机械指数(mechanical index, MI)过高早期破坏微气泡。使用造影剂前将5 ml生理盐水注入瓶中并轻轻摇匀备用,6 h内用完。造影剂采用肘前静脉团注方式,在2~3 s内将1.2 ml(可根据患者体重、身高及年龄调整剂量)配置好的造影剂注入肘前静脉,然后用10 ml生理盐水冲洗。同步开始录像并计时,保存足够时长(5 min)的动态视频,由一位副主任医师和一位主治医师共同分析,包括病变增强方式、峰值强度(与周围肝脏、肾实质比较)及造影剂消退情况等。参考欧洲医学和生物学超声协会联盟超声造影在非肝脏疾病的临床应用指导方针,CEUS在肾脏疾病中的相关研究显示[5],发育性肾脏假性肿瘤中在各期强化模式与周围实质一致,而恶性肿瘤表现出不同程度的强化模式。此外区分发育性肾脏假性肿瘤和恶性肿瘤的标准是血管结构,发育性肾脏假性肿瘤与周围实质相同,显示正常的血管结构,从肾门向周围分布,没有被破坏或异常的血管结构。
成像描述:由两名经验丰富的超声科医师回顾性分析B超图像、CDFI和CEUS图像,并达成一致意见。B超图像评估包括:回声(低、等、高)、均匀性、病变大小及病灶与皮质的比值。CDFI图像:血管(过度增生富血供、乏血供)、血管结构(规则、不规则)。CEUS图像:早期增强、高增强、低增强。
2.CT增强成像与方法:所有患者均使用西门子64排螺旋CT进行增强扫描。扫描参数:扫描层厚5 mm,管电压120 kV,管电流240~300 mA/s,转速0.5 s/r。
造影剂为非离子型造影剂(优维显),注射速度3.5~4.5 ml/s,剂量50~100 ml,并用50 ml生理盐水冲洗。造影剂经肘静脉采取团注的方式,注射后进行延迟扫描,皮质期扫描时间为20~30 s、实质期扫描时间为60~70 s、延迟期为2~5 min。由两名副高以上影像科医师对图像进行分析并达成一致。
3.MRI增强成像与方法:采用德国西门子3.0T磁共振进行检查; 使用腹部相控阵线圈加呼吸门控; 对比剂选择钆喷酸葡胺。
注射造影剂前先行常规磁共振扫描,主要观察病灶数量、大小、形态及信号特点,并联合DWI序列,其b值取800 s/mm2,获取DWI图像。CE-MRI检查常规定位后,进行T1WI、T2WI抑制序列扫描,一旦发现病灶,进行CE-MRI扫描,增强扫描在常规T1WI序列基础上进行扫描,采用钆喷酸葡胺对比剂,剂量为0.2 ml/kg,注射速率为2.0 ml/s,注射完毕后用20 ml生理盐水冲洗。获取图像后,传入工作站进行图像处理。由两名副高以上影像科医师对图像进行分析并达成一致。
4.参考标准:所有患者均行CT或(和)MRI增强扫描并以此结果作为参考标准,或(和)以手术病理结果作为参考金标准。CE-CT、CE-MRI检查认定为肾脏良性病变后,至少随访半年,病灶大小稳定或变小。CE-CT、CE-MRI断层图像由两名影像科副高或副高以上医师分析并达成一致。
三、统计学方法
应用SPSS 22.0软件进行统计分析。定量资料符合正态分布时,采用均值±标准差表示,采用t检验;不符合正态分布时,以中位数和四分位数间距表示,采用秩和检验。定性资料采用卡方检验。以P<0.05为差异有统计学意义。以CE-CT或(和)CE-MRI随访或(和)病理为参考标准,根据灵敏性、特异性的四格表计算公式,可分别计算出CEUS诊断发育性肾脏假性肿瘤的灵敏性、特异性及相应的阳性预测值、阴性预测值。
结 果
所有患者均成功行CEUS检查,无不良反应发生。12例肿瘤病例中,7例为肾脏透明细胞癌,2例为乳头状细胞癌,1例为肾嫌色细胞癌,1例为肾血管平滑肌脂肪瘤,1例为嗜酸细胞瘤。在42例患者中,有4例合并其它肿瘤病史,其中1例透明细胞癌患者合并甲状腺癌,3例发育性肾假性肿瘤患者分别伴有甲状腺癌、乳腺癌、结肠癌;患者一般资料见表1。发育性肾脏假性肿瘤常规超声及CEUS特征见图1。

表1 患者一般资料
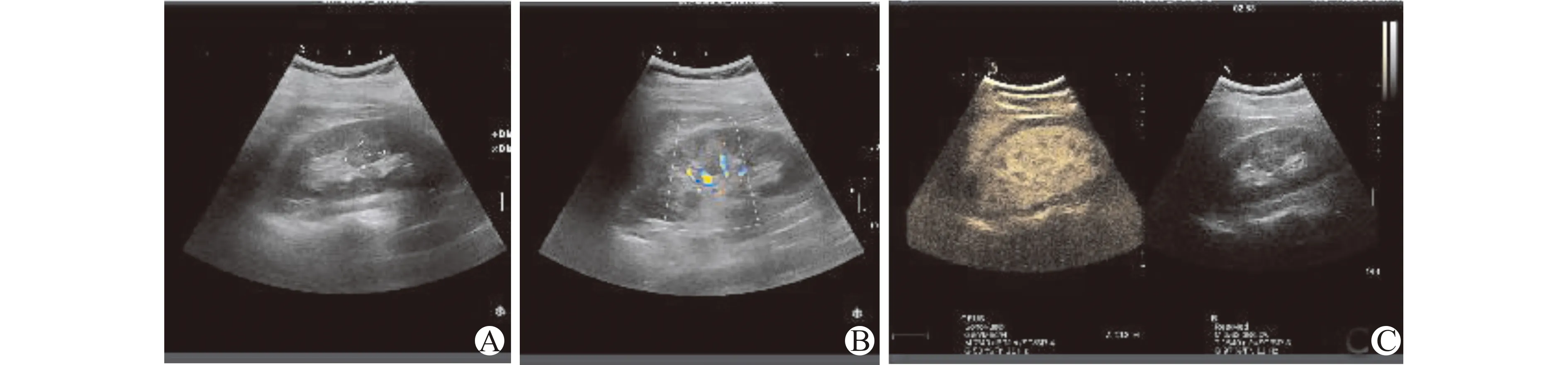
A:右肾中部见低回声结节,大小约2.49 cm×1.47 cm;B:CDFI显示正常血管分布的血流信号;C:CEUS增强模式与周围组织一致
在42例病灶中,CDFI显示肿瘤内部血管结构不规则12例,其中发育性肾脏假性肿瘤2例,恶性肿瘤10例,内部血管不规则病例中恶性肿瘤多于发育性肾脏假性肿瘤,差异有统计学意义(P<0.05);CEUS表现为高增强共14例,其中发育性肾脏假性肿瘤4例,恶性肿瘤10例,CEUS高增强表现的恶性肿瘤多于发育性肾脏假性肿瘤,差异有统计学意义(P<0.05);患者的年龄、性别、病灶大小、部位、回声特点、病灶厚度与皮质厚度比值、早期增强及低增强等比较,两者之间差异无统计学意义(P>0.05),见表2。
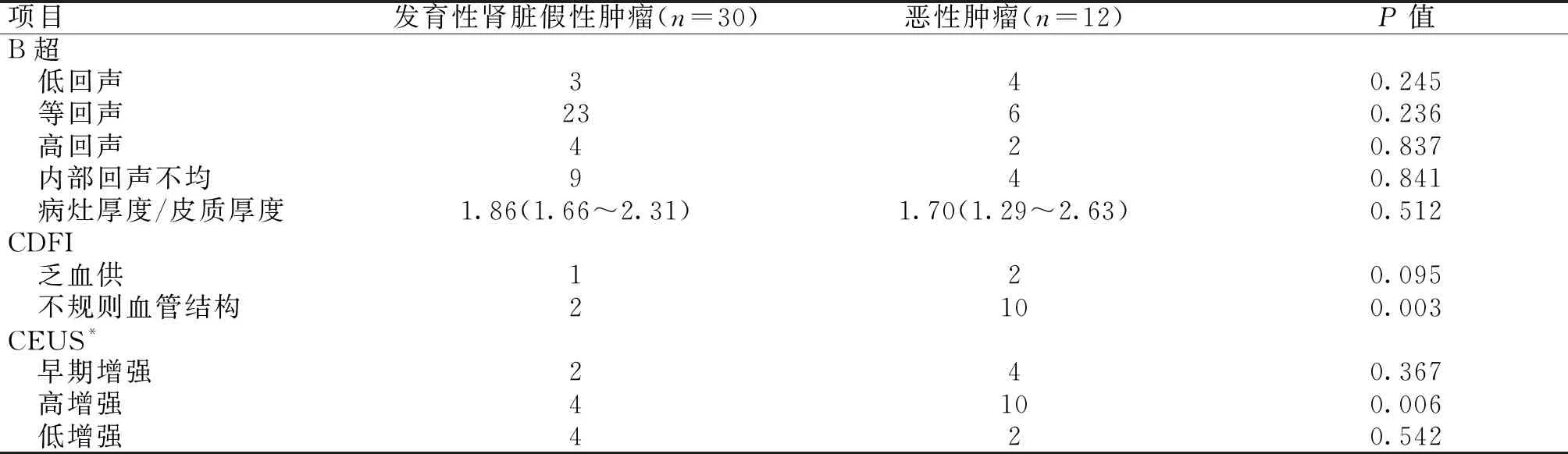
表2 B超、CDFI及CEUS特征
以CE-CT或(和)CE-MRI随访或(和)病理结果为参考标准,在12例肿瘤病灶中,CEUS正确识别10例,在30例发育性肾脏假性肿瘤中正确识别29例。根据表3可计算出CEUS诊断发育性肾脏假性肿瘤的灵敏性83.3%、特异性96.7%、阳性预测值90.9%、阴性预测值93.5%、准确性92.9%。

表3 CEUS诊断准确性
讨 论
CEUS是超声的一种新技术,也是医学界前沿研究领域的一种新技术,在过去的十年中,CEUS在肾脏疾病诊断中得到了广泛的应用。本研究结果表明,CEUS在发育性肾脏假性肿瘤诊断中具有较高的特异性(96.7%)。因此,对常规超声检查结果不确定的患者,CEUS作为一种附加的成像方法,可以很好的排除肾脏恶性肿瘤。
在肾脏假性肿瘤中,大致可分为4类:发育性假性肿瘤、感染所致的脓肿、肉芽肿及血肿,在发育性肾脏假性肿瘤中肾柱肥大最为常见,此外还包括驼峰肾及肾表面分叶现象。B超诊断发育性肾脏假性肿瘤主要依据是其回声与周围肾实质回声相同,而部分肾脏恶性肿瘤也可表现为此类回声模式,同时对小于2 cm没有引起肾脏轮廓改变的恶性肿瘤,两者很难从常规超声中鉴别出来。
在CEUS出现之前,CDFI可根据肿瘤内部血管结构来鉴别发育性肾脏假性肿瘤与恶性肿瘤,一般肾脏假性肿瘤没有占位效应,同时内部血管结构与周围正常组织相似,而恶性肿瘤内部血管不规则。本研究12例恶性肿瘤中,CDFI显示肿瘤内部不规则血管结构10例(10/12,83.3%),与发育性肾脏假性肿瘤相比差异有统计学意义。但是有研究报道,CDFI对于较小肿瘤或过度肥胖患者诊断的灵敏性较差[3]。
在CEUS检查中,具有规则血管结构的发育性肾脏假性肿瘤与周围正常肾实质增强保持一致[5],而肾脏恶性肿瘤则表现出不同幅度的高增强。本研究中,与发育性肾脏假性肿瘤相比,肾脏恶性肿瘤CEUS表现出高增强(83.3% vs 13.3%)。本研究中有2例恶性肿瘤CEUS没有发现,1例CEUS检查病灶与周围肾实质同步增强,术后病理证实为嗜酸细胞瘤;另1例患者因过度肥胖脂肪层较厚,CEUS病灶显示强度与周围肾实质相同,术后病理证实为透明细胞癌。
有研究表明CEUS后处理技术,如时间-强度曲线分析,可以提高诊断性能和量化发育性肾脏假性肿瘤的特征[3]。到目前为止,尚未有研究报道通过CEUS定量分析发育性肾脏假性肿瘤。但是对于肝脏,CEUS通过定量分析病灶内微循环灌注情况已被证实是一种快速且易于使用的诊断工具[6]。在发育性肾脏假性肿瘤中通过超声定量分析感兴趣区域的时间-强度曲线,可以鉴别出恶性肿瘤,发育性肾脏假性肿瘤与周围的肾实质应该具有相同的时间-强度曲线,从而可提高对肾脏假性肿瘤的诊断效能。
此外,CEUS在安全性方面具有独特的优势,其耐受性好、不良反应较少。有研究报道,在超过2万名患者中使用六氟化硫微气泡作为造影剂时,不良反应发生率为0.020%、0.009%[7-8]。在CE-MRI方面,有证据表明,随着患者CE-MRI检查次数的增加,钆沉积稳步增加[9]。CT造影剂所诱发的不良反应相对较重,有研究报道CT增强含碘造影剂诱发肾脏疾病的发生率在2%~12%[10],此外CT检查存在一定辐射,因此CEUS相对CT检查更加安全。
本研究尚存在一定局限性。我们通过回顾性单中心研究,通过CEUS评价肾脏病变,但是对于过度肥胖、肠道积气明显的患者,CEUS图像质量较差,同时对于位置较深和较小的病变会降低其诊断价值,也无法同时显示肾脏不同部位的病变。
综上所述,本研究结果显示CEUS可以很好的鉴别出发育性肾脏假性肿瘤,同时造影剂安全性能较高,不良反应发生率较低。随着CEUS技术的不断发展,以及在肾脏疾病中的广泛应用,其能够为临床提供较高的诊断价值。
