膀胱尿路上皮癌组织中LncRNA NNT-AS1、miR-22表达与预后的关系
2022-11-23段传军杨瑞赵红刘维明徐锐曹志刘勇李曙曦
段传军 杨瑞 赵红 刘维明 徐锐 曹志 刘勇 李曙曦
膀胱尿路上皮癌(bladder urothelial carcinoma, BUC)为膀胱癌中最常见的组织学类型,是最常见的泌尿系统恶性肿瘤之一,其中男性发病多于女性[1]。多数患者初诊时为非肌层浸润性BUC,肌层浸润性BUC患者占约30%[1]。BUC相较于其他实体癌复发倾向高,超过70%的BUC患者在术后2年内会复发,且复发患者通常伴随不良预后[2]。BUC发病率及病死率较高,且近年来呈上升趋势,因此,探究BUC发病机制,并寻找有效的治疗靶点,有助于改善BUC患者的预后[3]。长链非编码RNA(long non-coding RNA, LncRNA)为长度超过200 nt的RNA,不编码蛋白质,能够参与肿瘤的发生、发展,有望成为诊治肿瘤的生物标志物[4]。有研究报道,膀胱癌细胞中LncRNA烟酰胺核苷酸反义转氢酶RNA1(nicotinamide nucleotide transhydrogenase-antisense RNA1, NNT-AS1)表达上调,可能参与调节癌细胞生长[5]。LncRNA可与微小RNA(microRNA, miRNA)相互调控,参与肿瘤的发生、发展[6]。研究显示,肺鳞状细胞癌组织和细胞系中LncRNA NNT-AS1表达上调,微小RNA-22(microRNA-22, miR-22)表达下调,LncRNA NNT-AS1可通过与miR-22结合直接调节叉头盒蛋白M1的表达,从而影响肺鳞状细胞癌细胞的迁移、侵袭及凋亡[7]。但LncRNA NNT-AS1、miR-22与BUC患者临床病理特征的关系及其在BUC中表达的相关性尚未见报道,本研究通过检测LncRNA NNT-AS1、miR-22在BUC患者细胞及组织中的表达,探讨二者在BUC发生、发展中的作用,以期为BUC的预防及治疗提供理论依据。
材料与方法
一、一般资料
选取本院2016年8月至2021年2月收治的39例BUC患者作为研究对象。其中男32例,女7例;年龄中位数为60岁,<60岁者8例,≥60岁者31例。肿瘤浸润:肌层浸润25例,非肌层浸润14例。临床分期:Ta 4例,T15例,T27例,T313例,T410例。病理分级:低级别16例,高级别23例。有淋巴结转移(行泌尿系超声或CT检查评估)11例,无淋巴结转移28例。肿瘤直径(根据影像学检查结果评估)中位数为3 cm,<3 cm者13例,≥3 cm者26例。纳入标准:①符合《中国泌尿外科疾病诊断治疗指南》中相关诊断标准[8];②经病理确诊为BUC,且均为单发灶肿瘤;③术前均未行放化疗、膀胱灌注及免疫治疗等;④患者行膀胱全切或部分切除,或影像学检查发现膀胱内有肿物者,行膀胱肿瘤电切术。排除标准:①合并其他恶性肿瘤者;②合并严重肝肾功能不全者;③随访记录缺失者。本研究经医院伦理委员会批准。
二、研究方法
1.细胞培养及分组:人正常膀胱上皮细胞SV-HUC-1和人膀胱癌细胞株T24(中国科学院生物化学与细胞生物学研究所)均在RPMI-1640培养液(含10%胎牛血清)中进行培养,培养箱条件:37 ℃、含5% CO2。以T24细胞作为BUC细胞组,以SV-HUC-1细胞作为对照组。
2.组织样本采集:留取患者术中切除的癌组织39例,另取癌旁正常组织(距癌灶边缘5 cm以上)39例作为对照,新鲜的组织于液氮中速冻后,置于-80 ℃冰箱保存待测。
3.细胞及组织中LncRNA NNT-AS1、miR-22水平检测:采用Trizol试剂提取细胞及组织总RNA,经逆转录成cDNA,NNT-AS1基因的cDNA采用逆转录试剂盒(货号205111,德国Qiagen公司)合成,miRNA的cDNA采用miRNA cDNA链合成试剂盒(货号ZY130911,上海泽叶生物科技有限公司)合成。以所得cDNA为模板,配制qRT-PCR反应体系,其中LncRNA NNT-AS1内参为GAPDH,miR-22内参为U6(表1)。于荧光定量PCR仪(货号MA-6000,苏州雅睿生物技术股份有限公司)上检测细胞及组织中LncRNA NNT-AS1、miR-22水平。采用2-△△Ct法计算LncRNA NNT-AS1、miR-22相对表达量。

表1 LncRNA NNT-AS1、miR-22及相应内参GAPDH、U6的引物序列
4.双荧光素酶报告实验:利用ENCORI数据库预测miR-22与LncRNA NNT-AS1可能的结合位点。构建LncRNA NNT-AS1野生型质粒和突变型质粒,将LncRNA NNT-AS1野生型和突变型质粒与miR-22 mimics、miR-NC共转染至T24细胞中,转染48 h后检测荧光素酶相对活性,具体检测方法参照荧光素酶活性试剂盒(货号LM130595-100,上海联迈生物工程有限公司)。
三、随访
对所有患者进行随访,随访时间6~36个月,平均16.5个月,无失访者,随访开始时间为术后第1天,结束时间截至2021年8月或患者死亡。以电话、微信或院内复查等方式进行随访,每3个月至少随访1次。
四、统计学方法
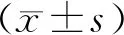
结 果
一、两组细胞中LncRNA NNT-AS1、miR-22的水平比较
BUC细胞组中LncRNA NNT-AS1水平高于对照组(P<0.05),miR-22水平低于对照组(P<0.05),见表2。
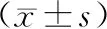
表2 两组细胞中LncRNA NNT-AS1、miR-22的水平比较
二、不同组织中LncRNA NNT-AS1、miR-22的水平比较
癌组织中LncRNA NNT-AS1水平高于癌旁正常组织(P<0.05),miR-22水平低于癌旁正常组织(P<0.05),见表3。
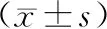
表3 不同组织中LncRNA NNT-AS1、miR-22的水平比较
三、LncRNA NNT-AS1、miR-22水平与BUC患者临床病理特征的关系
不同性别、年龄及肿瘤直径患者LncRNA NNT-AS1、miR-22水平比较,不同临床分期患者LncRNA NNT-AS1水平比较,差异均无统计学意义(P>0.05);LncRNA NNT-AS1、miR-22水平与患者肿瘤浸润、病理分级及淋巴结转移有关(P<0.05),且miR-22水平与患者临床分期有关(P<0.05),见表4。
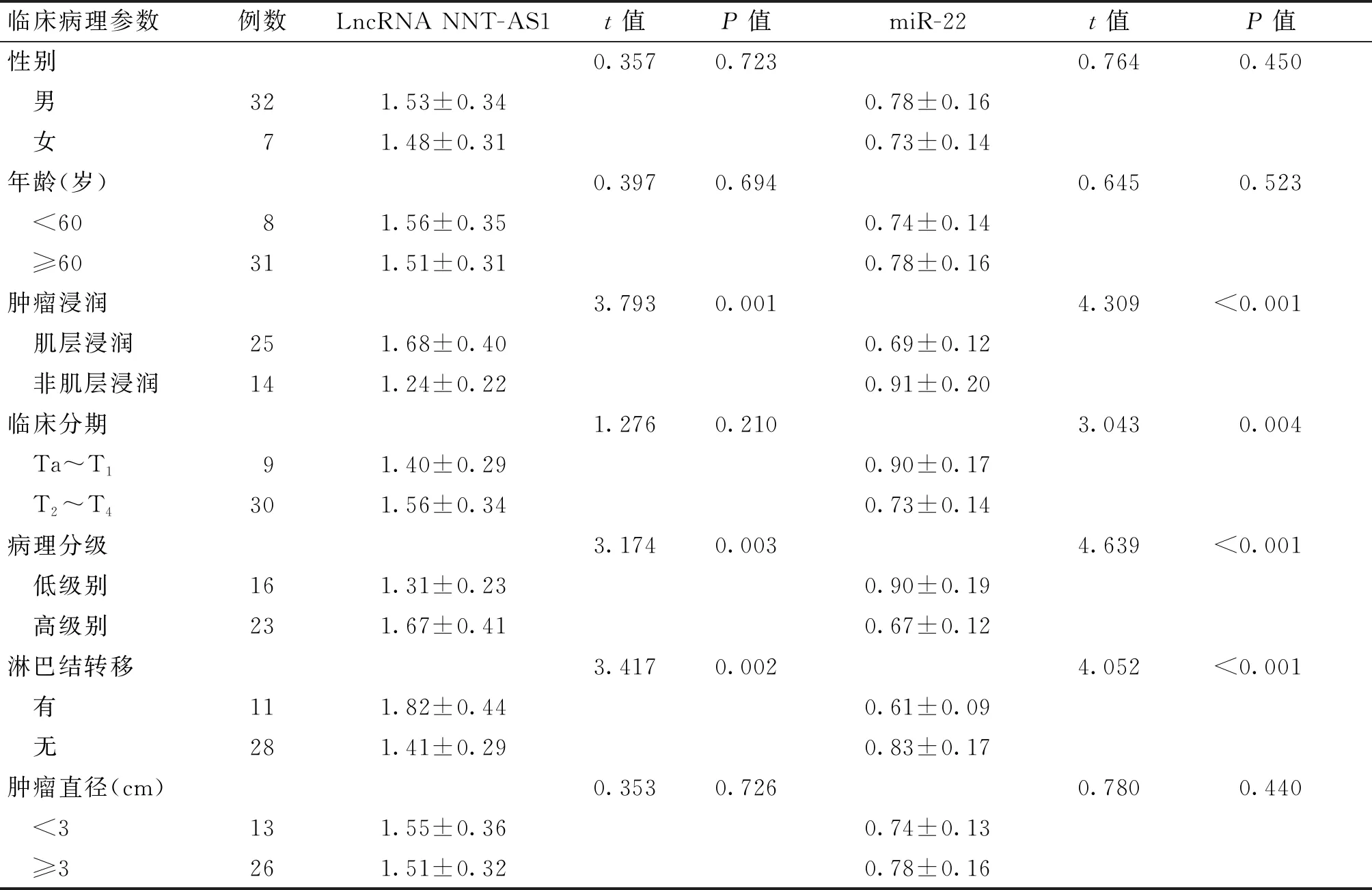
表4 LncRNA NNT-AS1、miR-22水平与BUC患者临床病理特征的关系
四、癌组织中LncRNA NNT-AS1、miR-22的相关性分析
ENCORI数据库预测显示,miR-22与LncRNA NNT-AS1存在相应的结合位点,见图1;双荧光素酶实验结果显示,相对于miR-NC与LncRNA NNT-AS1野生型质粒共转染组,miR-22 mimics与LncRNA NNT-AS1野生型质粒共转染组的荧光素酶相对活性明显降低(P<0.05);相对于miR-NC与LncRNA NNT-AS1突变型质粒共转染组,miR-22 mimics与LncRNA NNT-AS1突变型质粒共转染组的荧光素酶相对活性差异无统计学意义(P>0.05),见图2;Pearson法分析显示,BUC患者组织中LncRNA NNT-AS1与miR-22呈负相关(r=-0.479,P=0.002),见图3。
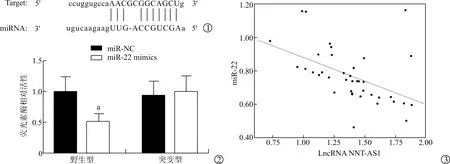
图1 LncRNA NNT-AS1与miR-22的结合位点
五、LncRNA NNT-AS1、miR-22水平与BUC患者总生存率的关系
39例BUC患者随访期间有10例死亡,总生存率为74.36%。以癌组织LncRNA NNT-AS1、miR-22表达的中位数(1.51、0.78)将39例患者分为LncRNA NNT-AS1高表达组(20例)、LncRNA NNT-AS1低表达组(19例)及miR-22高表达组(19例)、miR-22低表达组(20例)。经Kaplan-Meier生存分析显示,LncRNA NNT-AS1高表达组的总生存期平均值为22.93个月(95%CI:17.08~28.79),低表达组总生存期平均值为32.81个月(95%CI:29.04~36.57),LncRNA NNT-AS1高表达组的总生存率(60.0%)低于LncRNA NNT-AS1低表达组(89.5%),两组比较差异有统计学意义(log-rank检验χ2=5.834,P=0.016),见图4;miR-22高表达组的总生存期平均值为33.67个月(95%CI:29.93~37.40),低表达组总生存期平均值为22.92个月(95%CI:17.35~28.49),miR-22高表达组总生存率(94.7%)高于miR-22低表达组(55.0%),两组比较差异有统计学意义(log-rank检验χ2=6.940,P=0.008),见图5。
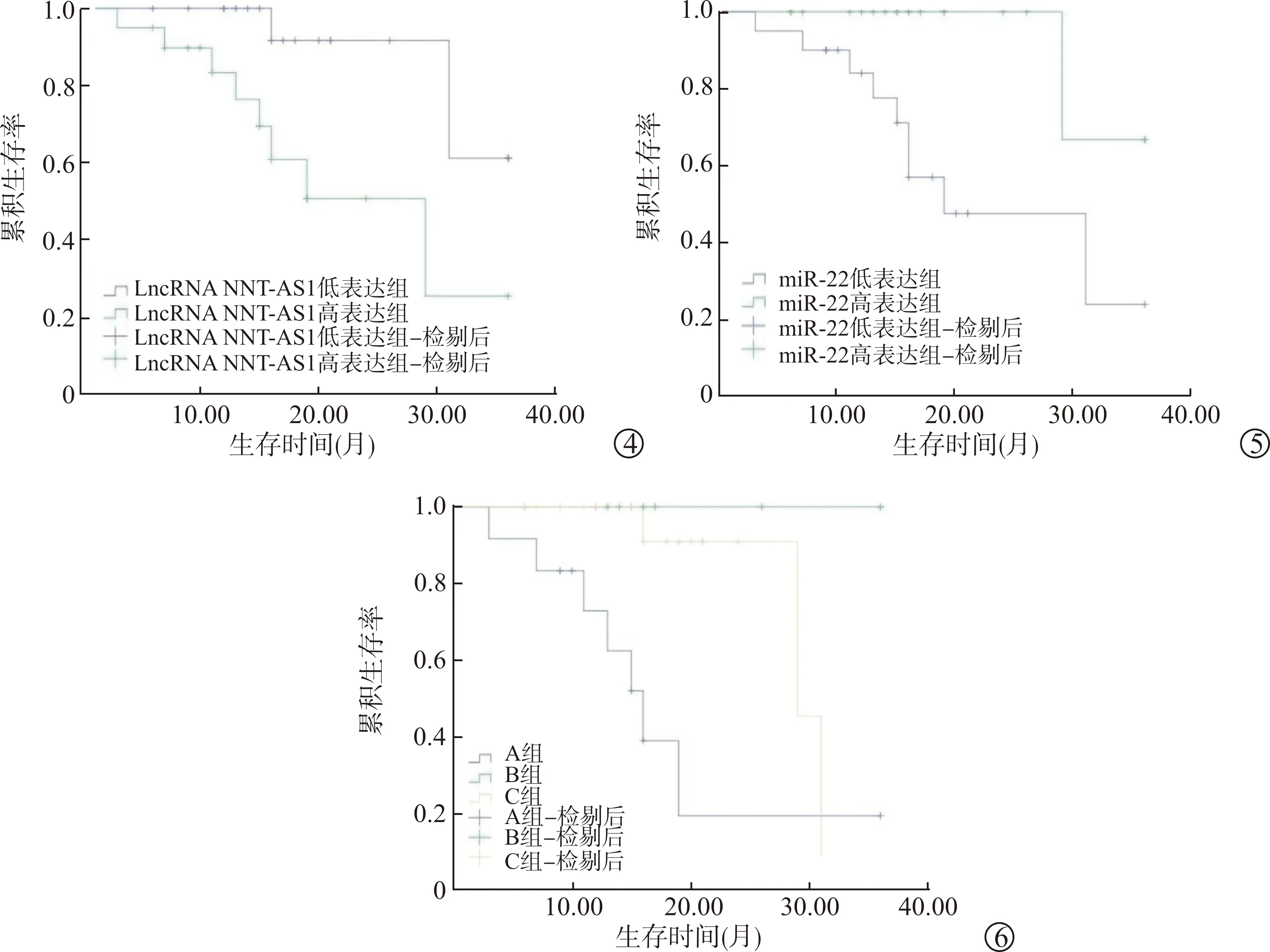
图4 LncRNA NNT-AS1高表达组和低表达组的生存曲线
将LncRNA NNT-AS1高表达+miR-22低表达患者12例作为A组,LncRNA NNT-AS1低表达+miR-22高表达患者10例作为B组,其余患者17例为C组,分析3组患者的总生存率,结果显示,A组总生存率最低,B组总生存率最高,3组比较差异有统计学意义(log-rank检验χ2=12.747,P=0.002),见图6。
讨 论
在过去几十年,BUC发病率持续增加[9],目前主要采用手术治疗BUC。BUC具有侵袭性强、术后复发率高的特点,尽管术后辅助免疫或灌注治疗等可一定程度上降低复发、转移率,但效果不甚理想,仍有部分患者会进展为肌层浸润性膀胱癌,导致预后不良[10]。因此,探索和开发可靠的预后生物标志物对于预测BUC患者的预后及治疗至关重要。
LncRNA不具备编码蛋白质的能力,但可通过染色质重塑激活或沉默相关基因,参与肿瘤细胞增殖、侵袭、转移、凋亡及细胞周期停滞等过程[11]。LncRNA NNT-AS1包含3个外显子,位于染色体5p12区域,是一种新发现的LncRNA分子。研究发现,与邻近的非癌组织和正常细胞相比,LncRNA NNT-AS1在多数癌组织和细胞系中上调,如消化系统肿瘤、女性生殖系统肿瘤等,且其高表达常与预后不良有关[12]。LncRNA NNT-AS1在胃癌细胞中呈高表达,可能通过上调凋亡蛋白表达从而促进胃癌细胞增殖,抑制细胞凋亡[13]。Yao等[14]研究发现,LncRNA NNT-AS1在前列腺癌细胞中明显上调,抑制LncRNA NNT-AS1表达可抑制前列腺癌细胞的活力、增殖及迁移,促进细胞凋亡。近年来研究显示,LncRNA NNT-AS1在膀胱癌细胞中表达上调,可通过靶向调控miR-1301-3p促进膀胱癌细胞生长并激活Wnt通路,敲低其表达可诱导癌细胞凋亡[5]。本研究中,BUC细胞组LncRNA NNT-AS1水平高于对照组,LncRNA NNT-AS1在癌组织中表达水平高于癌旁正常组织,且其水平与BUC患者肿瘤浸润、病理分级、淋巴结转移有关,提示LncRNA NNT-AS1可能通过促进癌细胞增殖、迁移等参与BUC的疾病进程。进一步研究显示,LncRNA NNT-AS1高表达患者总生存率低于低表达患者,其高表达预示着BUC患者预后不良。
miRNA同样无编码蛋白质的功能,可通过靶向3′UTR区的互补序列调节基因表达,已有研究发现多种miRNA在癌症中异常表达并参与癌症的发生、发展。miR-22在膀胱癌组织和癌细胞中表达下调,过表达miR-22可抑制膀胱癌细胞增殖、迁移、侵袭及上皮间质转化,其对癌细胞的生理过程的影响与靶向调控E2F转录因子3有关[15]。研究显示,miR-22-3p可通过靶向神经上皮细胞转化1促进膀胱癌细胞的化学抗性,有望成为膀胱癌患者预后生物标志物[16]。本研究中,BUC细胞及癌组织中miR-22水平下降,与上述研究一致,且不同肿瘤浸润、病理分级、临床分期及淋巴结转移患者miR-22水平比较差异有统计学意义,提示miR-22可参与BUC的发生、发展。此外,有研究表明,miR-22在BUC中异常表达,miRNA靶基因预测分析显示,其有望成为BUC的靶向治疗位点[17]。本研究还发现,miR-22高表达患者总生存率高于低表达患者,监测miR-22水平能够早期预测患者预后。有研究表明,LncRNA可与miRNA相互作用,共同影响肿瘤的发生、发展,LncRNA可作为miRNA前体直接影响miRNA功能,也可作为竞争内源性RNA间接影响miRNA的调控作用[18]。也有研究表明,LncRNA NNT-AS1可与不同miRNA相互作用,参与多种恶性肿瘤的疾病进程[5,7]。本研究双荧光素酶实验结果显示,LncRNA NNT-AS1与miR-22存在靶向关系,且通过绘制散点图发现LncRNA NNT-AS1与miR-22表达在BUC癌组织中呈负相关,二者可能共同调控BUC的发生及发展,但具体机制尚不明确,需进一步进行细胞实验或动物实验来验证。此外,LncRNA NNT-AS1高表达+miR-22低表达患者总生存率低于LncRNA NNT-AS1低表达+miR-22高表达患者及其他患者,亦提示二者可能共同影响BUC患者的预后,监测二者水平有助于筛选出BUC预后不良高危人群,并及时采取相关治疗措施以改善患者预后。
综上所述,在BUC细胞及癌组织中LncRNA NNT-AS1表达上调,miR-22表达下调,LncRNA NNT-AS1与miR-22呈负相关,且均与患者临床病理特征及预后有关。但本研究仍有一定局限性,如纳入BUC患者较少,且没有分析LncRNA NNT-AS1、miR-22与患者随访期间复发、转移的关系,下一步我们将纳入更多的患者,并充实研究内容,从而更好地为BUC预后评估提供依据。
