CCL2/CCR2信号通路在慢性肾脏病中的研究进展
2022-11-22余霞霞沈娱汀综述岳昌武陈丽华审校
余霞霞 沈娱汀 综述 岳昌武 陈丽华 审校
随着人口老龄化,糖尿病、高血压等慢性疾病患病率的升高,慢性肾脏病(CKD)的发病率也逐年上升,已成为严重危害人类健康的公共卫生问题之一,同时CKD的治疗也给患者及其家庭带来了巨大的经济负担和心理压力。目前,针对CKD的传统治疗只能控制或延缓疾病的进展,而无法达到治愈的效果[1]。趋化因子CCL2及其受体CCR2在肾脏免疫细胞浸润过程中发挥重要作用;阻断CCL2/CCR2信号轴能够有效延缓CKD的进展,然而其在不同病因引起的CKD中的作用效果和具体机制尚未进一步阐明。鉴于此,本文将围绕CCL2/CCR2信号通路在4种不同原发病因引发的CKD中的作用及其调控机制进行综述,以期为临床治疗CKD提供新的思路与方向。
CCL2/CCR2信号通路
趋化因子是一类由细胞分泌具有趋化作用的小分子蛋白质,分子质量8~10 kD,参与固有免疫细胞和适应性免疫细胞的迁移,与炎症反应的启动和维持密切相关[2]。大部分趋化因子成员有4个保守半胱氨酸(Cysteine,Cys),根据多肽链一级结构中第一位和第二位Cys的排列方式可将其分为4个亚族,包括(1)CXCL亚族(α-亚族):氨基端2个Cys之间含有1个其他氨基酸;(2)CCL亚族(β-亚族):氨基端2个Cys紧密相连;(3)XCL亚族(γ-亚族):第一和第三位Cys缺失,即氨基端只有1个Cys;(4)CX3C亚族:氨基端2个Cys之间含有3个其他氨基酸[2-3]。大多数趋化因子属于CXCL和CCL亚家族,CCL亚家族中主要包括五种单核细胞趋化蛋白(MCP):CCL2(MCP-1)、CCL8(MCP-2)、CCL7(MCP-3)、CCL13(MCP-4) 和CCL12(MCP-5),通过与细胞上趋化因子受体结合,趋化免疫细胞向受损组织募集,以此发挥不同的生物学功能[3]。
CCL2单核细胞趋化激活因子CCL2 又称MCP-1,人类CCL2基因位于17号染色体q11.2-q12区域[2,4],其通过趋化作用和对整合素的活化促进炎症细胞的迁移,参与机体炎症反应的发生和维持。CCL2由多种类型细胞分泌产生,包括巨噬细胞、单核细胞、内皮细胞、成纤维细胞、小胶质细胞、星形胶质细胞、肾小球系膜细胞、肾小管上皮细胞及平滑肌细胞等[4-6]。当肾脏发生损伤时,肾小管上皮细胞释放的CCL2趋化CCR2+的单核细胞、T细胞、树突状细胞和成纤维细胞迁移至损伤部位,以抵抗外部因素对于肾脏组织的损害,并促进受损部位的组织重塑和伤口愈合(图1)[7-8]。研究表明,CCL2的分泌受到促炎和抑炎细胞因子的双重调控作用,以白细胞介素1(IL-1)、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)为代表的促炎细胞因子能够加速肾小管上皮细胞对于CCL2的释放,而抑炎细胞因子(如维甲酸和糖皮质激素) 可抑制CCL2的分泌。此外白细胞介素4(IL-4)、巨噬细胞集落刺激因子(M-CSF)、血小板衍生生长因子(PDGF)、转化生长因子β(TGF-β)、脂多糖、活性氧和免疫复合物等细胞因子或生长因子,也能够诱导CCL2的产生,参与肾损伤及损伤后的修复过程[8]。
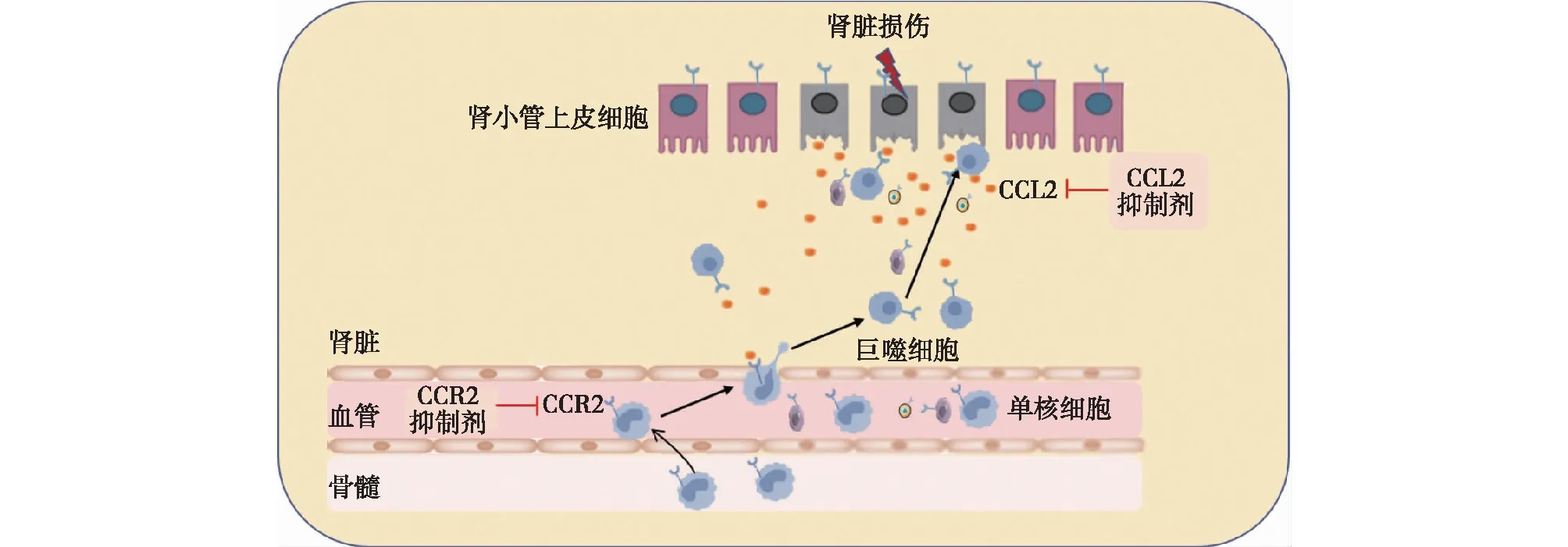
图1 CCL2/CCR2信号通路在慢性肾脏病中的作用机制[7-8]
CCR2CCR2是CCL2的主要受体,属于G蛋白偶联受体(G protein-coupled receptor, GPCR) 超家族成员,由一个氨基端胞外结构域和7个富含疏水氨基酸的 α 螺旋跨膜结构组成[3]。CCR2广泛表达于未成熟树突状细胞(iDC)、浆细胞样树突状细胞(pDC)、嗜碱性粒细胞(Bas)、辅助性T细胞1(Th1)、辅助性T细胞2(Th2)、自然杀伤细胞及辅助性T细胞17(Th17)等多种细胞[9]。在肾脏中,CCR2主要存在于肾小球系膜细胞、肾小球上皮细胞(足细胞) 等细胞表面。根据羧基端基因剪切方式的不同,CCR2被分为CCR2A和CCR2B两个亚型,并以CCR2B为主。其中CCR2A亚型表达于单个核细胞和血管平滑肌细胞表面,CCR2B亚型于单核细胞、活化记忆T细胞、自然杀伤细胞、B细胞和嗜碱性粒细胞表面表达[4,6,8]。
CCL2/CCR2信号通路在CKD中的作用及机制
糖尿病肾病(DN)DN是糖尿病严重的微血管并发症之一,也是导致CKD和终末期肾病(ESRD)的主要病因。Morii等[10]发现,高血糖可以刺激糖尿病小鼠肾脏系膜细胞和足细胞产生高水平的CCL2,导致肾脏巨噬细胞和肌成纤维细胞增多,促进肾脏纤维化。DN患者尿液中CCL2水平明显升高,且与肾间质中的巨噬细胞数量及肾小管病变程度呈正相关。Boels等[11]发现在链霉素诱导的小鼠DN模型中,CCL2的抑制剂NOX-E36可有效恢复肾脏血管内皮糖萼结构的屏障保护功能,调节巨噬细胞分泌组织蛋白酶L的能力,减少白蛋白尿,缓解肾脏疾病。 Raina等[12]在调查印度西北部旁遮普邦人群MCP-1中2518A>G(rs1024611) 基因型对2型糖尿病和ESRD的影响发现,该基因型可能增加2型糖尿病进展为ESRD的风险。已有研究表面,内质网应激(ERS)和表观遗传修饰在糖尿病的发病中发挥重要作用,Chen等[13]发现ERS可通过偶联的转录因子XBP1s诱导SET7/9的表达,从而影响小鼠肾皮质中CCL2的mRNA水平。 Ito 等发现CCR2低表达可能在DN中发挥重要作用,使用CCR2拮抗剂INCB3344可减少骨髓来源的巨噬细胞(BM-Mφs) 浸润,并抑制该细胞Toll样受体9(TLR9) 的表达和TNF-α的分泌,同时减少组织驻留巨噬细胞(Res-Mφs)中活性氧(ROS)的产生,从而对肾脏起保护作用[14]。此外,CCR2不仅能够介导单核/巨噬细胞浸润来参与肾组织损伤,也可通过在其他类型细胞如肾脏固有细胞足细胞上高表达进而参与DN的发展。You等[15]发现口服CCR2拮抗剂(RO5234444) 可特异性抑制足细胞上CCR2的表达,有效减少高糖诱导的足细胞凋亡,进而改善肾损伤,而过表达足细胞中CCR2基因可提高其尿白蛋白,血尿素氮的水平,增加肾脏中纤连蛋白和Ⅰ型胶原的表达,但是未发现小鼠肾脏中巨噬细胞数量及炎性细胞因子水平的增加,表明足细胞中CCR2的表达与单核细胞/巨噬细胞的募集无关。因此,靶向足细胞中的CCR2信号级联反应可能是治疗DN的一种新型疗法。
狼疮性肾炎(LN)临床上常用抗炎及免疫抑制疗法延缓LN的进展[16-17]。 早期研究显示,LN患者的尿液CCL2表达上调,通过促进循环单核细胞及组织巨噬细胞在肾间质中的聚集和激活参与LN的发展,并与LN患者的临床评分和肾病理活动Austin评分相关[18]。Kulkarni 等[19]研究发现应用CCL2的拮抗剂mNOX-E36可抑制MRL/lpr小鼠肾脏中CCL2的表达水平,减少单核/巨噬细胞在肾脏中的浸润和细胞外基质的沉积,从而改善肾脏纤维化和组织损伤情况,同时mNOX-E36也表现出良好的生物稳定性,无需进行结构改造,具备良好的药代动力学性质,不存在免疫相关不良反应,因此基于mNOX-E36抑制CCL2的治疗为LN的临床治疗提供了新思路。Pérez等[20]发现在MRL/lpr LN小鼠模型肾脏CCR2表达水平升高, CCR2基因敲除可减轻小鼠的淋巴结肿大,减少蛋白尿排泄,疾病活动指数评分减低,肾小球和肾小管间质中的T细胞和巨噬细胞浸润减少及抗dsDNA抗体水平减低,外周血中CD8+T细胞数量减少,证明 CCR2基因不仅影响肾脏中的单核细胞/巨噬细胞和T细胞的浸润,同时影响MRL/lpr小鼠的全身T细胞反应,是治疗LN的潜在靶点。Devarapu等[21]还发现CCL2和CXCL12的双重阻断可显著降低肾脏中IL-6、IL-12p40、CCL-5、CCL-2的分泌以及CCR-2 mRNA和蛋白的表达,可有效延缓LN的进展,提高生存率,其疗效与大剂量环磷酰胺相当,但后者不良反应更为明显。
肾血管性高血压(RVH)RVH是由于肾动脉狭窄,肾脏血流减少甚至缺血,导致肾实质进行性破坏和肾功能减低,最终发生肾衰竭,是肾脏疾病患者死亡的常见原因之一。Kashyap等[22]在野生型和CCL2基因敲除小鼠中构建RVH模型,发现CCL2基因敲除小鼠肾脏皮质萎缩减轻,单核细胞浸润减少以及CCL5、CCL7、CCL8、CCR2和CD206表达降低,肾损伤减轻,提示CCL2可能是RVH导致慢性肾损伤的关键因素。Kashyap等[23]发现在RVH小鼠模型中CCR2的药理阻断可显著减少F4/80+CD206+M2型巨噬细胞在肾脏中的浸润,同时降低肾脏中CCL5和TNF-α的表达水平。综上,阻断CCR2可能为临床RVH治疗提供一种新方法。
梗阻性肾病(ON)ON是CKD和ESRD的常见病因之一,其主要病理学改变为肾小球硬化、肾小管萎缩和肾间质纤维化,最终导致肾功能受损甚至衰竭。单侧输尿管结扎(UUO)和肾脏缺血再灌注(IRI)模型是目前用于研究肾纤维化机制的经典动物模型。Wada 等[24]发现在UUO小鼠模型中,通过基因突变阻断小鼠肾脏中CCL2的表达能够减少损伤部位CCR2+巨噬细胞的浸润、Ⅰ型胶原蛋白的沉积及TGF-β的分泌,同时UUO导致的肾脏纤维化程度减轻。此外,Braga 等[25]还发现与敲除小鼠CCL3、CCR4、CCR5相比,CCR2基因敲除小鼠肾脏损伤部位Th17分泌的促炎细胞因子减少,且肾脏纤维化程度减轻。早期研究发现,CCL2在IRI肾组织中表达上调,其通过招募CCR2+单核细胞从外周血向受损组织迁移从而介导肾脏损伤和纤维化的发生发展。使用CCR2抑制剂RS102895处理IRI小鼠,与未处理组相比,其肾脏组织损伤部位巨噬细胞、树突状细胞及T细胞浸润减少,促纤维化生长因子和促炎细胞因子表达水平降低,使得细胞外基质沉积和肾损伤标志物减少[26]。
CCL2/CCR2信号通路在CKD的诊治中的应用
研究发现,CCL2作为生物标志物在肾损伤早期发生显著变化,有助于监测疾病活动、评估治疗效果,且该种生物标志物容易地在血清和尿液中检测,同时CCL2蛋白具有较高的稳定性,有被用作生物标志物的潜质,因此加深对CCL2作为肾损伤标志物可行性的研究及对CCL2/CCR2信号通路具体过程及调控机制的研究,将为 CKD的诊断及干预治疗提供新思路[27]。
多种靶向抑制CCL2/CCR2信号通路的受体拮抗剂及小分子抑制剂等已尝试用于治疗CKD。CCX140-B是CCR2的抑制剂,该抑制剂的Ⅱ期临床试验(NCT01447147)从2011-12-07(第1例患者入组)持续到2014-08-04,共招募了332例患者,其中111例患者接受安慰剂治疗,110例患者接受5 mg/d CCX140-B治疗和111例患者接受10 mg/d CCX140-B治疗。安慰剂组在52周内尿蛋白与肌酐比值(UACR)较基准值变化为-2%,5 mg/d组UACR较基准值变化为-18%,10 mg/d组UACR较基准值变化为-11%。安慰剂组有81例(73%)发生不良反应,而5 mg/d组有71例(65%),10 mg/d组有68例(61%)。De Zeeuw等[28]研究发现,CCX140-B对DN患者的肾脏保护效果优于目前的治疗药物,显著改善蛋白尿,缓解DN, 现该药物的Ⅲ期临床试验正在筹备中。在另一临床试验(NCT01547897)中,Menne等[29]发现NOX-E36作为CCL2的抑制剂,其临床耐受性和安全性良好,可有效降低尿微量白蛋白/尿肌酐比值和糖化血红蛋白水平,但其缓解DN进程的疗效仍需更加深入的研究。PF-04634817是一种CCR2/CCR5拮抗剂,一项Ⅰ期临床研究(NCT01791855),以评估PF-04634817在26例具有不同程度肾损伤的DN患者中的安全性和耐受性,发现该药物具有良好的肾脏保护效果[30]。PF-04634817的Ⅱ期临床试验(NCT01712061)已经完成,在该试验中将226例DN患者随机分成了两组,分别为接受SOC(血管紧张素转化酶抑制剂或血管紧张素受体阻滞剂)治疗组和接受SOC及PF-04634817(150 mg/d或 200 mg/d)联合使用治疗组,研究发现PF-04634817单独治疗或与SOC联合治疗其安全性好,耐受性高,由于研究的持续时间较短,PF-04634817治疗对患者的肾功能(肾小球滤过率)改善并无显著效果,但目前的试验数据提示延长PF-04634817治疗时间可能改善肾损伤的效果更显著,因此该药在临床中能否治疗DN还需进一步探究[31-32]。目前,CCL2/CCR2信号通路的靶向抑制药物主要在DN中进行了临床试验,而在其他病因导致的CKD中,CCL2/CCR2信号通路的靶向抑制药物及体内实验仍需更多的临床研究来证明。
小结:越来越多的研究表明CCL2/CCR2信号通路在CKD的诊断、治疗中发挥重要作用,其在DN、LN、RVH、ON等多种疾病中通过调节损伤部位炎性细胞浸润和影响肾脏纤维化的发展,进而与CKD的发生发展密切相关。然而CKD的发展过程涉及细胞内的多种信号通路及分子,关于该信号轴与其他信号轴之间是否存在更加有效的协同或拮抗作用来影响CKD发展,目前还仍需进一步探索。转基因动物模型、单细胞组学等新技术的应用,将极大推进CCL2/CCR2信号通路在CKD中的研究,相信在不久的将来有望为CKD的防治提供更加可行的思路和靶点。
