p300/CBP在肾脏纤维化的作用和机制
2022-11-22王艳哲综述叶朝阳审校
王艳哲 吴 明 综述 叶朝阳 审校
慢性肾脏病(CKD)是一类常见的慢性疾病,以肾脏结构损伤、功能下降为特征[1]。随着高血压、糖尿病等患病率的增长,CKD的患病人数也逐年递增,已发展为严重的全球公共卫生问题[2]。肾脏纤维化是各种病因导致的CKD进展的最终结局。以肾间质成纤维细胞活化和细胞外基质(ECM)过度积聚为特征[3]。目前临床上尚无有效的治疗方法,患者可能需要终身替代治疗或进行肾脏移植。
组蛋白乙酰转移酶(HAT)可影响组蛋白的乙酰化,在体内与组蛋白去乙酰化酶(HDAC)共同调控基因表达和细胞周期的关键步骤。环磷酸腺苷反应元件结合蛋白(CREB)的结合蛋白(CBP)和高度同源的腺病毒早期区域1A蛋白(E1A)相关的300 kD蛋白(p300)分别能够与CREB和E1A特异性结合,两者具有高度同源性,是许多转录因子的共活化剂[4]。由于CBP和p300属于同一类蛋白质,又具有相近的氨基酸排序和功能,所以常写为p300/CBP。p300/CBP参与细胞周期进展和细胞的生长、分化和发展,是一类非常重要的辅激活因子[5]。越来越多的研究表明,p300/CBP与肾脏纤维化的发生发展密切相关,现对其作用机制作一简述,以期对肾脏纤维化的防治提供新的靶点和思路。
p300与CBP的结构和功能
结构p300基因位于22号染色体q13.2,编码含有2415个氨基酸的p300蛋白,CBP基因位于16号染色体p13.3,编码具有2442个氨基酸的CBP蛋白[6]。p300/CBP蛋白分为结构化与非结构化的区域,其中非结构化区域约占整体的50%以上。结构区主要包括转录适配器锌指结构域1(TAZ1)、激酶诱导的CREB相互作用结构域(KIX)、溴域(BRD)、植物同源结构域(PHD)、ZZ型锌指结构域(ZZ)、录适配器锌指结构域2(TAZ2)、反式激活区域(TAD)以及HAT结构域,这些结构域在一定条件下相互作用,保证组蛋白乙酰化酶HATs活性[7]。
功能p300和CBP是HAT的两个亚型,作为一种普遍表达的转录共激活因子,在多种组织中广泛表达,并能够介导组蛋白乙酰化修饰过程。其通过几种相互关联的机制调节基因的表达,发挥生物功能。这些生物功能包括(1)由于p300固有的HAT活性,通过组蛋白乙酰化诱导染色质松弛,使RNA聚合酶Ⅱ的募集,在基因启动子和增强子区域内形成活性转录复合物。(2)p300/CBP可以直接调节几种转录因子的功能,以增强靶基因的表达[8-9]。(3)p300/CBP可以和不同的辅助因子蛋白质组合成复合物,同时与多种蛋白质结合,促使转录因子和转录辅助因子发挥作用,使蛋白质-蛋白质和蛋白质-DNA之间发生相互作用[10]。
p300/CBP参与肾脏纤维化的分子机制
通过染色质重塑或与这些细胞过程中涉及的特定基因转录因子相互作用,p300在许多细胞过程中发挥重要作用,包括增殖、迁移、分化、衰老和凋亡。以下重点讨论p300/CBP参与调控肾纤维化的分子机制(图1)。
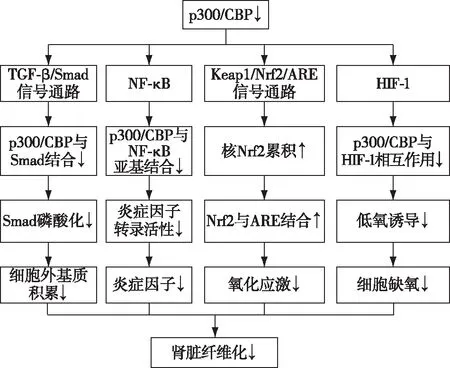
图1 p300/CBP参与肾脏纤维化的分子机制CBP:环磷酸腺苷反应元件结合蛋白的结合蛋白;TGF-β:转化生长因子β;NF-κB:核因子κB;Keap1:Kelch样环氧氯丙烷相关蛋白1;ARE:抗氧化反应元件;Nrf2:核因子E2相关因子2;HIF-1:缺氧诱导因子1;↑:为上调;↓:为下调
转化生长因子β(TGF-β)/Smad信号通路TGF-β是介导肾纤维化发生与发展的重要介质,其中TGF-β/Smad信号通路是调节肾脏纤维化的经典通路[11],抑制TGF-β/Smad信号通路可显著改善肾纤维化[12]。p300/CBP可作用于由Smad蛋白形成的复合物,激活下游的信号,从而调节细胞的增殖迁移[13]。Kapasi等[14]在肾皮质近曲小管上皮细胞(HK2)研究表明,当p300过表达时,TGF-β蛋白也表达增加,证明p300/CBP与TGF-β可发生相互作用。p300还可促使Smad 2/3快速磷酸化,发挥协调作用,增强转录活性,从而促使HK2细胞纤维化的发生。 Yuan等[15]在大鼠肾小球系膜细胞中,通过免疫共沉淀实验发现,TGF-β干预增强了p300和Smad2/3的相互作用。蛋白印迹结果显示,同时p300/CBP介导纤溶酶原激活物抑制剂1(PAI-1)和细胞周期依赖性蛋白激酶抑制因子1A(p21)的启动子组蛋白H3赖氨酸9(H3K9)/14Ac乙酰化,使PAI-1和p21的表达增加,肾脏纤维化相关指标人α平滑肌肌动蛋白(α-SMA)表达增加,肾脏纤维化加重。这些结果表明,p300/CBP可通过与TGF-β/Smad信号通路相互作用而影响肾脏纤维化的发生发展。目前大多数研究集中于抑制Smad磷酸化,从而调控肾脏纤维化。但越来越多的证据表明,乙酰化修饰在Smad磷酸化中发挥作用,其对肾脏纤维化中具有不可忽视的作用。因此,通过抑制p300/CBP靶向TGF-β/Smad信号通路从而改善肾脏纤维化具有重要研究意义。
核因子κB(NF-κB)NF-κB是一类具有多向调节作用的转录调控因子家族,与肾脏纤维化的发生发展密切相关[16]。p300作为共激活因子,具有核蛋白乙酰基转移酶活性,通过直接与NF-κB的P65亚基结合,促进转录因子与染色质中启动子或增强子的结合,激活其转录活性,从而促进肾脏炎症、纤维化的发生[17]。p300/CBP可显著增强小鼠肾脏中高糖引起促炎症和促纤维化分子的表达及肾小球活性氧(ROS)的过度产生[18-19]。使用p300/CBP的抑制剂C646可降低糖尿病肾病小鼠肾脏NF-κB的活性,随着组蛋白赖氨酸残基的乙酰化水平的下降,肿瘤坏死因子α(TNF-α)的表达也受到抑制。其他促炎因子[如人单核细胞趋化蛋白1(MCP-1),诱导型一氧化氮合酶(iNOS)]的表达降低,同时抑制促纤维化分子[如胶原蛋白4(Collagen Ⅳ),纤维黏连蛋白(Fibronectin)]的表达,从而对糖尿病肾病发挥保护作用[20]。Chung等[21]研究表明在单侧输尿管结扎(UUO)诱导的小鼠肾脏纤维化模型中,p300/CBP相关因子抑制剂garcinol阻止了NF-κB的激活,使UUO模型中肾脏纤维化减轻,促炎细胞因子表达减少。肾损伤后持续存在的炎症反应是肾脏纤维化发生发展的重要原因,因此抑制由NF-κB介导的炎症反应从而改善肾纤维化的进展具有重要的意义。基于以上研究,有望针对p300/CBP介导的炎症作用进行进一步的机制研究,探索相关抑制剂,并将其作为新的有效疗法应用于临床以减轻肾脏纤维化。
Kelch样环氧氯丙烷相关蛋白1(Keap1)/核因子E2相关因子2(Nrf2)/抗氧化反应元件(ARE)信号通路氧化应激是肾脏纤维化发生发展的一个重要原因。Keap1/Nrf2/ARE是抗氧化应激过程中具有重要作用的信号通路之一。研究表明,Nrf2是各种抗氧化基因的主要调节因子[22]。在稳态条件下,Nrf2与Keap1结合并停留在细胞质内,其通过Keap1依赖性泛素化和蛋白酶体降解而被抑制,抗氧化基因转录水平保持在低水平状态下。在缺氧环境中,Nrf2与Keap1解离,Nrf2蛋白的稳定性增加,从而更容易与ARE发生相互作用。与ARE结合后,Nrf2的活性会被激活,使各种抗氧化基因的转录增加,发挥抗氧化应激的作用。有研究通过建立小鼠UUO肾脏纤维化模型,第3天时,UUO小鼠肾脏中p300/CBP相关因子就呈高表达。依福地平干预后,p300/CBP相关因子被明显抑制,Nrf2增加,同时α-SMA等纤维化相关指标表达降低,肾脏纤维化程度减轻[23]。Chung等[21]表明p300/CBP相关因子表达变化与氧化应激密切相关。在UUO纤维化肾脏模型中,p300/CBP相关因子明显上调,同时NADPH氧化酶(NOX2)增加,而Nrf2减少。在使用p300/CBP相关因子的抑制剂治疗后,Nrf2的核积累增加,驱动炎症介质的转录减少和抗氧化剂的转录增加,阻止了肾脏纤维化的发生发展。但目前在肾脏中关于p300/CBP对Nrf2相关信号通路的研究尚少,其深入机制尚未阐述,但这将为未来通过调节氧化应激相关因子的乙酰化过程防治肾脏纤维化提供新的思路。
缺氧诱导因子1(HIF-1)组织的慢性缺氧在是发生肾脏纤维化的重要因素。在CKD的进展过程中,肾小球供氧减少,血管活性物质失衡,管周毛细血管稀疏及耗氧量的增加等均会导致肾脏的慢性缺氧。慢性缺氧导致成纤维细胞增殖活化和ECM在肾间质积累,从而促进肾小管间质纤维化的发生。HIF-1是一种α,β异二聚体转录因子,在低氧条件下,HIF-1的水平在多种细胞和组织中上调[24],其可介导细胞和全身对缺氧的反应,已发现肾小管上皮细胞中HIF-1的慢性持续激活可促进上皮间质转化(EMT)和肾脏纤维化[25]。HIF-1的内在无序C末端反式激活结构域通过与CBP的TAZ1结构域或p300之间相互作用,从而激活HIF-1介导的转录[26]。缺氧时,机体降低了对p300/CBP的氧气依赖性抑制,HIF-1和p300/CBP之间相互作用的增强,HIF-1与p300/CBP结合更紧密,从而促进HIF靶基因的表达[27]。Tanaka等[28]研究表明,可以通过抑制肾小管上皮细胞中的p300/CBP,抑制HIF靶基因的低氧诱导,从而减缓CKD的发生发展。通过上调GLU/ASP丰富羧基端域p300/CBP相互作用反式激活因子2,可以阻碍对HIF-1的招募,改善肾脏缺氧环境,减缓肾脏纤维化进程[29]。目前研究表明,HIF-1与p300/CBP之间有重要的相互作用,p300/CBP可能通过抑制HIF-1基因表达减缓肾脏纤维化。
干预p300/CBP信号通路治疗肾脏疾病
p300/CBP介导的乙酰化修饰是肾脏疾病过程中的重要因素。通过干预p300/CBP介导的乙酰化修饰或许能成为治疗肾脏疾病有效的途径。有研究显示,青蒿素可能通过增加肾脏中转录共激活因子p300/CBP 蛋白和糖皮质激素受体(GR)α mRNA 的表达,提高肾脏对糖皮质激素的敏感性,从而有效提升糖皮质激素对狼疮性肾炎小鼠的治疗效果[30]。Kim等[31]研究表明,山竹子素通过抑制转录共激活因子p300以及其功能蛋白组蛋白H3的乙酰化表达,抑制了NF-κB P65亚基的乙酰化,改善了顺铂诱导的小鼠急性肾损伤的肾功能和组织病理学损伤,减少了细胞炎症因子的增加,减轻氧化应激反应,发挥肾脏保护作用。在缺血再灌注大鼠模型中,姜黄素通过抑制p300/CBP的表达,降低HAT活性,从而使凋亡因子启动子区附近H3K9乙酰化减少,减少缺血再灌注造成的肾脏细胞凋亡,改善肾功能[32]。在小鼠UUO模型中,研究发现钙通道阻断剂依福地平可抑制p300/CBP,改善肾脏纤维化[23]。在高血压性心肾纤维化小鼠模型中,p300抑制剂L002有效抑制了细胞增殖、迁移、肌成纤维细胞分化及胶原蛋白的合成,拮抗成纤维细胞、足细胞和系膜细胞的促纤维化反应,改善了高血压相关的肾脏纤维化[33]。
小结:肾脏纤维化是所有CKD进展至ESRD的常见结局,至今尚无有效的治疗方法。乙酰化修饰在肾脏疾病中的作用受到越来越多的关注。p300/CBP在肾脏纤维化发生发展中起到的重要作用。已发现p300/CBP可通过影响TGF-β/Smad信号通路、Keap1/Nrf2/ARE途径、NF-κB及HIF-1来影响肾脏纤维化。但目前针对p300/CBP在肾脏纤维化中的作用的研究仍处于实验阶段,p300/CBP相关治疗药物深入的机制研究较少,尚未达到临床应用的程度。将来应针对p300/CBP对在肾脏纤维化中的作用及机制的不断深入研究,以期能获得突破性的进展,为防治肾脏纤维化提供新的线索。
