OptiPrep密度梯度分离液分离培养小鼠原代肝星状细胞的实验研究
2022-11-19黄会芳邓志华姚佳心
黄会芳, 邓志华, 严 微, 黄 卓, 姚佳心
1.山西医科大学第一医院消化科, 山西 太原 030001; 2.山西医科大学第二医院消化科
肝星状细胞(hepatic stellate cells,HSC)位于肝窦周围的间隙内,在生理情况下呈静止状态,是维生素A的主要储存处,参与维生素A的代谢,另外还有调节血管和肝窦血流的作用。在病理条件下HSC受多种细胞因子的作用,表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),出现肌成纤维母细胞(myofibroblast,MFB)样表型转化,出现细胞增殖,合成细胞外基质(extracellular matrix, ECM)增加等,活化的HSC成为肝纤维化发生发展的关键因素[1]。近年来HSC的免疫学特征也逐渐被人们认识,活化的HSC具有免疫细胞特征,并分泌具有免疫调节功能的细胞因子,直接参与肝脏的免疫调控[2-3]。目前研究发现,HSC可作为非专职抗原提呈细胞,可获得肝内、肝外抗原提呈功能,发挥免疫调节作用,诱导反应性T细胞凋亡,活化的HSC表达MHCⅡ、MHCⅠ、CD80、CD86,在肝脏移植中,活化的HSC以IL-2依赖的方式可选择性诱导扩增异基因Treg细胞,提高Treg细胞的免疫耐受和免疫抑制作用,减少肝细胞移植的免疫反应,提高肝细胞移植的存活率[4-6]。因此,对HSC的研究是目前科学界逆转肝纤维化和治疗免疫性肝病的希望所在。分离培养原代HSC成为科学界对HSC研究的关键,获得足够的有活力的原代HSC是顺利开展肝纤维化、免疫性肝病、肝移植等相关研究的重要保证。
HSC位于Disse间隙内,紧贴肝窦内皮细胞(sinusoidal endothelial cells,SEC)和肝细胞,常伸出数个星状胞突包绕肝血窦,由于HSC是肝脏非实质细胞,只占肝细胞总体数目的5%~8%及总体体积的1.4%[7],且与其他细胞如肝脏Kupffer细胞密度接近,分离培养技术要求高,活体肝脏灌注消化分离HSC非常困难,分离小鼠的HSC相比分离大鼠的HSC更困难。OptiPrepTM分离液的主要成分是碘克沙醇,碘克沙醇是一种高亲水性非离子的物质,这就决定了OptiPrepTM分离液是一种高密度、低黏度的溶液,在加入适当浓度的基本培养基或缓冲液,如PRMI、蔗糖或Hepes后,可将OptiPrepTM配制成连续的或不连续的等渗密度梯度溶液,它的密度和渗透性成线形关系,可用于各种细胞、细胞器、脂蛋白的分离[8-10]。
经过摸索研究,本实验选用了制作方便、密度准确的OptiPrepTM密度梯度离心分离液,结合肝脏原位手工灌注法,并对分离过程的诸多细节反复摸索、改进,探索出一套得率高、纯度高、存活率高的小鼠原代HSC的提取、培养方法。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:BALB/c小鼠(见图1A),SPF级,雄性,6~8周龄,体质量25~30 g,由山西医科大学实验动物中心提供,均予普通饲料喂养,自由进食,饲养环境为清洁级。
1.1.2 主要试剂:小鼠α-SMA单克隆抗体(Mouse Anti-α-SMA)(BM0002)、小鼠结蛋白单克隆抗体(Mouse Anti-Desmin)(BM0036)购自武汉Boster公司,胶原酶Ⅳ(Collagenase Ⅳ)(C8160)购自美国Solarbio公司,油红O染色试剂(Oil Red O Staining Kit)(G1260)购自美国ScienCell公司,DNase I(Deoxyribonuclease I)(D8071)购自Sigma公司,OptiPrepTM分离液(1114542)购自挪威Axis-shield公司,胎牛血清(fetal bovine serum,FBS)(0510)购自美国Gibco公司,青链霉素混合液100×(青霉素10 000 U/ml,链霉素10 mg/ml)(P1400-100)购自美国Solarbio公司,DMEM(高糖)培养液(PYG0073)、0.25%胰蛋白酶(PYG0086)、Hanks缓冲液(PYG0081)、D-Hanks缓冲液(不含酚红)(PYG0079)、SABC试剂盒(SA0025)均购自武汉Boster公司。
1.2 实验方法
1.2.1 肝脏手工灌注消化:采用3%戊巴比妥钠(60 mg/kg)腹腔注射麻醉,起效后固定小鼠于超净工作台,75%乙醇洗浴消毒腹部,剖腹,充分暴露门静脉、下腔静脉。用儿科止血钳夹闭肝上下腔静脉,手持24G套管针穿刺入肝下下腔静脉,手术缝线固定套管针,剪开门静脉(见图1B)。手持50 ml注射器连接24G套管针,手工注入37 ℃预热的D-Hanks液约50 ml,以5~7 ml/min的速度灌入,肝脏颜色逐渐变黄变白,门静脉流出的血液变为无色液体后,换为37 ℃预热的HBSS液(含0.4 mg/ml胶原Ⅳ)约50 ml,以3~5 ml/min的速度推注灌注液,灌注过程中肝脏颜色逐渐变黄变白,表面变软变脆,表面皱缩,压之凹陷不易恢复时(见图1C),停止灌注,拔出套管针,取下夹闭肝上下腔静脉的血管钳。

注:A:实验用的BALB/c小鼠;B:血管钳夹闭肝上下腔静脉,24G套管针穿刺入肝下下腔静脉,固定套管针,剪开门静脉,肝下下腔静脉灌入灌注液;C:肝脏颜色逐渐变黄变白,表面皱缩,灌注成功。
1.2.2 细胞分离培养:(1)细胞分散:用止血钳钳夹肝门部韧带将血管提起,小心剪断肝门部血管韧带、胆囊、下腔静脉,小心剥离肝脏周围韧带,迅速将肝脏移入消毒器皿内,HBSS液10 ml冲洗,在培养细胞的超净工作台面,充分细致剪碎肝组织成匀浆状,加入配制好的HBSS液20 ml(含0.4 mg/ml胶原Ⅳ,20 μg/ml DNase I),恒温水浴振荡器中38.5 ℃震荡消化20 min,若有未消化完全的颗粒状物,可适当延长5 min。
在比较法上,对于应收账款质押合同的形式的要求不尽相同。其中我国的台湾地区和意大利、瑞士的立法明确要求当事人在设立质权时必须要签订书面合同;而日本、法国和德国的立法则没有此项的强制规定,即口头或者书面形式都可以。
(2)细胞分离:细胞悬液中加入4 ℃ HBSS液(含20% FBS)20 ml混匀终止消化,经200目滤网过滤入50 ml离心管中;将过滤过的细胞悬液分装入4个15 ml离心管中,600g,4 ℃离心10 min,吸管吸出上清液至离心管2.5 ml处;混合至两个15 ml离心管,加入DNaseⅠ酶20 μg/ml,重悬,再加入HBSS至12 ml,重悬,600g,4 ℃离心10 min,吸管吸出上清液弃掉;15% OptiPrep 4 ml(含DNaseⅠ20 μg/ml)重悬肝脏非实质细胞(两个离心管液体混合),重悬之后实际为12.5%,上层再小心用1 ml注射器贴壁小心加入11.5% OptiPrep 4 ml,再上层用1 ml注射器贴壁小心加入3 ml HBSS液;4 ℃ 1 400g离心18 min,在HBSS与11.5% OptiPrep之间可见白色界面层细胞(见图2A),小心用1 000 U枪头吸出界面层细胞入4 ml HBSS液,重悬;4 ℃ 650g离心10 min,吸去上清弃掉,可见管底少量沉淀物为分离到的原代HSC(见图2B)。
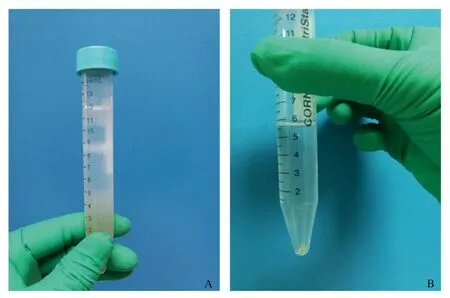
图2 分离到的白色界面层细胞(A)及管底少量沉淀物(B) Fig 2 Isolated white interface layer cells (A) and a small amount of sediment at the bottom of the pipe (B)
(3)细胞传代:分离到的原代HSC中加入含20% DMEM-高糖培养液(含1%青链霉素混合液100×)5 ml,活细胞鉴定后,装入30 ml培养瓶,放入37 ℃孵箱(含体积分数为5%的CO2)培养;培养12 h有部分细胞贴壁,24~48 h细胞贴壁增多,PBS清洗2遍,加入含10%FBS的DMEM-高糖培养液(含1%青链霉素混合液100×)5 ml换液;倒置显微镜观察细胞形态,贴壁情况,细胞培养液颜色、浑浊度等;每2~3 d细胞培养液换液1次,置入孵箱继续培养,镜下观察细胞呈星芒状生长至覆盖培养皿底80%~90%,可考虑传代培养,7~10 d传代1次,按照1∶2或1∶3传代培养。
1.3 原代HSC的鉴定
1.3.1 活细胞鉴定:取90 μl细胞悬液,加入0.4%台盼蓝溶液10 μl,混匀后光镜下未着色者为活细胞。倒置荧光显微镜下细胞内脂滴丰富,折光较强,在荧光显微镜328 nm波长的紫外光激发下,自发一过性蓝绿色荧光。用细胞计数板、计数器计算细胞得率和存活率(未着色细胞/镜下总细胞数)。
1.3.2 性质鉴定:(1)油红O染色:用24孔培养板制作细胞爬片48 h;倒置荧光显微镜下观察细胞贴壁良好,用PBS轻缓漂洗3遍;加入4%中性甲醛固定30 min;稀释油红储存液,油红∶去离子水=3∶2,滤纸过滤,室温放置10 min;染色10~20 min,加至体积覆盖住板底即可;用60%异丙醇分化脱色,去除多余的染料;复染,淡苏木素染色10~15 s(根据核染情况决定时间长短),PBS漂洗;甘油明胶封片;镜下观察;ScanScope数字病理扫描仪扫描。(2)Desmin及α-SMA免疫细胞化学染色:用24孔培养板制作细胞爬片48 h;用PBS漂洗2 min×2次;加4%中性甲醛室温固定30 min;PBS漂洗2 min×3次;0.5% Txitonx-100室温处理20 min;3% H2O2室温处理15 min;PBS漂洗2 min×2次;试剂盒中血清封闭液封闭30 min;取出甩干封闭液,加一抗(PBS稀释为1∶100),阴性对照用PBS代替,4 ℃过夜;PBS漂洗,3 min×3次;二抗孵育,试剂盒中的生物素化,37 ℃,20 min;PBS漂洗,2 min×3次;SABC孵育,湿盒内37 ℃,20 min;PBS漂洗,4 min×3次;加适量的DAB显色液显色,镜下观察细胞显色情况;自来水冲洗;苏木素复染;自来水冲洗;封片剂封片;镜下观察;ScanScope数字病理扫描仪扫描。
2 结果
2.1 原代HSC得率和存活率台盼蓝染色后镜下观察计数分离的细胞,小鼠原代HSC得率为(2~5)×106/只,存活率在95%以上。
2.2.1 倒置荧光显微镜观察:(1) 镜下观察,新分离的HSC呈圆形,具有折光性;培养12 h后大部分细胞贴壁;24 h后多数细胞呈圆形或纺锤形,已贴壁;48 h后贴壁的细胞体积增大开始伸展,数量增多,呈现梭形或星形,少数细胞伸出伪足,但细胞仍处于静止阶段(见图3A);培养5 d细胞数量增多,呈梭形或星形,伸出伪足(见图3B),培养7 d细胞数量明显增多,细胞呈长梭形,伸出细长的伪足(见图3C),说明细胞已经开始或部分活化。(2)倒置荧光显微镜下观察:新分离的HSC具有丰富的脂滴,在328 nm波长的紫外光激发下自发蓝绿色荧光,并在数秒内迅速减退(见图3D)。
2.2.2 原代HSC油红O染色:原代HSC培养48 h贴壁后,油红O染色,可见胞浆中的脂滴呈红色,细胞核复染后呈蓝色(见图3E~3F)。

注:A:分离培养48 h的原代HSC(放大200倍);B:培养5 d的原代HSC(放大200倍);C:培养7 d的原代HSC,细胞数量明显增多,细胞呈长梭形,伸出细长的伪足(放大200倍);D:在328 nm波长的紫外光激发下HSC自发蓝绿色荧光(放大100倍);E:培养48 h的原代HSC油红O染色(放大200倍);F:培养48 h的原代HSC油红O染色(放大400倍)。
2.2.3 Desmin免疫细胞化学染色:Desmin染色:小鼠原代HSC培养48 h、7 d和传2代消化后培养48 h的HSC培养皿内贴壁生长后,进行Desmin免疫细胞化学染色。Desmin阳性细胞胞浆染色为棕色颗粒,分离后培养48 h的原代HSC Desmin染色约60%呈阳性,原代HSC培养7 d Desmin阳性染色达100%,传2代培养的HSC Desmin阳性染色达100%(见图4A)。
2.2.4 α-SMA免疫细胞化学染色:α-SMA染色:小鼠原代HSC培养48 h、7 d和传2代消化后培养48 h的HSC培养皿内贴壁生长后, 进行α-SMA免疫细胞化学染色。α-SMA阳性细胞胞浆染色为棕色颗粒,分离后培养48 h的原代HSC α-SMA 染色约5%呈阳性;原代HSC培养7 d α-SMA阳性染色为60%~70%;传2代培养的HSC α-SMA阳性染色达100%(见图4B)。
3 讨论
肝纤维化是各种慢性肝损伤的病理结果,如无有效治疗,多数患者最终会发展为肝硬化、原发性肝癌、肝功能衰竭等,严重威胁着肝病患者的生存质量。HSC在肝纤维化发生发展中发挥着关键作用[11]。近年来发现HSC作为一种非专职抗原提呈细胞,参与肝脏免疫反应。在肝移植宿主对异体肝脏的免疫排异和免疫耐受中发挥着一定作用。因此,对HSC的研究是目前科学界逆转肝纤维化和肝移植存活及免疫性肝病免疫耐受的希望所在。
目前分离HSC需要考虑几方面的因素:(1)小鼠体积小,肝脏重量轻,HSC作为非实质细胞,数量极少;(2)HSC与Kupffer细胞密度相近,影响分离的纯度;(3)HSC易与肝细胞吸附,影响分离效果。因此,去除混杂的肝细胞和其他间质细胞得到高纯度、高得率的原代HSC是分离培养HSC的难点。目前国际上提取小鼠HSC的方法报道多采用肝脏原位灌注和密度梯度离心法相结合的方法[12-13]。本实验选用OptiPrep密度梯度分离液,提取到纯度高、得率高的HSC,值得总结推广。

注:原代HSC分离培养48 h(A1)、7 d(A2)、传2代HSC消化后培养48 h(A3)Desmin免疫细胞化学染色(放大400倍)和原代HSC分离培养48 h(B1)、7 d(B2)、传2代HSC消化后培养48 h(B3)α-SMA免疫细胞化学染色(放大400倍)。
由于小鼠体积小,脏器脆弱,血管纤细,操作难度大,所以操作时速度要快、穿刺要准。从插管成功到灌注结束,操作过程不超过20 min。本实验中选择血管钳直接夹闭肝上下腔静脉,充盈肝下下腔静脉和门静脉,一方面可以缩短手术操作时间,另一方面血管钳夹闭操作快,不易穿破胸腔,降低小鼠死亡率,延长存活时间,留出更多时间用于肝脏灌注,利于HSC的有效提取。采用24G套管针穿刺肝下下腔静脉,而未选择门静脉穿刺,是由于下腔静脉直径较门静脉直径粗,相对易于操作,整个灌注过程中套管针易于固定,不易因灌流压力高而刺破血管。在灌注的不同阶段需要采取不同灌注压力和速度,开始阶段为了快速冲洗出肝脏中的血液、免疫活性细胞、Ca2+以及其他杂质,要求压力高、速度快,之后灌注含胶原酶的液体时,需要酶液和肝脏的充分接触,达到更好的消化效果,另外活体灌注,以利于提取出高质量、高得率的HSC,因此,本实验采用原位灌注结合手工静脉推注法以满足以上要求。首先灌注D-Hanks液,D-Hanks液不含钙镁离子,以免钙镁离子影响肝脏的存活状态,酶灌注时选择Hanks液,Hanks液中有钙离子,这样利于扩张血管,酶灌注速度相对缓慢,使酶与肝组织接触更充分。灌注结束时,肝脏变脆,黄白色,压之凹陷不恢复,肝脏表面肝包膜皱缩,达到理想灌注效果。
肝脏灌注结束后,剪除胆囊、肝上下腔静脉,小心剥离肝脏周围韧带,充分细致剪碎肝组织成匀浆状,尽可能减少块状肝组织残留,以免影响细胞分散进而影响HSC得率。虽然链霉蛋白酶可以选择性消化肝细胞,但其对HSC也有一定的损伤,为避免此酶对HSC的毒副作用,我们选择DNase I酶避免了链霉蛋白酶的毒副作用,在容易破坏肝细胞步骤中均加入一定量的DNase I酶,清除在消化过程中被破坏的大量肝细胞释放出DNA,由于DNA带有粘性,使得包括HSC在内的各种细胞粘成一团,直接影响细胞的得率。
选择合适的密度梯度介质及建立准确的密度梯度离心体系是分离纯化HSC、提高HSC得率的关键步骤。密度梯度分离液的选择要遵循操作简便、液体易配、密度准确的原则。本研究选用OptiPrep密度梯度分离液,该分离原液为含碘克沙醇(iodixanol)的梯度分离液,原液密度为60%,只需按照操作说明书用HBSS配制成相应密度梯度分离液,与其他密度梯度介质相比,具有操作简便、密度准确、对细胞的粘附小较易洗脱、使提取时液体分层明显、可直接观测等优点。HSC密度为1.047~1.061 g/ml,而Kupffer细胞密度为1.083~1.095 g/ml,15% OptiPrep密度梯度分离液重悬细胞后实际浓度为12%~13%,11.5% OptiPrep密度梯度分离液密度约1.063 g/ml,分离后,HSC位于11.5% OptiPrep密度梯度分离液与HBSS液面层之间的界面层细胞,能保证HSC的纯度。
无菌操作观念要强,任何一个操作步骤均需严格掌握无菌操作技术,才能使后续分离到的HSC在培养过程中生长良好。无菌操作技术主要体现在三个大的操作步骤过程中:(1)体外肝脏灌注及摘除肝脏:从开始的液体配制,包括液体的过滤到灌注,手术过程包括手术器械消毒,剖腹、灌注、去除肝薄膜及周围血管韧带等,到将灌注好的肝脏移入无菌器皿;(2)密度梯度离心法提取细胞:包括细胞消化分散、密度梯度离心提取细胞,分离到的细胞孵箱培养;(3)孵箱培养细胞的换液、传代,到细胞爬片、免疫组化检测等。几十个步骤均需严格无菌操作,才能确保有效分离到原代HSC。
HSC为储存维生素A的储脂细胞,刚分离出的原代HSC含大量脂滴,并含维生素A而自发荧光[14]。在倒置荧光显微镜下紫外光激发下自发蓝绿色荧光。油红O染色阳性,分离培养48 h的HSC贴壁生长,处于静止期的HSC富含脂滴,代表静止期的HSC为储脂细胞,维生素A含量丰富[15]。具有肌细胞特点,细胞质中含有Desmin,稳定地存在于刚分离出及传代的HSC中,Desmin免疫细胞化学染色阳性。新鲜分离的HSC Desmin染色阳性率达60%,7 d后达100%,与报道[16]一致。活化HSC是肝纤维化发生发展的关键,活化的HSC表达α-SMA,α-SMA染色阳性是其活化的标志,在分离HSC 48 h后,α-SMA几乎不表达,在体外培养环境中,原代HSC可自发活化,培养7 d的HSC可达到近70%活化,传2代的HSC全部活化。
总之,整个操作过程中严格无菌操作,动作熟练、准确、轻柔,最大程度防止细胞污染和细胞损伤,保证小鼠原代HSC分离、培养成功。本实验采用的OptiPrep密度梯度分离液结合肝脏原位手工灌注法分离到高得率、高纯度的小鼠原代HSC,且操作简单易行,适于广泛开展,为进一步研究HSC奠定基础。
